Функционализированные бета 1,6 глюкозамин-дисахариды и способ их получения
Иллюстрации
Показать всеНастоящее изобретение относится к новому способу химического синтеза асимметрично или симметрично замещенного β-(1→6)-связанного глюкозамин-дисахарида формулы (1), а также к способу его очистки. В изобретении заявляются промежуточные соединения, относящиеся к данному способу. Согласно дополнительным аспектам изобретение относится к фармацевтической композиции, включающей указанные соединения, и к применению соединений при лечении расстройства, на которое влияет модулирование активности иммунной системы, включая подавление или активацию иммунной системы, такого как расстройство, выбранное из иммунных расстройств и/или рака. 14 н. и 12 з.п. ф-лы, 8 пр., 26 ил., 32 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому способу химического синтеза β-(1→6)-связанных глюкозамин-дисахаридов. Такие соединения могут использоваться как производные липида А. Примером производных липида А является ОМ-174-DP ® , впервые выделенный фирмой ОМ Фарма1 из частично разложившихся липополисахаридов Escherichia coli. Данное изобретение включает конструирование и химический синтез новых аналогов липида А, которые лишены обоих сахар-О-ацильных заместителей (по О-3 и О-3') и, следовательно, содержат только N-связанные остатки жирных кислот. Иммунологическая активность таких соединений родственна активности исходного биологического ОМ-174-DP ®.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Липополисахариды (LPS) являются основными соединениями, экспрессируемыми в наружной мембране почти всех грамотрицательных бактерий. Данные амфифильные макромолекулы обладают общей структурой, состоящей из гидрофильного полисахарида (образуемого из скелетного олигосахарида и О-специфичного полисахарида), ковалентно связанного с липофильным фрагментом, называемым липидом А2, который служит в качестве мембранного якоря LPS.
LPS, известные также как эндотоксины, являются сильными стимуляторами систем защиты хозяина как в качестве адъювантов для антигенов3 вакцин, так и в качестве индукторов или возбудителей неспецифичной стойкости к заражению на животных моделях4. Данные амфифильные макромолекулы обладают чрезвычайно сильной иммуностимулирующей активностью5. Биологическая активность LPS является следствием главным образом липидной А составляющей, хотя токсичность липида А зависит строго от его первичной структуры.
В целом, липид А имеет высококонсервативную структуру. Он обычно состоит из β-(1→6)-связанного глюкозамин-дисахаридного скелета, фосфорилированного в положениях О-1 и О-4', и шести или более жирных ацильных групп, связанных в виде сложных эфиров и амидов. Аномерный фосфат (О-1 положение) восстанавливающей части глюкозамина имеет исключительно α конфигурацию. Например, полная химическая структура липида А, выделенного из клеток E. coli (Фиг.1), установленная авторами Имото и др.6, содержит β-(1→6)-связанный глюкозамин-дисахаридный скелет, фосфорилированный в положениях О-1 и О-4' и ацилированный в 2,3 положении (R)-3-гидрокситетрадекановой кислотой, в 2' положении (R)-3-додеканоилокситетрадекановой кислотой, и в 3' положении (R)-3-тетрадеканоилокситетрадекановой кислотой.
Вследствие широкого спектра видов биологической активности был проявлен огромный интерес со стороны как промышленников, так и академических исследовательских лабораторий. Много сил было посвящено химическим модификациям структуры липида А с целью уменьшения природной эндотоксичности исходного соединения и в то же время поддержания или улучшения его благоприятных иммуностимулирующих свойств в восьмидесятых годах Ribi и др. изучили химический процесс с намерением отделить токсические эффекты природного липида А Salmonella Chlamydia RC595 от потенциально полезных иммуномодуляторных эффектов. Данный способ, основанный на селективном гидролизе 1-фосфоногруппы7 и (R)-3-гидрокситетрадеканоильного8 остатка, присоединенного к 3-положению сахара липида А, поставляемого известного иммуностимулятора монофосфорил-липида А (MPL®), который является эффективным адъювантом в профилактических и терапевтических вакцинах9 со значительно пониженной токсичностью по сравнению с его исходным липидом А. Однако MPL®, также как и липид А природного происхождения представляет собой смесь нескольких компонентов вследствие присущей LPS гетерогенности и несовершенных стадий хемоселективного гидролиза или стадий очистки. Вследствие этого иммуностимулятор MPL® включает несколько менее высоко ацилированных соединений в дополнение к основному гексаацильному соединению.
В начале девяностых фирмой ОМ ФАРМА из частично разложившегося LPS1 E. coli было выделено новое производное липида А (ОМ-174-DP ® , Фиг.1). Данное производное лишено обоих сахар-О-ацильных заместителей (в О-3 и O-3') и, следовательно, содержит только N-связанные остатки жирных кислот липида А E. coli, а именно (R)-3-гидрокситетрадеканоильную группу в N-2 и (R)-3-додеканоилокситетрадеканоильную группу в N-2', оставляя таким образом в структуре только три ацильные группы с длинной цепью. Тщательные фармакологические исследования данного нового соединения выявили, что оно обладает сильной противоопухолевой активностью на нескольких in vivo моделях опухоли10 и что оно является эффективным иммуноадъювантом с очень низкой токсичностью.
На протяжении последних двух десятилетий широко изучалась взаимосвязь структура-активность липида А. Shiba с сотрудниками направили серьезные усилия на изучение взаимосвязи структура-активность синтетического липида А E. coli и на разработку химического синтеза таких соединений. Они впервые реализовали химический синтез монофосфорил-липида А E. coli 11 и особенно тщательно подтвердили структуру липида А E. coli с помощью общего химического синтеза, основанного на N-Troc защищенных глюкозаминовых производных.12 Той же группой сообщалось о многих структурных вариациях липида А E. coli в смысле ацильных фрагментов (типов, чисел и положения в сахарном скелете)13 и в смысле гликозилфосфатного фрагмента (фосфоноксиэтильный аналог с α или β конфигурацией в положении 1).14
В 1997 г. они описали наиболее эффективный синтез предшественника липида А.15 К этому времени сообщалось о нескольких неприродных аналогах с модификациями ацильных цепей16 и модификациями гликозилфофатного фрагмента и о синтезе самого липида А.17 Группа опубликовала химический синтез липида А, выделенного из Helicobacter pylori с использованием усовершенствованного способа18. Их публикация включает триацилированный аналог липида А, в котором не хватает обоих сахар-О-ацильных заместителей (в О-3 и O-3'). Однако в дополнение к этому в соединении нет также замещения в 4'-O положении.
Работа Shiba была отправной точкой для более позднего синтеза разнообразных липидов А. В качестве доказательства авторами Kosma с сотрудниками в последнее время синтезированы синтетические тетра- и пентаацильные аналоги липида А Chlamydia, чтобы прояснить роль липида А в связанных с Chlamydia инфекциях.19 Группа Биомира разработала структуру неприродного синтетического липида А, содержащую новые липидные фрагменты, имитирующую встречающиеся в природе происходящие из E. coli и Salmonella производные структуры липида А.20 О химическом синтезе липида А P.gingivalis, триацилированного липида А, содержащего только N-связанные жирнокислотные остатки и с отсутствующей 4'-O-фосфатной группой, также сообщалось авторами Огава с сотрудниками. 21
LPS и родственные им соединения исследовались главным образом как LPS-агонисты. В последние годы родственные липиду А соединения изучались как LPS-антагонисты, которые могут обладать потенциалом в качестве иммуносупрессивных средств, а при аутоиммунных заболеваниях и септицемии путем дезактивирования LPS-индуцируемых агрессивных макрофагов. Например, Qureshi с сотрудниками22 выделили нетоксичный липид А как сильный LPS антагонист из Rhodobacter sphaeroides (Rs-DPLA), а группа Eisai разработала полный синтез предложенной структуры по их собственной методике23 и родственного соединения, а именно Е5564, сильного средства против септицемии.24 Существующие описанные ранее методики синтеза липида А, основанные на окончательном гидрогенолизе11-21, не могли быть применимыми вследствие присутствия в предложенном Rs-DPLA олефиновой функциональности. В последние годы были синтезированы родственные Rs-DPLA и Е5564 соединения.25
Молекулы липополисахаридов и липида А являются иммуностимулирующими агентами, потому что они активируют toll-подобный рецептор 4 (TLR4), однако некоторые LPS могут активировать TLT2, такие как LPS из Porphyromonas gingivalis26. Обычно TLR2 ответные реакции индуцируются только такими агентами, как мурамилпептиды (МРМ), бактериальные липопептиды BLP, пептидогликаны (PGN) и липотейхоевые кислоты (LTA). Очень интересно, изобретатели настоящего изобретения обнаружили в настоящее время, что синтетические соединения изобретения (а не только ОМ-174-DP, происходящий из природных источников, как уже описано в постере27 или в недавнем обзоре28) предпочтительно действуют через TLR2 человека, а не как в случае клеток мышей предпочтительно по ожидаемому TLR4 пути. Данное заметное межвидовое отличие (предпочтительно TLR4 в мышиных клетках и, скорее, TLR2 в клетках человека) ранее не было обнаружено.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Известный уровень техники, обсуждаемый выше, не раскрывает синтетические аналоги липида А, лишенные обоих сахар-О-ацильных заместителей (при О-3 и О-3') и включающие 4'-O-фосфатную группу или альтернативное замещение в 4'-O положении. Такие аналоги липида А обладают благоприятными свойствами и являются полезными в области медицины (человека). Однако такие аналоги липида А могут быть получены из природных источников только с помощью сложных способов, например с помощью процессов специфичного гидролиза. В дополнение к этому получение данных соединений из природных источников с фармацевтически приемлемой чистотой представляет дополнительную проблему, особенно потому, что исходное сырье в основном получают из потенциально патогенных организмов. Ввиду данных проблем целью настоящего изобретения является предоставление таких соединений в синтетической форме. Для этого настоящее изобретение согласно первому аспекту предоставляет новый способ химического синтеза β-(1→6)-связанных глюкозамин-дисахаридов.
Дополнительный аспект изобретения относится к способу, подходящему для обработки продуктов, получаемых с помощью синтетического способа изобретения. Продукты, обрабатываемые с помощью данного способа обработки, обладают измененным физико-химическим строением и в соответствии с предпочтительным воплощением имеют повышенную биологическую активность.
Согласно дополнительным аспектам настоящее соединение относится к соединениям, получаемым по способам изобретения, промежуточным соединениям способа синтеза, композициям, включающим данные соединения, и к применению данных соединений в процессе органического синтеза и/или медицине.
Стоит здесь упомянуть, что соединения изобретения предпочтительно действуют через TLR2 человека.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Важной стадией в способе согласно изобретению является реакция гликозилирования между соединением формулы 10:
в которой
R1 представляет собой группу, выбранную из (C3-C6)алкенила, такого как C3 или C4алкенил, предпочтительно 2-пропенил или 1-пропенил;
X представляет водород, группу, выбранную из бензила или замещенного бензила, такого как 4-метоксибензил или 3,4-диметоксибензил, или 2,5-диметоксибензил, или 2,3,4-триметоксибензил, или 3,4,5-триметоксибензил;
R0 выбран из R5 или R2, где R5 выбран из:
(i) ацильной группы, происходящей из карбоновой кислоты с линейной цепью, имеющей от 2 до 24 атомов углерода, предпочтительно гидроксиацильной группы, такой как 3-гидроксиацильная группа, оксоацильной группы, такой как 3-оксоацильная группа, аминоацильной группы, такой как 3-аминоацильная группа;
(ii) ацилоксиацильной группы, предпочтительно 3-ацилоксиацильной группы, ациламиноацильной группы, предпочтительно 3-ациламиноацильной группы, ацилтиоацильной группы, предпочтительно 3-ацилтиоацильной группы;
(iii) алкилоксиацильной, предпочтительно (C2-C24)алкилоксиацильной группы, алкенилоксиацильной, предпочтительно (C2-C24)алкенилоксиацильной группы, алкинилоксиацильной, предпочтительно (C2-C24)алкинилоксиацильной группы, алкиламиноацильной, предпочтительно (C2-C24)алкиламиноацильной группы, алкениламиноацильной, предпочтительно (C2-C24)алкениламиноацильной группы, алкиниламиноацильной, предпочтительно (C2-C24)алкиниламиноацильной группы; алкилтиоацильной, предпочтительно (C2-C24)алкилтиоацильной группы, алкенилтиоацильной, предпочтительно (C2-C24)алкенилтиоацильной группы, алкинилтиоацильной, предпочтительно (C2-C24)алкинилтиоацильной группы, ацильной группы, происходящей из карбоновой кислоты с разветвленной цепью, имеющей от 2 до 48 атомов углерода, предпочтительно карбоновой кислоты, разветвленной в 3-положении;
где в группах (i), (ii), (iii) углеводородная цепь ацила может быть насыщенной или ненасыщенной, и углеводородная цепь ацила, алкила, алкенила, алкинила может быть разветвленной или линейной и необязательно может быть замещена одной или более группами, независимо выбранными из галогена, такого как фтор, хлор, бром или йод; гидроксила или гидроксильного производного -OY, где Y имеет значения, определенные ниже; амина или производного амина -NHW, где W имеет значения, определенные ниже; группы -OZ, где Z выбран из (f), (g), (h), (i), (k), определенных ниже;
и R2 представляет группу, выбранную из (C1-C6)галогенированного алкоксикарбонила, такого как 2,2,2-трихлорэтоксикарбонил (TROC) или 1,1-диметил-2,2,2-трихлорэтоксикарбонил (TCBOC);
с соединением формулы 7:
где R4 выбран из
(a) ацильной группы, определенной в (i), (ii) или (iii) для R5;
(b) разветвленной или линейной алкильной, предпочтительно разветвленной или линейной (C1-C24) алкильной группы; разветвленной или линейной алкенильной, предпочтительно разветвленной или линейной (C1-C24) алкенильной группы, разветвленной или линейной алкинильной, предпочтительно разветвленной или линейной (C1-C24) алкинильной группы;
(c) группы -[(C1-C24)алкил]-COOX, -[(C2-C24)алкенил]-COOX или -[(C2-C24)алкинил]-COOX, где X имеет значения, определенные ниже;
(d) группы -[(C1-C24)алкил]-NHW, -[(C2-C24)алкенил]-NHW или -[(C2-C24)алкинил]-NHW, где W имеет значения, определенные ниже;
(e) формилалкильной группы, предпочтительно формил[(C1-C24)алкильной] группы; формилалкенильной группы, предпочтительно формил[(C1-C24)алкенильной] группы; формилалкинильной группы, предпочтительно формил[(C1-C24)алкинильной] группы;
(f) диметоксифосфорильной группы;
(g) группы -P(O)(OY)2, где Y имеет значения, определенные ниже;
(h) группы -P(O)(OH)-O[(C1-C24)алкил]NHW, -P(O)(OH)-O[(C2-C24)алкенил]NHW или -P(O)(OH)-O[(C2-C24)алкинил]NHW, где W имеет значения, определенные ниже;
(i) группы -P(O)(OH)-O[(C1-C24)алкил], -P(O)(OH)-O[(C1-C24)алкенил] или -P(O)(OH)-O[(C1-C24)алкинил];
(j) группы -P(O)(OH)-O[(C1-C24)алкил]-СООХ, -P(O)(OH)-O[(C1-C24)алкенил]-СООХ, -P(O)(OH)-O[(C1-C24)алкинил]-СООХ, где Х имеет значения, определенные выше;
(k) группы -S(O)(OH)2;
(l) защитной группы, выбранной из бензила или замещенного бензила, такого как 4-метоксибензил или 3,4-диметоксибензил, или 2,5-диметоксибензил, или 2,3,4-триметоксибензил, или 3,4,5-триметоксибензил; или из (C3-C6)алкенила, такого как C3 или C4алкенил, предпочтительно 2-пропенил или 1-пропенил;
где алкильная, алкенильная, алкинильная группы могут быть разветвленными или линейными и могут быть незамещенными или необязательно замещены одной или более группами, независимо выбранными из галогена, такого как фтор, хлор, бром или йод; гидроксила или гидроксильного производного -OY, где Y имеет значения, определенные ниже; амина или производного амина -NHW, где W имеет значения, определенные ниже; или группы -OZ, где Z выбран из (f), (g), (h), (i), (j) (k);
и где Y выбран из водорода; (C3-C6)алкенила, такого как C2 или C3алкенил, предпочтительно 2-пропенил или 1-пропенил; группы, выбранной из бензила или замещенного бензила, такого как 4-метоксибензил или 3,4-диметоксибензил, или 2,5-диметоксибензил, или 2,3,4-триметоксибензил, или 3,4,5-триметоксибензил; О-ксилиленовой группы;
и где W выбран из водорода; бензилоксикарбонильной группы или 9-флуоренилметилоксикарбонила;
и где R6 представляет группу, выбранную из трихлорацетимидата, фторида, хлорида, бромида, и Х и R2 имеют значения, определенные выше.
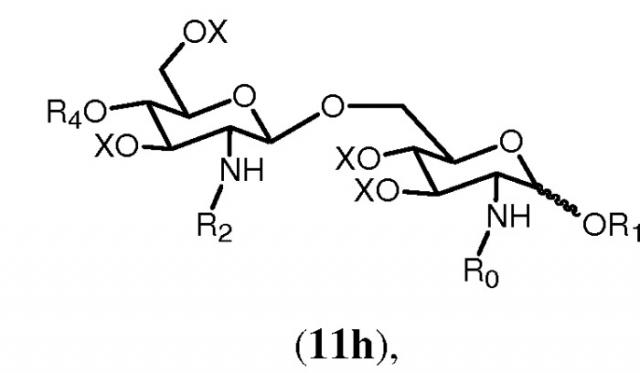
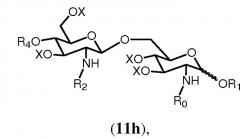
Реакция может осуществляться согласно общему методу гликозилирования, известному в данной области техники, такому как способ, описанный в Angew. Chem., Int. Ed. Engl., (1986), 212. В данном способе используют дихлорметан в качестве растворителя и каталитическое количество кислоты, такой как триметилсилилтрифторметансульфонат. Когда используют данный способ, получают только β-дисахарид согласно формуле 11h.
в которой R1, R2, R4, R0 и Х имеют значения, описанные выше. Связь в виде связи, присоединяющей OR1, указывает, что возможны как α, так и β аномер.
R5 может быть выбран из ацильной группы, определенной в (i), или альтернативно разветвленной ацильной группы, определенной в (ii), (iii). Ацильная группа может быть выбрана из группы, включающей ацилоксиацильную, ациламиноацильную, ацилтиоацильную, (C1-C24)алкилоксиацильную, (C1-C24)алкиламиноацильную и (C1-C24)алкилтиоацильную группу. (Cn-Cn), где n является целым числом, такой как (C1-C24) и (C2-C24), используемый в данном описании, обозначает, что насыщенная или ненасыщенная углеводородная цепь, к которой относится данный символ, может содержать число атомов углерода в интервале, таком как соответственно 1-24 и 2-24 атома углерода, такое как 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 атома углерода. Ацильная, алкильная, алкенильная и алкинильная углеводородная цепи в ациле и ацильных производных, определенных в (i), (ii) или (iii), может, каждая, индивидуально включать число от 1 до 50 атомов углерода, такое как от 2 до 48 атомов углерода, включая 1-24 атома углерода, такое как 2-24 атома углерода, в частности 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 атома углерода. В (C2-C24) алкилоксиацильной группе, например, алкильный углеводород может включать от 2 до 24 атомов углерода, и углеводородная цепь ацильного фрагмента может включать от 2 до 24 атомов углерода.
Углеводородная цепь ацильных групп может быть насыщенной или может включать одну или более ненасыщенных углеродных двойных или тройных связей. В дополнение к этому углеводородные цепи ацила, алкила, алкенила и алкинила могут быть разветвленными или линейными и могут быть необязательно замещены одной или более группами, независимо выбранными из галогена, такого как фтор, хлор, бром или йод; гидроксила или гидроксильного производного -OY, где Y имеет значения, определенные выше; амина или производного амина -NHW, где W имеет значения, определенные выше; группы -OZ, где Z выбран из (f), (g), (h), (i), (j),(k), определенных выше.
В случае ацилоксиацильной группы две ацильные группы связаны через атом кислорода, в случае ациламиноацильной группы - через NH группу, и в случае ацилтиоацильной группы - через атом серы. (C1-C24)алкилоксиацильная, (C1-C24)алкиламиноацильная и (C1-C24)алкилтиоацильная группа может быть получена из соответствующей гидрокси жирной кислоты.
Ацильные группы предпочтительно замещены в 3-положении и являются такими как 3-ацилоксиацильная, 3-ациламиноацильная и 3-ацилтиоацильная группа. То же самое применимо к упомянутым выше (C1-C24)алкильным эквивалентам.
Предпочтительно члены группы R5 включают один или два ацильных фрагмента, предпочтительно выбранных из остатков жирной кислоты, остатков гидрокси жирной кислоты и остатков окси жирной кислоты. Когда ацилоксиацильной группой является 3-ацилоксиацильная группа, данные ацильные фрагменты предпочтительно включают остаток 3-гидрокси жирной кислоты или для связанной сложноэфирной связью группы остатка 3-оксо жирной кислоты. Типичными примерами ацилоксиацильных групп являются 3-гидрокси(C4-C24)-жирная кислота-ацилы, которые связаны сложноэфирной связью с 3-гидрокси группой (C1-C24)-карбоновой кислоты. Предпочтительно ацилоксиацильной группой является 3-гидрокси(C8-C18)-жирная кислота-ацил, которая связана сложноэфирной связью с 3-гидрокси группой (C10-C18)-жирной кислоты. Такие ацилоксиацильные группы присутствуют в липидном А компоненте грам-отрицательных бактерий, таких как Escherichia coli, Haemophilus influenzae, Campylobacter jejuni, Rhodocyclus gelatinosus, Chromobacterium violaceum, Neisseria meningitides, Salmonella Minnesota.
В одной группе предпочтительных глюкозамин-дисахаридов согласно изобретению ацилоксиацильной группой, выбранной для R5, является 3-гидрокси-C14-жирная кислота-ацил, связанный сложноэфирной связью с 3-гидрокси группой C12-жирной кислоты, с данной ацилоксиацильной группой в N2'-положении. В еще одном предпочтительном глюкозамин-дисахариде согласно изобретению ацилоксиацильной группой, выбранной для R5, является 3-гидрокси-C14-жирная кислота-ацил, связанный сложноэфирной связью с 3-гидроксигруппой C14-жирной кислоты, и ацилоксиацильная группа находится в N-2' положении.
В еще одном предпочтительном глюкозамин-дисахариде согласно изобретению ацилоксиацильной группой, выбранной для R5, является 3-гидрокси-C14-жирная кислота-ацил, связанный сложноэфирной связью с 3-гидроксигруппой C12-жирной кислоты, с данной ацилоксиацильной группой в N-2 положении. В еще одном предпочтительном глюкозамин-дисахариде согласно изобретению ацилоксиацильной группой, выбранной для R5, является 3-гидрокси-C14-жирная кислота-ацил, связанный сложноэфирной связью с 3-гидроксигруппой C12-жирной кислоты, с ацилоксиацильной группой и в N2-положении, и в N2'-положении.
Когда соединение изобретения включает хиральный центр, изобретение охватывает все R- и S-энантиомеры и любую рацемическую смесь.
Другим выбором для R5 может быть ацильная группа или также ацилоксиацильная группа.
Согласно второй группе дисахаридов согласно изобретению ацильной группой является 3-гидрокси (C4-C24)-жирная кислота, предпочтительно 3-гидрокси (C10-C18)-жирная кислота. 3-Гидроксигруппа такой жирной кислоты может быть защищена группой Х, определенной ранее. В предпочтительных дисахаридах согласно изобретению ацильной группой является 3-гидрокси C14-жирная кислота, в N2-положении или в N2'-положении.
Однако R5 может также быть ацилоксиацильной группой, определенной здесь выше и включающей в число их 3-гидрокси-(C4-C24)жирную кислоту-ацил, который является связанным сложноэфирной связью с 3-гидрокси группой (C1-C20) карбоновой кислоты, предпочтительно 3-гидрокси-(C8-C18)жирную кислоту-ацил, связанный сложноэфирной связью с 3-гидрокси группой (C10-C18) жирной кислоты. Более предпочтительным является дисахарид, в котором R5 в N2-положении представляет собой 3-гидрокси-C14-жирную кислоту-ацил, связанный сложноэфирной связью с 3-гидрокси группой C12-жирной кислоты или C16-жирной кислоты, и в котором R5 в N2'-положении представляет 3-гидрокси-C14-жирную кислоту-ацил, связанный сложноэфирной связью с 3-гидрокси группой C12-жирной кислоты, C12-жирной кислоты или C14-жирной кислоты.
Согласно предпочтительному воплощению первая группа R5 выбрана из подгруппы (i), как она определена, и вторая группа R5 выбрана из подгруппы (ii) или (iii), определенных в п.1 формулы изобретения, где группа R5 в N-2 положении выбрана из (i). В альтернативных воплощениях обе группы R5 выбраны идентично или различно из подгруппы (i) или обе выбраны идентично или различно из подгрупп (ii) или (iii).
Отмечается, что в группе R5 ацильные группы и/или ацильная и алкильная группа могут быть взаимосвязаны.
В данном описании термин “остаток жирной кислоты” означает по существу гидрофобную цепь из C2-C30 атомов, которая может быть линейной, разветвленной, насыщенной, моно- или полиненасыщенной, имеющей один или более гетероатомов, таких как азот, кислород, сера, и которая может быть замещена одним или более заместителями, такими как гидроксил, оксо, ацилокси, алкокси, амино, нитро, циано, галоген, сульфгидрил, при условии, что биологическая активность по существу не испытывает отрицательного воздействия. Пример остатка замещенной жирной кислоты (включая амид-связанный заместитель) описан авторами Onozuka, K. et al. в Int. J. Immunopharmac, Volume 15, страницы 657-664 [1993]).
R4 может быть выбран из (a)-(l), определенных выше. Алкильная, алкенильная, алкинильная цепи в данных заместителях для R4 могут быть разветвленными или линейными и могут быть незамещенными или необязательно замещенными одной или более группами, независимо выбранными из галогена, такого как фтор, хлор, бром или йод; гидроксила или гидроксильного производного -OY, где Y имеет значения, определенные выше; амина или производного амина -NHW, где W имеет значения, определенные выше. Для групп (a), (b), (c), (d), (e) необязательные заместители могут дополнительно включать в их число группу -OZ, где Z выбран из (f), (g), (h), (i), (j), (k). Предпочтительно R4 выбран из (f), (g), (h), (i) или (j), более предпочтительно из (g). Предпочтительно группы (a), (b), (c), (d), (e), (f), (g), (h), (i), (j) включают от 1 до 50 атомов углерода, например от 2 до 24 атомов углерода.
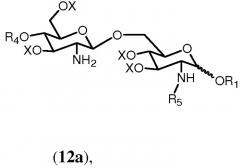
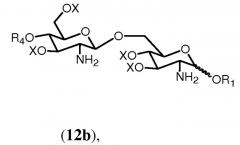
На последующей стадии ряд (С1-С6) галогенированных алкоксикарбонильных защитных групп R2 гидролитически удаляется из соединения формулы 11h. В данном описании ряд обозначает одну или более, если не конкретизировано иным образом. Предпочтительно, чтобы все группы R2 соединения формулы 11h удалялись. Если в качестве R5 выбран R0, тогда соединение формулы 11h будет включать одну группу R2. Если R0 выбран в качестве R2, тогда соединение формулы 11h будет включать две группы R2 и будет предпочтительно удалять обе данные группы. Группы R2 могут быть удалены любыми подходящими средствами, известными специалистам. Специалисту известно, что (С1-С6) галогенированные алкоксикарбонильные защитные группы, такие как Troc, могут удаляться с использованием цинк-медной пары в уксусной кислоте и воде.
Если в качестве R5 выбран R0, тогда получится соединение формулы 12а.
в которой R1, R4, R5 и Х имеют значения, определенные выше. Если R0 выбран в качестве R2 в формуле 11h, тогда получится предпочтительно соединение формулы 12b.
где R1, R4 и Х имеют значения, определенные выше.
К свободной аминогруппе соединения формулы 12a или 12b присоединяют группу R5. Это может достигаться с помощью реакции соединения формулы 12а или 12b с (активированной) карбоновой кислотой, соответствующей указанной группе R5. Реакция может проводиться любым способом, известным специалистам, таким как с использованием конденсирующего агента, такого как изобутилхлорформиат или 1-изобутилокси-2-изобутилоксикарбонил-1,2-дигидрохинолеин или карбодиимид. В реакции соединения 12а (активированная) карбоновая кислота, соответствующая указанной группе R5, может включать группу R5, одинаковую или отличную от группы R5 соединения формулы 12а.
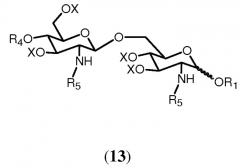
Реакция соединения формулы 12а или 12b с (активированной) карбоновой кислотой, соответствующей указанной группе R5, приводит в результате к образованию соединения формулы 13:
в которой R1, R4, R5 и Х имеют значения, определенные ранее. Группы R5 могут быть одинаковыми или различными. Являются ли группы R5 соединения 13 одинаковыми или различными, может зависеть от того, используется ли в реакции соединение 12а или соединение 12b, и от характера (активированной) карбоновой кислоты, используемой в реакции. Если используется соединение 12b, можно выбрать группу R5 (активированной) карбоновой кислоты, отличную от группы R5 соединения 12b. В данном случае группы R5 соединения 13 будут различаться. Однако группа R5 (активированной) карбоновой кислоты может быть также идентична группе R5 соединения 12b. И ясно очевидно, что в этом случае группы R5 соединения 13 будут идентичными. Если соединение 12а подвергается реакции с одной (активированной) карбоновой кислотой, группы R5 соединения 13 будут идентичными. Однако можно также использовать комбинаторную химию и подвергать реакции соединение 12b с рядом различающихся (активированных) карбоновых кислот. В этом случае будет получаться смесь соединений согласно общей формуле 13, в которых группы R5 являются одинаковыми или различными. Специалист в данной области очевидно понимает, что число различных соединений общей формулы 13 и их соотношения в смеси будут зависеть от числа различных (активированных) карбоновых кислот, используемых в реакции, и от их соотношений. Предпочтительно, чтобы, по меньшей мере, одна из R5 была выбрана из разветвленной ацильной группы, определенной в (ii), (iii). Более предпочтительно в качестве разветвленной ацильной группы выбирается группа R5, присоединенная в N2'-положении.
Полуацеталь формулы 14:
в которой R4, R5 и Х имеют значения, определенные выше, образуется с помощью удаления группы R1 из соединения формулы 13. Снятие защиты (C3-C6)алкенильной группы может достигаться любым способом, известным специалисту. Например, (C3-C6)алкенильная группа может быть удалена двухстадийным превращением. Если (C3-C6)алкенильной группой является, например, 2-пропенил, сначала аллильная группа в 13 может изомеризоваться в 1-пропенил с помощью обработки водород-активируемым иридиевым катализатором, таким как промышленно доступный гексафторфосфат ([бис(метилдифенилфосфин)]-(1,5-циклооктадиен)иридия(I)) в полярном растворителе, таком как тетрагидрофуран (Synthesis, (1981), 305-308). 1-пропенильная группа может затем отщепляться водным источником иода, таким как йод или N-бромсукцинимид. (J. Chem. Soc., Chem. Commun., (1982), 1274). По аналогии могут удаляться различные варианты группы R1.
Соединение 13 и полуацеталь формулы 14 являются важными промежуточными продуктами в способе синтеза согласно изобретению. В зависимости от реакций, проводимых с соединениями 13 и 14, и получающихся в результате их промежуточных соединений может получаться большое число различных защищенных β-(1→6)-связанных глюкозамин-дисахаридов с различными заместителями R8 в О-1 положении. Данные β-(→6)-связанные глюкозамин-дисахариды могут быть представлены общей формулой 15:
где R4, R5 и Х имеют значения, определенные ранее, и R8 выбран из (a), (b), (c), (d), (e), (f), (g), (h), (i), (j) или (k), определенных ранее для R4.
В одном из воплощений способа синтеза изобретения свободная гидроксильная группа соединения 14 может фосфорилироваться любым известным специалисту способом. Для этого может использоваться промышленно доступный тетрабензилпирофосфат в присутствии подходящего основания в полярном растворителе. Основание может быть выбрано из бис(триметилсилил)амида лития, а растворитель может быть выбран из тетрагидрофурана. Фосфорилирование соединения 14 дает в результате соединение 15а
Фосфорилирование может быть полезным для получения соединений, имеющих в О-1 положении заместители, выбранные из (g), (h), (i) или (j), определенных для R4. Если необходимо, фосфатная группа, получаемая в соединении 15а, может далее модифицироваться.
В еще одном воплощении свободная гидроксильная группа соединения 14 может сульфатироваться любым известным специалисту образом. Сульфатирование соединения 14 дает в результате соединение формулы 15b:
В еще одном воплощении способ согласно изобретению дополнительно предусматривает реакцию свободной гидроксильной группы соединения 14 с (активированной) карбоновой кислотой формулы R8OH, в которой R8 выбран из (а), определенного ранее для R4. Реакция может осуществляться любым известным специалисту образом, таким как в присутствии конденсирующего агента, такого как изобутилхлорформиат или 1-изобутилокси-2-изобутилоксикарбонил-1,2-дигидрохинолеин, или карбодиимид с образованием соединения 15с:
где R4, R5 и Х имеют значения, определенные выше, и R8 выбран из (а), определенного ранее для R4, и R8 может находиться в α- или β-конфигурации, и предпочтительно в β-конфигурации.
В еще одном воплощении группа, которая может функционировать в последующей реакции как уходящая группа, такая как трихлорацетимидатная группа, сочетается со свободной гидроксильной группой соединения 14. Это может осуществляться любым известным специалисту образом, например, с помощью реакции соединения 14 с трихлорацетонитрилом в присутствии неорганического основания, такого как карбонат цезия или карбонат калия, в полярном растворителе, предпочтительно апротонном полярном растворителе, таком как дихлорметан. Данная реакция соединения 14 приводит в результате к соединению формулы 24:
Соединение 24 может подвергаться реакции с органической молекулой R8OH с заменой трихлорацетимидатной группы группой R8. R8 может быть выбран из (b), (c), (d), (e), определенных для R4.
Реакция ацетимидатной группы с органическим спиртом известна специалистам. Она может происходить в полярном растворителе, предпочтительно апротонном полярном растворителе, таком как дихлорметан, в присутствии каталитического количества кислоты, такой как триметилсилилтрифторметансульфонат, и может проводиться по аналогии со способом, описанным в Angew. Chem., Int. Ed. Engl., (1986), 212. Реакция соединения 24 с группой R8 дает в результате соединение формулы 15d:
где R4, R5, R8 и Х имеют значения, определенные выше, и где R8 может находиться в α- или β-конфигурации, и предпочтительно в β-конфигурации.
Соединения 13, 15а, 15b, 15с и 15d могут далее подвергаться реакции так, чтобы удалить любые защитные группы, выбранные из Х, Y, W, отличных от Н. Удаление защитных групп может достигаться в соответствии с известными в технике способами. Например, бензильные защитные группы могут удаляться с помощью гидрогенолиза в присутствии благородного металла, такого как палладий-на-угле. Аллильные группы и аналогичные группы могут быть удалены, как обсуждалось выше для удаления аллильной группы из соединения 13. Удаление 4-метоксибензильной или 3,4-диметоксибензильной, или 2,5-диметоксибензильной, или 2,3,4-триметоксибензильной, или 3,4,5-триметоксибензильной, или фенильной, или 4-метоксифенильной, или 3,4-диметоксифенильной, или 2,5-диметоксифенильной, или 2,3,4-триметоксифенильной, или 3,4,5-триметоксифенильной групп может проводиться с помощью окислительного отщепления, такого как с помощью дихлордицианохинона (DDQ) или аммонийнитрата церия (CAN). О-Ксилиленовая группа и бензилоксикарбонильная группа могут удаляться с помощью гидрогенолиза в присутствии благородного металла, такого как палладий-на-угле. 9-Флуоренилметилоксикарбонил может удаляться основанием, таким как пиперидин, морфолин. Очевидно понятно, что различные защитные группы могут удаляться независимо. Следовательно, перед удалением Х может быть удалена любая защитная группа, присутствующая в R8.
Реакционноспособные группы, первоначально присутствующие в R8 или после удаления защитной группы, могу