Ферментативная противоопухолевая терапия
Иллюстрации
Показать всеГруппа изобретений относится к новым способам лечения и замедления роста опухолей, а в особенности злокачественных солидных опухолей, посредством введения эффективного количества аденозиндеаминазы, конъюгированной с неантигенным полимером, для восстановления уровней аденозина и дезоксиаденозина в тканях. После лечения опухоль проявляет уменьшенный объем или уменьшенную скорость роста. 2 н. и 17 з.п. ф-лы, 5 табл., 10 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННУЮ ЗАЯВКУ
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 60/913,039, поданной 20 апреля 2007 г., содержание которой включено в настоящую заявку путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение представляет новые способы лечения и замедления роста опухолей, а в особенности злокачественных солидных опухолей, посредством введения аденозиндеаминазы для восстановления уровней аденозина и дезоксиаденозина в тканях.
УРОВЕНЬ ТЕХНИКИ
Опухоль представляет собой доброкачественное или злокачественное образованием клеток или ткани, которое является результатом нерегулируемой клеточной пролиферации. Злокачественная опухоль является такой опухолью, которая распространяется из участка своего образования, и также известна в уровне техники как рак. Таким образом, опухоли и раковые опухоли представляют собой группу заболеваний, обладающих общим свойством нерегулируемого или ненадлежащего роста клеток. В широком смысле, злокачественные опухоли являются либо опухолями, происходящими из кроветворных клеток, такими как лейкоз, либо солидными опухолями. Злокачественные опухоли, происходящие из кроветворных клеток, обычно циркулируют в крови, а солидные злокачественные опухоли распространяются от первичной опухоли по всему телу. Затем распространенные опухолевые клетки могут развиться во множественные вторичные опухоли в процессе метастазирования. Чтобы солидная опухоль могла подвергнуться такому метастатическому распространению, клетки солидной опухоли должны покинуть первичную или исходную опухоль, попасть в кровоток или лимфатическую систему, а затем оттуда проникнуть в ткань других органов, где они делятся и формируют новые опухоли. Метастазирование представляет собой сложный многостадийный процесс, который включает изменения адгезии и подвижности опухолевых клеток, секрецию протеолитических ферментов, хемоатрактантов и протеогликанов, а также другие факторы. Кроме того, ангиогенез или формирование новых кровеносных сосудов также является существенно важным этапом в метастатическом процессе (Folkman, 1995, Nature Medicine 1:27-31).
Иммунная система, как было также показано, ингибирует метастазирование таких злокачественных опухолевых клеток, при этом сообщалось, что аденозин, в свою очередь, может ингибировать такие иммунные защитные реакции. Например, Loshkin и др. (2006, Cancer Res., 66: 7758-7765) сообщали, что аденозин ингибирует активацию и выработку цитокина в киллерных T-клетках. Аденозин отрицательно воздействует на другую свободную функцию, включая клеточные элементы и воспалительные функции (см., например, обзоры Spychala, 2000, Pharmacology & Therapeutics, 87:161-173 и Sitkovesky et al., 2005, Nature Reviews Immunology, 5:713-721). Sitkovesky и др. в WO 03/050241, опубликованном 19 июня 2003 г., также описали способы усиления иммунного ответа на антиген и лечения опухолей путем введения антагониста аденозинового рецептора, который может включать аденозиндеаминазу.
Также было показано, что аденозин способствует миграции опухолевых клеток и ангиогенезу (Barcz et al., 2000, Oncol. Rep., 7(6):1285-91; Adair, 2005, Am. J. Physiol. Regul. Integr. Comp. Physiol., 289:R283-R296) и что аденозин стимулирует пролиферацию клеток колоректального рака (Mujoomdar et al., 2003, Biochemical Pharmacology, 66:1737-1747). Asmar и др. (1966, Proc. Am. Assoc. Cancer Res., Реферат №73) также сообщали, что в мышиной модели асцита рост некоторых опухолевых клеток, более чем на 50%, ингибировала инъекция АДА. Это были клетки лимфатических лейкозов L1210 и L4946, лимфосаркомы 6C3HED, аденокарциномы молочной железы TA3, а также карциномы Эрлиха E2. В том же реферате аденокарцинома 755, как сообщали, была в два раза более устойчивой, а саркома 180 - полностью устойчивой к указанному эффекту. В WO03050241 A2 описаны эффекты ингибитора аденозиновых рецепторов в отношении клеток меланомы B 16. Хотя в WO03050241 A2 АДА упоминается как ингибитор аденозина, не приведено никакого конкретного описания применения АДА при лечении конкретных раковых опухолей, а в частности рака яичников и рака простаты.
Таким образом, для некоторых опухолей присутствие аденозина, по-видимому, обеспечивает сигнал "пуска" пролиферации опухоли и ангиогенеза опухоли, а также сигнал "стоп" для киллерных T-клеток, которые обычно уничтожали бы данные опухоли.
В противоположность вышеописанным результатам Lind и др. (патент США 6579857) сообщили, что аденозин в комбинации с ингибитором фермента аденозиндеаминазы и/или в комбинации с противоопухолевым средством, таким как коформицин, может применяться в способе потенцирования гибели неопластических клеток эпителиального происхождения. Таким образом, данная ссылка позволяет предположить, что роль аденозина в раке является более сложной и неустановленной.
Как указано выше, средством для снижения уровней эндогенного аденозина является фермент аденозиндеаминаза. Аденозиндеаминаза (АДА), обозначенная как EC 3.5.4.4, является важным ферментом в метаболизме пурина. АДА превращает аденозин или дезоксиаденозин, в присутствии воды, в инозин или дезоксиинозин и аммиак. Известно, что у людей, в гене АДА которых присутствуют неблагоприятные мутации, могут развиться иммунодефицитные состояния различной степени, от умеренной до тяжелой, то есть тяжелый комбинированный иммунодефицит (ТКИД). ТКИД, как было подтверждено, возникает в результате токсического накопления субстратов фермента, аденозина и дезоксиаденозина, в незрелых лимфоцитах. Начало заболевания может варьировать от раннего детского возраста до взрослого состояния, в зависимости от наследуемых мутаций. Дефицит АДА является одной из ведущих причин ТКИД у детей и служит одной из главных целей для методов генной терапии (R. Parkman et al., 2000, "Gene therapy for adenosine deaminase deficiency", Aim. Rev, Med., 51:33-47).
Ранее АДА выделяли в промышленном масштабе из источников, полученных из крупного рогатого скота, и применяли при лечении ряда заболеваний, включая ТКИД, в форме бычьей АДА, конъюгированной с полимером - полиэтиленгликолем (ПЭГ). ПЭГилированная АДА для медицинского применения коммерчески поставляется компанией Энзон Фармасьютикалз под торговой маркой ADAGEN® (ПЭГилированная АДА). Конъюгирование молекулы ПЭГ с АДА позволяет ферменту произвести свой полный терапевтический эффект благодаря повышению продолжительности циркуляции с сохранением при этом по сути неантигенности АДА в целях минимизации возможности развития иммуногенных реакций. Также можно получать рекомбинантные человеческие или бычьи ферменты АДА для применения в форме конъюгатов, как описано в заявке на патент США 11/738,012 (настоящего заявителя), озаглавленной "Стабилизированные белки" (Stabilized Proteins), и заявке на патент США______(настоящего заявителя), озаглавленной "Стабильная рекомбинантная аденозиндеаминаза" (Stable Recombinant Adenosine Deaminase), поданной в одну и ту же дату с настоящей заявкой и испрашивающей приоритет заявки на патент США 60/913,009, которые полностью включены в настоящую заявку путем отсылки.
Таким образом, в уровне техники существует многолетняя потребность в новых и улучшенных способах лечения или ингибирования роста, распространения и развития раковых опухолей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В этой связи изобретение обеспечивает способ лечения пациента, имеющего опухоль, включающий введение эффективного количества АДА пациенту, испытывающему в этом потребность. Эффективное количество является количеством, которое, как легко может определить средний специалист в данной области, снижает уровни аденозина или дезоксиаденозина в тканях пациента, и где рост или распространение опухоли ингибируется в результате существенного снижения уровней аденозина в тканях пациента. Путь введения является таким путем, как подкожный, внутривенный, внутримышечный, интратекальный, внутрибрюшинный, ингаляционный и трансуретральный.
Опухоль может быть злокачественной или доброкачественной и предпочтительно является солидной опухолью, например такой опухолью, как опухоль простаты, рак яичников и/или колоректальный рак.
Аденозиндеаминаза предпочтительно конъюгирована с по существу неантигенным полимером, таким как полиалкиленоксид (ПАО). Предпочтительно размер ПАО изменяется в диапазоне от приблизительно 4000 до приблизительно 45000 дальтон. ПАО предпочтительно является полиэтиленгликолем (ПЭГ). Молярное отношение АДА к полимеру может составлять 1:1, или на молекулу полимера может приходиться две или более молекул АДА, или, более предпочтительно, от приблизительно 1 до приблизительно 20 полимерных молекул (то есть 11-18 цепей ПЭГ) на молекулу АДА.
АДА-полимерный конъюгат предпочтительно вводят в дозе, варьирующей в диапазоне от приблизительно 10 Е до приблизительно 30 Е на кг или больше, и в течение достаточного промежутка времени, чтобы поддерживать ингибирование опухоли, например, от приблизительно 1 до приблизительно 20 дней или дольше.
Количество аденозиндеаминазы, которое вводят, является эффективным, чтобы существенно понизить уровни аденозина или дезоксиаденозина в тканях пациента, и где рост или распространение опухоли ингибируются в результате существенного снижения уровней аденозина в тканях указанного пациента. Например, это - доза аденозиндеаминазы, изменяющаяся в диапазоне от приблизительно 10 Е до приблизительно 30 Е на кг. Дозу вводят повторно в течение достаточного промежутка времени, чтобы поддерживать ингибирование опухоли, например, в течение от приблизительно 1 до приблизительно 20 дней или дольше. Дозу вводят любым подходящим путем, например подкожно, внутривенно, внутримышечно, интратекально, внутрибрюшинно, ингаляционно и трансуретрально.
Аденозиндеаминаза необязательно выделена из источника, который относится к крупному рогатому скоту, или является рекомбинантной аденозиндеаминазой. Рекомбинантная аденозиндеаминаза является, например, рекомбинантной бычьей аденозиндеаминазой (Ser74-рбАДА), включающей SEQ ID NO: 1, рекомбинантной аденозиндеаминазой человека (Ser74-рчАДА) включающей SEQ ID NO: 3, и рекомбинантной бычьей аденозиндеаминазой, включающей SEQ ID NO: 5, и/или их вариантами или полиморфизмами. Рекомбинантно полученная бычья аденозиндеаминаза, например SEQ ID NO: 5, необязательно кэпирована по Cys74 для повышения стабильности в водной среде.
В рамках настоящего изобретения термин "остаток", как следует понимать, означает ту часть соединения, к которому она относится, например ПЭГ, АДА, аминокислоту и т.д., которая остается после того, как она подверглась реакции замещения другим соединением.
В рамках настоящего изобретения термин "полимерный остаток", например, "остаток ПЭГ", как следует понимать, означает ту часть полимера или ПЭГ, которая остается после того, как он подвергся реакции с другими соединениями, группами и т.д.
В рамках настоящего изобретения термин "алкил", используемый в настоящем описании, относится к насыщенному алифатическому углеводороду, включая линейные, разветвленные и циклические алкильные группы. Термин "алкил" также включает алкил-тио-алкильные, алкоксиалкильные, циклоалкилалкильные, гетероциклоалкильные и C1-6-алкилкарбонилалкильные группы. Предпочтительно алкильная группа включает 1-12 атомов углерода. Более предпочтительно алкильная группа является низшим алкилом, включающим приблизительно 1-7 атомов углерода, наиболее предпочтительно приблизительно 1-4 атома углерода. Алкильная группа может быть замещена или незамещена. Когда алкильная группа замещена, замещенная группа (группы) предпочтительно включает гало, окси, азидо, нитро, циано, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-гидрокарбонил, арил и амино.
В рамках настоящего изобретения термин "замещенный", используемый в настоящем описании, относится к добавлению или замене одного или нескольких атомов, содержащихся в пределах функциональной группы или соединения, одной из групп, выбранных из гало, окси, азидо, нитро, циано, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-алкилкарбонилалкил, арил и амино.
В рамках настоящего изобретения термин "алкенил" относится к группам, содержащим, по меньшей мере, одну углерод-углеродную двойную связь, включая линейные, разветвленные и циклические группы. Предпочтительно алкенильная группа включает приблизительно 2-12 атомов углерода. Более предпочтительно алкенильная группа является низшим алкенилом, включающим приблизительно 2-7 атомов углерода, наиболее предпочтительно приблизительно 2-4 атома углерода. Алкенильная группа может быть замещена или незамещена. Когда алкенильная группа замещена, замещенная группа (группы) предпочтительно включает гало, окси, азидо, циано, нитро, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-алкилкарбонилалкил, арил и амино.
В рамках настоящего изобретения термин "алкинил" относится к группам, содержащим, по меньшей мере, одну углерод-углеродную тройную связь, включая линейные, разветвленные и циклические группы. Предпочтительно алкинильная группа включает приблизительно 2-12 атомов углерода. Более предпочтительно алкинильная группа является низшим алкинилом, включающим приблизительно 2-7 атомов углерода, наиболее предпочтительно приблизительно 2-4 атома углерода. Алкинильная группа может быть замещена или незамещена. Когда алкинильная группа замещена, замещенная группа (группы) предпочтительно включает гало, окси, азидо, нитро, циано, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-гидрокарбонил, арил и амино. Примеры "алкинила" включают пропаргил, пропин и 3-гексин.
В рамках настоящего изобретения термин "арил" относится к ароматической углеводородной кольцевой системе, содержащей, по меньшей мере, одно ароматическое кольцо. Ароматическое кольцо необязательно может быть сконденсировано или иным образом присоединено к другим ароматическим углеводородным кольцам или неароматическим углеводородным кольцам. Примеры арильных групп включают, например, фенил, нафтил, 1,2,3,4-тетрагидронафталин и бифенил. Предпочтительные примеры арильных групп включают фенил и нафтил.
В рамках настоящего изобретения термин "циклоалкил" относится к циклическому C3-8-углеводороду. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил.
В рамках настоящего изобретения термин "циклоалкенил" относится к циклическому C3-8-углеводороду, содержащему, по меньшей мере, одну углерод-углеродную двойную связь. Примеры циклоалкенила включают циклопентенил, циклопентадиенил, циклогексенил, 1,3-циклогексадиенил, циклогептенил, циклогептатриенил и циклооктенил.
В рамках настоящего изобретения термин "циклоалкилалкил" относится к алкильной группе, замещенной C3-8-циклоалкильной группой. Примеры циклоалкилалкильной группы включают циклопропилметил и циклопентилэтил.
В рамках настоящего изобретения термин "алкокси" относится к алкильной группе с указанным количеством атомов углерода, присоединенной к основной части молекулы через кислородный мостик. Примеры алкоксигрупп включают, например, метокси, этокси, пропокси и изопропокси.
В рамках настоящего изобретения "алкиларильная" группа относится к арильной группе, замещенной алкильной группой.
В рамках настоящего изобретения "аралкильная" группа относится к алкильной группе, замещенной арильной группой.
В рамках настоящего изобретения термин "алкоксиалкильная" группа относится к алкильной группе, замещенной алкоксигруппой.
В рамках настоящего изобретения термин "алкил-тио-алкил" относится к алкил-S-алкил-тиоэфиру, например метилтиометилу или метилтиоэтилу.
В рамках настоящего изобретения термин "амино" относится к азотсодержащей группе, которая, как известно из уровня техники, получена из аммиака путем замещения одного или нескольких водородных радикалов органическими радикалами. Например, термины "ациламино" и "алкиламино" относятся к определенным органическим радикалам, N-замещенным ацильной и алкильной замещающими группами соответственно.
В рамках настоящего изобретения термин "алкилкарбонил" относится к карбонильной группе, замещенной алкильной группой.
В рамках настоящего изобретения термины "галоген" или "гало" относятся к фтору, хлору, брому и иоду.
В рамках настоящего изобретения термин "гетероциклоалкил" относится к неароматической кольцевой системе, содержащей, по меньшей мере, один гетероатом, выбранный из азота, кислорода и серы. Гетероциклоалкильное кольцо необязательно может быть сконденсировано или иным образом присоединено к другим гетероциклоалкильным кольцам и/или неароматическим углеводородным кольцам. Предпочтительные гетероциклоалкильные группы включают от 3 до 7 членов. Примеры гетероциклоалкильных групп включают, например, пиперазин, морфолин, пиперидин, тетрагидрофуран, пирролидин и пиразол. Предпочтительные гетероциклоалкильные группы включают пиперидинил, пиперазинил, морфолинил и пирролидинил.
В рамках настоящего изобретения термин "гетероарил" относится к ароматической кольцевой системе, содержащей, по меньшей мере, один гетероатом, выбранный из азота, кислорода и серы. Гетероарильное кольцо может быть сконденсировано или иным образом присоединено к одному или нескольким гетероарильным кольцам, ароматическим или неароматическим углеводородным кольцам или гетероциклоалкильным кольцам. Примеры гетероарильных групп включают, например, пиридин, фуран, тиофен, 5,6,7,8-тетрагидроизохинолин и пиримидин. Предпочтительные примеры гетероарильных групп включают тиенил, бензотиенил, пиридил, хинолил, пиразинил, пиримидил, имидазолил, бензимидазолил, фуранил, бензофуранил, тиазолил, бензотиазолил, изоксазолил, оксадиазолил, изотиазолил, бензизотиазолил, триазолил, тетразолил, пирролил, индолил, пиразолил и бензопиразолил.
В рамках настоящего изобретения термин "гетероатом" относится к азоту, кислороду и сере.
В некоторых вариантах осуществления замещенные алкилы включают карбоксиалкилы, аминоалкилы, диалкиламино, гидроксиалкилы и меркаптоалкилы; замещенные алкенилы включают карбоксиалкенилы, аминоалкенилы, диалкениламино, гидроксиалкенилы и меркаптоалкенилы; замещенные алкинилы включают карбоксиалкинилы, аминоалкинилы, диалкиниламино, гидроксиалкинилы и меркаптоалкинилы; замещенные циклоалкилы включают такие группы, как 4-хлорциклогексил; арилы включают такие группы, как нафтил; замещенные арилы включают такие группы, как 3-бромфенил; аралкилы включают такие группы, как толил; гетероалкилы включают такие группы, как этилтиофен; замещенные гетероалкилы включают такие группы, как 3-метокси-тиофен; алкокси включает такие группы, как метокси; и фенокси включает такие группы, как 3-нитрофенокси. Гало, как следует понимать, включает фтор, хлор, иод и бром.
В рамках настоящего изобретения "положительное целое число", как следует понимать, включает целое число, большее или равное 1 и, как будет понятно средним специалистам в данной области, находится в пределах области рациональности.
В рамках настоящего изобретения термин "связанный", как следует понимать, включает ковалентное (предпочтительно) или нековалентное присоединение одной группы к другой, то есть в результате химической реакции.
Понятия "эффективные количества" и "достаточные количества" в рамках настоящего изобретения должны означать количество, которое обеспечивает достижение требуемого эффекта или терапевтического эффекта, причем эффект как таковой понятен средним специалистам в данной области.
В рамках настоящего изобретения термин "аденозин", как следует понимать, включает нуклеозиды аденозин и дезоксиаденозин. Аденозин также включает аденозин и дезоксиаденозин, присутствующие в форме АМФ, АДФ, АТФ, дАМФ, дАДФ или дАТФ.
В рамках настоящего изобретения понятия "аденозин-опосредованная опухоль" или "аденозиндеаминаза-реактивная опухоль", как следует понимать, широко включают любые типы опухолей, при которых успешно применяют введение АДА или ее активной фракции и т.д., независимо от пути введения.
В рамках настоящего изобретения понятия "лечение аденозин-опосредованной опухоли", или "лечение аденозиндеаминаза-реактивной опухоли", или "ингибирование роста аденозин-опосредованной опухоли", или "ингибирование роста аденозиндеаминаза-реактивной опухоли", как следует понимать, означают минимизацию или уменьшение проявления симптомов или состояний, по сравнению с наблюдаемыми в отсутствие лечения с применением АДА. Степень реконвалесценции можно подтвердить, например, по снижению уровня аденозина.
В широком смысле, лечение следует считать успешным, когда получен требуемый клинический ответ. Например, успешность лечения можно подтвердить, получив, например, 10%-ное или выше (то есть 20%-ное, 30%-ное, 40%-ное) ингибирование роста опухоли. В альтернативе успешность лечения можно подтвердить, получив, по меньшей мере, 20%-ное или предпочтительно 30%-ное, более предпочтительно 40%-ное или выше (то есть 50%-ное или 80%-ное) снижение уровня аденозина в раковых клетках или тканях, включая другие клинические показатели, рассматриваемые специалистом в данной области, по сравнению с наблюдаемым в отсутствие лечения с применением АДА, описанного в настоящей заявке.
Кроме того, применение терминов в форме единственного числа для удобства описания никоим образом не следует считать ограничивающим в какой-либо мере. Таким образом, например, ссылка на композицию, включающую фермент, относится к одной или более молекулам данного фермента. Нужно также понимать, что настоящее изобретение не ограничено конкретными конфигурациями, стадиями процессов и материалами, описанными в настоящей заявке, поскольку такие конфигурации, стадии процессов и материалы могут несколько изменяться.
Нужно также понимать, что терминология, используемая в настоящей заявке, используется лишь с целью описания конкретных вариантов осуществления и не должна являться ограничивающей, поскольку объем настоящего изобретения будет определяться прилагаемой формулой и ее эквивалентами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, настоящее изобретение обеспечивает новые способы лечения опухолей, включая раковые опухоли, посредством введения фермента АДА пациенту, испытывающему в этом потребность, в количестве и в течение некоторого промежутка времени, достаточных для снижения количества аденозина, присутствующего в тканях и/или жидкостях в организме пациента. Предпочтительно фермент АДА конъюгирован с полимером. В отношении опухолей, которые зависят от присутствия аденозина, необходимого для их роста, метастатического распространения и/или для защиты от иммунной системы пациента, достаточное снижение уровня эндогенного аденозина ограничивает или предотвращает развитие рака, распространение метастазов и/или обеспечивает нормальную противоопухолевую активность иммунной системы пациента.
Также предусматривается, что лечение опухолей с применением АДА в соответствии с изобретением необязательно проводят в комбинации или совместно с одним или несколькими другими подходящими, известными из уровня техники способами лечения онкологических заболеваний и противоопухолевыми средствами, как более подробно описано ниже. Комбинированное лечение настоящего изобретения включает введение эффективного количества соединений, описанных в настоящей заявке, отдельно или в комбинации, одновременно или последовательно, со вторым химиотерапевтическим средством.
Примеры известных в уровне техники противоопухолевых средств, предназначенных для подобных способов комбинированного лечения, включают, например, Таксол™, бевацизумаб (Авастин 11), винкристин, винбластин, неомицин, комбретастатин(ы), подофиллотоксин(ы), ФНО-альфа, ангиостатин, эндостатин, васкулостатин, антагонисты интегрина альфаv-бета3, кальций-ионофоры, средства, индуцирующие поток ионов кальция, а также любые их производные или пролекарства.
Дополнительные противоопухолевые средства также включают химиотерапевтические средства, радиотерапевтические средства, цитокины, антиангиогенные средства, апоптоз-индуцирующие средства или противоопухолевые иммунотоксины или коагулирующие лиганды. Одним из таких иммунотоксинов является, например, Эрбитукс® (цетуксимаб). "Химиотерапевтические средства", используемые в настоящей заявке, относятся к классическим химиотерапевтическим средствам или лекарственным средствам, применяемым при лечении злокачественных новообразований. Указанный термин используется для простоты, несмотря на тот факт, что в качестве химиотерапевтических средств технически могут быть указаны другие соединения, которые оказывают противоопухолевое действие. Впрочем, "химиотерапевтический" имеет четкое значение в уровне техники и используется согласно данному стандартному значению.
Таким образом, способ настоящего изобретения может применяться в комбинации с одним или несколькими химиотерапевтическими средствами, которые, как известно, являются эффективными при лечении рака, включающими, помимо прочих, 5-азацитидин, 5-фторурацил, необязательно в комбинации с лейковорином, 5-фтордезоксиуридин, 6-меркаптопурин, 6- тиогуанин, митоксантрон, азиридинилбензохинон (AZQ), кармустин (BCNU или BiCNU®, Bristol-Myers-Squibb), блеомицин, карбоплатин (CBDCA), ломустин (CCNU), метил-CCNU или MeCCNU, хлорамбуцил, хлордезоксиаденозин, цисплатин, циклофосфамид, цитарабин, дактиномицин, даунорубицин, дезоксикоформицин, доксорубицин, доксикоформицин, DTIC (дакарбазин), эпирубицин, этопозид (VP-16), флударабин, гексаметилмеламин, гидроксимочевина, идарубицин, ифосфамид, ифосфамид и месна, левамизол, N- ацетилцистеин (NAC), L-фенилаланин мустард, 4'-(9-акридиниламино)-метансульфон-м-анизидид (mAMSA), известные в уровне техники ингибиторы мультирезистентности к лекарственным средствам (то есть ингибиторы MDR), мелфалан, метотрексат, необязательно в комбинации с лейковорином, митрамицин, митомицин-C, ингибиторы белка, ассоциированного с мультирезистентностью к лекарственным средствам (ингибиторы MRP), паклитаксел, прокарбазин, стрептозотоцин, N,N'N'-триэтилентиофосфорамид (tioTEPA), ингибиторы топоизомеразы I и/или топоизомеразы II, таксол, винбластин, винкристин, винкристин, виндезин, тенипозид (VM-26®), а также другие, слишком многочисленные для перечисления. Другие способы лечения рака, рассматриваемые для применения в комбинации со способами настоящего изобретения, включают облучение рентгеновским излучением, гамма-излучением, непосредственно или посредством томографического направления, обработку тканей злокачественных опухолей имплантированными радиоактивными гранулами или "зернами", облучение нейтронным пучком тканей, подвергшихся первоначальной обработке соединениями бора, и/или другие известные в уровне техники типы терапии с применением пучка частиц.
Дополнительные противоопухолевые или противораковые средства (противобластомные средства), которые необязательно вводят в комбинации или совместно со способами настоящего изобретения, включают средства, описанные в издании "GOODMAN AND OILMAN'S, THE PHARMACOLOGICAL BASIS OF THERAPEUTICS", TENTH EDITION, Eds. Hardman and Limbird, полностью включенном в настоящую заявку путем отсылки.
В целях более полного понимания изобретения приведено определение следующих терминов.
Ссылка на "аденозин" в настоящем описании также охватывает дезоксиаденозин и их известные из уровня техники варианты и производные, присутствующие in vivo, если не указано иное.
Ссылка на аденозиндеаминазу или АДА включает любую известную из уровня техники форму указанного фермента, включая очищенный природный фермент, например, очищенную природную АДА, рекомбинантную человеческую или бычью АДА, а также их варианты, полиморфизмы и производные. Фермент АДА, выделенный из источников, относящихся к крупному рогатому скоту, имеет последовательность согласно SEQ ID NO: 5, с природно кэпированным или защищенным цистеином остатком Cys74, при этом шесть C-концевых остатков, предсказанных на основе гена, кодирующего АДА SEQ ID NO: 5, не присутствуют. Однако предусматривается, что изобретение может быть осуществлено с альтернативными вариантами природной бычьей АДА, включая альтернативные аллели и полиморфизмы, как природные, так и полученные генно-инженерными методами, с и без предсказанных шести C-концевых остатков. Полиморфизмы бычьей АДА включают, например, глутамин в положении 198 вместо лизина; аланин в положении 245 вместо треонина; аргинин в положении 351 вместо глицина.
Предпочтительные производные фермента АДА включают фермент АДА, полученный генно-инженерными методами, который был мутирован с целью повышения стабильности по сравнению с не мутированным рекомбинантным ферментом АДА. Они включают, например, рекомбинантные ферменты АДА, модифицированные на основе SEQ ID NO: 5 и/или SEQ ID NO: 5 с одним или несколькими вышеуказанными полиморфизмами, чтобы заменить окисляемый гидрофильный остаток Cys подходящим неокисляемым аминокислотным остатком. Такой неокисляемый остаток включает любой известный из уровня техники остаток природной аминокислоты и/или ее любые известные из уровня техники производные. Например, зрелая рекомбинантная АДА, экспрессируемая с гена, первоначально выделенного из источника, относящегося к крупному рогатому скоту или человеку, имеет нестабильный остаток Cys74, который предпочтительно заменяют неокисляемым аминокислотным остатком, например Ser74. Такие рекомбинантные ферменты АДА приведены в SEQ ID NO: 1 (структура бычьей АДА) и SEQ ID NO: 3 (структура АДА человека). В SEQ ID NO: 2 и SEQ ID NO: 4 показаны применяемые молекулы ДНК, предназначенные для экспрессии того же, которые были оптимизированы по кодонам для экспрессии в E. coli. Дополнительные подробности касательно таких рекомбинантных АДА мутеинов, а также получения и очистки указанных белков приведены в заявке на патент США _______, которая испрашивает приоритет заявки на патент США 60/913,009, озаглавленной "Стабильная рекомбинантная аденозиндеаминаза", поданной в одну и ту же дату с настоящей заявкой и включенной в настоящую заявку путем отсылки в полном объеме. Точные данные относительно векторов и способов можно найти в указанной заявке, в особенности в разделе Примеры, а в частности в Примерах 1-4.
В альтернативе ферменты АДА могут быть стабилизированы, при необходимости, посредством кэпирования гидрофильного окисляемого остатка Cys путем обработки фермента АДА достаточным количеством кэпирующего агента, при таких условиях реакции, которые являются достаточными для кэпирования реакционно-способного цистеина, без существенной инактивации белка АДА. В данном процессе предпочтительно используют АДА, полученную генно-инженерными методами, в форме мутеина или фермента дикого типа.
Например, кэпирующие агенты включают без ограничения окисленный (предпочтительно) глутатион, иодацетамид, иодуксусную кислоту, цистин и другие дитиолы, известные средним специалистам в данной области, а также их смеси. Количество и концентрация кэпирующего агента, вводимого в ходе реакционной фазы способов, описанных в настоящей заявке, в некоторой степени зависит от конкретного используемого кэпирующего агента и потребностей специалиста, но не будет подвергаться излишнему экспериментальному исследованию. При использовании окисленного глутатиона в качестве прототипа его концентрация, используемая в ходе взаимодействия с рекомбинантным белком, таким как рчАДА, может варьировать приблизительно от 25 мкМ до приблизительно 100 мМ. Предпочтительно окисленный глутатион взаимодействует с рекомбинантным белком при концентрации приблизительно от 5 нМ до приблизительно 25 мм.
Условия реакции, используемые в ходе взаимодействия кэпирующего агента и рекомбинантного белка, дополнительно включают использование водного раствора, имеющего pH от приблизительно 6,5 до приблизительно 8,4, предпочтительно от приблизительно 7,2 до приблизительно 7,8. Кроме того, водный раствор предпочтительно включает подходящий буферный раствор, такой как натрий фосфатный, калий фосфатный, Трис и HEPES, а также их смеси в концентрациях от 10 до 150 мМ (необязательно кэпирование может выполняться при концентрациях буфера, находящихся вне указанного диапазона, например ниже 10 или выше 150 мМ). Условия реакции дополнительно включают проведение реакции при температурах, которые не будут способствовать деградации белка, то есть при температурах приблизительно 4-37°C. Необязательно кэпирование может выполняться вне указанного диапазона температур, например в диапазоне температур ниже 0-4°C или выше 31°C. Реакцию проводят в течение времени, которое является достаточным, чтобы достичь требуемой стабилизации реакционно-способного цистеина. Просто в качестве примера реакцию проводят в течение от приблизительно 5 секунд до приблизительно 8 часов (например, в течение ночи).
Дополнительные подробности касательно кэпированной, стабилизированной рекомбинантной АДА приведены в заявке на патент США (настоящего заявителя) 11/738,012, озаглавленной "Стабилизированные белки", в особенности в разделе Примеры, которая включена в настоящую заявку путем ссылки.
Кроме того, применение терминов в форме единственного числа для удобства описания никоим образом не следует считать ограничивающим в какой-либо мере. Таким образом, например, ссылка на композицию, включающую фермент, относится к одной или более молекулам данного фермента. Нужно также понимать, что настоящее изобретение не ограничено конкретными конфигурациями, стадиями способов и материалами, описанными в настоящей заявке, поскольку такие конфигурации, стадии способов и материалы могут несколько изменяться.
A. АДА-полимерные конъюгаты
Предпочтительной формой АДА является форма конъюгированного с полимером фермента. АДА-полимерный конъюгат настоящего изобретения в целом соответствуют формуле (I):
(I) [R-NH]z-(АДА),
в которой
(ADA) представляет собой фермент аденозиндеаминазу или, необязательно, ее производное или фрагмент;
NH- представляет собой аминогруппу аминокислоты, присутствующей в АДА, ее производном или фрагменте, которая служит для присоединения к полимеру;
(z) является положительным целым числом, предпочтительно от приблизительно 1 до приблизительно 80, более предпочтительно от приблизительно 5 до приблизительно 80, наиболее предпочтительно от приблизительно 11 до приблизительно 18; и
R является по существу неантигенным полимерным остатком, который присоединен к АДА обратимым или необратимым способом.
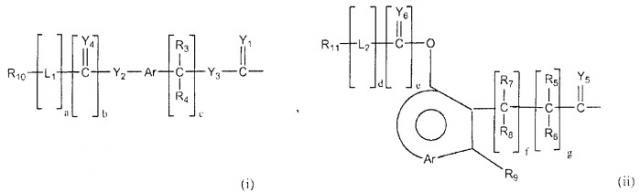
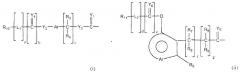
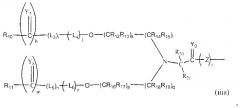
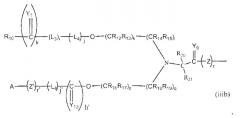
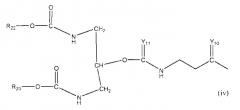
Неантигенная полимерная часть (R) конъюгата может быть выбрана из неограничивающего списка систем на основе полимеров, таких как:
в которых:
R10-11 и R22-23 могут быть одинаковыми или различными и являются независимо выбранными неантигенными полимерными остатками;
R3-9, R12-21 и R24 (см. ниже) являются одинаковыми или различными, при этом каждый из них независимо выбран из водорода, C1-6-алкилов, разветвленных C3-12-алкилов, C3-8-циклоалкилов, замещенных C1-6-алкилов, замещенных C3-8-циклоалкилов, арилов, замещенных арилов, аралкилов, C1-6-гетероалкилов, C1-6-алкокси, фенокси и C1-6-гетероалкокси;
Ar представляет собой группу, которая формирует многозамещенный ароматический углеводород или многозамещенную гетероциклическую группу;
Y1-11