Новые композиции на основе полисахаридов, привитых с помощью полиаминных или полисульфированных соединений
Иллюстрации
Показать всеИзобретение относится к способу получения композиции, содержащей полисахарид, имеющий одну или более комплексообразующих групп, полученных ковалентным связыванием путресцина, спермина, спермидина или кадаверина с указанным полисахаридом, при этом все или некоторые из указанных комплексообразующих групп образуют комплекс с радиоактивномеченым металлом 99mTc. Заявленный способ включает контактирование полисахарида с агентом, контролирующим окисление, приведение окисленного полисахарида в контакт с комплексообразующим соединением, выбранным из числа путресцина, спермина, спермидина или кадаверина и приведение полисахарида, полученного на стадии ii), в контакт с солью 99mTc. Изобретение также относится к диагностической композиции для медицинской или ветеринарной визуализации, которая получена указанным способом, а также к применению диагностической композиции для сцинтиграфической визуализации. 4 н. и 9 з.п. ф-лы, 20 ил., 4 табл., 7 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к новым фармацевтическим композициям на основе привитых полисахаридов и их применению в диагностической визуализации, в частности сцинтиграфии, и при внутренней рентгенотерапии.
Уровень техники
Векторные частицы радиоактивных элементов в течение длительного времени используются в области медицины и биологии (см. общий обзор Hafeli, 2001), например, для оценки тока крови в ткани с помощью нерассасывающихся микрочастиц достаточного размера (несколько десятков микрометров), которые встречаются в первичной капиллярной сети сразу, как только их вводят в сосудистую сеть. Несмотря на то, что указанные частицы можно использовать в форме стеклянных частиц, например (Hafeli et al., 1999), для обработки отдельной ткани (в частности, опухолевой ткани) ионизирующей радиацией, тот факт, что частицы являются нерассасывающимися, означает, что из-за этого невозможно разработать обычные методы применения in vivo на диагностическом уровне, а также часто на терапевтическом уровне (когда общая ишемия целевой ткани нежелательна).
Наиболее распространенным применением микрочастиц у людей in vivo является использование для сцинтиграфического обнаружения легочной эмболии. Эта распространенная болезнь (приблизительно 650000 новых случаев ежегодно в США) вызывается кровяными сгустками, в большинстве случаев из нижних конечностей, которые мигрируют по венозной системе, проходят через правую половину сердца и блокируют легочные капилляры. Если эмболия тяжелая, существует риск нарушения работы сердца. Для эффективного предотвращения значительных эмболий необходимо определять небольшие эмболии с целью своевременного проведения длительного лечения антикоагулянтами. Метод рентгеновской спиральной компьютерной томографии (рентгеновский сканер) приобретает широкое распространение в последние годы, но его продуктивность в отношении периферических эмболий является недостаточной. Кроме того, доза ионизирующей радиации, действию которой подвергается грудная клетка, способна вызвать рак груди. Таким образом, в настоящее время перфузионная сцинтиграфия сохраняет свое место, при этом вентиляцию оценивают с помощью аэрозоля или посредством радиоактивных газов.
Исторически, одним из первых способов применения рассасывающихся частиц, как известно, была перфузионная сцинтиграфия легких с использованием частиц оксида железа, меченных 99mTc (US 3962412 и US 4057616). Этот способ, при котором использовали ионы железа Fe2+, давал возможность уменьшить количество пертехнетата, при этом достигался хороший уровень связывания на оксидах и гидроксидах железа, которые образовывали ядро (внутреннюю часть) частиц. Однако одно из ограничений технологии данного типа заключалось в трудности достижения однородного размера частиц около нескольких десятков микрометров. Более того, процесс лиофилизации указанных препаратов, которые подлежали использованию в форме этикетированного набора, также был непростым.
Альтернативой применения указанных частиц является использование белков в качестве матриц частиц (US 3663685), в частности альбумина яиц или альбумина сыворотки (US 4024233). Существуют способы получения однородных размеров (например, US 6709650), часто с относительно высоким уровнем сложности в отношении производства, что приводит к значительному уровню вариабельности между партиями. Кроме того, способы нанесения метки с использованием йода и технеция являются относительно простыми, проверенными способами (US 4410507, например). Эти продукты в настоящее время широко используются для диагностики легочной эмболии в клинической практике. Однако эти частицы имеют три значительных ограничения для применения у человека, в частности в перфузионной сцинтиграфии легких после внутривенной инъекции:
- кинетика деградации in situ часто продолжается в течение относительно длительных периодов времени, больше четырех часов. Такая продолжительность является менее подходящей, чем более короткий период времени (от одного до двух часов) в отношении внутривенной обработки фибринолитическими средствами, что дает возможность ранней диагностики и делает возможной эффективную остановку потом, непосредственно после обработки;
- эти частицы могут быть иммуногенами, и поэтому предпочтительным является использование белков человеческого происхождения;
- являются ли эти частицы человеческого или животного происхождения, все эти рецептуры потенциально несут риск передачи инфекций, в частности вирусных инфекций (HIV, гепатит и т.д.), и прионов (нетрадиционные инфекционные агенты, которые ответственны за болезнь Крейцфельда-Якоба и т.д.), причем эту передачу в настоящее время очень трудно предотвратить. Исключительно единственным способом увеличения безопасности является получение частиц с растворами альбумина, которые хранятся в течение шести месяцев. Не говоря об имеющих место дополнительных затратах, данная предосторожность не является полностью надежной, так как один из доноров крови может быть подвергнут сероконверсии или может обнаружить болезнь позднее, и таким образом может оказаться носителем (и потенциально загрязнителем) после бессимптомного инкубационного периода в течение нескольких лет (в случае нетрадиционных инфекционных агентов).
Отдельные группы специалистов предлагали применение липосом, имеющих особенное преимущество - отсутствие токсичности. Однако изготовление больших липосом (несколько десятков микрометров), которые являются стабильными во время лиофилизации, и восстановление влагосодержания (растворение) является чрезвычайно трудным. Более того, существует три основных способа мечения липосом: включение радиоактивного продукта во внутреннее пространство везикул (во время приготовления или с помощью липофильного продукта, который становится гидрофильным во внутреннем пространстве, такого как I′НМРАО-99mTc), с использованием алифатического ядра липидного бислоя в качестве системы удерживания гидрофобного продукта (такого как 11lIn-оксин), или поверхностно-привитых (surface-grafting) комплексообразующих агентов, как в случае I′HYNIC-99mTc. Во всех вышеуказанных случаях достижение хорошей степени мечения затруднено вследствие нестабильности липосом.
Чтобы обойти эти ограничения, для применения были предложены полностью синтетические биодеградируемые полимеры (ES 2096521, Delgado A. et al., 2000). Однако, даже по мнению самих авторов, использование полиэфиров затрудняет достижение подходящего мечения и хорошего уровня воспроизводимости в отношении лиофилизации и кинетики высвобождения.
Дополнительным путем получения полезных полимеров и частиц является использование природных или искусственных полисахаридов (US 3663685, US 3758678). Растительное или микробиологическое происхождение некоторых из указанных полисахаридов гарантирует, что в этом случае не может быть передачи патогенов из животного царства. В дополнение к простоте, с которой их можно получить, и низким затратам (некоторых из них), их разнообразная химия дает возможность хорошо контролировать процесс биодеградации.
Соответственно патентная заявка Франции 2273516 раскрывает использование микроносителя амилопектина в виде бусин, которые поперечно связаны эпихлоргидрином и помечены с помощью 99mTc, для перфузионной сцинтиграфии легких. Однако гидроксильные группы амилопектина образовывают слабые связи с технецием и не дают возможности достижения стабильного мечения. Кроме того, известно, что эпихлоргидрин, который использовали для поперечного связывания, является высокотоксичным и мутагенным.
Также раскрыты (FR 2797769) частицы крахмала, привитые к радиоактивным элементам посредством аминных комплексообразующих систем, содержащих, по меньшей мере, один атом серы. Скорость комплексообразования радиоактивных элементов с помощью комплексообразующих групп, по-видимому, является относительно удовлетворительной, но отдельные описанные композиции демонстрируют очень быструю кинетику деградации (меньше, чем 10 минут), которая является лимитирующим фактором в отношении томографии. Кинетика деградации, по-видимому, частично зависит от скорости окисления и скорости прививки выбранного кукурузного крахмала. Более того, они, по-видимому, имеют ограниченную стабильность при хранении. Наконец, комплексообразующие группы, описанные в данном документе, являются относительно комплексными структурами, которые могут требовать нескольких стадий химического синтеза, что может увеличить риск токсичности радиофармацевтической композиции и производственные затраты. На токсикологическом уровне метаболические пути деградации исследованных соединений не установлены и могут представлять собой источник потенциально опасных вторичных соединений.
В общем, полимеры полисахарида, на которых были зафиксированы радиоактивные атомы, использовали в качестве радиоактивных меченых агентов (декстран, меченный 99mTc) для сосудистых и/или внутритканевых зон (как функция молекулярной массы декстрана, Kellaway I.W., et al., 1995); в качестве индикатора проницаемости (Akgun A. et al., 2005) или для обнаружения сигнального лимфатического узла (Paiva G.R. et al., 2006); в качестве агента, позволяющего увеличить количество радиоактивных атомов при внутренней рентгенотерапии (декстран, йодированный 131I, связанный с белками, Andersson A. et al., 1992) и даже в качестве агента, позволяющего увеличить почечный клиренс радиоактивного меченого вещества с целью увеличения отношения «сигнал-шум» при применении для активной векторизации посредством пептидов или антител (декстран, меченный 99mTc, Line B.R., et al., 2000).
Раскрытие изобретения
Согласно первой цели изобретение относится к композициям, содержащим полисахарид, имеющий одну или более комплексообразующих групп формулы (I) или (II), ковалентно связанных с указанным полисахаридом:
в которых:
Ro представляет атом водорода или C1-С6 алкильную группу;
R1, Ra, являются одинаковыми или разными, представляют атом водорода, линейную или разветвленную C1-С6 алкильную группу, и необязательно являются замещенными аналогичным или отличным образом одним или более атомами галогена (фтор, хлор, бром, йод), алкилом, алкенилом, оксогруппой, -C(=O)OR0, -C(=O)R0, нитрогруппой, цианогруппой, гидроксилом, алкоксигруппой, аминогруппой, алкил(С1-С6)аминогруппой, диалкил(С1-С6)аминогруппой, фосфиновой, фосфатной, фосфонатной, дифосфонатной группами или несульфированным пептидным радикалом,
или R1, Ra, одинаковые или разные, представляют -C(=O)OR0, -C(=O)R0, оксимную группу, не-сульфированный пептидный радикал, фосфонатную группу или дифосфонатную группу;
Rb представляет собой атом водорода, линейную или разветвленную C1-С6 алкильную группу, которая необязательно является замещенной аналогичным или отличным образом одним или более атомами галогена (фтор, хлор, бром, йод), алкилом, алкенилом, оксогруппой, C(=O)OR0, -C(=O)R0, гидроксилом, алкоксигруппой, тиогруппой, алкилтиогруппой, фосфиновой, фосфатной, фосфонатной, дифосфонатной группами или пептидным радикалом,
или Rb представляет собой -C(=O)OR0, -C(=O)R0, оксимную группу, пептидный радикал, фосфонатную группу или дифосфонатную группу;
L1 представляет линейную или разветвленную C1-С6алкиленовую группу, линейную или разветвленную С2-С6алкениленовую группу, ариленовую или бисариленовую группу, указанные группы L1 могут быть одинаковыми или разными при n>1, необязательно прерванными одним или более атомами кислорода, и могут быть замещенными аналогичным или отличным образом при n>1 одним или больше атомами галогена (фтор, хлор, бром, йод), алкилом, алкенилом, оксогруппой, -C(=O)OR0, -C(=O)R0, нитрогруппой, цианогруппой, гидроксилом, алкоксигруппой, аминогруппой, алкил(С1-С6)аминогруппой, диалкил(С1-С6)аминогруппой, фосфиновой, фосфатной, фосфонатной, дифосфонатной группами или несульфированным пептидным радикалом;
L2 представляет собой линейную или разветвленную C1-С6 алкиленовую группу, линейную или разветвленную С2-С6 алкениленовую группу, ариленовую или бисариленовую группу, указанные группы L2 могут быть одинаковыми или разными при n>1, необязательно прерванными одним или более атомами кислорода и/или серы, и могут быть замещенными аналогичным или отличным образом при n>1 одним или более атомами галогена (фтор, хлор, бром, йод), алкилом, алкенилом, оксогруппой, C(=O)OR0, -C(=O)R0, гидроксилом, алкоксигруппой, тиогруппой, алкилтиогруппой, фосфиновой, фосфатной, фосфонатной, дифосфонатной группами или пептидным радикалом;
n представляет собой целое число между 1 и 6, и m и р являются одинаковыми или разными и могут быть 0, 1 или 2, m и р каждый предпочтительно представлен 0,
все или часть указанных групп формулы (I) или (II) образуют комплекс, по меньшей мере, с одним поливалентным металлом.
Эти композиции являются особенно удобными в том отношении, что они дают возможность достижения увеличенной скорости комплексообразования указанных поливалентных атомов, и это позволяет снизить дозы радиофармацевтической композиции, введенной пациенту, с точки зрения радиоактивных атомов, улучшить качество изображения в процессе рентгенографии и уменьшить токсикологический риск.
Кроме того, эти композиции имеют очень хорошее аккумулирование в легких, являются нетоксичными в используемых дозах, легко подвергаются биодеградации с помощью известных способов биовыведения, являются стерилизуемыми и могут быть упакованы в виде диагностического набора.
Полисахарид согласно изобретению предпочтительно находится в форме сферических частиц, в частности микрочастиц или наночастиц.
Размер частицы может быть между 10 нм и 200 мкм, предпочтительно между 10 и 100 мкм и более предпочтительно около 40 мкм для применения при закупорке капилляров (таких как перфузионная сцинтиграфия легких, например, для сцинтиграфического диагностирования легочной эмболии). Наномерные частицы, т.е. частицы, имеющие размер меньше, чем 1 мкм (в частности, частицы с размером между 10 и 500 нм, особенно частицы с размером приблизительно от 40 до 80 нм), в частности, пригодны для введения композиции согласно изобретению внутритканевым образом, например, для определения наличия и/или визуализации сторожевых узлов, для лимфосцинтиграфии, для получения изображения костного мозга или лимфатических узлов после внутривенного введения ("сцинтиграфия с мечеными коллоидами") или также для облучения ткани указанными полисахаридами при внутренней рентгенотерапии.
Микромерные частицы, т.е. имеющие размер около 1 мкм и больше (приблизительно до 10 мкм), можно вводить внутривенно, и, в частности, они пригодны для визуального наблюдения при диагностической визуализации системы мононуклеарных фагоцитов, например, печени, костного мозга, или также для лечения опухолей печени или селезенки с помощью внутренней рентгенотерапии.
Полисахарид, который можно использовать согласно изобретению, предпочтительно является полисахаридом природного происхождения, в частности растительного или микробиологического происхождения. Примеры включают, в частности, крахмал, целлюлозу, амилопектин, амилозу, агарозу, пуллулан, хитозан или декстран и их производные, а также их смеси из двух или более; особенно предпочтительным является крахмал.
Преимущественно, полисахарид уменьшает микробиологические риски радиофармацевтических композиций по сравнению с композициями, основанными на протеинах, таких как альбумин человека и желатин, в большинстве случаев свиной желатин. Дополнительное преимущество заключается в том, что кинетика деградации in situ может быть модифицирована за счет скорости окисления или прививки полисахарида; этого трудно достичь воспроизводимым образом с белками.
Крахмал может быть, например, кукурузным, пшеничным, рисовым, картофельным или крахмалом проса и т.д. или производным, таким как гидроксиэтиламидон (HES), который медленно деградирует после внутривенной инъекции, делая возможным его применение в качестве раствора, заполняющего сосуды, в случае гиповолемического шока. Этот продукт не активирует комплемент и таким образом не приводит к побочным эффектам.
Предпочтительно комплексообразующие группы представляют собой группы формулы (I), в которых R1 и/или Ra представляет атом водорода.
Предпочтительно n представляет собой 1, 2 или 3.
Предпочтительно, по меньшей мере, одно из значений m или р представляет 0, или m и р каждый представляет 0.
Предпочтительно L1 представляет собой алкиленовую группу, в частности С2-С5 алкиленовую группу.
Примеры особенно предпочтительных комплексообразующих групп формулы (I) включают, в частности, группы, полученные ковалентным связыванием путресцина NH2(CH2)4NH2, спермина Н2Н(СН2)3NH(СН2)4NH(СН2)3NH2, спермидина NH2(CH2)3NH(CH2)4NH2 или кадаверина NH2(CH2)5NH2 с окисленным полисахаридом.
Эти комплексообразующие группы являются особенно пригодными, так как их получают из биогенных полиаминов, т.е. полиаминов, присутствующих в биологической среде, и это уменьшает риск токсичности композиций, так как способы деградации этих продуктов хорошо известны. Кроме того, эти эндогенные полиамины являются коммерчески доступными при низкой стоимости.
Доля комплексообразующих групп может составлять от 0,1 до 200%, исходя из моносахаридных единиц полисахарида, предпочтительно от 10 до 100%.
Поливалентный металл, присутствующий в композициях, может быть выбран из элементных металлов, имеющих атомное число между 20 и 33, между 38 и 51, между 56 и 84 или между 88 и 103.
Неограничивающие примеры поливалентных металлов включают радиоактивные изотопы технеция, такие как 99mTc, 94Тс или 94mTc; изотопы рения, такие как 188Re или 186Re; изотопы меди, такие как 60Cu, 61Cu, 64Cu или 67Cu; изотопы стронция, такие как 89Sr; изотопы индия, такие как 111In или 113In; изотопы самария, такие как 153Sm; изотопы олова, такие как 113mSn; изотопы скандия, такие как 44Sc; изотопы иттрия, такие как 90Y или 86Y; изотопы галлия, такие как 67Ga или 68Ga; изотопы гадолиния или изотопы лютеция; 99mTc являются особенно предпочтительными.
Предпочтительно, композиции согласно изобретению также включают фармацевтически приемлемый носитель или эксципиент.
Предпочтительно указанные композиции содержат эффективное количество полисахарида, помеченного радиоактивным элементом посредством комплексообразующих групп формулы (I) или (II) согласно изобретению.
Композиции согласно изобретению являются предпочтительно фармацевтическими и/или диагностическими композициями.
Фармацевтические композиции согласно изобретению могут быть представлены в формах, предназначенных для парентерального, внутривенного, внутриартериального, внутримышечного, внутритканевого, внутримозгового, подоболочечного или внутрилегочного введения, для введения через ORL сферу (сферу оториноларингологии), глазные, вагинальные или ректальные слизистые мембраны или даже энтерально (прохождение через желудок) и посредством аэрозолей.
Следовательно, они могут быть представлены в форме растворенных веществ, растворов или суспензий для инъекций или в форме порошков или пузырьков для однократного или многократного приема.
Наиболее удобными переносчиками для парентерального применения являются вода, водные растворы, физиологическая сыворотка и изотонические растворы.
Композиции согласно изобретению можно получить путем применения или адаптации любого способа, известного по существу, и/или в пределах компетенции специалиста в данной области техники, в частности, описанные Larock в Comprehensive Organic Transformations, VCH Pub., 1989, или путем применения или адаптации способов, описанных в последующих примерах.
Следовательно, согласно дополнительной цели изобретение также относится к способу получения композиции согласно изобретению, включающему стадии:
i) приведения в контакт полисахарида с агентом, контролирующим окисление;
ii) приведения в контакт окисленного полисахарида с соединением формулы (Ia) или (IIa):
в которой L1, L2, Ro, R1, Ra, Rb, m, n и р представляют собой, как определено выше, чтобы получить полисахарид, содержащий комплексообразующие группы формулы (I) или (II), ковалентно связанные с указанным полисахаридом;
iii) необязательно, приведения в контакт полученного полисахарида с восстановителем;
iv) приведения в контакт полученного полисахарида с солью поливалентного металла. Способ согласно изобретению в большинстве случаев осуществляют в воде при температуре окружающей среды.
Примеры агентов, контролирующих окисление, которые можно использовать, включают, в частности, периодаты, например периодат натрия.
Примеры восстановителей включают, в частности, борогидрид натрия.
Без связи с какой-либо отдельной теорией, контролируемое окисление полисахарида приводит к образованию карбонильных функциональных групп, которые реагируют с HN- или HS-группами соединений формулы (Ia) или (IIa) соответственно.
В качестве примера, контролируемое окисление крахмала приводит к образованию альдегидных групп, которые могут реагировать с H2N-группами путресцина, спермина, спермидина или кадаверина с образованием, в особенности после восстановления, иминных ковалентных связей (-CH=N-).
Стадия iv) приведения в контакт полученного полисахарида с солью поливалентного металла (реакция маркировки) может быть выполнена, и в случае маркировки (мечения) преимущественно выполняется с 99mTc, в присутствии восстановителей олова, бората и производных или типа аскорбиновой кислоты, или любых других средств, которые эффективно восстанавливают радиоактивную соль поливалентного металла, в частности, в случае технеция.
Производные формулы (Ia) или (IIa), в которых L1, L2, R0, R1, Ra, Rb, m, n и р имеют то же самое значение, как в формуле (I) или (II) выше, являются или коммерчески доступными, или их получают с помощью способов, описанных в литературе.
Способ согласно изобретению также может включать дополнительную стадию выделения полученной композиции.
Согласно дополнительной цели изобретение относится к применению композиций, получивших определение выше, в частности для получения диагностической композиции для диагностической визуализации в медицине человека и в ветеринарии, в частности в монофотонной, бифотонной или даже полифотонной сцинтиграфической визуализации.
Кроме того, композиции согласно изобретению являются, в частности, пригодными для визуализации одного или более органов у пациента или животного, таких как легкое, печень, селезенка, костный мозг или лимфатические узлы.
Некоторые композиции согласно изобретению также можно применять для визуализации сигнальных лимфатических узлов.
Согласно дополнительной цели композиции согласно изобретению можно использовать для получения фармацевтической композиции для лечения рака у пациента или животного с помощью внутренней рентгенотерапии, в частности для лечения лимфатических узлов или опухолей печени или селезенки.
В данном контексте композиции изобретения в целом используются для обработки раковых опухолей, в частности печени и/или селезенки, или лимфатических узлов, ионизирующей радиацией.
Согласно дополнительной цели изобретение относится к полисахаридам, содержащим одну или более комплексообразующих групп формулы (I) или (II), связанных ковалентно с указанными полисахаридами, указанные полисахариды представляют собой, как определено выше.
Эти полисахариды являются, в частности, пригодными для получения композиции согласно изобретению.
Изобретение также относится к полисахаридам, содержащим одну или более комплексообразующих групп формулы (I) или (II), ковалентно связанных с указанными полисахаридами, полученными в соответствии со стадиями i) - iii) способа, как определено выше.
При использовании выше и в целом в описании изобретения термины, если не установлено иначе, должны рассматриваться, как имеющие следующие значения.
Термин "полисахарид" обозначает полимер, полученный в результате соединения множества единиц полисахаридов, в частности от 10 до 1000 моносахаридов.
Согласно настоящему изобретению алкильные радикалы представляют собой неразветвленные или разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода.
Линейные радикалы включают метиловый, этиловый, пропиловый, бутиловый, пентиловый и гексиловый радикалы.
Изопропиловый, трет-бутиловый, 2-этилгексиловый, 2-метилбутиловый, 2-метилпентиловый и 1-метилпентиловый радикалы можно упомянуть, в частности, как разветвленные радикалы или радикалы, замещенные одним или более алкильными радикалами.
Алкокси-радикалы согласно настоящему изобретению представляют собой радикалы формулы -O-алкил, алкил, как определено выше.
Алкилтио-радикалы согласно настоящему изобретению представляют собой радикалы формулы -S-алкил, алкил, как определено выше.
Алкиленовые радикалы представляют собой разветвленные или линейные двухвалентные углеводородные радикалы, содержащие от 1 до 6 атомов углерода.
Алкениленовые радикалы представляют собой неразветвленные или линейные двухвалентные углеводородные радикалы и содержат один или больше этиленовых ненасыщенных связей. Алкениленовые радикалы включают в частности -СН=СН-, -СН2СН=СН-, -С(СН3)=СН-, -СН2СН=СНСН2-радикалы.
Арилен обозначает двухвалентный моноциклический или бициклический ароматический углеводородный радикал, содержащий от 6 до 10 атомов углерода. Ариленовые радикалы включают, в частности, фениленовый или нафтиленовый радикал.
Бис-арилен обозначает двухвалентную систему, содержащую два моноциклических или бициклических ароматических углеводородных радикала, содержащих от 6 до 10 атомов углерода. Бис-ариленовые радикалы включают, в частности, бифениленовый или бинафтиленовый радикал.
Фигуры
Фиг.1: Присоединение кадаверина к частицам крахмала, наблюдаемое с помощью оптического флуоресцентного микроскопа в присутствии флуорескамина.
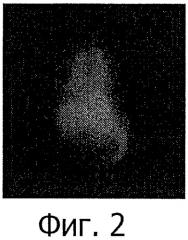
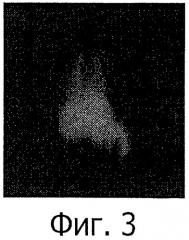
Фиг.2 и 3: Типичные сцинтиграфические изображения крыс (передняя проекция), получивших внутривенно 20% окисленных частиц крахмала, меченных 4 МБк 99mTc, непосредственно после инъекции (фиг.2) и через 15 минут (фиг.3).
Фиг.4, 5, 6: Типичные сцинтиграфические изображения крыс (передняя проекция), получивших внутривенно 50% окисленных частиц крахмала, связанных с кадаверином, меченных 4 МБк 99mTc, через 15 минут (фиг.4), 30 минут (фиг.5) и 90 минут после инъекции (фиг.6).
Фиг.7, 8, 9: Типичные сцинтиграфические изображения крыс (передняя проекция), получивших внутривенно 50% окисленных частиц крахмала, связанных с кадаверином, меченных 4 МБк 99mTc, через 5 минут (фиг.7), 15 минут (фиг.8) и 30 минут после инъекции (фиг.9).
Фиг.10 и 11: Морфологические характеристики, наблюдаемые с помощью оптической микроскопии (при увеличении 10 ×) 50% окисленных микрочастиц крахмала, меченых до (фиг.10) и после реакции с кадаверином (фиг.11).
Фиг.12: Пример распределения по размерам окисленных микрочастиц крахмала, связанных с кадаверином, измеренного с помощью счетчика Coulter Multisizer 3.
Фиг.13: Графическое изображение влияния температуры (В1), времени реакции (В2), эквивалентного значения восстановителя (В3) и, наконец, времени восстановления (В4) на процентное содержание азота в готовых микрочастицах.
Фиг.14: Двухмерное графическое моделирование влияния 4 экспериментальных параметров (эквивалентное значение амин/крахмал; значение рН реакции; уровень окисления крахмала и концентрация крахмала в реакционной среде) на выход кадаверина, соединенного с микрочастицами крахмала.
Фиг.15: Типичные изображения, полученные после внутривенного введения микрочастиц крахмала, меченных 99mTc (композиция С), на крысах-самцах линии Вистар. Плоские изображения (то же самое кадрирование) были получены на 10, 20, 60 и 120 минутах динамического исследования продолжительностью 120 минут (180 45-секундных изображений).
Фиг.16: Пример кривой время-активность, полученной при динамических сцинтиграфических исследованиях, проведенных после внутривенного введения микрочастиц крахмала, меченных 99mTc (композиция С), на самцах крыс линии Вистар.
Фиг.17: Типичные изображения; полученные после внутривенного введения микрочастиц крахмала, меченных 99mTc (композиция С), на самцах крыс линии Вистар. Изображения представляют собой результат рентгенографического получения изображения вместе со статическим сцинтиграфическим наблюдением (то же самое кадрирование), которое проводили через 10, 20 и 90 минут после инъекции (600-секунд статически).
Фиг.18, 19 и 20: Разделение мочевых метаболитов с помощью гельпроникающей хроматографии, собранных после внутривенной инъекции самцам крыс линии Вистар микрочастиц крахмала, меченных 99mTc (композиция С).
Различные собранные образцы мочи элюировали с использованием колонки Sephadex G15 с пределом исключения 1500 дальтон (18), с использованием колонки Р6 с пределом исключения 5000 дальтон (19) и с использованием Sephadex G50 с пределом исключения 10000 дальтон (20).
Следующие примеры иллюстрируют изобретение, но не ограничивают его. Используемые исходные материалы представляют собой продукты, которые или являются известными или получены в соответствии с известными способами.
Примеры
№1: Частицы крахмала, связанные с природным полиамином: подтверждение связывания посредством реакции с флуорескамином
Контролируемое окисление частиц крахмала:
10 г (соответствует 0,055 моль единиц глюкозы) картофельного крахмала (природный картофельный крахмал в соответствии с монографией Европейской фармакопеи), просеянного в промежутке 36 и 50 мкм, диспергировали в 100 мл воды. Добавили 0,028 моль периодата натрия (NaIO4), т.е. 6 г, предварительно растворенных в 100 мл воды. Суспензию перемешивали в течение 18 часов при комнатной температуре. Через 18 часов получили суспензию частиц из 50% окисленного крахмала. Окисленный крахмал собирали с помощью центрифугирования, затем три раза промыли 200 мл воды.
Функционадизация окисленного крахмала посредством связывания с природным полиамином:
После промывки 1 г крахмала, т.е. 0,0055 моль единиц глюкозы, инкубировали в 60 мл воды и приводили в контакт с раствором 0,00385 моль природного полиамина (путресцин, кадаверин, спермин или спермидин) в 10 мл воды, т.е. 0,0077 моль NH2 (1,4 экв.), в течение 18 часов при комнатной температуре. Для того чтобы стабилизировать образованный имин, 0,56 г NaBH4, т.е. 0,015 моль, добавили к модифицированной суспензии крахмала при перемешивании в течение 1 часа. Затем частицы сцеживали, фильтровали и промывали три раза 200 мл воды, затем лиофилизировали.
Подтверждение связывания крахмал-амин посредством оптической флуоресцентной микроскопии:
Связывание кадаверина с частицами крахмала подтверждали путем наблюдения с помощью оптической флуоресцентной микроскопии, флуоресцентный комплекс образовывался во время добавления 100 мкл раствора флуорескамина 3 мг на мл (C17H10O4) к частицам крахмала, функционализированным кадаверином (10 мг в 300 мкл воды). Образование этого флуоресцентного комплекса, подтвержденное флуоресцентной микроскопией, показывает наличие первичных аминных функций (NH2) на функционализированных частицах крахмала со специфической реакцией указанных аминов на чистый флуорескамин, который затем изменяет цвет на зеленовато-желтый, подтверждая эффективность соединения крахмал/окисленный амин.
№2: Частицы окисленного картофельного крахмала в качестве радиоизотопа, применяемого для сцинтиграфического получения изображения печени и селезенки
Контролируемое окисление частиц крахмала:
Как в примере 1, 10 г (соответствует 0,055 моль единиц глюкозы) картофельного крахмала (природный картофельный крахмал в соответствии с монографией Европейской фармакопеи), просеянного в промежутке 36 и 50 мкм, диспергировали в 100 мл воды. К суспензии частиц добавили 0,0112 моль периодата натрия (NaIO4), т.е. 2,4 г, предварительно растворенных в 100 мл воды. Суспензию перемешивали в течение 18 часов при комнатной температуре. Через 18 часов получили суспензию частиц из 20% окисленного крахмала. Окисленный крахмал собирали с помощью центрифугирования, затем промывали три раза 200 мл воды и затем лиофилизировали.
Реакция мечения с помощью 99mTc:
20 мг 20% окисленного и лиофилизированного крахмала поместили в пустую колбу для элюирования в инертной атмосфере. Затем добавили 4 мл физиологической сыворотки, 20 мкг SnCl2, 2H2O. Добавили 1 мл 185 МБк/мл раствора натрий пертехнетата (Na+ 99mTcO4 -). Раствор перемешивали в течение 1 минуты и регулировали радиохимическую чистоту (RCP) посредством фильтрования 1 мл раствора на 0,22 мкм фильтре и промывки фильтра 5 мл физиологической сыворотки.
Радиохимическая чистота соответствует:
RCP = (Активность на фильтре/Общая активность)×100;
В примере 2 она составляет больше, чем 99%.
Сцинтиграфическая визуализация биораспредедения после внутривенной инъекции у крыс:
После мечения 4 МБк 20% окисленных частиц крахмала, меченных 99mTc, внутривенно вводили (в пенильную вену) самцам крыс линии Вистар весом приблизительно 200 г. Сцинтиграфическое обнаружение 30 kCps осуществляли непосредственно после инъекции и затем позже на 15 минут. После фазы визуализации легких (верхняя область), печени и селезенки (нижняя правая область) активность быстро (в течение 15 минут) концентрировалась в печени и селезенке (неподвижная точка в нижней правой области изображения) (фиг.2 и 3).
№3: Частицы окисленного картофельного крахмала, связанные с кадаверином, в качестве радиоизотопа, применяемого для сцинтиграфического получения изображения перфузии легкого:
Контролируемое окисление частиц крахмала:
10 г (соответствует 0,055 моль единиц глюкозы) картофельного крахмала (природный картофельный крахмал в соответствии с монографией Европейской фармакопеи), просеянного в промежутке 36 и 50 мкм, диспергировали в 100 мл воды. Добавили 0,028 моль периодата натрия (NaIO4), т.е. 6 г, предварительно растворенных в 100 мл воды. Суспензию перемешивали в течение 18 часов при комнатной температуре. Через 18 часов получили суспензию частиц из 50% окисленного крахмала. Окисленный крахмал собирали с помощью центрифугирования, затем промывали три раза 200 мл воды.
Функционализация окисленного крахмала посредством связывания с кадаверином:
10 г окисленного крахмала, т.е. 0,055 моль единиц глюкозы, инкубировали в 600 мл воды и приводили в контакт с 4 г кадаверина (NH2(CH2)5NH2), растворенными в 100 мл воды, т.е. 0,0385 моль кадаверина, т.е. 0,077 моль NH2 (1,4 экв.) в течение 18 часов при температуре окружающей среды. Для того чтобы стабилизировать образованный имин, 5,6 г NaBH4, т.е. 0,15 моль, добавили к модифицированной суспензии крахмала при перемешивании в течение 1 часа. Затем частицы сцеживали, фильтровали и промывали три раза 200 мл воды, затем лиофилизировали.
Реакция мечения с помощью 99mTc:
20 мг крахмала, связанного с кадаверином, поместили в колбу для элюирования в инертной атмосфере. Затем добавили 4 мл физиологической сыворотки, 60 мкг SnCl2, 2H2O. Добавили 1 мл 185 МБк/мл раствора натрий пертехнетата (Na+ 99mTcO4 -). Раствор перемешивали в течение 1 минуты и регулировали радиохимическую чистоту (RCP) посредством фильтрования 1 мл раствора на 0,22 мкм фильтре и промывки фильтра 5 мл физиологической сыворотки.
Радиохимическая чи