Способ биотестирования токсичности вод и водных растворов
Иллюстрации
Показать всеИзобретение относится к биофизическому определению токсичности вод и водных растворов. Способ включает облучение исследуемого образца растительного объекта прерывистым светом высокой интенсивности 100-250 Вт/м2 от синих светоизлучающих диодов с возбуждением свечения этого образца и регистрацией послесвечения в красной спектральной области фотоприемником между световыми импульсами, пропускаемыми через красный светофильтр, причем за счет сокращения длительности световых периодов возбуждения свечения при одновременном увеличении темновых интервалов между ними создают условия низкого светового облучения, а за счет увеличения соотношения длительности световых периодов к темновым создают условия высокого светового облучения, измеряют интенсивность замедленной флуоресценции исследуемого образца в режиме высокого светового облучения в начале каждой кривой затухания, интенсивность в режиме низкого светового облучения измеряют в конце каждой кривой затухания, а о токсичности судят по их отношению. Достигается повышение точности и чувствительности определения. 3 пр., 3 ил.
Реферат
Настоящее изобретение относится к биофизическим методам определения токсичности вод и водных растворов и может быть применено для оперативного биотестирования токсичности природных и сточных вод, а также для установления класса опасности различных отходов при использовании в качестве тест-объекта микроводорослей и других растительных организмов.
Известен способ определения фитотоксичности вод, основанный на регистрации изменения интенсивности миллисекундного фотоиндуцируемого послесвечения (замедленной флуоресценции) хлоропластов или клеток хлореллы под действием химических соединений, содержащихся в тестируемых пробах [авт. свид. СССР №492805, G01N 33/00, опубл. 25.11.75 г.].
Недостатком данного способа является то, что он не обеспечивает высокую точность измерения степени воздействия токсических веществ в анализируемых водах, поскольку интенсивность регистрируемой замедленной флуоресценции (ЗФ) будет зависеть не только от степени токсичности пробы, но и от мутности и цветности тестируемой воды или раствора, а также количества взятого тест-организма.
Наиболее близким техническим решением для способа определения содержания фитотоксических веществ, выбранным в качестве прототипа, является [патент РФ №2069851, G01N 21/64, G01N 33/00, опубл. 27.11.1996 г.], основанный на определении токсичности различных вод и водных растворов путем измерения отношения интенсивностей ЗФ тест-организма в индукционном максимуме на высоком и низком возбуждающем свету. Данный относительный параметр ЗФ не зависит от мутности и цветности анализируемых проб, а также количества взятого тест-организма, поскольку изменение интенсивности свечения во всех случаях будет пропорциональным для обоих световых условий возбуждения и регистрации ЗФ и потому не отражается на величине его относительного параметра.
Недостатком этого способа является трудность подбора интенсивности низкого возбуждающего света, обеспечивающего максимальную чувствительность и точность данного метода. Ситуация усугубляется тем, что этот способ не использует возможности покомпонентной регистрации интенсивности ЗФ, что также оказывает существенное влияние на показатели чувствительности растительных тест-организмов к токсикантам.
Техническим результатом изобретения является повышение точности и чувствительности способа измерения токсичности при биотестировании вод и водных растворов за счет создания новых условий регистрации замедленной флуоресценции хлорофилла растительных объектов.
Технический результат достигается тем, что в способе биотестирования токсичности вод и водных растворов, включающем облучение исследуемого образца растительного объекта прерывистым светом высокой интенсивности 100-250 Вт/м2 от синих светоизлучающих диодов с возбуждением замедленной флуоресценции этого образца и ее регистрации в индукционных максимумах в красной спектральной области фотоприемником между световыми импульсами, причем за счет сокращения длительности световых периодов возбуждения свечения при одновременном увеличении темновых интервалов между ними создают условия низкого светового облучения, а за счет увеличения соотношения длительности световых периодов к темновым создают условия высокого светового облучения, измеряют интенсивность замедленной флуоресценции исследуемого образца в режиме высокого светового облучения в начале каждой кривой затухания, интенсивность в режиме низкого светового облучения измеряют в конце каждой кривой затухания, а о токсичности судят по их отношению.
Заявляемый способ биотестирования вод и водных растворов отличается увеличением диапазона реагирования относительного показателя замедленной флуоресценции хлорофилла растительного тест-организма при воздействии на него поллютантов, что обеспечивает большую точность и чувствительность способа измерения токсического эффекта.
Таким образом, заявляемый способ биотестирования токсичности вод и водных растворов соответствует критерию «новизна».
Признаки, отличающие заявляемое техническое решение от прототипа, не выявлены в других технических решениях при изучении данных и смежных областей техники и, следовательно, обеспечивают заявляемому решению соответствие критерию «изобретательский уровень».
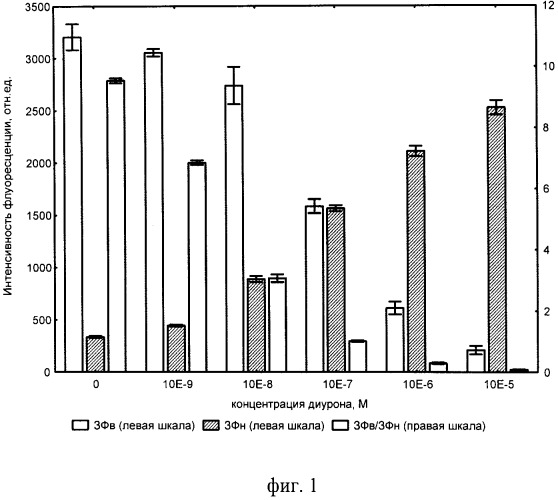
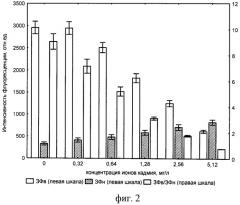
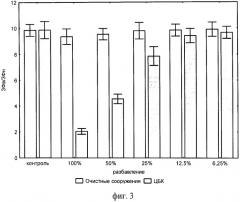
Изобретение поясняется чертежами. На фиг.1 показаны зависимости интенсивности ЗФ суспензии хлореллы, возбуждаемой в режимах высокого (ЗФв) и низкого (ЗФн) света, от концентрации (в молях/литр) диурона - токсиканта, вызывающего подавление фотосинтетического транспорта электронов. На фиг.2 показаны концентрационные зависимости показателей ЗФ водоросли хлорелла в присутствии ионов кадмия. На фиг.3 показана зависимость относительного показателя ЗФ от концентрации (процента разбавления) тестируемых сточных вод.
Сущность изобретения заключается в том, что токсическое воздействие на тест-организмы оценивается на основе регистрации интенсивности замедленной флуоресценции содержащегося в них хлорофилла с помощью устройства для регистрации ЗФ хлорофилла растительных объектов. При определении токсичности тестируемых вод по относительному показателю (ОП) ЗФ в индукционном максимуме измерение интенсивности свечения тест-организма при возбуждении светом высокой интенсивности производят в начале каждой кривой затухания, а в режиме возбуждения низким светом - в ее конце. При этом условия низкого светового облучения создают посредством сокращения длительности световых импульсов возбуждения при одновременном увеличении длительности темновых интервалов между ними. В свою очередь, формирование условий высокого светового облучения обеспечивают не только путем использования высокоинтенсивного возбуждающего света, но через повышение среднего уровня светового облучения тест-организма за счет увеличения длительности световых периодов и сокращения темновых.
Пример 1
В 6 кювет из материала с низким уровнем послесвечения (ЗФ) вносят по 4 см3 суспензии водоросли хлореллы с оптической плотностью 0,040, измеренной при длине волны 560 нм и толщине слоя 2 см. В первую из них добавляют 0,1 см3 дистиллированной воды (контроль), а в остальные по 0,1 см3 раствора диурона различных концентраций. После этого кюветы загружают в устройство для регистрации замедленной флуоресценции хлорофилла растительных объектов и производят измерение ЗФ в двух световых режимах. На фиг.1 показаны зависимости интенсивности ЗФ суспензии хлореллы, возбуждаемой в режимах высокого (ЗФв) и низкого (ЗФн) света, от концентрации (в молях/литр) диурона - токсиканта, вызывающего подавление фотосинтетического транспорта электронов. Первый режим достигают тем, что относительно длительные импульсы (20 мсек) возбуждающего света высокой интенсивности (100-250 Вт/м2) чередуют со сравнительно короткими темновыми интервалами (5 мсек), во время которых, в первую миллисекунду, регистрируют ЗФ. Режим низкого света получен благодаря тому, что столь же яркий импульс возбуждения подают в течение 1-4 мсек, после которого следует более длительный темновой интервал (50 мсек). При этом интенсивность ЗФ измеряют не сразу после окончания светового возбуждения, а с задержкой 20-30 мсек. Поскольку в этот промежуток быстрые компоненты успеют полностью затухнуть, то в конце кривой затухающего свечения остаются и регистрируются только медленные компоненты.
В связи с тем, что интенсивность этих компонент у контрольной тест-культуры водоросли в отсутствие токсикантов в несколько сотен раз ниже, чем быстрых компонент, то при переходе в режим низкого света чувствительность системы регистрации автоматически увеличивается в 100 раз. Поэтому для реального представления о величине ОП ЗФ его значения, показанные на фиг.3, надо увеличить в 100 раз. Чтобы интенсивность свечения могла быть измерена в его индукционных максимумах, световые импульсы возбуждения, чередующиеся периодами, регистрируется ЗФ, подаются в течение 2-3 секунд.
Представленные на фиг.1 данные показывают, что интенсивность ЗФв тест-культуры водоросли хлорелла с ростом концентрации токсиканта многократно снижается. В этих условиях ЗФн столь же значительно возрастает. При этом относительный показатель ЗФ, в виде отношения интенсивностей свечений в режимах высокого и низкого возбуждающего света, уменьшается в 100 и более раз.
Пример 2
В кюветы, аналогичные примеру 1, вместо диурона вносят различные концентрации ионов кадмия. Согласно рекомендациям [патент РФ №2222003, G01N 21/64, опубл. 20.01.2004 г.] тестируемые пробы, для большего проявления действия данного тяжелого металла на клетки водоросли, в течение 1 часа подвергают световой экспозиции. Интенсивность светового облучения кювет с тест-культурой водоросли составляет 60 Вт/м. На фиг.2 показаны концентрационные зависимости показателей ЗФ водоросли хлорелла в присутствии ионов кадмия, измеренные в условиях, аналогичных указанным в примере 1. Хорошо видно, что и этот токсикант вызывает значительное снижение интенсивности ЗФв и увеличение ЗФн. Величина отношения этих показателей ЗФ также многократно снижается.
Пример 3
В кюветы, аналогичные примеру 1, вносят по 3,6 см3 сточных вод целлюлозно-бумажного комбината (ЦБК) и сточных вод на выходе городских очистных сооружений (ОС), разбавленные дистиллированной водой в ряд кратный двум. В качестве контроля используют дистиллированную воду. В каждое разведение сточных вод добавляют по 0,4 см3 культуры водоросли хлорелла с оптической плотностью 0,4. После 1-часовой световой экспозиции с интенсивностью светового облучения 60 Вт/м2 производят измерение интенсивности замедленной флуоресценции в режимах высокого и низкого светового облучения. На фиг.3 показана зависимость относительного показателя ЗФ от концентрации (процента разбавления) тестируемых сточных вод (параметры замера ЗФ, как в примере 1). Сточная вода после очистных сооружений практически не вызывает изменения относительного показателя ЗФ культуры водоросли, что свидетельствует о ее нетоксичности. И наоборот, стоки ЦБК проявляют достаточно высокую токсичность, которая снимается только после их 8-кратного разбавления чистой водой.
Преимущество заявляемого способа биотестирования токсичности вод и водных растворов заключается в повышении точности и чувствительности измерения токсичности вод при биотестировании вследствие увеличения диапазона реагирования относительного показателя замедленной флуоресценции хлорофилла растительного тест-организма при воздействии на него поллютантов, за счет создания новых условий регистрации замедленной флуоресценции хлорофилла растительных тест-организмов.
Способ биотестирования токсичности вод и водных растворов, включающий облучение исследуемого образца растительного объекта прерывистым светом высокой интенсивности 100-250 Вт/м2 от синих светоизлучающих диодов с возбуждением свечения этого образца и регистрацией послесвечения в красной спектральной области фотоприемником между световыми импульсами, пропускаемыми через красный светофильтр, причем за счет сокращения длительности световых периодов возбуждения свечения при одновременном увеличении темновых интервалов между ними создают условия низкого светового облучения, а за счет увеличения соотношения длительности световых периодов к темновым создают условия высокого светового облучения, измеряют интенсивность замедленной флуоресценции исследуемого образца в режиме высокого светового облучения в начале каждой кривой затухания, интенсивность в режиме низкого светового облучения измеряют в конце каждой кривой затухания, а о токсичности судят по их отношению.