Способ оценки овариальной функции у больных раком молочной железы репродуктивного возраста, подвергавшихся неоадъювантной химиотерапии
Иллюстрации
Показать всеИзобретение относится к диагностике, а именно к способу оценки овариальной функции у больных раком молочной железы репродуктивного возраста, подвергавшихся неоадъювантной химиотерапии. Способ оценки овариальной функции у больных раком молочной железы репродуктивного возраста, подвергавшихся неоадъювантной химиотерапии, включающий исследование сыворотки крови, в которой определяют концентрации тестостерона и фолликулостимулирующего гормона, оценку овариальной функции проводят по определенной формуле, и при значении менее 8,0 у.е. и/или значении концентрации тестостерона менее 0,320 нг/мл делают вывод о снижении овариальной функции в результате лечения. Вышеописанный способ позволяет оптимизировать оценку овариальной функции у больных раком молочной железы репродуктивного возраста, подвергавшихся неоадъювантной химиотерапии, и расширяет арсенал способов такой оценки. 1 ил., 3 табл., 4 пр.
Реферат
Изобретение относится к медицине, в частности к онкологии и эндокринологии, и может быть использовано для оценки овариальной функции у больных раком молочной железы репродуктивного возраста, подвергавшихся неоадъювантной химиотерапии (НХТ).
Помимо хирургического и лучевого лечения, в терапии рака молочной железы значимое место занимают системные подходы, которые условно могут быть подразделены на эндокрино- и химиотерапию. Химиотерапия применяется по показаниям как у больных менопаузального, так и репродуктивного возраста, и, помимо адъювантного (послеоперационного) варианта, достаточно широко используется в неоадъювантном режиме, т.е. в дооперационном периоде (Семиглазов В.Ф., Семиглазов В.В., Клетсель А.Е. Неоадъювантное и адъювантное лечение рака молочной железы. М.: МИА. 2008, 288 с.; Moulder S, Hortobagyi GN. Advances in the treatment of breast cancer. Clin Pharmacol Ther. 2008, Vol.83(1), P.26-36).
В репродуктивном возрасте неоадъювантная химиотерапия часто, но не всегда, приводит к нарушению цикла, а то и к полной аменорее (С.А.Тюляндин, В.М.Моисеенко /ред./ Практическая онкология: избранные лекции. СПб.: Центр ТОММ, 2004. - 784 с.; Anderson RA, Cameron DA. Pretreatment serum anti-müllerian hormone predicts long-term ovarian function and bone mass after chemotherapy for early breast cancer. J Clin Endocrinol Metab. 2011, Vol.96(5), P.1336-1343). Наступление аменореи, даже эквивалентной по продолжительности критериям естественной менопаузы (более 12 месяцев с момента прекращения менструации), еще не означает полного выключения овариальной функции. Степень сохранения или утраты последней (что может быть обозначено и как овариальный резерв, хотя в буквальном смысле под этим нередко понимают число яйцеклеток, способных к оплодотворению) и ее оценка на фоне использования НХТ при раке молочной железы имеет большое биологическое и клиническое значение.
Действительно, можно выделить, как минимум, три фундаментально-прикладных аспекта НХТ-опосредованного выключения овариальной функции. Первый, как наиболее очевидный - утрата способности к деторождению. Второй, рассматриваемый как позитивный, - частичное снижение овариальной функции, индуцированное неоадъювантной химиотерапией, может быть важным дополнительным механизмом, способствующим (как традиционно считается, за счет выпадения эстрогенов) улучшению итоговых результатов лечения больных раком молочной железы (Veronesi U, Boyle Р, Goldhirsch A. et al. Breast cancer. Lancet. 2005, Vol.365(9472), P.1727-1741; Berruti A, Generali D, Kaufmann M. et al. International expert consensus on primary systemic therapy in the management of early breast cancer. J Natl Cancer Inst Monogr. 2011, 2011(43), P.147-151). И третий - это развитие эндокринно-обменных нарушений по типу метаболического синдрома, спровоцированных лекарственным повреждением функции яичников.
Известные методы исследования овариального резерва, в принципе, могут быть подразделены на инструментальные (прежде всего, сонография) и лабораторные. Лабораторные методы включают определение содержания в крови эстрадиола, ингибина В и антимюллерового гормона (АМГ), а также уровня гипофизарного гонадотропина (ФСГ), поскольку его повышение до определенных значений свидетельствует о наступлении менопаузы.
Известен способ оценки овариальной функции у больных раком молочной железы репродуктивного возраста, подвергавшихся НХТ, включающий определение содержания в крови эстрадиола и ФСГ (Han HS, Ro J, Lee KS et al. Analysis of chemotherapy-induced amenorrhea rates by three different anthracycline and taxane containing regimens for early breast cancer. Breast Cancer Res Treat. 2009, Vol.115(2), P.335-342; Del Mastro L, Boni L, Michelotti A. et al. Effect of the gonadotropin-releasing hormone analogue triptorelin on the occurrence of chemotherapy-induced early menopause in premenopausal women with breast cancer: a randomized trial. JAMA. 2011 Vol.306(3), P.269-276). Этот способ принят авторами за прототип.
Относительным недостатком способа является ориентация на селективную роль эстрогенов и эстрогенозависимости как характеристики, соответственно, овариальной функции и потенциальной гормональной регуляции канцерогенеза в молочной железе, без учета известного (Kaaks R, Rinaldi S, Key TJ et al. Postmenopausal serum androgens, oestrogens and breast cancer risk: the European prospective investigation into cancer and nutrition. Endocr Relat Cancer. 2005, Vol.12(4), P.1071-1082; Eliassen AH, Hankinson SE. Endogenous hormone levels and risk of breast, endometrial and ovarian cancers. Adv Exp Med Biol. 2008, Vol.630, P.148-165) вовлечения в эти процессы андрогенного компонента. Между тем, содержание основного стероида из группы андрогенов - тестостерона, подавляющая доля которого у женщин образуется в яичниках, по некоторым данным, в фолликулярной жидкости может до 10000 раз превосходить его концентрацию в крови взрослых женщин (Grant VJ, Irwin RJ, Standley NT et al. Sex of bovine embryos may be related to mothers' preovulatory folliculartestosterone. Biol Reprod. 2008, Vol.78, P.812-815).
Техническим результатом изобретения является расширение арсенала средств по оценке овариальной функции у больных раком молочной железы, завершивших курс неоадъювантной химиотерапии, и оптимизация этой оценки.
Указанный технический результат достигается тем, что в известном способе оценки овариальной функции у больных раком молочной железы репродуктивного возраста, подвергавшихся неоадъювантной химиотерапии, включающем исследование сыворотки крови, согласно изобретению определяют концентрации тестостерона и фолликулостимулирующего гормона (ФСГ), находят их отношение по формуле:
и при значении этого отношения менее 8,0 у.е. и/или значении концентрации тестостерона менее 0,320 нг/мл делают вывод о снижении овариальной функции в результате лечения.
Всего была обследовано 37 больных раком молочной железы, не имевших признаков менопаузы, из которых 25 женщин в возрасте от 29 до 54 лет (контрольная группа) не подвергались химиотерапии, а 12 женщин в возрасте от 30 до 53 лет (основная группа) обследовались в основном через 2-3 месяца после завершения курса неоадъювантной химиотерапии, проводившейся, преимущественно, по схемам ТАС (таксотер, доксорубицин, циклофосфамид) или FAC (вместо таксотера использовался 5-фторурацил). Число циклов НХТ варьировало при этом от 4 до 10 и составило в среднем 5,3±0,6. В контрольной группе в 21 случае имелся сохраненный менструальный цикл, а еще в четырех наблюдениях отмечалась аменорея длительностью от 1,5 до 9,5 мес. В основной группе среди больных, получавших НХТ, аменорея длительностью от 1,5 до 6 месяцев имела место в 9 из 12 случаев, а в 3 остальных случаях менструальный цикл был сохранен.
Обследование всех больных проводилось утром натощак, после 10-12-часового ночного голодания. Венозную кровь, взятую из кубитальной вены, отстаивали в течение 30-45 мин, центрифугировали, отделяли сыворотку и сохраняли ее вплоть до исследования гормональных параметров в морозильной камере при температуре -20°C. Для определения содержания тестостерона, эстрадиола и ФСГ в сыворотке крови иммуноферментным методом использовали сертифицированные наборы (DRG, Германия), включающие в себя материал для построения стандартных кривых. Индекс массы тела рассчитывали по формуле вес тела, кг/(рост, м)2. Результаты подвергали статистической обработке (включая вычисление медианы, средней, ошибки средней, среднего квадратического отклонения и ранговый корреляционный анализ) в программе Statistica for Windows, версия 8.0.
В табл.1 представлены сравнительные данные по основной и контрольной группам, включающие возраст, индекс массы тела и содержание исследованных в сыворотке крови гормонов (M±m).
| Таблица 1 | |||||
| Группа | Возраст, лет | Индекс массы тела, усл. ед. | Тестостерон, нг/мл | Эстрадиол, пг/мл | ФСГ, мМЕд/мл |
| Без лечения (n=25) | 43,0±1,3 | 25,3±1,0 | 0,579±0,055 | 163,4±59,7 | 15,9±3,6 |
| После НХТ (n=12) | 40,7±2,2 | 24,7±1,3 | 0,320±0,027 | 20,4±8,9 | 63,9±9,8 |
| P | <0,01 | <0,01 | <0,01 |
Как следует из представленных сведений (табл.1), у больных раком молочной железы, подвергавшихся НХТ, впервые выявлено снижение концентрации тестостерона в крови, статистическая значимость которого в принципе не уступает таковой, регистрируемой в отношении снижения эстрадиолемии или повышения в циркуляции уровня ФСГ. У шести из 12 больных, вошедших в основную группу (получавших НХТ), уровень тестостеронемии был равен или ниже 0,320 нг/мл. Поскольку при этом содержание эстрадиола в крови в 5 из 6 случаев находилось в пределах 0-19,9 пг/мл, т.е. было крайне низким, был сделан вывод, что тестостеронемия менее 0,32 нг/мл позволяет с высокой вероятностью судить о снижении овариальной функции. Тем не менее, так как разнонаправленные изменения содержания тестостерона и ФСГ в крови в результате применения НХТ оказались вполне очевидны, было сочтено целесообразным оценить и отношение этих показателей как в среднем для сравниваемых групп, так и в индивидуальном плане.
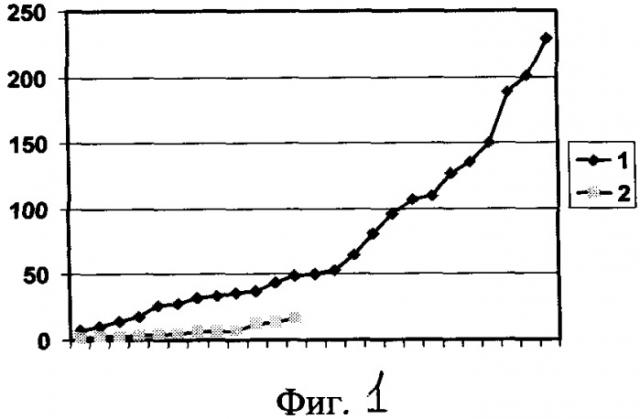
По средним данным, значение отношения [(концентрация тестостерона/концентрация ФСГ)×100] в контрольной группе (без лечения) достоверно превосходило его значение у больных, подвергавшихся курсам неоадъювантной химиотерапии (соответственно, 77,2±12,7 и 6,9±1,4; p<0,01). Сопоставление индивидуальных значений этого отношения также выявило весьма существенные различия: ни у одной из больных раком молочной железы, обследовавшихся до начала лечения, его величина не была ниже 8,0, в то время, как в группе, подвергавшейся НХТ, значение менее 8,0 (избранное, как следствие, в качестве пограничного) выявлялось в 9 из 12 случаев, т.е. у 75% больных.
В табл.2 представлен анализ сравнения концентраций тестостерона, эстрадиола и ФСГ (M±m) в крови подвергавшихся неоадъювантной химиотерапии больных раком молочной железы в зависимости от состояния их менструального цикла.
| Таблица 2 | |||
| Группа | Тестостерон, нг/мл | Эстрадиол, пМ/л | ФСГ, мМЕд/мл |
| Аменорея (n=9) | 0,321±0,035 | 60,8±37,8 | 69,1±9,1 |
| Сохраненный менструальный цикл (n=3) | 0,316±0,047 | 116,6±72,5 | 48,7±30,6 |
Как видно из табл.2, уровень тестостерона в крови снижается фактически до одинаковых значений как при НХТ-индуцированной аменорее, так и при сохраненном менструальном цикле. Это, с одной стороны, подтверждает тот факт, что сохранение менструаций еще не означает интактности овариальной функции, а, с другой, указывает на то, что определение тестостеронемии в такой ситуации, по крайней мере, не уступает оценке содержания в крови эстрадиола, поскольку, как оказывается на примере больных с сохранением менструального цикла, уровень тестостерона при этом снижается более отчетливо, чем эстрадиолемия.
При сравнении коэффициентов ранговой корреляции по Спирмену между уровнем тестостерона в крови больных, не подвергавшихся и подвергавшихся НХТ, и рядом других изучавшихся параметров (табл.3) выяснилось, что после лечения характер этих связей меняется, дополнительно подчеркивая зависимость тестостеронемии от изменения овариальной функции при раке молочной железы, подвергнутом консервативной дооперационной терапии.
| Таблица 3 | |||
| Группа больных | vs индекс массы тела | vs уровень эстрадиола в крови | vs уровень ФСГ в крови |
| Без лечения (n=24*) | 0,43 (p<0,05**) | 0,15 | 0,25 |
| После НХТ (n=12) | -0,29 | 0,25 | 0,09 |
| Примечания: | |||
| *Из-за неполноты некоторых сведений у 1 пациентки обсчет производился у 24 больных. **Степень корреляционной связи была в остальных случаях статистически незначимой. |
В совокупности полученные данные дают возможность заключить, что определение уровня тестостерона в крови и соотношения этого показателя с концентрацией ФСГ позволяет оценить состояние овариальной функции у больных раком молочной железы репродуктивного возраста, подвергавшихся НХТ, и судить о степени ее снижения.
Способ иллюстрируется фиг.1, на которой представлен график распределения данных о величине коэффициента в виде отношения [(концентрация тестостерона/концентрация ФСГ)×100] у больных раком молочной железы репродуктивного возраста, не подвергавшихся (кривая 1) и подвергавшихся (кривая 2) неоадъювантной химиотерапии. По оси ординат - значения коэффициента в у.е., по оси абсцисс - отдельные больные.
Способ осуществляют следующим образом.
Определяют концентрацию тестостерона и ФСГ в сыворотке крови и по найденным значениям концентрации тестостерона и отношения (концентрация тестостерона/концентрация ФСГ)×100 оценивают овариальную функцию. Считают, что при значении концентрации тестостерона менее 0,320 нг/мл и/или значении отношения (концентрация тестостерона/концентрация ФСГ)×100 менее 8,0 у.е. овариальная функция снижена в результате лечения.
Способ иллюстрируется следующими клиническими примерами.
Пример 1. Больная А., 50 лет, впервые выявленный рак молочной железы без лечения. При обследовании: тестостерон 0,359 нг/мл, ФСГ 13,6 мМЕд/мл, отношение [(концентрация тестостерона/концентрация ФСГ)×100]=26,5 у.е. Вывод: лабораторных признаков снижения овариальной функции не установлено.
Пример 2. Больная Д., 53 г., подверглась 7 курсам неоадъювантной химиотерапии, длительность аменореи 11 мес. При обследовании: тестостерон 0,231 нг/мл, ФСГ 16,8 мМЕд/мл, отношение [(концентрация тестостерона/концентрация ФСГ)×100]=13,7 у.е. Вывод: лабораторные признаки снижения овариальной функции в результате лечения.
Пример 3: Больная О., 36 лет, подверглась 4 курсам неоадъювантной химиотерапии, длительность аменореи 4 мес. При обследовании: тестостерон 0,429 нг/мл, ФСГ 63,8 мМЕд/мл, отношение [(концентрация тестостерона/концентрация ФСГ)×100]=6,8 у.е. Вывод: лабораторные признаки снижения овариальной функции в результате лечения.
Пример 4. Больная М., 46 лет, подверглась 4 курсам неоадъювантной химиотерапии по схеме ТАС. При обследовании: тестостерон 0,272 нг/мл, ФСГ 55,99 мМЕд/мл, отношение [(концентрация тестостерона/концентрация ФСГ)×100] 4,86 у.е. Вывод: убедительные лабораторные признаки снижения овариальной функции в результате лечения.
Предлагаемый способ позволяет оптимизировать оценку овариальной функции у больных раком молочной железы репродуктивного возраста, подвергавшихся НХТ, и расширяет арсенал средств такой оценки.
Способ оценки овариальной функции у больных раком молочной железы репродуктивного возраста, подвергавшихся неоадъювантной химиотерапии, включающий исследование сыворотки крови, отличающийся тем, что определяют концентрации тестостерона и фолликулостимулирующего гормона ФСГ, находят их отношение по формуле и при значении этого отношения менее 8,0 у.е. и/или значении концентрации тестостерона менее 0,320 нг/мл делают вывод о снижении овариальной функции в результате лечения.