Силибининовый компонент для лечения гепатита
Иллюстрации
Показать всеПредложены: применение силибининового компонента общей формулы (I) для получения лекарственного средства для парентерального введения для лечения вирусного гепатита, причем лекарственное средство необязательно содержит циклодекстрин и/или фосфолипид, и набор того же назначения, включающий указанный силибининовый компонент и другое лекарственное средство, представляющее собой один или несколько фармацевтических агентов: из аргинина глутамата, силимарина, цитиолона, эподемиола, орнитина оксоглурата, тидиацикаргинина, миоинозита, метионина и N-ацетилметионина, холина, орнитина аспартата, цианиданола, тиопронина, бетаина, цианокобаламина, лейцина, левулозы, ацикловира, идоксуридина, видарабина, рибавирина, ганцикловира, фамцикловира, валацикловира, цидофовира, пенцикловира, валганцикловира, бривудина, интерферона. Показано снижение вирусной нагрузки и реактивация пациентов после парентерального введения заявленного силибининового компонента. Лекарственное средство предпочтительно не содержит силидианина, и/или силикристина, и/или изосилибинина. 2 н. и 19 з.п. ф-лы, 12 ил., 5 пр., 12 табл.
Реферат
Настоящее изобретение относится к применению силибининового компонента для получения лекарственного средства для лечения вирусного гепатита, предпочтительно гепатита В или С, в частности для снижения вирусной нагрузки. Предпочтительно лекарственное средство адаптировано для парентерального введения. Предпочтительно силибининовый компонент является сложным эфиром силибинина.
Силибинин {3,5,7-тригидрокси-2-(3-(3-гидрокси-4-метоксифенил)-2-(гидроксиметил)-2,3-дигидробензо[b][1,4]-диоксин-6-ил)хроман-4-он, или по номенклатуре Европейской фармакопеи (2R,3R)-3,5,7-тригидрокси-2-[(2R,3R)-3-(4-гидрокси-3-метоксифенил)-2-(гидроксиметил)-2,3-дигидро-1,4-бензодиоксин-6-ил]-2,3-дигидро-4Н-1-бензопиран-4-он}, представляет основную составную часть силимарина и основной флавоноид, экстрагированный из расторопши (Silybum marianum Gaertneri).
Силибинин имеет структуру:
Диастереоизомеры силибинин А и силибинин В представляют в литературе раздельно:
Силибинин представляет основную составляющую часть силимарина (в смеси 50:50 силибина А и силибина В). К другим составляющим частям относятся изосилибинин (изосилибин А и изосилибин В), силидианин, силикристин, изосиликристин, таксифолин и другие. Способы выделения силибинина известны в предшествующем уровне техники (например, US 4871763).
Силибинин и силимарин подробно изучены и описаны. В связи с этим можно сослаться на работы N.-C. Kim и др., Org. Biomol. Chem. 1, 2003, сс.1684-1689; D.Y.W. Lee и др., J. Nat. Prod. 66, 2003, сс.1171-1174; D.J. Kroll и др., Integrative Cancer Therapies, 6, 2007, сс.110-119; Z.Wen и др., DMD Fast Forward, doi:10.1124/dmd.107.017566; и US 4871763.
История лекарственного растения Silybum marianum насчитывает примерно 2000 лет. Силимарин - экстракт семян расторопши, представляет старинное лекарство для лечения различных расстройств печени и желчного пузыря, включая гепатит, цирроз, а также гепатопротектор, защищающий печень от отравления дикими грибами, алкоголем, химическими веществами и токсинами из окружающей среды. Механизм действия силимарин разнообразен. Самое большое рандомизированное контролируемое исследование, проведенное в 1970-е годы, показало, что длительное применение силимарина может снизить смертность пациентов с хроническим циррозом (P.Ferenci и др., J Hepatol 9, 1989, сс.105-113). Тем не менее, роль этого лекарственного средства для лечения болезней печени остается противоречивой (S.Verma и др., Clinical Gastroenterology and Hepatology 5, 2007, сс.408-416; F.Rainone, Am Fam Phys 72(7), 2005, cc.1285-1288). Частично эта неопределенность вызвана ограниченными сведениями по фармакокинетике и по оптимальным режимам дозирования. Силимарин плохо растворим в воде, и пероральное применение приводит к ограниченной биодоступности.
Фармацевтические применения силибинина также известны. Силибинин обладает сильными антиоксидативными свойствами (см. A.Pietrangelo и др., Gastroenterology 109, 1995, сс.1941-1949; М.I.Lucena и др., Int J Clin Pharmacol Ther 40, 2002, cc.2-8; L.Mira и др., Biochem Pharmacol 48, 1994, cc.753-759) и противофиброзными свойствами (см. G.Boigk и др., Hepatology 26, 1987, сс.643-649; С.Dehmlow и др., Hepatology 23, 1996, сс.749-754), поэтому он потенциально применим в качестве лекарственного средства для лечения хронических заболеваний печени. Чистое вещество силибинин вводят внутривенно, например, при отравлении печени бледной поганкой (токсины аменитин, фаллоидин) для предотвращения разрушения печени (см. К.Hruby и др., Hum Toxicol 2, 1983, сс.138-195). Действие при грибном отравлении частично объясняется стимулированием ядрышковой полимеразы А, которая повышает синтез рибосомального белка и ингибирует перекисное окисление липидов (J.Sonnenbichler и др., Prog Clin Biol Res. 213, 1986, cc.319-331). Клинические исследования также были успешны в предупреждении и лечении некоторых типов рака (L.Varghese и др., Clin Cancer Res 11(23), 2005, сс.8441-8447; К. Letschert и др., Toxicological Sciences 91, 2006, сс.140-149).
Сложный эфир силибинина получают в виде раствора для инфузии, например продукт Legalon® SIL в Федеративной Республике Германии.
Вирусный гепатит относится к инфекциям, которые поражают печень и вызываются вирусами. Вирусные гепатиты активно исследуют во всем мире. Вирусный гепатит не только вызывает высокую смертность, но также истощает медицинские ресурсы и может вызвать тяжелые экономические последствия. Большинство всех вирусных гепатитов можно предотвратить.
К понятию «вирусный гепатит» относится пять разных заболеваний, которые вызываются по меньшей мере пятью разными вирусами. Гепатит А и гепатит В (инфекционный гепатит и сывороточный гепатит соответственно) представляют разные заболевания и оба диагностируются по специфическому серологическому тесту. Гепатиты С и Е представляют третью категорию, отличающуюся по типу, причем гепатит С передается парентерально, а гепатит Е передается энтерально. Гепатит D, или дельта гепатит, представляет заболевание, вызываемое вирусом другого типа, зависящего от инфицирования гепатитом В. Эта форма гепатита может быть в форме суперинфекции у носителя гепатита В или в форме совместного инфицирования у индивидуума с острым гепатитом В.
Гепатит С - инфекционное заболевание людей, вызываемое вирусом гепатита С (ВГС). Инфицирование вирусом гепатита С может привести к тяжелому поражению печени, например воспалению паренхимы печени, фиброзу печени, циррозу печени и карциноме печени. Более чем у 80% инфицированных пациентов инфекция ВГС становится хронической. Передача ВГС обычно происходит парентеральным путем через кровь.
Установлено, что примерно 170 миллионов людей в мире инфицировано вирусом гепатита С (ВГС). На протяжении десятилетий у инфицированных пациентов симптомы заболевания отсутствуют до тех пор, пока не разовьется цирроз печени и/или гепатоцеллюлярная карцинома. Примерно в 40-50% случаев в США трансплантация печени вызвана инфекциями ВГС. Было идентифицировано шесть генотипов ВГС (ВГС1-ВГС6), которые отличаются по географическому распространению и по их ответу на лечение.
Установлено, что белки ВГС индуцируют активирование STAT-3 через оксидативный стресс и Са2+ передачу сигнала (К.Koike и др., Hepatol Res 34, 2006, сс.65-73; G.Waris и др., J Virol 79, 2005, сс.1569-1580), а также продукты перекисного окисления липидов и антиоксидантную генную экспрессию (М.Okuda и др., Gastroenterology 122, 2002, сс.366-375). Предполагают, что баланс оксидативного и восстановительного потенциалов в клетке (клеточный окислительно-восстановительный потенциал) имеет выраженные последствия в отношении метаболических путей сигнальной трансдукции (Y.M.Janssen и др., Am J Physiol 273, 1997, сс.789-796), включая ослабленную ИФН-альфа передачу сигнала (D.Di Bona и др., J Hepatol. 45, 2006, сс.271-279).
Инфекция ВГС поделена по требованиям ICD10 (ВОЗ, версия 2007) на острый (В17.1) и хронический гепатит С (В18.2).
ВГС является одной из наиболее важных причин развития острого или хронического гепатита. Однако течение болезни может сильно различаться и в высокой степени подвержено изменчивости. Поэтому нельзя говорить о типичном течении болезни, поскольку инфекция ВГС проявляется широким спектром клинического проявления, т.е. вариабельными симптомами, разными клиническими картинами и различными вторичными заболеваниями печени и поражениями за пределами печени.
Примерно у 20% пациентов с острым гепатитом воспаление печени является следствием инфекции ВГС. Однако в острой фазе гепатит С обычно протекает бессимптомно и поэтому примерно в 85% случаев не диагностируется. В некоторых случаях имеются только неспецифические симптомы, напоминающие грипп. Обычно инфекция не проявляется во время острой фазы.
Гепатит С становится хроническим примерно у 85% пациентов с острой инфекцией ВГС. Такая высокая степень перехода заболевания в хроническую фазу является результатом высокой изменчивости ВГС, т.е. ген, который кодирует оболочку ВГС, мутирует с высокой частотой. Из-за высокой вариабельности вируса и, в частности, высокой вариабельности антигенного эпитопа ВГС, мутантный ВГС избегает распознавания иммунной системой человека. Примерно у 25% пациентов результатом хронического воспаления печени является формирование цирроза печени и повышение риска развития карциномы печени (см., например, J.Н.Hoofnagle, Hepatology 1997, 26, приложение 1, сс.15S-20S; М.I. Memon и др., Journal of Viral Гепатит 9, 2002, сс.84-100; S.L.Tan и др., Nature Reviews, Drug Discovery 1, 2002, cc.867-881).
Пациенты, инфицированные ВГС, обычно получают стандартное комбинированное лечение пэгелированным интерфероном-α2а или интерфероном-α2b и рибавирином. При инфекциях ВГС с генотипами 2 или 3 (инфекции ВГС2 или ВГС3) такое комбинированное лечение проводят в течение 24 недель. При инфекциях ВГС с генотипом 1 (ВГС1) для ВГС1-положительных пациентов проводят комбинированное лечение в течение 48 недель. Многие из ВГС-инфицированных пациентов, однако, прерывают лечение из-за имеющихся побочных эффектов и/или из-за неприятия парентерального введения и длительности применения. Кроме того, только примерно 50% пациентов с инфекцией ВГС1 достигают положительного результата столь длительного лечения, т.е. оставшиеся не реагируют на такое лечение, т.е. являются нон-респондерами (см., например, R.E.T.Smith, Nature Reviews, Drug Discovery, 5, 2006, с.715). Лечение вызываемого вирусом гепатита С заболевания пэгелированным интерфероном плюс рибавирином оказывается неэффективным примерно у половины пациентов с генотипом 1. Неэффективность лечения происходит или из-за отсутствия реакции организма на лечение (минимальное снижение титра вируса), или из-за рецидива (сильный первоначальный ответ на лечение сменяется новым ростом титра вируса во время или после лечения). Такие разные последствия лечения могут зависеть от разных факторов, включая генетический статус хозяина, иммунный ответ и генетические отличия вирусов (см. M.W.Fried и др., New England Journal of Medicine 347, 2002, сс.975-982; H.S.Conjeevaram и др., Gastroenterology 131, 2006, сс.470-477; M.P.Manns и др., Lancet 358, 2001, сс.958-965; D.B.Strader и др., Hepatology 39, 2004, с.114771; S.J.Hadziyannis и др., Ann Intern Med, 140, 2004, сс.346-355). Генетические отличия вирусов могут включать или различия, имевшиеся до начала лечения, или различия, которые возникают во время лечения из-за эволюции вируса в ответ на давление применяемого лечения.
Разрабатывают новые варианты лечения, включающие оптимизацию имеющегося стандартного лечения пэгелированным интерфероном плюс рибавирином, особенно целевую противовирусную терапию в отношении ВГС, новые иммуномодулирующие агенты и лечение, направленное на снижение фиброза (см. R.E.Stauber и др., Drugs 68(10), 2008, с.1347).
До настоящего времени нет вакцины против ВГС. Стандартные методы лечения очень дорогие, дают незначительный эффект в плане уничтожения инфекции ВГС и иногда вызывают значительные побочные эффекты (S.L.Tan и др., Nature Reviews, Drug Discovery 1, 2002, с.867; R.Bartenschlager, там же, с.911).
Существует потребность в лекарственных средствах для лечения вирусного гепатита, особенно гепатита В и С.
Задача, решаемая в настоящем изобретении, заключается в получении эффективного лекарственного средства для лечения вирусного гепатита, в частности гепатита В или С, которое обладает преимуществами по сравнению с лекарственными средствами предшествующего уровня техники. Лекарственное средство по возможности не должно иметь побочных эффектов или иметь слабовыраженные побочные эффекты, и быть эффективным, например, для пациентов с гепатитом С, которые существенным образом не отвечают на традиционное комбинированное лечение пэгинтерфероном/рибавирином. Кроме того, лекарственное средство должно обладать выраженными противовирусными свойствами и, таким образом, надежно снижать нагрузку вируса.
Достижение указанной задачи изложено в формуле настоящего изобретения.
Неожиданно было установлено, что силибинин, его фармацевтически приемлемые соли и/или производные применимы для лечения воспаления, вирусных болезней печени, особенно гепатита С. Таким образом, у пациентов с гепатитом С, которые не отвечают на лечение иммуномодулирующей/ противовирусной комбинированной терапией (нон-респондеры), например пэгинтерфероном/рибавирином, которая представляет в настоящее время стандартное лечение гепатита С, существенное снижение нагрузки вируса может быть достигнуто путем введения, предпочтительно парентерального введения, силибининового компонента. Также было показано, что предварительное лечение силибининовым компонентом повышает ответ пациентов на более позднее введение интерферона и рибавирина.
Исследования, касающиеся лечения инфекций ВГС, особенно касающиеся подавления инфекций ВГС, путем введения силимарина, описаны в предшествующем уровне техники (см., например, R.Sailer и др., Drugs 61(14), 2001, сс.2035-2063; К.Е.Mayer и др., Journal of Viral Hepatitis, 12, 2005, cc.559-67; US 2005/0123628; S.J.Polyak и др., Gastroenterology 132, 2007, cc.1925-1936).
R.Sailer и др. сообщают, что хотя не установлено влияния силимарина на репликацию вируса, по фармакологическим оценкам можно ожидать, что он ингибирует воспаление и цитотоксический каскад событий, запускаемых вирусной инфекцией. Пероральное введение комплекса силибинина-фосфатидилхолина (IdB1016, 240 мг силибинина дважды в сутки) в краткосрочном с плацебо-контролем экспериментальном исследовании 20 пациентов с хроническим гепатитом показало, что эволюция уровней AST существенно понижена в группе силибинина при отсутствии существенных отличий других исследовавшихся показателей функции печени (см. A.Vailati и др., Fitoterapia, 64(3), 1993; G.Buzzelli и др., Int. J.Clin. Pharmacol. Ther. Toxicol. 31, 1993, cc.456-460).
K.E.Mayer и др. описывают, что пероральное лечение силимарином приводит к снижению трансаминаз в сыворотке по сравнению с исходными показателями в четырех исследованиях и с плацебо только в одном исследовании. Однако нет доказательства, что силимарин влияет на нагрузку вируса или улучшает гистологию печени при гепатите В или С (см. M.L.Chavez, J.Herb. Pharmacother. 1(3), 2001, сс.79-90; L.B.Seeff и др., Hepatology, 34(3), 2001, сс.595-603). Был сделан вывод, что силимариновые соединения вероятно снижают уровень сывороточных трансаминаз у пациентов с хроническим вирусным гепатитом, но предположительно не влияют на нагрузку вируса или гистологию печени.
US 2005/0123628 относится inter alia к получению и пероральному введению композиций, включающих глицирризин, препарат лимонника, аскорбиновую кислоту, L-глутатион, силимарин, липоевую кислоту и D-альфа-токоферол. Сообщают, что указанные композиции применимы для снижения оксидативного стресса и перекисного окисления липидов, для лечения хронического заболевания печени, хронической инфекции вирусного гепатита С и неалкогольного жирового гепатита. Многочисленные исследования сообщают о гепатопротекторных свойствах, которые силимарин проявляет против большого количества разных токсинов, включая ацетаминофен, этанол, четыреххлористый углерод и D-галактозамин, а также против ишемического повреждения, радиации и токсичности железа. В течение первых двадцати недель открытого нерандомизированного одноцентрового клинического исследования субъектам давали для орального введения два раза в сутки в совокупности 1000 мг глицирризина; три раза в сутки в суммарном количестве 1500 мг экстракта растения лимонника; три раза в сутки в суммарном количестве 6000 мг аскорбиновой кислоты; два раза в сутки в суммарном количестве 300 мг L-глутатиона; три раза в сутки в суммарном количестве 750 мг экстракта расторопши; два раза в сутки в суммарном количестве 300 мг липоевой кислоты; и один раз в сутки в количестве 800 ME D-альфа-токоферола. В течение первых десяти недель исследования субъектам вводили внутривенной инъекцией дважды в неделю четыре разные парентеральные композиции, из которых ни одна не содержит силимарина. Через 10 недель 12,0% субъектов, через 20 недель 24,0% субъектов проявили 1 log снижение нагрузки вируса. В US 2005/0123628 нет даже намека на то, что силимарин, или что только силибинин, может быть ответственным за относительно небольшое снижение вирусной нагрузки.
S.J.Polyak и др. сравнивают in vitro стандартизированный экстракт силимарина (МК-001) с коммерческими препаратами силимарина. Сообщают, что оба препарата проявляют противовирусное действие при использовании моделей, основанных на культуре клеток, хотя воздействие коммерческих препаратов не такое сильное по сравнению с МК-001. МК-001 ингибирует экспрессию фактора альфа некроза опухоли в анти-CD3 простимулированных мононуклеарных клетках периферической крови и зависимую от ядерного фактора каппа В транскрипцию в клетках гепатомы человека Huh7. Кроме того, доза МК-001 подавляет инфекцию клеток Huh7 и Huh7.5.1 вирусом JFH-1 дозозависимым способом. МК-001 проявляет действие против инфекции ВГС в выделенных клетках и при комбинировании с интерфероном-α ингибирует репликацию ВГС в большей степени по сравнению с ингибированием только одним интерфероном-α. Для сравнения анти-ВГС действия МК-001 с коммерческими препаратами силимарина, также тестируют продукт Ultrathistle® (фирма Natural Wellness, Монтгомери Нью-Йорк) и продукт Silybinin® (фирма Indena SpA, Милан). Однако сообщают, что МК-001 проявляет более сильное противовирусное действие по сравнению с продуктами Ultrathistle® и Silybinin®. На основании исследований in vitro был сделан вывод о том, что поскольку есть действие анти-ВГС, стандартизированный экстракт силимарина МК-001 превосходит два коммерческих продукта. S.J.Polyak ничего не сообщает о парентеральном введении очищенного силибинина, не говоря уже о лечении нон-респондеров. Кроме того, выводы, сделанные Polyak и др., противоречат клиническим исследованиям, которые показали отсутствие воздействия силимарина на ВГС у пациентов с хроническим гепатитом С (M.D.Tanamly и др., Dig Liver Dis. 36, 2004, сс.752-759; Е.Gabbay и др., World J Gastroenterol. 13, 2007, сс.5317-5323).
В настоящее время неожиданно было обнаружено, что введение, особенно парентеральное введение, предпочтительно чистого компонента силибинина снижает in vivo нагрузку вируса у пациентов с вирусным гепатитом. Таким образом, компонент силибинин способен понизить вирусную нагрузку. Это обстоятельство позволяет оптимизировать дозу силибинина при отсутствии других компонентов силимарина, которые могут вызвать нежелательные побочные эффекты.
Снижение вирусной нагрузки путем парентерального введения силибининового компонента особенно неожиданно, поскольку клинические исследования показывают, что силимарин не влияет на ВГС у пациентов с хроническим гепатитом С (М.Torres и др., P.R.Health Sci J 23(2), 2004, сс.69-74; M.D.Tanamly и др., Dig Liver Dis., 36, 2004, сс.752-759; A Gordon и др., J Gastroenterol Hepatol. 21, 2006, cc.275-280; E.Gabbay и др., World J Gastroenterol. 13, 2007, cc.5317-23; L.B.Seeff и др., Hepatology, 80(11), 2008, cc.1900-1906).
M.Torres и др. сообщают о клиническом исследовании, в котором приглашали принять участие пациентов в возрасте 21-65 лет с хроническим гепатитом С, не подвергавшихся воздействию противовирусной терапии. Рандомизируют 34 пациентов для лечения S.marianum 160 мг перорально трижды в неделю в течение четырех недель или лечение не проводилось (контроль). Исследование показало, что S.marianum не действует в качестве противовирусного агента.
M.D.Tanamly и др. сообщают о клиническом исследовании, в котором 177 пациентов с хроническим гепатитом, вызванным вирусом гепатита С, были рандомизированно поделены для получения или перорально силимарина или поливитаминных добавок. Исследование показало, что рекомендованная доза силимарина не воздействует на вирусемию вирусом гепатита С.
A.Gordon и др. сообщают о клиническом исследовании, в которое были вовлечены 24 субъекта с хроническим гепатитом С, а именно в рандомизированное двойное слепое с плацебо-контролем исследование. Субъекты получали 12 недель S.marianum (или 600 мг, или 1200 мг/сутки) и плацебо. Поводили биохимические, вирусологические, психологические исследования, а также анализ качества жизни. Семнадцать пациентов полностью прошли исследование. Исследование показало, что средние изменения титров РНК ВГС не отличались существенным образом у субъектов, получавших S.marianum, по сравнению с теми, кто получал плацебо.
Е.Gabbay и др. сообщают о клиническом исследовании, в которое было вовлечено 100 пациентов с хронической инфекцией ВГС, для которых лечение интерфероном было неудачным, и которые были рандомизированы для получения семи разных антиоксидантов наряду с капсулами силимарина, 250 мг, трижды в сутки. Основными конечными точками исследования были ферменты печени, уровни РНК ВГС и гистология. Исследование показало, что антиоксидативная терапия не влияет на вирусную нагрузку.
L.B.Seeff и др. сообщают об исследовании длительного противовирусного лечения цирроза при гепатите С с циррозом (HALT-C), включающем субъектов со сформированным хроническим гепатитом С, которые являются нон-респондерами в отношении первичной противовирусной терапии, но готовы участвовать в долгосрочном лечении пэгелированным интерфероном. Не обнаружено полезного воздействия силимарина на уровни РНК вируса гепатита С (ВГС). Таким образом, у получавших силимарин были сходные уровни ВГС при сравнении с уровнями у тех, кто не получал такого лечения.
Кроме того, неожиданно было обнаружено, что введение, особенно парентеральное введение, компонента силибинина способствует общепринятому лечению пэгинтерфероном/рибавирином. Установлено, что компонент силибинин активирует (реактивирует) чувствительность пациентов к традиционному лечению пэгинтерфероном/рибавирином и/или энхансерами антивирусного действия традиционной терапии пэгинтерфероном/рибавирином.
Краткое описание фигур
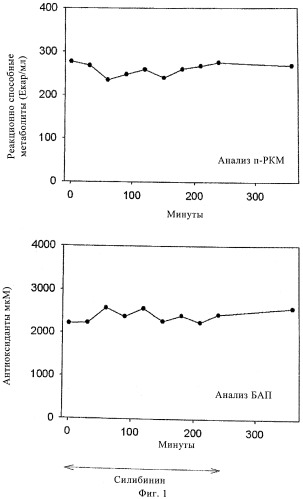
Фиг.1. Пример 1, исследование 1: параметры оксидативного стресса до и после инфузии 10 мг/кг силибининового компонента на протяжении 4 ч (п-РКМ = производные соединения реактивных кислородных метаболитов, БАП = биологический антиоксидантный потенциал).
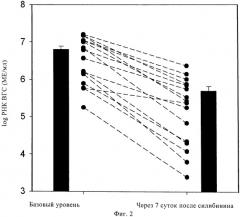
Фиг.2. Пример 1, исследование 1: РНК ВГС (log МЕ/мл; средняя величина ± стандартное отклонение) до (1 сутки) и после (7 суток) внутривенного введения 10 мг/кг силибининового компонента/сутки.
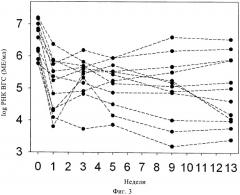
Фиг.3. Пример 1, исследование 1: изменения ВГС-РНК после внутривенного введения 10 мг/кг/сутки силибининового компонента в течение 7 суток с последующей комбинированной терапией пэгинтерфероном альфа 2а/рибавирином и 140 мг силимарина три раза в сутки.
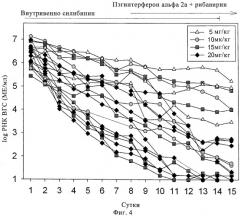
Фиг.4. Пример 1, исследование 2: изменения ВГС-РНК во время введения силибининового компонента в разных дозах в течение 14 суток с последующей комбинированной терапией пэгинтерфероном альфа 2а/рибавирином, начатой на 8 сутки.
Фиг.5. Пример 1, исследование 2: средняя величина ± среднеквадратичное отклонение снижения ВГС-РНК в течение 7 суток монотерапии в виде внутривенного введения компонента силибинина и 7 суток внутривенного введения компонента силибинина с пэгинтерфероном альфа 2а/рибавирином в разных дозах.
Фиг.6. Пример 1, исследование 2: изменения ВГС-РНК после завершения внутривенного введения силибинина (2 недели) у 14 пациентов, получавших силибинин в количестве 15 или 20 мг/кг/сутки. Комбинированную терапию пэгинтерфероном альфа 2а/рибавирином начинают на 8 сутки и 280 мг силимарином три раза в сутки на 15 сутки.
Фиг.7. Пример 2, конкретный пациент, изменения ВГС-РНК после внутривенного введения 20 мг/кг/сутки силибининового компонента во время двух интервалов введения, включающих 14 суток подряд, первый интервал во внутривенном введении начинается на 24 сутки, а второй интервал во введении, начиная с 35 недели, на протяжении непрерывной комбинированной терапии с применением 180 мкг пэгинтерферона альфа 2а/рибавирина в течение 60 недель.
Фиг.8. Пример 2, конкретный пациент, изменения в ВГС-РНК после внутривенного введения 20 мг/кг/сутки силибининового компонента во время интервала введения, включающего 14 последовательных суток, и начиная с 32-й недели на протяжении непрерывной комбинированной терапии с применением 180 мкг пэгинтерферона альфа 2а/рибавирина в течение 60 недель.
Фиг.9. Пример 2, конкретный пациент, изменения в ВГС-РНК после внутривенного введения 20 мг/кг/сутки силибининового компонента во время интервала введения, включающего 14 последовательных суток и начиная с 72-й недели на протяжении непрерывной комбинированной терапии с применением 180 мкг пэгинтерферона альфа 2а/рибавирина в течение 80 недель.
Фиг.10. Схематически показаны различные способы совместного применения рибавирина и/или пэгелированного интерферона альфа и лекарственного средства, содержащего силибининовый компонент.
Фиг.11. Данные, полученные в исследовании подавления in vitro NS5B для шести очищенных компонентов силимарина.
Фиг.12. Данные, полученные в исследовании подавления in vitro NS5B для силибинин-бис(гидрогенсукцината).
Настоящее изобретение относится к применению силибининового компонента для получения лекарственного средства, предпочтительно вирусостатического или противовирусного, более предпочтительно снижающего вирусную нагрузку, для лечения вирусного гепатита, в частности гепатита В или С, предпочтительно инфекций хронического или острого вирусного гепатита С, предпочтительно парентеральным введением.
В контексте настоящего изобретения понятие «лекарственное средство» предпочтительно является синонимом «лекарственного лечения».
В предпочтительном варианте осуществления настоящее изобретение относится к применению силибининового компонента для получения лекарственного средства, которое практически не содержит силидианина, и/или силикристина, и/или изосилибинина, для лечения вирусного гепатита, предпочтительно гепатита В или С.
В предпочтительном варианте осуществления настоящего изобретения лечение вирусного гепатита, в частности гепатита В или С, проводят путем снижения вирусной нагрузки. Установлено, что силибининовые компоненты способны снижать вирусную нагрузку у пациентов с гепатитом В или С. Это особенно неожиданно, поскольку в предшествующем уровне техники нет доказательства, что силимарин, смесь которого содержит определенное количество силибинина, влияет на вирусную нагрузку или улучшает гистологию печени при гепатите В или С (см. К.Е.Mayer и др., Journal of Viral Hepatitis, 2005, 12, 559-567).
В другом предпочтительном варианте осуществления настоящего изобретения лечение вирусного гепатита, в частности гепатита В или С, проводят у пациентов, которым предстоит или которые перенесли трансплантацию печени. Пациенты, перенесшие трансплантацию печени из-за вирусного гепатита, подвержены риску возобновления вирусного гепатита в трансплантированной печени. Обычно вирус удаляется не полностью из организма, когда инфицированную печень удаляют хирургически, и оставшиеся в организме вирусы заново инфицируют трансплантированную печень. При хроническом гепатите С инфицированные пациенты заново инфицируются после трансплантации печени в 100% случаев. Неожиданно было установлено, что силибинин может снизить вирусную нагрузку, риск повторной инфекции после трансплантации печени может быть существенно понижен путем введения, предпочтительно парентерального введения, компонента силибинина.
Формы вирусного гепатита известны специалистам в данной области.
В настоящее время установлено по меньшей мере шесть разных форм: гепатиты А, В, С, D, Е и G. Организмами-возбудителями этих инфекций являются гепатотропные вирусы. Они принадлежат к разным семействам вирусов в каждом случае и имеют геном из ДНК или РНК. Трансмиссия происходит или через пищу, или через тканевые жидкости, например сперму и кровь. Также имеются различия у разных форм, касающиеся течения заболевания и его тяжести. Хотя гепатиты А и Е обычно бывают в острой форме, гепатиты В, С и D могут привести к хроническому течению заболевания, и в некоторых случаях, к тяжелым осложнениям.
В настоящем описании понятие «вирусный гепатит» предпочтительно включает гепатиты В и С.
В предпочтительном варианте осуществления настоящего изобретения проводят лечение путем снижения вирусной нагрузки одного или нескольких вирусов, выбранных из группы, состоящей из генотипов ВГС1, ВГС2, ВГС3, ВГС4, ВГС5 и ВГС6, предпочтительно ВГС1, но не только из них.
Если генотипом является генотип вируса ВГС1, предпочтительны подтипы 1a, 1b, 1c, 1d, 1e, 1f, 1g, 1h, 1i, 1j, 1k и 1l. Если генотипом является генотип вируса ВГС2, предпочтительны подтипы 2а, 2b, 2с, 2d, 2е, 2f, 2g, 2h, 2i, 2j, 2k, 2l, 2m, 2n, 2o, 2p и 2q. Если генотипом является генотип вируса ВГС3, предпочтительны подтипы 3а, 3b, 3с, 3d, 3е, 3f, 3g, 3h, 3i, 3j и 3k. Если генотипом является генотип вируса ВГС4, предпочтительны подтипы 4а, 4b, 4с, 4d, 4е, 4f, 4g, 4h, 4i, 4j, 4k, 4l, 4m, 4n, 4o, 4p, 4q, 4r и 4t. Если генотипом является генотип вируса ВГС5, предпочтителен подтип 5а. Если генотипом является генотип вируса ВГС6, предпочтительны подтипы 6а, 6b, 6с, 6d, 6е, 6f, 6g, 6h, 6i, 6j, 6k, 6l, 6m, 6n, 6o, 6p и 6q. О номенклатуре генотипов и подтипов вируса гепатита С см., например, P.Simmonds и др., Hepatology, 42, 2005, 962-973.
В предпочтительном варианте осуществления настоящее изобретение относится к применению компонента силибинина для получения лекарственного средства, которое предпочтительно адаптировано для парентерального введения для лечения вирусного гепатита, предпочтительно гепатита С, пациентам, которые не отвечают на обычную иммуномодулирующую/противовирусную комбинированную терапию, например терапию рибавирином/интерфероном («нон-респондеры»), и/или пациентам, которые частично отвечают на традиционную иммуномодулирующую/противовирусную комбинированную терапию, например, терапию рибавирином/интерфероном («частичные респондеры»), и/или пациентам, которые проявляют четкий начальный ответ с последующим возобновлением вирусных титров во время или после терапии («рецидивы»).
Настоящее изобретение также относится к лечению вирусного гепатита С с помощью силибининового компонента, причем это лечение следует за традиционной комбинированной терапией с помощью рибавирина/интерферона. Предпочтительно лечение введением силибининового компонента начинается после неудачного лечения рибавирином/интерфероном (или сначала, или после определенного периода лечения).
В связи с традиционным лечением гепатита С путем введения рибавирина/интерферона понятия «нон-респондеры», «частичные респондеры» и «больные с рецидивом» известны специалистам в данной области. В настоящее время лечение вирусного гепатита С пэгилированным интерфероном вместе с рибавирином неудачно примерно для половины случаев у пациентов при генотипе 1. Неудача в лечении проявляется или в виде отсутствия ответа на лечение (минимальное снижение титров вируса), или в развитии рецидива (первоначальный четкий ответ на лечение сменяется восстановлением титров вируса во время или после лечения).
С целью спецификации нон-респондерами предпочтительно называют пациентов, у которых отсутствует снижение вирусной нагрузки на <2 log10 МЕ/мл (т.е. в 100 раз) при введении рибавирина/интерферона (обычно пэгинтерферона α), предпочтительно в течение 12 недель. В предпочтительном варианте осуществления настоящего изобретения у нон-респондеров титры вируса снижаются на величину ≤2,1 log10 МЕ/мл и абсолютные титры ≥4,62 log10 МЕ/мл при минимальной величине.
С целью спецификации частичными респондерами предпочтительно называют пациентов, у которых отсутствует снижение вирусной нагрузки на ≥2 log10 МЕ/мл к 12 неделе при выявляемой ВГС РНК на 24 неделю.
С целью спецификации больными с рецидивом предпочтительно называют пациентов, у которых снижение титров вирусов составляет ≥2,8 log10 и абсолютные титры временно падают ниже предела обнаружения (2,78 log10 МЕ/мл).
В настоящем описании понятие «лекарственная форма» предпочтительно является синонимом понятию «вводимая форма» или «дозированная форма». Например, если лекарственная форма предназначена для перорального введения, например, в форме таблетки, такая таблетка предпочтительно представляет дозированную форму для введения, которая содержит дозу компонента силибинина, предназначенную для введения в соответствующее время в рамках схемы введения. Если дозированная единица включает одну таблетку, дозированная единица соответствует вводимой форме. Однако дозированная форма также может быть поделена на ряд вводимых форм, например, на ряд таблеток, которые в каждом случае содержат только часть дозы, но вместе они содержат целую дозу компонента силибинина, предназначенную для введения в соответствующее время в рамках схемы введения (такие таблетки дозированной единицы предназначены для практически одновременного введения).
В настоящем изобретении понятие «силибининовый компонент» предпочтительно относится к силибинину, включая все его стереоизомеры, например силибинин А и силибинин В, его фармацевтически приемлемые соли и/или производные, в частности сложные эфиры. Предпочтительными сложными эфирами являются производные неорганических кислот, например фосфорной кислоты или серной кислоты; или органических кислот, например муравьиной кислоты, уксусной кислоты, пропионовой кислоты, лимонной кислоты, яблочной кислоты, миндальной кислоты и др.
Среди гемиэфиров дикарбоновых кислот особенно предпочтительны гемиэфиры, например, яблочной кислоты, глутаровой кислоты, янтарной кислоты, адипиновой кислоты, суберовой кислоты, азелаиновой кислоты, себациновой кислоты, фумаровой кислоты, малеиновой кислоты, итаконовой кислоты, фталевой кислоты, терефталевой кислоты, изофталевой кислоты и др. Предпочтительными гемиэфирами являются дигемисукцинаты, которые могут содержаться в виде свободных кислот или их солей, например солей натрия, калия или аммония. Одна или несколько гидроксильных групп силибинина может быть этерифицирована. Предпочтительно, 1, 2, 3, 4 или все гидроксильные группы силибинина этерифицированы.
В предпочтительном варианте осуществления настоящего изобретения силибининовым компонентом является силибинин-С-2',3-бис(гидрогенсукцинат) или его фармацевтически приемлемая соль, например натриевые соли, калиевые соли, соли аммония и др., а также их смеси. Особо предпочтительна динатриевая соль.
Соответствующими сложными эфирами являются также сложные эфиры глюконовой кислоты.
Предпочтительно силибининовый компонент представляет соединение с общей формулой (I)
в которой
R1, R2, R3, R4 и R5 независимо друг от друга выбраны из группы, состоящей из -Н, -SO3H, -PO3H2, -СО-С1-С8-алкилен-ОН, -СО-С1-С8-алкилен-CO2H, -СО-С1-С8-алкилен-SO3H, -СО-С1-С8-алкилен-OPO3H2, -СО-С1-С8-алкилен-PO3H2, -(С2-С3-алкилен-O)n-Н, где n= от 1 до 20, -СО-С1-С8-алкилен-N(С1-С3-алкил)3 +Х-, где X- представляет фармацевтически допустимый анион,
или их фармацевтически допустимые соли. Предпочтительно, R1, R2 и R5 представляют -Н.
Более предпочтительно, силибининовый компонент общей формулы (I) имеет стереохимическую общую формулу (I-A) или (I-Б)
В предпочтительном варианте осуществления настоящего изобретения соединение общей формулы (I-A) перемешивают с соединением общей формулы (I-Б) в каком-либо относительном соотношении массы, например 50±5:50±5. В предпочтительном варианте осуществления настоящего изобретения, однако, диастериомерный избыток (ди) соединения общей формулы (I-A) составляет по меньшей мере 50% ди, более предпочтительно по меньшей мере 75% ди, еще более предпочтительно по меньшей мере 90% ди, еще более предпочтительно по меньшей мере 95% ди, наиболее предпочтительно по меньшей мере 98% ди и особенно предпочтительно по меньшей мере 99% ди. В другом предпочтительном варианте осуществления настоящего изобретения диастериомерный избыток (ди) соединения общей формулы (1-Б) составляет по меньшей мере 50% ди, более предпочтительно по меньшей мере 75% ди, еще более предпочтительно по меньшей мере 90% ди, еще более предпочтительно по меньшей мере 95% ди, наиболее предпочтительно по меньшей мере 98% ди и особенно предпочтительно по меньшей мере 99% ди.
Другие предпочтительные силибининовые компоненты описаны в патенте WO 03/090741, на сущность которого в настоящем описании приводится ссылка.
Предпочтительно силибининовый компонент в чистой воде при комнатной температуре имеет лучшую растворимость по сравнению с силибинином как таковым.
В предпочтительном варианте осуществления настоящее изобретение относится к применению сложного эфира силибинина для получения лекарственного средства, которое предпочтительно перерабатывают для парентерального или перорального введения, для лечения вирусного гепатита, в частности