Применение l-карнозина для приготовления нанопрепарата, обладающего антигипоксической и антиоксидантной активностью
Иллюстрации
Показать всеПредложено применение L-карнозина для приготовления нанопрепарата, обладающего антигипоксической и антиоксидантной активностью в сочетании с комбинацией веществ, выбранных из группы фосфолипидов, неполярных липидов при следующем соотношении компонентов, в мас.%: L-карнозин - 1,1-1,2, неполярные липиды, такие как триглицериды, холестерол, свободные жирные кислоты, DL-α-Токоферол - 1,2-2,5, фосфолипиды, такие как фосфатидил-холин, фосфатидил этаноламин, лизофосфатидилхо-лин, лизофосфатидил этаноламин, сфингомиелин - 95,3-96,3 для приготовления лекарственного средства, обладающего антигипоксической и антиоксидантной активностью. Изобретение обеспечивает увеличение стабильности L-карнозина и время его жизни в организме до трех дней на фоне повышения эффективности его действия в малых дозах, а также для улучшения переносимости ишемии головного мозга, восстановления после острой гипоксии и для повышения антиоксидантного статуса тканей головного мозга. Лекарственное средство может быть выполнено в виде липосом, содержащих L-карнозин. 2 з.п. ф-лы, 4 ил., 2 табл.
Реферат
Изобретение относится к медицине, конкретно к неврологии и кардиологии, а именно к получению лекарственного средства в виде биологически активного нанопрепарата, обладающего антигипоксической и антиоксидантной активностью. Общепризнанно, что такие распространенные заболевания, сопровождающиеся гипоксией, как ишемическая болезнь сердца (ИБС), сердечная недостаточность и мозговой инсульт, занимают в настоящее время лидирующее положение среди причин инвалидизации и смертности населения. Поэтому разработка новых лекарственных средств для лечения сердечно-сосудистой системы - проблема весьма актуальная. В последнее время в клинической практике при лечении таких заболеваний в качестве биологически активных веществ с широким фармакологическим спектром действия все чаще применяют соединения карнозина (Ивницкий Ю.Ю., Головко А.И., Софронов Г.А. Янтарная кислота в системе средств метаболической коррекции функционального состояния и резистентности организма. - СПб., 1998. - 82 с. - Бюллетень эксп. биол. и мед., 2000, Т.129, 2, 149-151).
L-карнозин является природным нейропептидом, который проявляет разнообразную биологическую активность. Показана его высокая эффективность по защите нейронов как в условиях in vitro (индивидуальные реакции повреждения макромолекул, суспензии изолированных нейронов или срезов мозга в условиях свободнорадикальной атаки), так и in vivo - на различных моделях экспериментальной ишемии мозга и сердца, гипобарической гипоксии (Болдырев А.А. Карнозин. Биологическое значение и возможности применения в медицине. - М.: Изд-во МГУ, 1998, 320 стр.). Установлено, кроме того, что карнозин является важным природным фактором системы антиоксидантной защиты мозга в условиях окислительного стресса (Болдырев А.А. Карнозин и защита тканей от окислительного стресса. - М.: Изд-во "Диалог - МГУ", 1999, 362 с.).
Было также обнаружено, что L-карнозин как природное активно метаболизирующее соединение, имеет ограниченное время жизни в организме, подвергаясь расщеплению специфическим ферментом карнозиназой. Через 15 мин после внутрибрюшинного введения крысам его содержание в крови достигает максимума, после чего сразу начинает снижаться, возвращаясь к исходному низкому уровню через 30 мин после введения. Мозг и печень характеризуются схожей кинетикой накопления карнозина, хотя время достижения максимума сдвинуто к 30 минутам, а убыли до исходного уровня - к 45-60 минутам (Гуляева Н.В. Перспективы создания лекарственных препаратов на основе карнозина (некоторые новые принципы). Биохимия, т.57, вып.9, 1992, с.1398-1403).
Лечебные мероприятия с помощью L-карнозина и его эфиров осуществляются при патологии, сопровождающейся гипоксией (сердечно-сосудистые заболевания, заболевания мозга и нервной системы).
Известно применение метилового и этилового эфиров карнозина в качестве антиоксидантного и антигипоксического средства, полученного с помощью ферментативного гидролиза (RU 2191592, 27.10.2002). Данный источник информации рассмотрен нами в качестве ближайшего аналога. Средство, полученное с помощью ферментативного гидролиза, повышает окислительную устойчивость биологических структур. При этом было установлено, что в концентрации 150 мкМ L-карнозин и его эстерифицированные производные после преинкубации с эквимолярными концентрациями меди и цинка практически полностью ингибируют восстановление НСТ, что свидетельствует о наличии выраженной супероксид-перехватывающей активности (СПА) у исследуемых соединений. Константа полуингибирования (К0,5) для карнозина составляет 30 мкМ, а для этилового и метилового эфиров - 25 и 60 мкМ соответственно. Таким образом, эффективность СПА для этих комплексов значительно различается в области концентраций 20-60 мкМ. Высокая СПА отмечена у этилового эфира карнозина и более низкая - у карнозина и его метилового эфира. Эффективная доза при эксперименте на животных, в частности антигипоскического и антиоксидантного действий карнозина и его этилового эфира в стабилизированной сульфат-анионами форме, является 100 мг/кг.
Указанный препарат в настоящее время успешно используется в медицинской практике. Однако применение его в виде биологически активного вещества при патологии, развивающейся на фоне гипоксии (инфаркт, инсульт, гипертония и др.), в оптимальных дозах затруднено в связи с ограниченным временем его жизни в организме. Создание нанопрепарата, содержащего L-карнозин, позволяет увеличить его время жизни в организме и, следовательно, вводить его в терапевтических дозах в малом объеме.
Технический результат изобретения заключается в том, что липосомальные контейнеры, содержащие L-карнозин, увеличивают стабильность L-карнозина и время его жизни в организме на фоне повышения эффективности его действия в малых дозах, а также расширяют ассортимент таких средств.
Технический результат достигается тем, что применяют L-карнозин для приготовления нанопрепарата, обладающего антигипоксической и антиоксидантной активностью в сочетании с комбинацией веществ, выбранных из группы фосфолипидов и неполярных липидов при следующем соотношении компонентов, в мас.%: L-карнозин - 1,1-1,2, неполярные липиды, такие как триглицериды, холестерол, свободные жирные кислоты, DL-α-Токоферол - 1,2-2,5, фосфолипиды, такие как фосфатидилхолин, фосфатидил этаноламин, лизофосфатидилхолин, лизофосфатидил этаноламин, сфингомиелин - 95,3-96,3 для приготовления лекарственного средства, обладающего антигипоксической и антиоксидантной активностью.
Предлагается также применение, в котором лекарственное средство используют для улучшения переносимости ишемии головного мозга, восстановления после острой гипоксии, а также для повышения антиоксидантного статуса тканей головного мозга.
Предлагается также применение, в котором лекарственное средство выполнено в виде липосом, содержащих L-карнозин.
Изобретение иллюстрируется следующими примерами.
Приготовление липосом, содержащих L-карнозин.
Пример 1
5 г смеси сухих липидов, содержащей 4,76 г фосфолипидов, таких как фосфатидилхолин, фосфатидил этаноламин, лизофосфатидилхолин, лизофосфатидил этаноламин, сфингомиелин и 0,24 г неполярных липидов, таких как триглицериды, холестерол, свободные жирные кислоты, DL-α-Токоферол смешивают с 50 мл дистиллированной воды, к полученной эмульсии добавляют 50 мл водного раствора L-карнозина с концентрацией 50 мМ (количество L-карнозина 0,317 г) и помещают в стакан для перемешивания на магнитной мешалке. Перемешивание производят в течение 30 минут до полной гидратации с образованием однородной суспензии. Далее с помощью гомогенизатора эту грубодисперсную суспензию подвергают гомогенизации в замкнутом контуре в непрерывном процессе под давлением 50 МПа при температуре 30-35°С. Количество циклов гомогенизации (проходов) может быть от 5 до 10. Суспензия после гомогенизации получается в виде полупрозрачного липосомального раствора. Липосомы, содержащие L-карнозин согласно данному примеру имеют размер 120 нм. Затем полученную липосомальную композицию стерилизуют при давлении 1 избыточной атм в течение 45 минут. Средний диаметр липосомальных частиц увеличивается до 150-160 нм. Полученные липосомы состоят из 96,3% фосфолипидов, 1,2% неполярных липидов и содержат 1,1% L-карнозина (по массе), остальное до 100% вода.
Пример 2
5 г смеси сухих липидов, содержащей 4,76 г фосфолипидов, таких как фосфатидилхолин, фосфатидил этаноламин, лизофосфатидилхолин, лизофосфатидил этаноламин, сфингомиелин и 0,24 г неполярных липидов, таких как триглицериды, холестерол, свободные жирные кислоты, DL-α-Токоферол, смешивают с 50 мл дистиллированной воды. После чего в эту массу грубодисперсной липосомальной суспензии добавляют L-карнозин до конечной концентрации 25 мМ (количество L-карнозина 0,317 г). Полученную липосомальную композицию подвергают гомогенизации в замкнутом контуре в непрерывном процессе с помощью гомогенизатора высокого давления при давлении 60 МПа и температуре 30-35°С. Количество циклов гомогенизации (проходов) может быть от 5 до 15. После гомогенизации получают суспензию в виде полупрозрачного липосомального раствора. Липосомы, содержащие L-карнозин согласно данному примеру, имеют размер 90-100 нм. Затем полученную липосомальную композицию стерилизуют при давлении 1 избыточной атм в течение 45 минут. Средний диаметр липосомальных частиц увеличивается до 120-130 нм. Полученные липосомы состоят из 96,3% фосфолипидов, 1,2% неполярных липидов и содержат 1,1% L-карнозина (по массе), остальное до 100% вода.
Пример 3
5 г смеси сухих липидов, содержащей 4,5 г фосфолипидов, таких как фосфатидилхолин, фосфатидил этаноламин, лизофосфатидилхолин, лизофосфатидил этаноламин, сфингомиелин и 0,5 г неполярных липидов, таких как триглицериды, холестерол, свободные жирные кислоты, DL-α-Токоферол смешивают с 50 мл дистиллированной воды, к полученной эмульсии добавляют 50 мл водного раствора L-карнозина с концентрацией 50 мМ (количество L-карнозина 0,331 г) и помещают в стакан, для перемешивания на магнитной мешалке. Перемешивание производят в течение 30 минут до полной гидратации с образованием однородной суспензии. Далее с помощью гомогенизатора эту грубодисперсную суспензию подвергают гомогенизации в замкнутом контуре в непрерывном процессе под давлением 50 МПа при температуре 30-35°С. Количество циклов гомогенизации (проходов) может быть от 5 до 10. После гомогенизации получают суспензию в виде полупрозрачного липосомального раствора. Липосомы, содержащие L-карнозин, согласно данному примеру имеют размер 120 нм. Затем полученную липосомальную композицию стерилизуют при давлении 1 избыточной атм в течение 45 минут. Средний диаметр липосомальных частиц увеличивается до 150-160 нм. Полученные липосомы состоят из 95,3% фосфолипидов, 2,5% неполярных липидов и содержат 1,2% L-карнозина (по массе), остальное до 100% вода.
Исследования атигипоксической и антиоксидантной активности фосфолипидных нанолипосом, нагруженных L-карнозином (с содержанием 1,1-1,2% по отношению к массе липосом), их стабильности и времени жизни в организме и эффективности их действия в малых дозах проводили на следующих моделях. In vitro была использована клеточная модель окислительного стресса, индуцированного в гранулярных клетках мозжечка. Использовали гранулярные клетки мозжечка 10-12 дневных мышей линии SAMR1. Для разрыхления межклеточного вещества использовали раствор коллагеназы, приготовленный на растворе Хенкса (Wako collagenase, 2 mg/ml, 1 мл/1 животное). Измельченные скальпелем фрагменты ткани мозга инкубировали при 32°С в течение 20 мин, не перемешивая. После инкубации декантацией удаляли раствор коллагеназы, трижды отмывали осадок раствором Хенкса; после отмывки добавляли к осадку раствор Хенкса из расчета 1 мл на 1 животное и пипетированием диссоциировали клетки до опалесцирующей суспензии; полученную суспензию пропускали через фильтр с размером пор 60 мкм, затем проводили подсчет клеток при помощи камеры Горяева. Для работы на проточном цитометре число клеток не должно быть меньше 106/мл. Перед проведением эксперимента клетки оставляли на 30 минут при 32°С, после чего нагружали флуоресцентным красителем на свободные радикалы дихлорофлюоресцеин диацетат (DCF-DA) с конечной концентрацией 10 мкМ.
Окислительный стресс in vitro создавали инкубацией первичной культуры с пероксидом водорода. Внутриклеточный уровень свободных радикалов и количество мертвых клеток в препаратах определяли с помощью проточного цитометра марки FACSCalibur (BD Biosciences, USA), (Boldyrev A., Song R., Dyatlov V., Lawrence D., Carpenter D. Neuronal cell death and reactive oxygen species., Cell. Mol. Neurobiol., 2000, 20: 433-450).
Фосфолипидные нанолипосомы, нагруженные L-карнозином, полученные по примеру 1, были испытаны в качестве возможных протекторов нейронов от окислительного стресса.
Используемые в экспериментах гранулярные клетки мозжечка характеризуются некоторым исходным уровнем флуоресценции DCF, соответствующей стационарному уровню радикальных соединений. Инкубация клеток с «пустыми» (ненагруженными L-карнозином) нанолипосомами несколько снижает, хотя и недостоверно, уровень флуоресценции. В этих же условиях применение карнозинсодержащих нанолипосом существенно понижает уровень внутриклеточных радикалов, что увеличивает устойчивость клеток к окислительному стрессу.
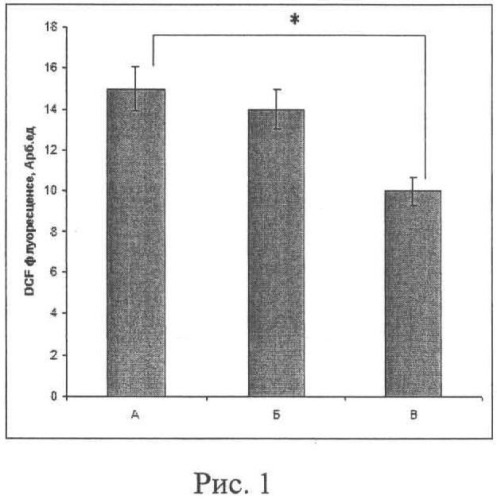
Стационарный уровень свободных радикалов в изолированных гранулярных клетках мозжечка мышей в разных условиях: А - интактные свежевыделенные гранулярные клетки, Б - клетки после инкубации с «пустыми» нанолипосомами, В - то же с нанолипосомами, содержащими L-карнозин, показан на рис.1. Средняя флуоресценция в случае А составляет 15,6±0,7 отн. ед., в случае Б - 14±0,5, и в случае В - 10±0,4 (* - р<0,05 по отношению к интактным клеткам).
Было обнаружено, что наносомы, не содержащие L-карнозина, в условиях стресса, вызываемого пероксидом водорода, не препятствуют как накоплению внутриклеточных радикалов, так и клеточной смерти. В то же время наносомы, содержащие L-карнозин, эффективно снижают накопление кислородных радикалов в нейронах. Индукция окислительного стресса пероксидом водорода (10 мМ, 30 мин) в отсутствие (А) и в присутствии наносом, нагруженных карнозином (Б), показана на рис.2. Серый фон - интактные клетки, черная линия - после инкубации с Н2О2: по оси ординат - количество клеток, по оси абсцисс - относительные единицы флуоресценции активные формы кислорода (АФК).
При этом и смертность нейрональных клеток оказывается достоверно ниже: в популяции клеток, содержащихся в среде с пероксидом водорода, эта величина составляла 21,2±3,0%, а в присутствии карнозинсодержащих нанолипосом она не превышала 15,4±2,9%.
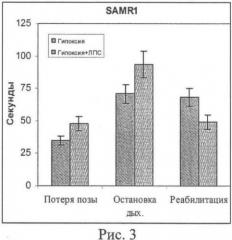
Для исследований в условиях in vivo была разработана модель гипобарической гипоксии, имитирующая острое ишемическое состояние с использованием взрослых мышей линии SAMR1. Возраст животных составлял 8 месяцев. Окислительный стресс вызывали воздействием острой гипобарической гипоксии. Исследование проводили в проточной барокамере. В ходе создания разрежения, соответствующего подъему на высоту 10000 метров, отмечали время, протекающее до потери позы, и время до остановки дыхания, характеризующие устойчивость к гипоксическому повреждению, а также время реабилитации после воздействия гипоксии. Влияние нанолипосом, нагруженных L-карнозином, на устойчивость мышей линии SAMR1 к воздействию острой гипобарической гипоксии показано на рис.3. Нанолипосомы, нагруженные L-карнозином, полученные по примеру 2, вводили за 1 ч до гипоксии в дозе 20-25 мг на килограмм тела животного (свободный карнозин демонстрирует активность в дозе, которая составляет 100 мг на килограмм тела животного).
Из рис.3 видно, что введение препарата нанолипосом, нагруженных L-карнозином, перед гипоксическим воздействием приводит к повышению устойчивости мышей SAMR1 к гипоксическому шоку, увеличивая время сохранения позы и время до остановки дыхания. При этом длительность реабилитации сокращалась, что указывает на повышение адаптационного статуса мышей.
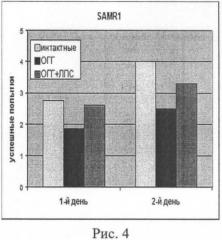
В то же время тестирование мышей в «водном лабиринте Морриса», позволяющее оценить характеристики когнитивных функций животных, показывает более эффективное действие нанолипосом, содержащих L-карнозин, на мышей линии SAMR1. Эти животные были менее успешны в процессе обучения поиску платформы в бассейне в первый день эксперимента после гипоксического воздействия, но лучше сохраняли приобретенные навыки на следующие сутки после обучения, см. рис.4, на котором показано тестирование мышей линии SAMR1 в «водном лабиринте Морриса»: 5 обучающих попыток через сутки после гипоксического воздействия и 5 попыток на следующие сутки для контроля запоминания (р<0,05 по отношению к гипоксии). Светлый столбик - количество успешных попыток у интактных мышей, темный столбик - без воздействия нанолипосом, нагруженных L-карнозином, серый столбик - при воздействии нанолипосом, нагруженных L-карнозином в дозе 20 мг/кг массы тела животного, полученных по примеру 3. Нанолипосомы, нагруженные L-карнозином, вводили 2 раза - за 1 час до гипоксии и через 1 час после гипоксии.
Для оценки воздействия нанолипосом, нагруженных L-карнозином, на общую антиоксидантную активность в ткани мозга была использована система тестирования на основе стабильного радикала дифенилпикрилгидразила (ДФПГ). Измеряли суммарное восстановление радикала за 30 мин при добавлении в систему экстракта из ткани мозга. Было показано, что суммарная антиоксидантная активность восстановления ДФПГ, обеспечиваемая экстрактами из ткани мозга мышей, перенесших гипоксическое воздействие, на третьи сутки реперфузии достоверно не отличается от этого показателя для интактных животных. Введение L-карнозинсодержащих нанолипосом обеспечивает повышение суммарной антиоксидантной активности, что согласуется с более высокими показателями этих животных в тесте Морриса (рис.4).
Результаты влияния L-карнозинсодержащих нанолипосом на суммарную антиоксидантную активность экстрактов из ткани мозга в ДФПГ-тесте показаны в таблице 1. Нанолипосомы, нагруженные L-карнозином вводились животным дважды - за один час до гипоксии и дополнительно через 1 час после гипоксии. Декапитацию проводили через 3 часа после второго тестирования в «водном лабиринте Морриса».
| Таблица 1 | ||
| Условия эксперимента | Гашение ДФПГ, мкмоль/г ткани | Условия достоверности данных |
| Интактные мыши | 4,2±0,86 | |
| Мыши, перенесшие гипоксию без введения нанолипосом, нагруженных L-карнозином | 4,06±0.98 | р>0.06 по отношению к интактным мышам |
| Мыши, перенесшие гипоксию на фоне введения нанолипосом, нагруженных L-карнозином | 5,7±1,1 | р<0.01 по отношению к мышам, перенесшим гипоксию без введения нанолипосом с L-каонозином |
В таблице 2 показано влияние исследуемого препарата на продолжительность сохранения антиоксидантной активности у мышей линии SAMR1 в условиях гипоксии и времени жизни L-карнозина в организме мышей (нанолипосомы, нагруженные L-карнозином, 20 мг/кг), n=10 в каждой группе.
| Таблица 2 | |||
| Изучаемые препараты | Доза, мг/кг | Продолжительность сохранения антиоксидантной активности, часы | Время жизни L-карнозина в организме, (часы) |
| L-карнозин, полученный ферментативным гидролизом | 150 | 3 | 3 |
| Нанолипосомы, нагруженные L-карнозином | 20 | 72 | 72 |
| Нанолипосомы, нагруженные L-карнозином | 25 | 80 | 80 |
Как следует из данных, представленных в таблице 2, введение нанолипосом, нагруженных L-карнозином, полученных по примеру 1-3 при введении в организм экспериментального животного в дозе 20-25 мк/кг, увеличивало длительность антиоксидантного и антигипоксического действия на фоне острой гипоксии и обеспечивало улучшение переносимости ишемии головного мозга, восстановления после острой гипоксии, а также повышение антиоксидантного статуса тканей головного мозга в сравнении с введением L-карнозина, полученного ферментативным гидролизом в дозе 150 мк/кг.
Таким образом, использование нанолипосом, содержащих L-карнозин в дозе 20-25 мг на киллограмм тела животного, увеличивает суммарную антиоксидантную активность тканей мозга. Эта активность сохраняется в течение 3-х дней после введения нанолипосом, полученных по примерам 1-3 (для свободного карнозина показано разложение его в организме через 3 часа после введения).
Следовательно, нанопрепарат L-карнозина, полученный по примеру 1-3, может рассматриваться как перспективная наноконструкция, обладающая антигипоксическими и антиоксидантными свойствами и увеличивающая стабильность и время жизни L-карнозина в организме на фоне повышения его эффективности в малых дозах. Кроме того, это позволит расширить ассортимент таких средств.
1. Применение L-карнозина для приготовления нанопрепарата, обладающего антигипоксической и антиоксидантной активностью в сочетании с комбинацией веществ, выбранных из группы фосфолипидов, неполярных липидов при следующем соотношении компонентов, мас.%: L-карнозин - 1,1-1,2, неполярные липиды, такие как триглицериды, холестерол, свободные жирные кислоты, DL-α-Токоферол - 1,2-2,5, фосфолипиды, такие как фосфатидилхолин, фосфатидил этаноламин, лизофосфатидилхолин, лизофосфатидил этаноламин, сфингомиелин - 95,3-96,3 для приготовления лекарственного средства, обладающего антигипоксической и антиоксидантной активностью.
2. Применение по п.1, в котором лекарственное средство используют для улучшения переносимости ишемии головного мозга, восстановления после острой гипоксии, а также для повышения антиоксидантного статуса тканей головного мозга.
3. Применение по п.1 или 2, в котором лекарственное средство выполнено в виде липосом, содержащих L-карнозин.