Средство для лечения диабета, фармацевтическая композиция и способ лечения заболеваний
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и медицине и представляет собой обладающую гипогликемизирующей, гипохолестеринемической, гиполипидемической и (или) антиоксидантной активностью комбинацию бис-(γ-L-глутамил)-L-цистеинил-глицина в виде динатриевой соли и липоевой кислоты в виде натриевой соли, и координационных соединений, образованных палладием, медью и γ-L-глутамил-L-цистеинил-глицином, где мольное соотношение бис-(γ-L-глутамил)-L-цистеинил-глицина динатриевая соль: липоат натрия: палладий: медь находится в диапазоне 100-10000:100-10000:1-10:1-10. Изобретение обеспечивает повышение терапевтической эффективности. 3 н. и 4 з.п. ф-лы, 4 пр., 2 табл.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к бионеорганической химии и медицине, а именно к области получения лекарственных препаратов, и может быть использовано в бионеорганической химии, фармакологии, медицине и ветеринарии.
Предшествующий уровень техники
Повышение терапевтической эффективности биологически активных молекул, востребованных в фармакологических решениях, посредством оптимизации их фармакокинетики и/или фармакодинамики и/или снижения токсичности за счет химической модификации структуры молекулы и/или ее сочетанным использованием с другим химическим соединением или соединениями является одним из направлений создания лекарственных препаратов нового поколения, проявляющих свою активность в физиологически более оптимальных дозах.
Гипогликемизирующий, гипохолестеринемический, гиполипидемический, антиоксидантный фармакологические эффекты тиоктовой кислоты востребованы в лечении метаболического синдрома, сахарного диабета второго типа и их осложнений. Однако достижение необходимого в терапии фармакологического действия сопряжено с необходимостью введения доз тиоктовой кислоты, приводящих к развитию тяжелых побочных эффектов, в числе которых наиболее опасны кратковременная задержка или затруднение дыхания, повышение внутричерепного давления, судороги, дисфункции тромбоцитов.
В этой связи существует необходимость в фармакологическом решении, позволяющем сохранить всю полноту спектра востребованной фармакологической активности тиоктовой кислоты при ее введении в организм человека или другого млекопитающего в физиологически адекватных дозах в составе лекарственной формы энтерального, парентерального и иного возможного способа введения.
Сущность изобретения
Задачей данного изобретения является создание нового средства на основе тиоктовой кислоты, которое могло бы применяться по обычным для тиоктовой кислоты показаниям, и в частности для лечения диабета и родственных заболеваний.
Данная задача решается тем, что предложена комбинация бис-(γ-L-глутамил)-L-цистеинил-глицина или его соли и липоевой кислоты или ее солей и координационных соединений, образованных палладием, медью и γ-L-глутамил-L-цистеинил-глицином. Указанная комбинация далее обозначается как «средство по изобретению».
Целесообразно, когда в комбинации бис-(γ-L-глутамил)-L-цистеинил-глицин представлен в виде натриевой соли, а липоевая кислота представлена в виде натриевой соли.
Мольное соотношение бис-(γ-L-глутамил)-L-цистеинил-глицина динатриевой соли: липоата натрия: палладия: меди предпочтительно находится в диапазоне 100-10000:100-10000:1-10:1-10, например 1000:1000:1:1.
В качестве источника палладия может быть выбран цис-диаминодихлорпалладий, а в качестве источника меди - медь двухлористая.
Указанная комбинация может применяться в терапии. Она обладает гипогликемизирующей, гипохолестеринемической, гиполипидемической и(или) антиоксидантной активностью.
Предложена также фармацевтическая композиция, содержащая указанную комбинацию и фармацевтически приемлемые эксципиенты. Такая композиция обладает гипогликемизирующей, гипохолестеринемической, гиполипидемической и(или) антиоксидантной активностью.
Предложен также способ лечения заболевания, выбранного из группы, включающей метаболический синдром, сахарный диабет второго типа и их осложнения, при котором нуждающемуся в этом пациенту вводят указанную комбинацию или фармацевтическую композицию.
Подробное описание изобретения
Средство по изобретению оказывает эффекты, присущее тиоктовой кислоте, при существенно меньших дозах тикотовой кислоты, что дает возможность избежать присущих тиоктовой кислоте побочных эффектов.
Тиоктовая кислота (липоевая кислота, альфа-липоевая кислота) - это 1,2-дитиолан-3-пентановая кислота формулы
Альфа-липоевая кислота (тиоктовая кислота) является веществом, которое эндогенно присутствует в организме, синтезируется в высоких концентрациях клетками, регулирует обмен веществ и выполняет роль коферментов в окислительном декарбоксилировании пировиноградной кислоты и альфа-кетокислот. По характеру биохимического действия близка к витаминам группы В.
Альфа-липоевая кислота участвует в регулировании липидного и углеводного обмена, влияет на обмен холестерина. Улучшает функции печени (в т.ч. детоксицирующую), защищает ее от действия экзо- и эндогенных повреждающих факторов, оказывает гепатопротективное и дезинтоксикационное действие. Улучшает трофику нейронов. Уменьшает содержание сахара в крови и увеличивает содержание гликогена в печени. Обладает способностью связывать свободные радикалы.
Применяют тиоктовую кислоту при полинейропатии (диабетической, алкогольной), коронарном атеросклерозе, заболеваниях печени (гепатит, цирроза печени), отравлениях.
Известно, что тиоктовая кислота обладает гепатопротективным, дезинтоксикационным, гипохолестеринемическим, гиполипидемическим, антиоксидантным действием.
Как фармацевтический препарат тиоктовая кислота обычно находится в виде амида или натриевой соли.
Глутатион, гамма-глутаминил-цистеинил-глицин, представляет собой трипептид, образованный остатками трех аминокислот: глутаминовой кислоты, цистеина и глицина.
Глутатион содержится во всех живых организмах и имеет важное значение для окислительно-восстановительных реакций в связи со способностью сульфгидрильной группы (SH-) цистеина вступать в обратимую реакцию:
Восстановленный глутатион (GSH) в данном описании обозначен как (γ-L-глутамил)-L-цистеинил-глицин. Окисленная форма глутатиона (GSSG) обозначена как бис-(γ-L-глутамил)-L-цистеинил-глицин.
Если не указано иное, под глутатионом в данном описании подразумевается восстановленный глутатион.
Глутатион способен образовывать соли с катионами, в частности Na.
Комбинация по изобретению содержит d-металлы. Источниками d-металлов, палладия и меди могут служить их различные соли, которые при растворении в воде приводят к образованию комплексных соединений. В частности, при внесении в водный раствор простых солей меди(II), таких как CuCl2 или CuBr2, происходит их аквотация, сопровождающаяся последующим гидролизом и образованием в растворе олигоядерных аквагидроксокомплексов меди(II). Палладий также может быть добавлен в виде его подходящих солей, в частности цис-диаминодихлорпалладия.
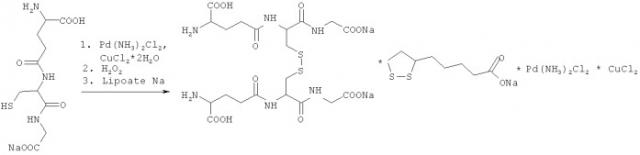
Химическая реакция получения средства по изобретению GSSGNa2/липоат Na/Pd/Cu=1000/1000/1/1 соответствует уравнению
Получение средства по изобретению может быть реализовано несколькими способами.
Один из вариантов реализации процесса получения средства по изобретению заключается в предварительном получении палладиево-медного катализатора (координационных соединений палладия и меди и γ-L-глутамил-L-цистеинил-глицина) с последующим внесением полученного раствора катализатора в реакционную массу, проведением оксиления, смешиванием полученного раствора с раствором тиоктовой кислоты, фильтрации и лиофилизации.
В другом варианте реализации предложен вариант получения палладиево-медного катализатора in situ, с последующим проведением окисления, смешиванием полученного раствора с раствором тиоктовой кислоты, фильтрации и лиофилизации.
В третьем варианте реализации предложен вариант раздельного получения с введением дополнительной стадии вакуумно-сублимационной сушки (лиофилизации) раствора динатриевой соли бис-(γ-L-глутамил)-L-цистеинил-глицина (содержащем координационные соединения палладия и меди), последующим растворением полученного лиофилизата, смешиванием с раствором тиоктовой кислоты, фильтрацией и лиофилизацией раствора средства по изобретению.
При каталитическом окислении тиолов RSH одной из наиболее важных функций палладия является образование координационных соединений - продуктов присоединения к иону палладия тиолат-ионов RS- с последующим их окислением и разрушением координационного полиэдра.
Экспериментальные исследования каталитических систем с применением медно-палладиевых катализаторов показывает их значительно большую каталитическую эффективность по сравнению с биядерными тиолатмостиковыми соединениями палладия(II). В отличие от водных растворов окисленного глутатиона GSSG, содержащих тиолатные комплексы меди Cu| k(SR)m, водные растворы, содержащие Pd-Cu катализаторы, по данным 1H ЯМР, ИК спектроскопии и ВЭЖХ устойчивы к процессам разложения.
Исследования показывают, что в Pd-Cu катализаторах соотношения Pd:Cu оптимально лежат в пределах от 1:0.2 до 1:2.
Для процессов мягкого селективного окисления GSH до GSSG можно сделать вывод о том, что биядерные тиолатмостиковые комплексы палладия(II) выполняют основную функцию катализаторов окисления, а тиолатные комплексы меди(I) следует отнести к химическим сайтам, меняющим их каталитическую активность или, говоря иначе, управляющим их каталитической активностью.
Таким образом, сочетание функциональных биядерных палладиевых координационных соединений, например формулы [Pd2 ||(µ-SR)2(NN3)4], с бидентатномостиковой координацией глутатиона с управляющим сайтом типа {Cu| k(SR)m}, образующимся из солей меди CuX2 (где Х=Cl- или Br-), превращающихся в среде тиолов в соответствующие тиолатные производные комплексов меди(I), показывает один из наиболее эффективных подходов к управлению активностью каталитических систем на основе комплексов палладия Pd2 || и Cu|.
Образование комплексного соединения, включающего Cu, Pd и GSH в сопоставимых количествах, обеспечивает биологический эффект предложенной комбинации.
Для получения фармацевтических композиций по изобретению используют фармацевтически приемлемые эксципиенты. В частности, это неорганические или органические носители. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.п. могут быть использованы, например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.п. Подходящими носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические композиции могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подсластители, красители, корригенты, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты и другие необходимые компоненты.
В общем, все продукты и способы по изобретению альтернативно могут включать в себя, состоять или по существу состоять из любых подходящих компонентов и стадий, раскрытых в данном описании или известных специалисту из уровня техники, и такие продукты или способы по изобретению могут дополнительно или альтернативно исключать какой-либо компонент, или стадию, или объект, который использован в продукте или способе, известном из уровня техники, или который не является необходимым для достижения технического результата данного изобретения.
Примеры осуществления изобретения
Пример.1. Получение средства по изобретению (GSSGNa2/липоат Na/Pd/Cu=1000/1000/1/1)
330 г (1,074 моль) восстановленного глутатиона суспендируют в 3100 мл воды. К полученной суспензии добавляют 42,96 г (1,074 моль) гидроксида натрия в виде 16% водного раствора. После окончания выделения углекислого газа реакционную массу охлаждают и добавляют 0,1135 г (0,537 ммоль) цис-диаминодихлорпалладия и 0,0915 г (0,537 ммоль) хлорида меди 2-водного. К полученному раствору добавляют 304,5 г 6% р-ра (0,537 моль) перекиси водорода, контролируя температуру (не более 15ºС). После добавления перекиси полученный раствор выдерживают при комнатной температуре 1,5 часа. К полученному раствору окисленного глутатиона добавляют 122,6 г (0,537 моль) липоата натрия, растворенного в минимальном количестве воды, фильтруют через фильтр 0,22µ и лиофилизируют. Выход соединения GSSGNa2/липоат Na/Pd/Cu (1000/1000/1/1) составляет 99%.
Пример. 2. Изучение гипогликемизирующего, гипохолестеринемического, гиполипидемического, антиоксидантного эффектов средства по изобретению
Приготовление растворов исследуемых соединений для проведения исследования.
Белые кристаллические вещества хранили при 4ºС; непосредственно перед началом эксперимента вещество растворяли в физиологическом растворе. Раствор стерилизовали пропусканием через фильтры 0,22 мкм Millex-GS (Millipore) в стерильном ламинарном боксе. Для изучения гипогликемического действия исследуемые вещества вводили мышам натощак внутривенно в физиологическом растворе тиоктовая кислота в дозе 100 мг/кг, 200 мг/кг, средство по изобретению (GSSGNa2/липоат Na/Pd/Cu=1000/1000/1/1) в дозе 10 и 20 мг/кг.
Проведение исследования.
Для оценки сахаропонижающей активности препарата использовали официально рекомендованные тесты (Методические рекомендации по экспериментальному изучению новых пероральных гипогликемических фармацевтических средств. В сб. «Руководящие методические материалы по экспериментальному и клиническому изучению лекарственных средств. Часть 6», М., 1986, с.202; Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Хабриева Р.У. 2 - изд. - М.: Изд. «Медицина». 2005. 832 С):
- гипогликемический тест (снижение содержания сахара в крови у интактных животных);
- тест нагрузки глюкозой (снижение содержания сахара у животных с гипергликемией, вызванной введение глюкозы натощак);
- модель аллоксанового диабета (снижение содержания сахара в условиях экспериментальной хронической инсулиновой недостаточности).
Кровь получали через 1 час пункцией хвостовой вены и определяли уровень глюкозы в сыворотке ортотолуидиновым методом.
Эксперименты по изучению влияния исследуемых веществ на уровень глюкозы в крови выполнялись на белых мышах массой 17-18 г. С вечера накануне эксперимента животные лишались корма. Утром натощак мышам подкожно вводили 10% раствор глюкозы из расчета 1 г/кг (0.1 мл/10 г массы тела). Сразу после введения глюкозы экспериментальным животным подкожно вводили препараты сравнения (инсулин в дозе 0.3 ЕД/кг). Исследуемые вещества вводили внутримышечно: тиоктовую кислоту 5,5, 11, 100 и 200 мг/кг (две первые дозы соответствуют содержанию тиоктовой кислоты в составе средства по изобретению); средство по изобретению - 10 и 20 мг/кг. Уровни глюкозы в крови определяли на протяжении 4 часов с интервалом 1 час.
В другой серии экспериментов использовалась модель аллоксанового диабета. Аллоксановый диабет вызывали однократным подкожным введением аллоксангидрата (фирма «Хемапол», Чехия) в дозе 100 мг/кг голодавшим в течение суток крысам массой 180-200 г. Исследовались следующие группы животных: интактные крысы, нелеченые крысы с диабетом, животные с диабетом, получавшие ежедневно в течение 1 месяца тиоктовую кислоту в дозе 100 мг/кг и средство по изобретению в дозе 10 мг/кг внутрижелудочно 1 раз в день. Введение препаратов начинали через 7 дней, когда уровень глюкозы крови повышался по сравнению с контролем приблизительно в 2 раза. Каждая группа содержала по 20 животных обоего пола. В ходе эксперимента фиксировали общее состояние животных, потребление корма и воды, массу тела, уровни глюкозы, общих липидов, триглицеридов, липопротеидов и холестерина сыворотки крови.
Результаты исследования.
Влияние исследуемых соединений на уровень глюкозы в крови животных после нагрузки глюкозой приведены в таблице 1.
| Таблица 1 | ||||
| Уровень сахара в крови мышей (ммоль/л, М±m) в тесте нагрузки глюкозой | ||||
| Препарат | Время после введения | |||
| 1 час | 2 часа | 3 часа | 4 часа | |
| Контроль | 4.8±0.3 | 4.4±0.6 | 4.3±0.5 | 4.3±0.4 |
| Средство по изобретению (10 мг/кг) | 2.6±0.7 | 2.5±0.6 | 2.6±0.2 | 3.0±0.4 |
| Средство по изобретению (20 мг/кг) | 1.9±0.6 | 2.0±0.3 | 2.0±0.2 | 2.4±0.5 |
| Инсулин | 1.1±0.1 | 1.1±0.1 | 1.3±0.2 | 2.0±0.1 |
| Тиоктовая к-та 5.5 мг/кг | 4,7±0.2 | 4,7±0.2 | 4.4±0.3 | 4.6±0.1 |
| Тиоктовая к-та 11 мг/кг | 4.5±0.2 | 4.9±0.2 | 4.9±0.7 | 4.9±0.7 |
| Тиоктовая к-та 100 мг/кг | 3.1±0.2 | 3.2±0.4 | 2.9±0.8 | 3.4±0.4 |
| Тиоктовая к-та 200 мг/кг | 2.6±0.5 | 2.6±0.5 | 2.3±0.4 | 2.2±0.2 |
Результаты исследования показывают сопоставимость эффектов тиоктовой кислоты на уровень сахара в крови в дозе 100 и 200 мг/кг и средства по изобретению в дозе 5,5 и 11 мг/кг. Без координационного соединения тиоктовая кислота в дозах 5,5 и 11 мг/кг гипогликемизирующим действием не обладала.
Экстраполируя на крыс, можно предположить, что эффективной однократной дозой будет 20 мг/кг средства по изобретению и 200 мг/кг тиоктовой кислоты, вводимой обособленно. Эта дозы и была выбрана для лечения экспериментального диабета у крыс, результаты которого приведены в таблице 2.
| Таблица 2 | ||||
| Интегральные показатели, показатели углеводного и липидного обмена у белых крыс с экспериментальным диабетом (М±m) | ||||
| Показатели | Экспериментальные группы животных | |||
| Интактные | Диабет | Диабет + средство по изобретению | Диабет + тиокт. к-та | |
| 14 дней | ||||
| Процент живых | 100 | 65 | 100 | 100 |
| Масса тела, г | 190±10 | 170±10 | 185±5 | 180±10 |
| Суточное потребление воды | 15±1 | 35±2 | 25±3 | 25±5 |
| Глюкоза, ммоль/л | 4.5±0.3 | 18.4±1.5 | 4.9±0.7 | 6.2±0.8 |
| Общие липиды, г/л | 12.2±1.3 | 19.2±1.8 | 10.8±0.6 | 10.1±1.5 |
| Холестерин, ммоль/л | 1.2±0.2 | 8.7±1.2 | 2.0±0.6 | 2.6±0.8 |
| Триглицериды, ммоль/л | 2.7±0.4 | 4.8±1.4 | 2.4±0.8 | 2.3±0.4 |
| Липопротеиды, г/л | 2.1±0.3 | 2.9±0.9 | 2.2±0.3 | 2.1±0.2 |
| 20 дней | ||||
| Процент живых | 100 | 50 | 100 | 100 |
| Масса тела, г | 195±10 | 165±10 | 190±5 | 185±10 |
| Суточное потребление воды | 17±4 | 45±5 | 20±3 | 22±5 |
| Глюкоза, ммоль/л | 4.2±0.2 | 19.9±2.2 | 4.5±0.2 | 4.7±0.7 |
| Общие липиды, г/л | 11.1±1.3 | 18.8±2.3 | 9.6±1.2 | 10.7±0.9 |
| Холестерин, ммоль/л | 1.4±0.2 | 8.7±0.2 | 1.6±0.3 | 1.9±0.6 |
| Триглицериды, ммоль/л | 2.7±0.2 | 3.9±0.5 | 1.9±0.1 | 2.5±0.8 |
| Липопротеиды, г/л | 2.2±0.3 | 2.6±0.1 | 2.3±0.3 | 2.4±0.5 |
| 30 дней | ||||
| Процент живых | 100 | 25 | 100 | 100 |
| Масса тела, г | 200±15 | 160±10 | 195±5 | 195±10 |
| Суточное потребление воды | 18±2 | 60±5 | 21±3 | 21±3 |
| Глюкоза, ммоль/л | 4.3±0.1 | 16.5±1.5 | 4.0±0.5 | 4.9±0.7 |
| Общие липиды, г/л | 9.5±0.2 | 19.1±0.8 | 10.5±1.5 | 9.7±0.2 |
| Холестерин, ммоль/л | 1.3±0.3 | 8.2±1.2 | 1.4±0.2 | 1.4±0.6 |
| Триглицериды, ммоль/л | 2.1±0.5 | 3.8±0.9 | 1.6±0.2 | 1.8±0.4 |
| Липопротеиды, г/л | 2.1±0.3 | 2.9±0.3 | 2.2±0.1 | 2.1±0.3 |
Полученные результаты свидетельствуют о том, что средство по изобретению оказывает хорошее лечебное действие при диабете средней тяжести, причем эффект препарата сопоставим с эффектом тиоктовой кислоты, вводимой самостоятельно в дозе двадцатикратно превышающей ее количество в составе средства по изобретению. У всех животных, получавших средство по изобретению, отмечалось снижение уровня глюкозы в крови и нормализация показателей липидного обмена. Эти животные нормально набирали вес, а потребление ими воды не отличалось от контрольной группы.
Следовательно, средство по изобретению обладает достаточным гипогликемизирующим, гипохолестеринемическим, гиполипидемическим, антидиабетическим действием, что при экспериментальном диабете проявилось нормализацией значений показателей углеводного и липидного обмена, в частности достоверном снижении уровня холестерина в крови экспериментальных животных.
Таким образом, средство по изобретению характеризует присущая тиоктовой кислоте фармакологическая активность подобной степени выраженности, но достигаемая при меньших дозах действующего вещества.
Пример 3. Получение лекарственной формы средства по изобретению
В емкости для приготовления раствора вместимостью 1,0 л к 0,8 л воды для инъекций добавляют 13,6 г ацетата натрия 3-водного, 60 г субстанции средства по изобретению и перемешивают до растворения с последующим доведением общего объема до 1,0 л. Определяют значение рН с помощью рН-метра и доводят 20% уксусной кислотой до рН 6,0±0,2. Проводят стерилизующую фильтрацию с использованием стерилизующего фильтра с размером пор 0,22 мкм и проводят розлив (1 мл - 1 ампула) в стеклянные ампулы. В результате получают 970 ампул (с учетом потерь), содержащих композицию для внутривенного или внутримышечного введения, соответствующую требованиям нормативной документации в течение 3 лет и имеющей следующий состав:
| Средство по изобретению | 60 г |
| Ацетат натрия, 3-водный | 13,6 г |
| Уксусная кислота | до рН 6,0 |
| Вода | до 1000 мл |
Пример 4. Получение лекарственной формы средства по изобретению
В емкости для приготовления раствора вместимостью 1,0 л к 0,8 л воды для инъекций добавляют 13,6 г ацетата натрия 3-водного, 30 г субстанции средства по изобретению и перемешивают до растворения с последующим доведением общего объема до 1,0 л. Определяют значение рН с помощью рН-метра и доводят 20% уксусной кислотой до рН 6,0±0,2. Проводят стерилизующую фильтрацию с использованием стерилизующего фильтра с размером пор 0,22 мкм и проводят розлив (1 мл - 1 ампула) в стеклянные ампулы. В результате получают 970 ампул (с учетом потерь), содержащих композицию для внутривенного или внутримышечного введения, соответствующую требованиям нормативной документации в течение 3 лет и имеющую следующий состав:
| Средство по изобретению | 30 г |
| Ацетат натрия, 3-водный | 13,6 г |
| Уксусная кислота | до рН 6,0 |
| Вода | до 1000 мл |
1. Обладающая гипогликемизирующей, гипохолестеринемической, гиполипидемической и (или) антиоксидантной активностью комбинация бис-(γ-L-глутамил)-L-цистеинил-глицина в виде динатриевой соли и липоевой кислоты в виде натриевой соли, и координационных соединений, образованных палладием, медью и γ-L-глутамил-L-цистеинил-глицином, где мольное соотношение бис-(γ-L-глутамил)-L-цистеинил-глицина динатриевая соль: липоат натрия: палладий: медь находится в диапазоне 100-10000:100-10000:1-10:1-10.
2. Комбинация по п.1, где мольное соотношение бис-(γ-L-глутамил)-L-цистеинил-глицина динатриевая соль: липоат натрия: палладий: медь составляет 1000:1000:1:1.
3. Комбинация по п.1, где в качестве источника палладия выбран цис-диаминодихлорпалладий.
4. Комбинация по п.1, где в качестве источника меди выбрана медь двухлористая.
5. Комбинация по пп.1-4 для применения в терапии.
6. Фармацевтическая композиция, обладающая гипогликемизирующей, гипохолестеринемической, гиполипидемической и (или) антиоксидантной активностью, содержащая комбинацию по пп.1-5 и фармацевтически приемлемые эксципиенты.
7. Способ лечения заболевания, выбранного из группы, включающей метаболический синдром, сахарный диабет второго типа, при котором нуждающемуся в этом пациенту вводят комбинацию по любому из пп.1-5 или фармацевтическую композицию по п.6.