Средство, индуцирующее дифференцировку стволовых кроветворных клеток в тромбоциты
Иллюстрации
Показать всеИзобретение относится к области медицины. Заявлено средство, индуцирующее дифференцировку стволовых кроветворных клеток в тромбоциты, представляющее собой рекомбинантный циклофилин А человека (рчЦфА). Изобретение обеспечивает расширение ассортимента средств указанного назначения. 2 ил.
Реферат
Изобретение относится к области медицины.
Применение химиотерапии у онкологических больных приводит к повреждению и гибели кроветворных клеток костного мозга со снижением количества тромбоцитов в периферической крови. Тромбоцитопения является серьезной проблемой в лечении онкологических больных (Lorusso D, Ferrandina G, Greggi S, Gadducci A, Pignata S, Tateo S, Biamonte R, Manzione L, Di Vagno G, Ferrau' F, Scambia G. // Phase III multicenter randomized trial of amifostine as cytoprotectant in first-line chemotherapy in ovarian cancer patients. Ann. Oncology. 2003 Jul; 14(7): 1086-93).
Известно ограниченное количество средств, способствующих дифференцировке тромбоцитов. Наиболее близким к заявляемому средству является тромбопоэтин (прототип). Тромбопоэтин - гормон, индуцирующий дифференцировку мегакариоцитарного ростка из стволовых клеток костного мозга и влияющий на пролиферацию, созревание и дифференцировку мегакариоцитов и образование тромбоцитов (Nagahisa H, Nagata Y, Ohnuki T, Osada M, Nagasawa Т, Abe T, Todokoro K. // Bone marrow stromal cells produce thrombopoietin and stimulate megakaryocyte growth and maturation but suppress proplatelet formation. Blood. 1996 Feb 15; 87(4):1309-16).
Задачей изобретения является расширение ассортимента средств, индуцирующих дифференцировку тромбоцитов. Задача решается тем, что предлагается новое средство, индуцирующее дифференцировку тромбоцитов, представляющее собой рекомбинантный циклофилин А человека (рчЦфА).
РчЦфА известен как белок с молекулярной массой 18 кД, присутствующий в различных тканях, усиливает миграцию стволовых клеток, предшественников дендритных клеток, гранулоцитов и лимфоцитов из костного мозга на периферию, способствует дифференцировке дендритных клеток и гранулоцитов (Khromykh L.M., Kulikova N.L., Anfalova T.V. et al. // Cyclophilin A produced by thymocytes regulates the migration of murine bone marrow cells. Cell Immunol. - 2007. - vol. 249(1). - p.46-53; Bharadwaj U, Zhang R, Yang H, Li M, Doan LX, Chen C, Yao Q. // Effects of cyclophilin A on myeloblastic cell line KG-1 derived dendritic like cells (DLC) through p38 MAP kinase activation. J Surg Res. 2005 Jul 1; 127(1):29-38; Патент РФ №2370277).
РчЦфА усиливает адгезивные свойства тромбоцитов (Патент РФ №2435607). Для выполнения поставленной задачи оценивали влияние рчЦфА на дифференцировку стволовых клеток лейкаферезного концентрата и костного мозга онкологических больных после химио-лучевой терапии и здоровых доноров. Дифференцировку клеток тромбоцитарного ростка оценивали по экспрессии маркера CD61, который присутствует на всех этапах становления тромбоцитов от стволовых до зрелых клеток.
Для получения рчЦфА использовали клетки Escherichia coli BL21, трансформированные плазмидой pCyPAwt/pGEX-2TK (M.Bukrinsky Albert Einstein College of Medicine of Yeshiva University, США). Качество полученного рчЦфА оценивали с помощью SDS-PAAG по Лэммли (U.K.Laemmli. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature, 1970; V.227, P.680-685). Концентрацию рчЦфА определяли по методу Бредфорда (Bradford, M.M. (1976) A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal. Biochem. 72:248-254). Идентификацию рчЦфА проводили с помощью Wetstern-blott анализа (Gershoni JM, Palade GE. Electroblotting of proteins from polyacrylamide gels. Methods Mol Biol. 2004; 244:345-352) с использованием кроличьих антител к рчЦфА (е-Biosciences). Чистота полученного рчЦфА составила более 98%.
Для исследования использовали лейкаферезный концентрат, представляющий собой фракцию клеток периферической крови с преобладанием мононуклеаров. Лейкаферезный концентрат получали у пяти онкологических больных после химио-лучевой терапии путем сепарации клеток периферической крови.
В качестве образцов использовали костный мозг трех онкологических больных и трех здоровых доноров.
С целью мобилизации стволовых кроветворных клеток пациентам предварительно проводили стимуляцию кроветворения гранулоцитарным колониестимулирующим фактором (Г-КСФ) в стандартной дозе 5 мкг/кг в течение 3-14 дней. Количество CD34+ стволовых клеток в аликвотах образцов ленкаферезного концентрата варьировало от 0,25% до 1,3%, в аликвотах образцов костного мозга от 2,1% до 5,8%.
Клетки крови и костного мозга человека культивировали при концентрации 1×106/мл в питательной среде альфа-МЕМ (для клеток крови, Gibco) и IMDM (для клеток костного мозга, Gibco) с добавлением 20% эмбриональной телячьей сыворотки, 2-меркаптоэтанола 5×10-5 M, L-глютамина 2 мМ и цифрана 100 мкг/мл. Культивирование клеток проводили при температуре 37°C в присутствии 5% CO2 в пластиковых 24-луночных планшетах (Corning) в течение 5 дней. Концентрация рчЦфА составила 10,0 мкг/мл.
Анализ клеточных маркеров проводили при помощи проточного цитофлюориметра Faxcanto II (Beckton Dickenson) с использованием флюоресцентномеченных антител анти-CD61Fitc (E-Bioscience). Контрольные маркеры были установлены в соответствии с изотипическим контролем: анти-IgG Fitc. Для исключения неспецифического окрашивания до окраски с флюоресцентными антителами клетки человека инкубировали с донорской сывороткой крови (IV группа) в разведении 1:10. Погибшие клетки исключали путем гейтирования в параметрах прямого и бокового рассеивания (FSC/SSC), а также включения 7-амино-актиномицина D (Calbiochem, CA). Данные анализировали при помощи программ BD FACSDiva (версия 6.1.2, Beckton Dickinson) и WinMDI 2.8 (J.Trotter, http://facs.scripps.edu/).
Изобретение иллюстрировано фиг.1 и 2.
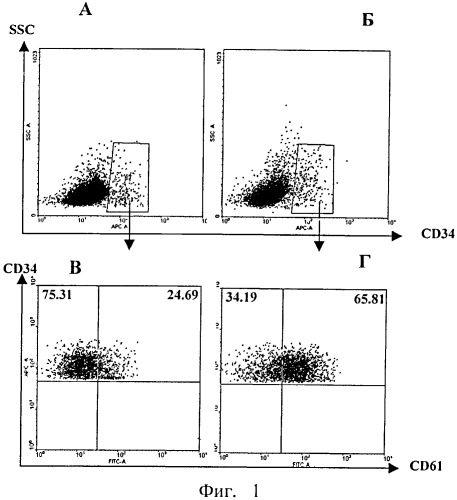
На фиг.1(А-Г) представлено влияние рчЦфА на дифференцировку тромбоцитов в лейкаферезном концентрате.
На фиг.1 (А и Б) по оси абсцисс обозначен уровень экспрессии маркера CD34, по оси ординат (SSC) - уровень клеточной гранулярности. На фиг.1А представлена идентификация стволовых клеток, несущих маркер CD34+, в контроле, и на фиг.1Б - в присутствии рчЦфА (очерченный регион).
На фиг.1(В и Г) по оси абсцисс показан уровень экспрессии маркера CD61, по оси ординат - уровень экспрессии маркера CD34. На фиг.1В представлено количество стволовых клеток, несущих маркер CD61 в контроле (24,69%), и на фиг.1Г - под влиянием рчЦфА (65,81%).
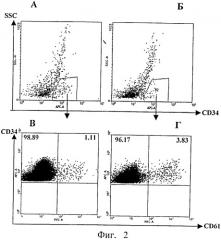
На фиг.2 (А-Г) показано влияние рчЦфА на дифференцировку тромбоцитов в костном мозге.
На фиг.2 (А и Б) по оси абсцисс обозначен уровень экспрессии маркера CD34, по оси ординат - уровень клеточной гранулярности (SSC).
На фиг.2А представлена идентификация стволовых клеток костного мозга в контроле и на фиг.2Б - в присутствии рчЦфА (очерченный регион).
На фиг.2 (В и Г) по оси абсцисс показан уровень экспрессии маркера CD61, по оси ординат - уровень экспрессии маркера CD34.
На фиг.2 В представлено количество стволовых клеток, несущих маркер CD61 в контроле (1,11%) и на фиг.2Г - под влиянием рчЦфА (3,83%).
Таким образом, показано, что под влиянием рчЦфа наблюдается увеличение количества стволовых клеток, экспрессирующих маркер CD61, в лейкаферезном концентрате и костном мозге - в 3 раза относительно контрольных значений.
Технический результат изобретения
Средство, индуцирующее дифференцировку тромбоцитов, представляет собой рекомбинантный циклофилин А человека.
Средство, индуцирующее дифференцировку стволовых кроветворных клеток в тромбоциты, представляющее собой рекомбинантный циклофилин А человека.