Аминопропилиденовое производное
Иллюстрации
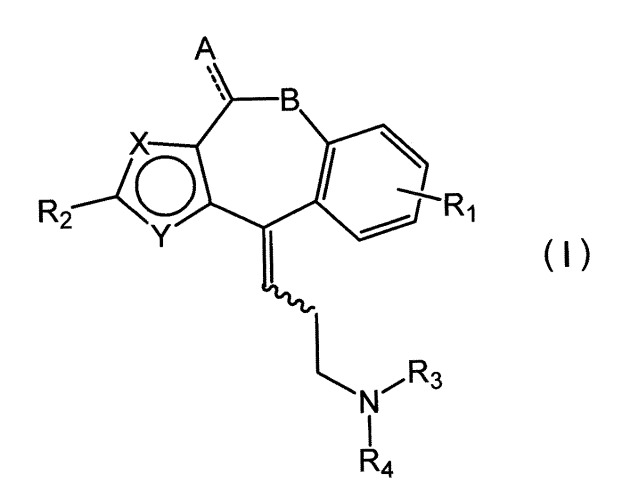
Показать всеНастоящее изобретение относится к аминопропилиденовому производному, представленному формулой (I)
, где R1 и R2, которые могут быть одинаковыми или отличными друг от друга, представляют собой водород или заместитель, выбранный из следующих (а)-(с), при условии, что случай, когда оба представляют собой водород, исключается: (а) карбонил, замещенный гидрокси, алкокси или гидроксиалкиламино, (b) карбонилалкил, замещенный гидрокси или алкокси, и (с) акриловая кислота, включая ее алкиловый эфир, R3 и R4, которые могут быть одинаковыми или отличными друг от друга, представляют собой водород, алкил, который может быть замещен фенилом, или циклоалкил, или R3 и R4, которые вместе образуют гетероциклическое кольцо с атомом азота, связанным с ними, представляют собой пирролидино, пиперидино, который может быть замещен оксо или пиперидино, пиперазинил, замещенный алкилом или фенилом, морфолино или тиоморфолино, А означает оксо или отсутствует, В представляет собой углерод или кислород, один из X и Y представляет собой углерод, а другой представляет собой серу, часть, представленная прерывистой линией, представляет собой простую связь или двойную связь, и волнистая линия представляет собой цис-форму и/или трансформу. Изобретение также относится к фармацевтической композиции, обладающей антагонистическим действием в отношении гистаминового рецептора, на основе указанных соединений. Технический результат: получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения бронхиальной астмы, аллергического ринита, поллиноза, аллергической сыпи и атопического дерматита. 4 н. и 6 з.п. ф-лы, 12 табл., 58 пр.
Реферат
Область изобретения
Настоящее изобретение относится к аминопропилиденовому производному или его соли, или гидрату, которые являются фармацевтически приемлемыми, которые являются полезными в качестве фармацевтических композиций, в частности, активных ингредиентов, таких как антигистаминные средства.
Предпосылки изобретения
Гистамины являются репрезентативными химическими медиаторами, которые индуцируют аллергические реакции, и гистамины выделяются из клеток, таких как тучные клетки и базофилы, когда вещества, которые вызывают аллергию, поступают в организм. Высвободившиеся гистамины связываются с белком гистаминового рецептора типа 1 (H1 рецептор), проявляя фармакологические действия, такие как гипотензия, сосудистая гиперпроницаемость, сокращение гладких мышц, вазодилатация или гиперсекреция желез, и вовлечены в проявление аллергических реакций и воспалений. Как описано выше, гистамины связаны с различными заболеваниями человека, и аллергические заболевания и воспаления можно предотвратить или вылечить, контролируя их действия. Средства для контроля высвобождения гистаминов и средства для ингибирования связывания гистаминов с рецепторами (антигистаминные средства) являются коммерчески доступными в большом количестве, и такие средства используют при заболеваниях, таких как бронхиальная астма, аллергический ринит, сенная лихорадка, крапивница и атопический дерматит.
Однако антигистаминные средства, как это общеизвестно, демонстрируют некоторые нежелательные побочные эффекты, такие как седативное действие, сонливость, головокружение и недомогание, основанные на действиях на центральную нервную систему; и сухость во рту, сухость слизистой оболочки и ухудшение зрения, основанные на антихолинергических действиях; поэтому существуют ограничения их применения, такие как запрет приема антигистаминов перед тем, как сесть за руль автомобиля, что, в свою очередь, вызывает неудобства применения таких средств. По этим причинам антигистаминные средства, которые не имеют таких проблем и обладают отличными эффектами, имеют спрос как у пациентов, так и со стороны медицинских учреждений. Авторами настоящего изобретения было обнаружено аминопропилиденовое производное по настоящему изобретению, обладающее меньшими побочными эффектами на центральную нервную систему и сильным антигистаминным действием.
Что касается аминопропилиденовых производных, содержащих тиабензоазуленовый скелет, непатентная публикация 1 раскрывает соединения, содержащие тиофеновое кольцо или бензольное кольцо, замещенное галогеном, метокси или диметиламиносульфонильной группой. Однако эта публикация только описывает, что эти соединения синтезируют, и конкретно не указывает, что эти соединения обладают фармакологическими действиями, такими как антигистаминные действия.
Публикации, известные из уровня техники
Непатентная публикация(и)
Непатентная публикация 1: Helvetica Chimica Acta, 49, No. 26, (1966), 214-234 (см. стр. 220-221, таблица 3).
Краткое описание изобретения
Задачи, решаемые настоящим изобретением
Целью настоящего изобретения является обеспечение фармацевтической композиции, которая обладает меньшими побочными действиями на центральную нервную систему, такими как сонливость, и отличным действием, в частности, полезного соединения в качестве активного ингредиента, такого как антигистамин.
Средства решения задач
В результате всесторонних исследований антигистаминовых соединений, имеющих характеристики, указанные выше, авторами настоящего изобретения было обнаружено, что аминопропилиденовое производное, представленное структурной формулой (I), показанной ниже, представляет собой соединение, полезное в качестве лекарственного средства, которое обладает отличным антигистаминовым действием и уменьшает побочные эффекты на центральную нервную систему, такие как сонливость. Таким образом, было создано настоящее изобретение.
Эффекты настоящего изобретения
Аминопропилиденовое производное по настоящему изобретению обладает отличным антагонистическим действием в отношении гистаминовых рецепторов и демонстрирует низкий перенос в головной мозг даже в тесте связывания с церебральными рецепторами, где мышам перорально вводили соединение, и, следовательно, демонстрирует эффект уменьшения побочных эффектов на центральную нервную систему, таких как сонливость. Поэтому аминопропилиденовое производное обладает свойствами, желательными для активных ингредиентов фармацевтических композиций, таких как антигистаминные средства, и является чрезвычайно полезным.
Способы осуществления изобретения
Настоящее изобретение относится к аминопропилиденовому производному или его соли, или гидрату, которые являются фармацевтически приемлемыми и являются полезными в качестве лекарственного средства, такого как антигистаминные средства, где аминопропилиденовое производное представлено следующей общей формулой (I):
где R1 и R2, которые могут быть одинаковыми или отличными друг от друга, представляют собой водород или заместитель, выбранный из следующих (a)-(c), при условии, что случай, когда оба представляют собой водород, исключается:
(a) карбонил, замещенный гидрокси, алкокси, гидроксиалкиламино,
(b) карбонилалкил, замещенный гидрокси или алкокси, и
(c) акриловая кислота, включая ее алкиловый эфир,
R3 и R4, которые могут быть одинаковыми или отличными друг от друга, представляют собой водород, алкил, который может быть замещен фенилом, или циклоалкил, или
R3 и R4, которые вместе образуют гетероциклическое кольцо с атомом азота, связанным с ними, представляют собой пирролидино, пиперидино, который может быть замещен оксо или пиперидино, пиперазинил, замещенный алкилом или фенилом, морфолино или тиоморфолино,
A означает незамещенный или оксо, В представляет собой углерод или кислород, один из X и Y представляет собой углерод, а другой представляет собой серу, часть, представленная прерывистой линией, представляет собой простую связь или двойную связь, и волнистая линия представляет собой цис-форму и/или транс-форму.
В представленной выше общей формуле (I) алкил (включая "алкил" в описанных выше заместителях, таких как карбонилалкил, алкиловый эфир акриловой кислоты, гидроксиалкиламино или алкилпиперазинил) представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, и такая алкильная группа предпочтительно представляет собой метил, этил, пропил, изопропил, бутил, изобутил, фтор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, гексил, изогексил или подобные.
Алкокси представляет собой линейную или разветвленную алкоксигруппу, содержащую от 1 до 6 атомов углерода, и алкоксигруппа предпочтительно представляет собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, фтор-бутокси, трет-бутокси, н-пентилокси, н-гексилокси или подобные.
Циклоалкил представляет собой циклический алкил, содержащий от 3 до 6 атомов углерода, и циклоалкил предпочтительно представляет собой циклопропил, циклобутил, циклопентил или циклогексил.
Галоген представляет собой фтор, хлор, бром, йод или подобные.
Из соединений по настоящему изобретению предпочтительными соединениями являются следующие.
Гидрохлорид этил (E,Z)-3-[4-(3-диметиламинопропилиден)-9,10-дигидро-4H-3-тиабензо[f]азулен-2-ил]акрилата [Соединение 1]
Гидрохлорид этил (E,Z)-4-(3-диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-карбоксилата [Соединение 3]
(E,Z)-4-(3-диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-карбоновая кислота [Соединение 4]
Гидрохлорид (E)-[4-(3-диметиламинопропилиден)-9,10-дигидро-4H-3-тиабензо[f]азулен-2-ил]уксусной кислоты [Соединение 5]
Гидрохлорид этил (E,Z)-3-[4-(3-диметиламинопропилиден)-9,10-дигидро-4H-1-тиабензо[f]азулен-2-ил]акрилата [Соединение 6]
(E,Z)-3-[4-(3-Диметиламинопропилиден)-9,10-дигидро-4H-1-тиабензо[f]азулен-2-ил]акриловая кислота [Соединение 7]
(E,Z)-4-(3-Диметиламинопропилиден)-9,10-дигидро-4H-3-тиабензо[f]азулен-2-карбоновая кислота [Соединение 8]
(2-Гидроксиэтил)амид (E,Z)-4-(3-диметиламинопропилиден)-9,10-дигидро-4H-1-тиабензо[f]азулен-2-карбоновой кислоты гидрохлорид [Соединение 9]
(E,Z)-3-[4-(3-Диметиламинопропилиден)-9,10-дигидро-4H-3-тиабензо[f]азулен-2-ил]акриловая кислота [Соединение 11]
(2-Гидроксиэтил)амид (E)-4-(3-диметиламинопропилиден)-9,10-дигидро-4H-3-тиабензо[f]азулен-2-карбоновой кислоты [Соединение 12]
Гидрохлорид этил (E,Z)-3-[4-(3-диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]акрилата [Соединение 13]
(E,Z)-3-[4-(3-Диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]акриловая кислота [Соединение 14]
(E)-[4-(3-Диметиламинопропилиден)-9,10-дигидро-4H-1-тиабензо[f]азулен-2-ил]карбоновая кислота [Соединение 15]
(Z)-[4-(3-Диметиламинопропилиден)-9,10-дигидро-4H-1-тиабензо[f]азулен-2-ил]карбоновая кислота [Соединение 16]
Гидрохлорид (E)-[4-(3-диметиламинопропилиден)-9,10-дигидро-4H-1-тиабензо[f]азулен-2-ил]уксусной кислоты [Соединение 17]
Гидрохлорид (Z)-[4-(3-диметиламинопропилиден)-9,10-дигидро-4H-1-тиабензо[f]азулен-2-ил]уксусной кислоты [Соединение 18]
(E)-[4-(3-Диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 19]
(Z)-[4-(3-Диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 20]
Гидрохлорид этил (E,Z)-2-[4-(3-диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]-2-метилпропионата [Соединение 21]
(E,Z)-2-[4-(3-Диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]-2-метилпропионовая кислота [Соединение 22]
(E,Z)-2-[4-(3-Диметиламинопропилиден)-9,10-дигидро-4H-1-тиабензо[f]азулен-2-ил]-2-метилпропионовая кислота [Соединение 23]
Гидрохлорид этил (E)Z)-2-[4-(3-диметиламинопропилиден)-10-оксо-9,10-дигидро-4H-1-тиабензо[f]азулен-2-ил]-2-метилпропионата [Соединение 24]
(E)-{2-Метил-2-[4-(3-метиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]}пропионовая кислота [Соединение 25]
(E)-{4-[3-(Пирролидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 26]
(Z)-{4-[3-(Пирролидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 27]
(Z)-[4-(3-Диметиламинопропилиден)-4,10-дигидро-9-окса-1-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 28]
(E)-[4-(3-Диметиламинопропилиден)-4,10-дигидро-9-окса-1-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 29]
(E)-[4-(3-Этилметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 30]
(Z)-[4-(3-Этилметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 31]
(E)-{4-[3-(Морфолин-4-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 32]
(Z)-{4-[3-(Морфолин-4-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 33]
(E)-{4-[3-(Пиперидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 34]
(Z)-{4-[3-(Пиперидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 35]
(E)-4-{4-[3-(Пирролидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}масляная кислота [Соединение 36]
(Z)-4-{4-[3-(Пирролидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}масляная кислота [Соединение 37]
(E)-[4-(3-Этиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 38]
(Z)-[4-(3-Этиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 39]
(E)-[4-(3-Бензилметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 40]
(Z)-[4-(3-Бензилметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 41]
(E)-[4-(3-Бензиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 42]
(Z)-[4-(3-Бензиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 43]
(E)-[4-(3-Циклопентиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 44]
(Z)-[4-(3-Циклопентиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 45]
(E)-[4-(3-Изопропиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 46]
(Z)-[4-(3-Изопропиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 47]
(E)-3-[4-(3-Диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]пропионовая кислота [Соединение 48]
(Z)-3-[4-(3-Диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]пропионовая кислота [Соединение 49]
(E)-{4-[3-(4-Метилпиперазин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 50]
(Z)-{4-[3-(4-Метилпиперазин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 51]
(E)-3-{4-[3-(Пирролидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}пропионовая кислота [Соединение 52]
(Z)-3-{4-[3-(Пирролидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}пропионовая кислота [Соединение 53]
(E)-{4-[3-(4-Фенилпиперазин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 54]
(Z)-{4-[3-(4-Фенилпиперазин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 55]
Гидрохлорид (E)-3-[4-(3-диметиламинопропилиден)-4,10-дигидро-9-окса-1-тиабензо[f]азулен-6-ил]пропионовой кислоты [Соединение 56]
Гидрохлорид (Z)-3-[4-(3-диметиламинопропилиден)-4,10-дигидро-9-окса-1-тиабензо[f]азулен-6-ил]пропионовой кислоты [Соединение 57]
(E)-3-{4-[3-(Пирролидин-1-ил)пропилиден]-4,10-дигидро-9-окса-1-тиабензо[f]азулен-6-ил}пропионовая кислота [Соединение 58]
(Z)-3-{4-[3-(Пирролидин-1-ил)пропилиден]-4,10-дигидро-9-окса-1-тиабензо[f]азулен-6-ил}пропионовая кислота [Соединение 59]
(E)-4-[4-(3-Диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]масляная кислота [Соединение 60]
(Z)-4-[4-(3-Диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]масляная кислота [Соединение 61]
(E)-{4-[3-(4-Оксопиперидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 62]
(Z)-{4-[3-(4-Оксопиперидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 63]
(E)-[4-(3-Диметиламинопропилиден)-9,10-дигидро-4H-3-тиабензо[f]азулен-6-ил]уксусная кислота [Соединение 64]
Гидрохлорид (Z)-[4-(3-диметиламинопропилиден)-9,10-дигидро-4H-3-тиабензо[f]азулен-6-ил]уксусной кислоты [Соединение 65]
Диформиат (E)-{4-[3-([1,4']бипиперидин-1'-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусной кислоты [Соединение 66]
Диформиат (Z)-{4-[3-([1,4']бипиперидин-1'-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусной кислоты [Соединение 67]
(E,Z)-{4-[3-(Тиоморфолин-4-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусная кислота [Соединение 68]
(E,Z)-2-Метил-2-{4-[3-(пирролидин-1-ил)пропилиден]-9,10-дигидро-4H-1-тиабензо[f]азулен-2-ил}пропионовая кислота [Соединение 69]
Гидрохлорид (E)-{4-[3-(пирролидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусной кислоты [Соединение 70]
Гидрохлорид (Z)-{4-[3-(пирролидин-1-ил)пропилиден]-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил}уксусной кислоты [Соединение 71]
Из перечисленных выше соединений по настоящему изобретению более предпочтительные соединения включают соединения, перечисленные в Таблицах 9 и 10, представленных ниже. Кроме того, соединения, перечисленные в Таблице 12, обладающие отличным антигистаминным действием и низким переносом в головной мозг, являются особенно предпочтительными.
Общий способ получения соединения по настоящему изобретению представлен ниже. Соединение по настоящему изобретению, представленное описанной выше общей формулой (I), можно получить в соответствии со способом, описанным ниже. В этой связи специалистам в данной области должно быть очевидно, что конкретные способы, которые можно использовать для получения определенных соединений, могут варьировать в зависимости от химических структур соединений.
Из указанных выше соединений по настоящему изобретению, представленных общей формулой (I), 4-(аминопропилиден)-9,10-дигидро-4H-1-тиабензо[f]азуленовое соединение можно получить в соответствии со способами, описанными в Helvetica Chimica Acta, 49, Fasc. Emile Cherbuliez, No. 26, 214-233 (1966) или Collect. Czech. Chem. Commum. 59, 667-674 (1994), 4-(аминопропилиден)-9,10-дигидро-4H-3-тиабензо[f]азуленовое соединение можно получить в соответствии со способами, описанными в Helvetica Chimica Acta, 54, Fasc. 1, 277-282 (1971), 4-(аминопропилиден)-4H-1-тиабензо[f]азуленовое соединение и 4-(аминопропилиден)-4H-3-тиабензо[f]азуленовое соединение можно получить в соответствии со способами, описанными в Helvetica Chimica Acta, 49, Fasc. Emile Cherbuliez No. 26, 214-233 (1966), 4-(аминопропиден)-4,10-дигидро-9-окса-1-тиабензо[f]азуленовое соединение и 4-(аминопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азуленовое соединение можно получить в соответствии со способами, описанными в Японской выложенной патентной заявке № Sho 63-10784 или WO 2005/003131, и 4-(аминопропилиден)-10-оксо-9,10-дигидро-4H-1-тиабензо[f]азуленовое соединение можно получить в соответствии со способами, описанными в Helvetica Chimica Acta, 59, Fasc. 3, 866-877 (1976). Здесь введение заместителей осуществляют путем выбора исходных веществ, ранее содержащих какие-либо заместители в положении, соответствующем этому.
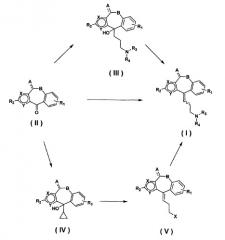
Соединение общей формулы (I) можно получить посредством реакции Виттига, реакции Виттига-Хорнера, реакции Мак-Мурри соединения общей формулы (II). Например, в случае, когда используют реакцию Виттига, получение можно осуществить в соответствии со способом, описанным в J. Org. Chem. 44, 22, 3760-3765 (1979), J. Med. Chem. 35, 2074-2084 (1992), или подобными способами. Иными словами, соединение общей формулы (I) можно получить путем взаимодействия соединения общей формулы (II) с соответствующей 3-аминопропилфосфониевой солью или подобным веществом, в присутствии основания, такого как н-бутиллитий или бутоксид калия, в неводном растворителе, таком как ТГФ (тетрагидрофуран), толуол, диэтиловый эфир или CPME (циклопентилметиловый эфир), при подходящей температуре, предпочтительно, в пределах от 0°С до температуры кипения растворителя.
Кроме того, соединение общей формулы (II) можно преобразовать в соединение общей формулы (I), подвергая соединение, представленное общей формулой (III), образованное после реакции Гриньяра, реакции дегидратирования. Этот способ получения можно осуществить в соответствии со способом, описанным в Helvetica Chimica Acta, 54, Fasc. 1, 277-283 (1971). Например, реакцию Гриньяра осуществляют путем обработки соединения общей формулы (II) соответствующим реагентом Гриньяра, таким как 3-аминопропилмагнийгалогенид, в неводном растворителе, таком как ТГФ, толуол, диэтиловый эфир или CPME, при подходящей температуре от температуры плавления до температуры кипения растворителя. Последующую реакцию дегидратирования можно осуществить с использованием хлористоводородной кислоты, трифторуксусной кислоты, тионилхлорида или подобных, в отсутствие растворителя или в подходящем растворителе, таком как вода, этанол или дихлорметан, при оптимальной температуре реакции от температуры плавления до температуры кипения растворителя.
Кроме того, в качестве альтернативного способа можно использовать способ, описанный в Collect. Czech. Chem. Commum. 59, 667-674 (1994). Иными словами, соединение общей формулы (II) обрабатывают реагентом Гриньяра, полученным из магния и бромциклопропана, или подобным, в неводном растворителе, таком как ТГФ, толуол или CPME, при подходящей температуре в пределах от температуры плавления до температуры кипения растворителя с получением соединения, представленного общей формулой (IV). Затем полученное соединение подвергают реакции галогенирования с бромистоводородной кислотой, триметилсиланбромидом, тионилхлоридом или подобным веществом, в подходящем растворителе, таком как вода, уксусная кислота, дихлорметан, хлороформ или 1,4-диоксан, при подходящей температуре в пределах от 0°C до температуры кипения растворителя, преобразовывая, таким образом, соединение в соединение, представленное общей формулой (V). Затем полученный галогенированный продукт можно обработать соответствующим аминовым соединением в растворителе, таком как ацетон, метанол, этанол, ТГФ, 1,4-диоксан или ацетонитрил, при подходящей температуре, предпочтительно, в пределах от комнатной температуры до температуры кипения растворителя, посредством чего можно получить соединение (I). В этой реакции аминирования карбонат калия, гидроксид натрия, триэтиламин или подобные вещества можно использовать подходящим образом в качестве основания, как это необходимо.
Соединение формулы (II) можно получить в соответствии со способом, описанным в японской выложенной патентной заявке № Sho-49-69677, Helvetica Chimica Acta, 54, Fasc. 1, 214-233 (1996), Helvetica Chimica Acta, 54, Fasc. 1, 277-282 (1971), WO 2005/003131, Японской патентной заявке № 2008-019121 и т.п.
Образование функциональных групп по ароматическому кольцу можно осуществить, подвергая соединение общей формулы (I), соединение общей формулы (II) или соединение общей формулы (III) или (IV), синтезированное с использованием реагента Гриньяра, указанного выше, реакции литиообразования с алкиллитиевым реагентом, реакции ацилирования Фриделя-Крафтса, реакции формилирования Вилсмейера или подобным. Кроме того, соединение, содержащее бромированное ароматическое кольцо, выбирают в качестве исходного вещества и подвергают реакции карбонилирования, реакции Хека, реакции цианирования, реакции формилирования, реакции Ульмана, реакции сочетания по методу Сузуки или подобным, с использованием или без катализатора на основе переходного металла, такого как палладий, посредством чего ароматическое кольцо может быть преобразовано таким образом, чтобы оно содержало желаемую функциональную группу. В таком типе реакции можно также использовать способ, описанный в J. Am. Chem. Soc., 124, 12557-12565 (2002), Tetrahedron Lett., 40, 8193-8195 (1991), или подобные.
Например, реакцию алкилирования можно осуществить путем обработки соединения, содержащего бромированное ароматическое кольцо, с использованием сложноэфирного производного, такого как этилацетат, трет-бутилацетат или этил изобутират, основания, такого как бутоксид калия, гидрид калия, LiHMDS (гексаметилдисилазид лития) или LiNCy2 (дициклогексиламид лития), и лиганда, такого как DPPF (1,1'-бис(дифенилфосфино)ферроцен), PPh3 (трифенилфосфин), P(o-Tol)3(трис(2-метилфенил)фосфин), P(t-Bu)3 (три-трет-бутилфосфин) или N,N'-(2,6-диизопропилфенил)дигидроимидазолийхлорид, в присутствии катализатора на основе переходного металла, такого как Pd(dba)2 (палладий(0) бис(дибензилиденацетон)), Pd2(dba)3 (дипалладий(0) трис(дибензилиденацетон)), Pd(OAc)2 (палладий(II) ацетат) или Pd(PPh3)4 (палладий(0)тетракис(трифенилфосфин)). Эту реакцию можно осуществить в растворителе, таком как толуол, бензол, пентан, циклогексан или смесь таких растворителей, при подходящей температуре, предпочтительно, в пределах от комнатной температуры до температуры кипения растворителя.
Представленное выше соединение общей формулы (I) также охватывает цис-транс изомерную смесь этого соединения, и эти изомеры можно разделить при помощи жидкостной хроматографии или методом избирательной кристаллизации с использованием или без подходящего противоиона. Например, в случае, когда используют высокоэффективную жидкостную хроматографию, разделение осуществляют с использованием смеси, подходящим образом сформулированной с органическим растворителем, таким как метанол или ацетонитрил, и водного раствора, к которому добавлена муравьиная кислота или трифторуксусная кислота, как требуется для конкретного случая, в качестве элюента.
Соединение, представленное общей формулой (I), указанной выше, включает, в случае, когда присутствует его фармацевтически приемлемая соль, различные типы солей такого соединения и включает, например, аддитивные соли с кислотой, такой как хлористоводородная кислота, щавелевая кислота, фумаровая кислота, п-толуолсульфоновая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, лимонная кислота, винная кислота, угольная кислота, азотная кислота или муравьиная кислота. Соли карбоксильной группы соединений также могут включать подходящие соли щелочных металлов натрия, калия, кальция и т.п. Эти соли можно получить из каждого соединения в свободной форме или путем преобразования обратимым образом, в соответствии с известным способом. Кроме того, в случае, когда соединения присутствуют в виде пространственного изомера, такого как цис-транс изомер, оптический изомер или координационный изомер, или гидрата или комплекса с металлом, настоящее изобретение охватывает любые из пространственных изомеров, гидратов и комплексных соединений.
Соединение по настоящему изобретению можно объединить с подходящим фармацевтическим носителем или разбавителем с получением лекарственного средства. Также соединение можно получить в виде препаратов любым традиционно используемым способом и соединения можно получить в виде композиций как средство для перорального введения, например, такого как таблетка, капсула, тонкодисперсный порошок или жидкость, или как средство для парентерального введения для подкожного введения, внутримышечного введения, интратекального введения или интраназального введения. Согласно рецептуре, соединение по настоящему изобретению можно использовать в форме его фармацевтически приемлемой соли и соединения можно использовать отдельно или в подходящем сочетании и, кроме того, в смеси с другим фармацевтически активным ингредиентом.
Препарат для перорального введения можно использовать непосредственно или в подходящей комбинации с подходящей добавкой, например, традиционным эксципиентом, таким как лактоза, маннит, кукурузный крахмал или картофельный крахмал, вместе со связующим, таким как кристаллическая целлюлоза, производное целлюлозы, аравийская камедь, кукурузный крахмал или желатин, разрыхлителем, таким как кукурузный крахмал, картофельный крахмал, калиевая соль карбоксиметилцеллюлозы, смазывающим веществом, таким как тальк или стеарат магния, и другой добавкой, такой как наполнитель, смачивающее вещество, буфер, консервант или отдушка и подобные, с получением таблетки, порошка, гранулы или капсулы.
Кроме того, соединение можно получить в виде препаратов в лекарственной форме, отличной от указанных выше, которая является оптимальной для лечения, в зависимости от типа заболевания и пациентов, включая, например, средства для наружного применения, такие как инъекции, суппозитории, препараты для ингаляций, аэрозоли, сиропы, инстилляции и мази и подобные.
Желаемая доза для соединения по настоящему изобретению варьирует в зависимости от субъекта, которому ее вводят, лекарственной формы, способа введения, периода времени, в течение которого осуществляют введение и подобных факторов. Для получения желаемого эффекта соединение по настоящему изобретению, как правило, можно вводить перорально в количестве от 0,5 до 1000 мг и, предпочтительно, от 1 до 500, в расчете на взрослого человека, в виде одной дозы или в виде нескольких введений в день. В случае парентерального введения (например, инъекции), суточная доза предпочтительно составляет от одной трети до одной десятой дозы для каждой из указанных выше доз.
ПРИМЕРЫ
Далее настоящее изобретение будет конкретно описано при помощи примеров, без намерения ограничить ими объем настоящего изобретения.
Температуру плавления определяли, помещая образец в стеклянную капиллярную пробирку и используя устройство для определения температуры плавления Yamato Scientific, Model MP-21. Не использовали никакую компенсацию на погрешность термометра. MS спектр измеряли при помощи POLARIS Q (Thermo Quest). 1H-ЯМР измеряли при помощи анализатора ядерного магнитного резонанса Model ARX500 (Bruker), при этом химический сдвиг при измерении в дейтерированном органическом растворителе выражали в м.д., с использованием TMS в качестве внутреннего стандарта (δ=0 м.д.). Также, при измерении в дейтерированной воде использовали пик, соответствующий воде при 4,67 м.д., в качестве внутреннего стандарта. Колоночную хроматографию на силикагеле осуществляли с использованием силикагеля PSQ 100B или NH-DM1020 для хроматографии (FUJI SILYSIA CHEMICAL LTD.). Тонкослойную хроматографию осуществляли с использованием силикагеля F254 (Merck, No. 5715) или ТСХ пластины NH (FUJI SILYSIA CHEMICAL LTD.) и детекцию осуществляли с использованием УФ лампы и реагента для проявления цвета 5% фосфомолибденовой кислоты-этанол. Разделение геометрических изомеров осуществляли при помощи высокоэффективной жидкостной хроматографии, с использованием 880-PU (Nippon Bunko) в качестве насоса для подачи жидкости, 875-UV (Nippon Bunko) в качестве детектора и STR PREP-ODS (20 мм в.д. × 250 мм) (Shinwa Kako) в качестве препаративной колонки.
Пример 1
Получение этил 3-(4-оксо-9,10-дигидро-4H-3-тиабензо[f]азулен-2-ил)акрилата
Триэтиламин (34 мл), этилакрилат (27,5 мл), ацетат палладия (0,4 г) и P(o-Tol)3 (1,5 г) добавляли к DMF (50 мл) раствору 2-бром-9,10-дигидро-3-тиабензо[f]азулен-4-она (7,00 г) и смесь перемешивали в течение ночи при 80°C в атмосфере аргона. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, смесь экстрагировали этилацетатом и органический слой затем промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии на силикагеле (хлороформ-метанол = 9:1) с получением 6,39 г (85%) указанного в заголовке соединения в виде аморфного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,26 (т, J=7,1 Гц, 3H), 3,10-3,19 (м, 4H), 4,19 (кв., J=7,1 Гц, 2H), 6,55 (д, J=16,1 Гц, 1H), 7,40-7,44 (м, 2H), 7,55-7,59 (м, 2H), 7,80-7,82 (м, 1H), 8,59 (с, 1H).
Пример 2
Получение гидрохлорида этил (E,Z)-3-[4-(3-диметиламинопропилиден)-9,10-дигидро-4H-3-тиабензо[f]азулен-2-ил]акрилата [Соединение 1]
1,6 моль/л раствора н-бутиллития в гексане (42 мл) добавляли к ТГФ (100 мл) раствору гидробромида диметиламинопропилтрифенилфосфония (23,5 г) при охлаждении льдом и смешанный раствор перемешивали при комнатной температуре в течение 1 часа. ТГФ (100 мл) раствор соединения, полученного в Примере 1 (6,11 г), добавляли к этому раствору и смесь продолжали перемешивать в течение ночи. Растворитель отгоняли при пониженном давлении, к остатку добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на силикагеле (хлороформ-метанол = 9:1), полученный очищенный продукт растворяли в 1,4-диоксане (20 мл), добавляли 4 моль/л раствора хлористый водород-диоксан (1,1 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Растворители отгоняли при пониженном давлении и осажденные кристаллы отфильтровывали и сушили с получением 0,51 г (6%) указанного в заголовке соединения в виде смеси E-формы и Z-формы.
Пример 3
Получение трет-бутил (E,Z)-[4-(3-диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]ацетата
Раствор 1,6 моль/л н-бутиллитий-гексан (14 мл) добавляли по каплям к гексаметилдисилазану (3,53 г) в атмосфере аргона при охлаждении льдом. К этому раствору добавляли по каплям трет-бутилацетат (1,2 мл) и перемешивали в течение 30 минут. Добавляли Pd(dba)2 (0,30 г), N,N'-(2,6- диизопропилфенил)дигидроимидазолинийхлорид (0,22 г) и (E,Z)-[3-(6-бром-10H-9-оксо-3-тиабензо[f]азулен-4-илиден)пропил]диметиламин (2,01 г) и смесь нагревали до комнатной температуры и перемешивали в течение ночи. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии на силикагеле (гексан-этилацетат = 19:1) с получением 0,80 г (36%) указанного в заголовке соединения в виде маслянистого продукта, представляющего собой смесь E-формы и Z-формы.
MS (EI): m/z 400 [M++1]. 1H-ЯМР (ДМСО-d6) δ: 1,35-1,42 (м, 9H), 2,07-2,66 (м, 10H), 3,51-3,55 (м, 2H), 5,05-5,12 (м, 2H), 5,84-6,06 (м, 1H), 6,77-7,53 (м, 5H).
Пример 4
Получение (E,Z)-[4-(3-диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусной кислоты
Трифторуксусную кислоту (2,0 мл) постепенно добавляли к соединению, полученному в Примере 3 (1,53 г), и смесь перемешивали при комнатной температуре в течение 2 часов. Трифторуксусную кислоту отгоняли при пониженном давлении, к остатку добавляли 5% водный раствор карбоната калия, pH раствора затем доводили до 7 при помощи разбавленной хлористоводородной кислоты и раствор экстрагировали хлороформом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением 1,20 г (91%) указанного в заголовке соединения в виде маслянистого продукта, представляющего собой смесь E-формы и Z-формы.
Пример 5
Получение (E)-[4-(3-диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусной кислоты [Соединение 19] и (Z)-[4-(3-диметиламинопропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил]уксусной кислоты [Соединение 20]
Соединение, полученное в Примере 4 (1,20 г), растворяли в 30 мл смешанного раствора 0,2% водный раствор муравьиной кислоты/метанол и пробу раствора, отфильтрованного при помощи 0,45 мкм мембранного фильтра, выделяли и очищали при помощи высокоэффективной жидкостной хроматографии (элюент: смешанный раствор, представляющий собой 0,2% раствор муравьиной кислоты/метанол (3:2)). Скорость потока составляла 6,5 мл/минута, и длина волны измерения составляла 254 нм. Соединение 19 элюировали в интервале 20 минут - 24 минуты и соединение 20 элюировали в интервале 15 минут - 18 минут. Растворители каждого из собранных элюатов отгоняли при пониженном давлении и осажденные белые кристаллы отфильтровывали и сушили с получением 00,0,53 г (44%) и 0,28 г (23%) соединения 19 и соединения 20, соответственно.
Пример 6
Получение метил (4-циклопропил-4-гидрокси-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил)ацетата
Безводный ТГФ (50 мл) раствор бромциклопропана (8,3 мл) добавляли по каплям к металлическому магнию (2,5 г) при нагревании. После завершения добавления по каплям к смеси добавляли безводный ТГФ (20 мл) и смесь подвергали нагреванию до температуры кипения с обратным холодильником еще в течение 2 часов. Затем реакционную смесь оставляли на воздухе для охлаждения и этот раствор добавляли по каплям к безводному ТГФ (30 мл) раствору метил (4-оксо-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил)ацетата (10,0 г), предварительно охлажденному на ледяной бане. После перемешивания смеси в течение 30 минут к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворители отгоняли при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии на силикагеле (гексан-этилацетат = 5:1) с получением 9,0 г (79%) указанного в заголовке соединения в виде маслянистого продукта.
1H-ЯМР (ДМСО-d6) δ: 0,16-0,18 (м, 1H), 0,29-0,31 (м, 1H), 0,44-0,47 (м, 1H), 0,60-0,62 (м, 1H), 1,74-1,78 (м, 1H), 3,60-3,65 (м, 5H), 4,78 (д, J=15,4 Гц, 1H), 5,36 (д, J=15,4 Гц, 1H), 6,10 (с, 1H), 6,72-6,73 (м, 1H), 7,07-7,51 (м, 4H).
Пример 7
Получение метил (E,Z)-[4-(3-бромпропилиден)-4,10-дигидро-9-окса-3-тиабензо[f]азулен-6-ил)ацетата
Дихлорметановый (20 мл) раствор триметилсиланбромида (3,6 мл) добавляли по каплям к дихлорметановому (100 мл) раствору соединения, полученного в Примере 6 (9,0 г), при комнатной температуре для осуществления реакции бромирования. После перемешивания смеси в течение 1 часа добавляли насыщенный водный раствор гидрокарбоната натрия и органическому слою давали отделиться. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. Растворители отгоняли при пониженном давлении и затем полученный остаток очищали при помощи колоночной хроматографии на силикагеле (гексан-этилацетат = 9:1) с получением 9,3 г (87%) указанного в заголовке соединения в виде маслянистого продукта, представляющего со