Кристаллический d-изоглутамил-d-триптофан и моноаммонийная соль d-изоглутамил-d-триптофана
Иллюстрации
Показать всеПредлагается способ получения чистого кристаллического D-изоглутамил-D-триптофана, включающий стадию снятия защиты с по существу чистого N-трет-бутоксикарбонил-D-изоглутамил-D-триптофана или его диэфира с получением по существу чистого D-изоглутамил-D-триптофана. Предлагается аморфная аммонийная соль D-изоглутамил-D-триптофана (1:1). Также предлагается способ получения чистой моноаммонийной соли D-изоглутамил-D-триптофана из по существу чистого N-трет-бутоксикарбонил-D-изоглутамил-D-триптофана. Заявлено соединение H-D-Glu-(γ-D-Trp-OR2)-α-OR1
и его фармацевтически приемлемые кислотно-аддитивные соли. Также заявлена твердая фармацевтическая композиция и ее применение в качестве иммунодепрессанта или средства против псориаза, 21 н. и 30 з.п. ф-лы, 14 пр., 8 ил., 1 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к новой стабильной кристаллической форме D-изоглутамил-D-триптофана и способу ее выделения в чистой форме, свободной от неорганических солей. Данное изобретение также относится к новой стабильной аммонийной соли D-изоглутамил-D-триптофана и способу ее получения в чистой форме кристаллизацией и/или традиционной хроматографией на колонке с силикагелем.
УРОВЕНЬ ТЕХНИКИ
D-Изоглутамил-D-триптофан (также известный как H-D-iGlu-Trp-OH или тимодепрессин [Thymodepressin]) представляет собой синтетический геморегуляторный дипептид, созданный для лечения аутоиммунных заболеваний, в том числе псориаза (Sapuntsova, S. G., et al. (May 2002), Bulletin of Experimental Biology and Medicine, 133(5), 488-490). Тимодепрессин считается в России эффективным средством для лечения псориаза (патент США 5736519), где лекарственное средство на данное время присутствует на рынке как динатриевая соль в жидком препарате для инъекционного и интраназального введения. Он представляет собой иммунодепрессант и избирательно ингибирует пролиферацию клеток костного мозга, таким образом, вызывая угнетение иммунитета.
Известная твердая форма динатриевой соли D-изоглутамил-D-триптофана представляет собой аморфный порошок, который является гигроскопическим и очень сложным в обращении с технологической точки зрения. Структура динатриевой соли тимодепрессина описана в Kashirin, D. M., et al. (2000), Pharmaceutical Chemistry Journal, 34(11), 619-622. Мононатриевая соль D-изоглутамил-D-триптофана идентифицирована Службой Chemical Abstracts (CAS) и приведена в реестрах CAS REGISTRYSM, но отсутствуют публикации относительно ее получения и физических свойств. Порошковая или аморфная форма соединения, такого как D-изоглутамил-D-триптофан, предназначенного для фармацевтического применения, может создавать производственные проблемы за счет проблем с насыпной плотностью, гигроскопичностью и варьирующим содержанием воды, которое не может быть отрегулировано сушкой под вакуумом. D-Изоглутамил-D-триптофан представляет собой дипептид, и сушка аморфной формы при повышенной температуре, например 80-100°C, под вакуумом не рекомендуется.
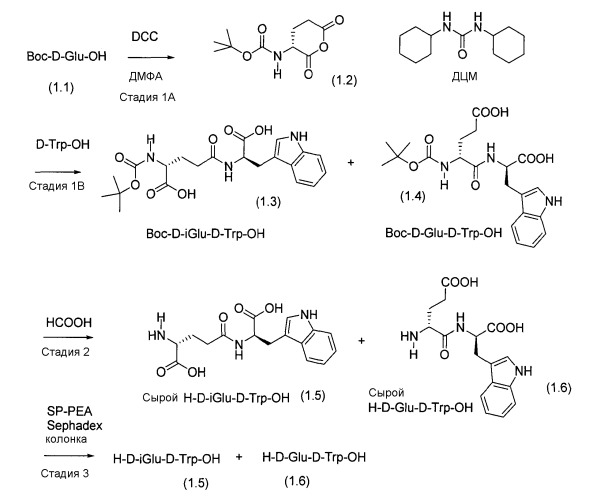
Единственный путь синтеза H-D-iGlu-D-Trp-OH, известный из литературы, раскрыт в патенте США 5736519. В соответствии со способом, приведенным в Примере 1 патента США 5736519, изображенным в данном описании как Схема 1, Boc-D-Glu-OH (1.1) реагирует с 1,3-дициклогексилкарбодиимидом (ДЦК) с образованием циклического ангидрида (1.2). После удаления дициклогексилмочевины (ДЦМ, DCU) фильтрацией, ангидрид (1.2) реагирует с H-D-Trp-OH с образованием смеси дипептида Boc-D-iGlu-D-Trp-OH (1.3) и Boc-D-Glu-D-Trp-OH (1.4). Объединенный выход сырых Boc-D-iGlu-D-Trp-OH (1.3) и Boc-D-Glu-D-Trp-OH (1.4) составляет 70%. Однако смесь содержит только не более 35% целевого промежуточного соединения Boc-D-iGlu-D-Trp-OH (1.3). Защитную группу Boc удаляют, перемешивая растворы (1.3) и (1.4) в муравьиной кислоте как растворителе при температуре 40°C в течение 1 часа. Отношение (1.3) и (1.4) к муравьиной кислоте составляет приблизительно 1 г:8 мл (масс./об.). Продукт представляет собой смесь H-D-iGlu-D-Trp-OH (1.5) и H-D-Glu-D-Trp-OH (1.6). Поскольку пептиды (1.5) и (1.6) выделяют в равном количестве, очистка требует ионообменной хроматографии с использованием пиридинового ацетатного буфера. Выход целевого продукта H-D-iGlu-D-Trp-OH (1.5) составляет 35% от количества Boc-D-iGlu-D-Trp-OH (1.3). Таким образом, общий выход H-D-iGlu-D-Trp-OH (1.5) от количества Boc-D-Glu-OH составляет 12,25%.
Схема 1: Синтез H-D-iGlu-D-Trp-OH в соответствии с патентом США 5736519.
Способу, описанному в патенте США 5736519, свойственны несколько недостатков, как указано ниже:
1. ДЦК на стадии 1A может приводить к образованию других побочных продуктов, таких как
О побочных продуктах в результате соединения пептидов с ДЦК сообщалось в Marder, О., и Albericio, F. (июнь 2003), Chemical Oggi (Chemistry Today), 6-32.
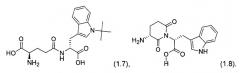
2. Снятие защиты с Boc-D-iGlu-D-Trp-OH (1.3) требует повышенной температуры, и конечная очистка H-D-iGlu-D-Trp-OH требует крайне токсичного растворителя пиридина. Повышенная температура в ходе снятия защиты с (1.3) может приводить к образованию N-трет-бутилиндольного производного (1.7) как примеси (Löw, M., et. al. (1978), Hoppe-Seyler's Z. Physiol. Chem., 359(12):1643-51). Кроме того, пептид может циклизоваться с образованием глутаримида (1.8) (Pandit, U.K. (1989), Pure & Appl. Chem., Vol. 61, No. 3, pp. 423-426).
3. В ходе реакции соединения образуется только смесь Boc-D-iGlu-D-Trp-OH (1.3) и Boc-D-Glu-D-Trp-OH (1.4) в соотношении 1:1. Максимальный выход (1.3) не может превышать 50% на стадии соединения 1B. Смесь D-Glu-D-Trp-OH и D-iGlu-D-Trp-OH образуется в конце синтеза. Пептиды необходимо отделять ионообменной хроматографией и препаративной обращенно-фазовой высокоэффективной жидкостной хроматографией (ВЭЖХ). Общий выход H-D-iGlu-D-Trp-OH (1.5) составляет 12,25%, а очистка препаративной ВЭЖХ представляет собой очень длительный и неэффективный процесс. Время удерживания для двух подобных изомеров, H-D-iGlu-D-Trp-OH (1.5) и H-D-Glu-D-Trp-OH (1.6), не приведено. Повторные циклы выделения для повышения чистоты целевого изомера (1.5) являются очень неэффективными. Данный способ не может быть адаптирован к крупномасштабному производству.
4. Противоположный диастереомер L-изоглутамил-L-триптофана (также известный как H-L-iGlu-L-Trp-OH или Бестим [Bestim]) представляет собой иммуностимулятор (см. патент США 5774452). Бестим применяют в лечении язв. Он уменьшает воспалительные явления в желудке и слизистой оболочке двенадцатиперстной кишки и вызывает регресс клинических симптомов и рубцевание язвы (Tkacheva, А., et al. (2004), Eksp Klin Gastroenterol. (6):29-33, 163).
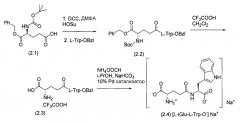
Синтез мононатриевой соли H-L-iGlu-L-Trp-OH (1:1) показан на Схеме 2 (патент США 5744452).
Схема 2: Синтез [L-iGlu-L-Trp-O-]Na+ в соответствии с патентом США 5744452.
В способе из патента США 5744452 на стадии 1 как побочный продукт образуется дициклогексилмочевина, которая должна быть удалена фильтрацией. Заявлено, что на второй стадии трифторуксусная кислота удаляет γ-o-бензиловый эфир с фрагмента глутаминовой кислоты (2.2). Бензиловый эфир (2.3) удаляется гидрированием с помощью аммония формиата в качестве донора водорода, палладиевого катализатора, натрия бикарбоната в изопропаноле при повышенной температуре с образованием мононатриевой соли H-L-iGlu-L-Trp-OH (2.4). Твердофазный синтез (2.4) также описан в указанном патенте, но триптофановый фрагмент должен быть защищен как формамид, и позже защита должна быть снята. Другие диастереомеры, L-изоглутамил-D-триптофан и D-изоглутамил-L-триптофан, также представляют собой известные соединения (патент США 5916878).
Синтез H-D-iGlu-L-Trp-OH, и H-L-iGlu-D-Trp-OH приведен на Схеме 3 и Схеме 4 соответственно (патент США 5916878).
Схема 3: Синтез H-D-изоглутамил-L-триптофана в соответствии с патентом США 5916878.
Схема 4: Синтез H-L-изоглутамил-D-триптофана в соответствии с патентом США 5916878.
Способы, приведенные на Схемах 2, 3 и 4, могут обеспечить синтез региоспецифичного гамма-амидного продукта (2.2), (3.2) и (4.2) без образования альфа-амидного продукта, но они включают стадию гидрирования в ходе удаления бензилового эфира в соединениях (2.3), (3.2) и (4.2). Это требует использования большого количества палладиевого катализатора. Второй аспект касается частичного восстановления индольного кольца в производственном масштабе. Третий аспект касается образования глутаримида, 2-(3-амино-2,6-диоксо-пиперидин-1-ил)-3-(1H-индол-3-ил)пропионовой кислоты, в процессе гидрирования. Четвертый аспект касается стоимости. Стоимость производного CBz-Glu-OBzl, такого как (3.1) и (4.1), почти вдвое превышает цену соответствующего Boc-Glu-OBzl при производстве с помощью технологий тонкого химического синтеза. Способы на схемах 3 и 4 требуют очистки конечного продукта методом ВЭЖХ. Значение выхода составляет 33% и 35,9% соответственно. Схема 2 требует использования трифторуксусной кислоты, которая вводит другие примеси в реакцию. Кроме того, в способе на Схеме 2 используют дициклогексилкарбодиимид как пептидный конденсирующий агент. Удаление следовых количеств примесей из этого реактива представляет собой серьезную проблему в химическом производстве. Технология, таким образом, не может быть адаптирована к промышленному производству и также не может быть адаптирована для крупномасштабного производства H-D-изоглутамил-D-триптофана.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение касается новой стабильной кристаллической формы D-изоглутамил-D-триптофана и способа выделения указанного соединения в чистой форме, свободной от неорганических солей, осаждением из воды, без препаративной обращенно-фазовой высокоэффективной жидкостной хроматографии. Способ предназначен для получения чистого N-трет-бутоксикарбонил-D-изоглутамил-D-триптофана и его диэфира, свободного от N-трет-бутоксикарбонил-D-глутамил-D-триптофана, и превращения N-трет-бутоксикарбонил-D-изоглутамил-D-триптофана и его диэфира в чистый кристаллический D-изоглутамил-D-триптофан. Новый кристаллический D-изоглутамил-D-триптофан по данному изобретению легко очищать. В сравнении со способами из уровня техники, описанными выше, данное изобретение предлагает целый ряд преимуществ, как указано ниже.
Во-первых, D-изоглутамил-D-триптофан получают в кристаллической форме без применения препаративной высокоэффективной жидкостной хроматографии.
Во-вторых, ключевое промежуточное соединение Boc-D-iGlu-D-Trp-OH или соль H-D-Glu-(γ-D-Trp-OMe)-α-OBzl HCl получают с высоким выходом и высокой чистотой.
В-третьих, предложен способ превращения Boc-D-iGlu-D-Trp-OH и его диэфира или H-D-Glu-(γ-D-Trp-OMe)-α-OBzl HCl соли в D-изоглутамил-D-триптофан с высоким выходом и высокой чистотой.
В-четвертых, чистая кристаллическая форма D-изоглутамил-D-триптофана по данному изобретению неизвестна из предыдущего уровня техники. Она может применяться непосредственно в форме жидкого препарата с коррекцией pH, что устраняет потребность в использовании чрезвычайно гигроскопической и нестабильной динатриевой соли D-изоглутамил-D-триптофана.
Данное изобретение также касается новой стабильной аммонийной соли D-изоглутамил-D-триптофана и способа ее получения из N-трет-бутоксикарбонил-D-изоглутамил-D-триптофана, а также выделения такого соединения в чистой форме кристаллизацией и/или традиционной хроматографией на колонке с силикагелем.
Моноаммонийная соль D-изоглутамил-D-триптофана представляет собой стабильное твердое вещество, пригодное для дозирования с целью получения препаративных форм. Предлагается график идентификации состава для идентификации форм соли при разных значениях pH.
Новый способ получения D-изоглутамил-D-триптофана и аммонийной соли D-изоглутамил-D-триптофана (1:1) позволяет избежать вышеописанных производственных проблем и делает возможным выделение и обработку тимодепрессина и моноаммонийной соли тимодепрессина в традиционном оборудовании для химических процессов.
Объект данного изобретения - предложить пригодный способ производства D-изоглутамил-D-триптофана, который давал бы субстанцию лекарственного средства, полностью свободную от других диастереомеров, как обсуждалось выше, и способность материала сохранять стабильную форму в течение длительного периода хранения до введения в препарат.
Другой объект данного изобретения - предложить D-изоглутамил-D-триптофан, свободный от альфа-амидного изомера D-глутамил-D-триптофана.
Другой объект данного изобретения - предложить способ получения чистого D-изоглутамил-D-триптофана (H-D-iGlu-D-Trp-OH) из кислотно-аддитивной соли H-D-iGlu-D-Trp-OH, что дает продукт, по существу или полностью свободный от остатков органических растворителей и не требующий очистки обращенно-фазовой высокоэффективной жидкостной хроматографией. Твердый D-изоглутамил-D-триптофан выделяют из воды.
Другой объект данного изобретения - предложить способ получения чистого D-изоглутамил-D-триптофана (H-D-iGlu-D-Trp-OH) из основно-аддитивной соли H-D-iGlu-D-Trp-OH, который дает продукт, по существу или полностью свободный от остатков органических растворителей и не требующий очистки обращенно-фазовой высокоэффективной жидкостной хроматографией. Твердый D-изоглутамил-D-триптофан выделяют из воды.
Другой объект данного изобретения - предложить способ, в результате которого образуется D-изоглутамил-D-триптофан, по существу свободный от загрязняющих веществ в форме неорганических солей.
Другой объект данного изобретения - получение кристаллического D-изоглутамил-D-триптофана с порошковой рентгенограммой (XRPD), как показано на фиг. 1.
Другой объект данного изобретения - получение моноаммонийной соли D-изоглутамил-D-триптофана из кислотно-аддитивной соли D-изоглутамил-D-триптофана, что дает продукт, по существу или полностью свободный от остатков органических растворителей и не требующий очистки обращенно-фазовой высокоэффективной жидкостной хроматографией. Твердую аммонийную соль D-изоглутамил-D-триптофана выделяют из изопропанола и аммиака после обработки ионообменной смолой для удаления неорганических солей.
Другой объект изобретения - продуцирование моноаммонийной соли D-изоглутамил-D-триптофана с XRPD, представленной на фиг. 2.
Другой объект данного изобретения - получение аморфной моноаммонийной соли D-изоглутамил-D-триптофана, которая по существу характеризуется ИК-спектром с Фурье-преобразованием (ИК-ФП), показанным на фиг. 5.
Другой объект данного изобретения - предложить способ получения моноаммонийной соли D-изоглутамил-D-триптофана, по существу свободной от загрязняющих веществ в форме неорганических солей.
Другой объект данного изобретения - предложить способ получения кислотно-аддитивной соли, H-D-iGlu-D-Trp-OH, в частности гидрохлорида, из чистого Boc-D-iGlu-D-Trp-OH.
Другой объект данного изобретения - предложить способ получения чистого дипептида Boc-D-iGlu-D-Trp-OH без хроматографического выделения.
Другой объект данного изобретения - предложить простой способ хроматографического выделения на колонке с силикагелем для очистки D-изоглутамил-D-триптофана и его моноаммонийной соли.
Другой объект данного изобретения - предложить график идентификации состава для определения интервала pH для выделения D-изоглутамил-D-триптофана и его одновалентной моносоли. Доминирующий интервал pH для осаждения D-изоглутамил-D-триптофана из воды составляет от приблизительно 2,5 до приблизительно 3,0.
Кислотно-аддитивную соль D-изоглутамил-D-триптофана получают из дипептида Boc-D-iGlu-D-Trp-OH, образующегося в результате оснόвного гидролиза соединения формулы I:
,
где R1 выбран из группы, состоящей из C1-C4 алкила и бензила, и R2 представляет собой C1-C4 алкил, при условии что C4 алкил не является трет-бутилом,
с помощью гидроксида металла в воде и инертном растворителе в присутствии метанола с образованием Boc-D-iGlu-D-Trp-OH, свободного от других диастереомеров. Гидроксид металла выбирают из группы, состоящей из гидроксида лития, гидроксида натрия и гидроксида калия.
Соединение формулы I, в свою очередь, получают в результате пептидной конденсации Boc-D-Glu(OH)-OR1 и D-Trp-OR2, где R1 и R2 являются такими, как определено выше, с пептидными конденсирующими реагентами, такими как HOBt и ЭДК. Такой способ синтеза Boc-D-iGlu-D-Trp-OH обеспечивает значительные преимущества по сравнению с предыдущим уровнем техники, представленным в патенте США 5736519, поскольку продукт представляет собой исключительно гамма-пептидный продукт Boc-D-iGlu-D-Trp-OH, и альфа-пептидный продукт Boc-D-Glu-D-Trp-OH не может образоваться в ходе синтеза, поскольку используется Boc-D-Glu(OH)-OR1.
Снятие защиты с чистого дипептида Boc-D-iGlu-D-Trp-OH с помощью кислоты, такой как хлороводородная кислота, трифторуксусная кислота, дает кислотно-аддитивную соль. pH раствора кислотно-аддитивной соли составляет от приблизительно 2,5 до приблизительно 3,0 с получением тимодепрессина в виде твердого осадка.
Альтернативно кислотно-аддитивная соль может быть преобразована в аммонийную соль путем обработки водного раствора материала ионообменной хроматографией со смолой на основе сульфоновой кислоты. При удалении соли элюированием с использованием воды ионообменную смолу промывают смесью аммиака и изопропанола для получения сырой аммонийной соли, которую перекристаллизуют из изопропанола и воды с получением чистой моноаммонийной соли.
Раствор основно-аддитивной соли D-изоглутамил-D-триптофана получают путем снятия защиты с помощью кислоты, в частности снятия защиты с помощью HCl, из соединения формулы I, где каждый из R1 и R2 независимо выбран из группы, состоящей из C1-C4 алкила и бензила, с получением кислотно-аддитивной соли диэфира H-D-Glu-(γ-D-Trp-OR2)-α-OR1, которую далее обрабатывают гидроксидом металла в воде и инертном растворителе в присутствии метанола с образованием основно-аддитивной соли H-D-iGlu-D-Trp-OH. Гидроксид металла выбирают из группы, состоящей из гидроксида натрия, гидроксида лития и гидроксида калия. Экстракция растворителем, не смешивающимся с водой, удаляет органическую примесь в органическую фазу; водную фракцию отделяют и доводят pH до значений от приблизительно 6 до приблизительно 7 с помощью гидроксида металла. После выпаривания растворителя для уменьшения количества растворителя до соотношения растворенного вещества и растворителя менее чем приблизительно 1:8, где растворенное вещество представляет собой пептид D-изоглутамил-D-триптофан в форме основно-аддитивной соли, pH полученного раствора основно-аддитивной соли составляет от приблизительно 2,5 до приблизительно 3,0 с помощью неорганической кислоты, чтобы вызвать осаждение D-изоглутамил-D-триптофана.
Хотя не предусматривается ограничения каким-либо способом контекста и практики данного изобретения теорией или способом практики изобретения и его возможными объяснениями, считается, что при pH от приблизительно 2,5 до приблизительно 3,0 график идентификации состава на фиг. 7 и фиг. 8 показывает, что основными формами тимодепрессина являются свободный пептид (H-D-iGlu-D-Trp-OH) и одновалентная соль. Поскольку растворимость H-D-iGlu-D-Trp-OH в воде, не содержащей органических растворителей, невысока (растворимость в воде <23 мг/мл), соединение осаждается из раствора в чистой форме. XRPD материала показана на фиг. 1.
При производстве моноаммонийной соли раствор тимодепрессина при pH от приблизительно 6,0 до приблизительно 8,0 очищают ионным обменом для удаления соли. Регенерирующий раствор на основе аммиака дает чистую моноаммонийную соль после кристаллизации из изопропанола и воды. Хотя можно допускать, что моноаммонийная соль является неустойчивой и может снова превращаться в свободный дипептид, на практике соединение фактически сохраняет стабильность в течение более двух лет. Заявителем изобретена моноаммонийная соль тимодепрессина, которая представляет собой стабильный новый химический объект, который может легко кристаллизоваться из изопропанола и воды. Свойства полученного кристаллического материала показаны на фиг. 2.
Упомянутые выше способы дают чистый тимодепрессин и моноаммонийную соль без обращенно-фазовой ВЭЖХ в промышленных масштабах, но тимодепрессин и моноаммонийная соль могут быть очищены традиционной хроматографией на колонке с силикагелем с использованием указанных выше условий. Таким образом, вместо отбрасывания порции тимодепрессина в маточном растворе кристаллизации по желанию фильтрат может быть упарен и дополнительно очищен хроматографией на колонке с силикагелем.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Кристаллические соли по данному изобретению описаны в Примерах ниже.
Фиг. 1 представляет график XRPD кристаллического D-изоглутамил-D-триптофана. Параметры XRPD также могут быть представлены в значениях межплоскостных расстояний d, угла Брэгга 2θ и относительной интенсивности (выраженной как процентное содержание по отношению к наиболее интенсивной линии), как показано ниже.
| Угол [°2θ] | Значение d [Å] | Относительная интенсивность [%] |
| 6,67 | 13,239 | 3 |
| 11,09 | 7,975 | 4,4 |
| 11,77 | 7,515 | 1,2 |
| 13,29 | 6,655 | 4 |
| 14,26 | 6,205 | 11,3 |
| 15,58 | 5,685 | 33,3 |
| 16,81 | 5,269 | 28,9 |
| 17,27 | 5,13 | 30,4 |
| 18,35 | 4,832 | 12,2 |
| 18,87 | 4,7 | 95,8 |
| 20,05 | 4,424 | 63,6 |
| 20,9 | 4,247 | 33,2 |
| 22,03 | 4,032 | 17,1 |
| 22,88 | 3,884 | 100 |
| 23,74 | 3,744 | 97,9 |
| 24,54 | 3,625 | 41,9 |
| 25,44 | 3,499 | 20,3 |
| 25,69 | 3,465 | 12,1 |
| 26,31 | 3,384 | 16,4 |
| 27 | 3,3 | 27,4 |
| 27,75 | 3,212 | 24,9 |
| 28,18 | 3,164 | 19,3 |
| 28,79 | 3,099 | 6,8 |
| 29,13 | 3,063 | 6,2 |
| 29,91 | 2,985 | 79,2 |
| 31,04 | 2,879 | 8,6 |
| 31,49 | 2,839 | 33,7 |
| 32,54 | 2,749 | 4,4 |
| 33,29 | 2,689 | 9,3 |
| 33,97 | 2,637 | 10,5 |
| 34,99 | 2,562 | 17,3 |
| 35,54 | 2,524 | 21,8 |
| 36,14 | 2,483 | 5,1 |
| 36,74 | 2,444 | 5,9 |
| 37,35 | 2,406 | 7,7 |
| 38,31 | 2,348 | 25,6 |
| 39,01 | 2,307 | 20,3 |
Образцы порошка получены обычной техникой фронтальной упаковки и проанализированы на системе дифрактометра D8 Discovery с источником Cu-kα, действующим в режиме 45 кВ/45 мА. Система оборудована 2D-пропорциональным детектором площади (GADDS). Экспериментальные данные были получены на двух фреймах с контактом 600 сек для каждого, что охватывало интервал 3o-35o (2θ). Полученные 2D дифракционные изображения далее были интегрированы для получения стандарта, I против 2θ, характера дифракции. Данные обрабатывали с помощью разнообразного программного обеспечения для обработки данных Bruker AXS, в том числе: Eva™ 8.0 и Topas™, версия 2.1 (для анализа аппроксимации профиля и при необходимости масштабирования).
Фиг. 2 представляет собой XRPD кристаллической моноаммонийной соли D-изоглутамил-D-триптофана. Параметры XRPD могут также быть представлены в терминах межплоскостных расстояний d, угла Брэгга 2θ и относительной интенсивности (выраженной как процентное содержание по отношению к наиболее интенсивной линии), как указано ниже:
| Угол [°2θ] | Значение d [ Å] | Относительная интенсивность [%] |
| 9,29 | 9,517 | 4,1 |
| 12,19 | 7,258 | 4,5 |
| 13,93 | 6,354 | 76,2 |
| 15,17 | 5,837 | 27,4 |
| 16,49 | 5,371 | 9,8 |
| 17,18 | 5,157 | 3 |
| 18,56 | 4,778 | 31,6 |
| 18,88 | 4,696 | 10,5 |
| 20,02 | 4,431 | 100 |
| 22,28 | 3,986 | 3 |
| 23,31 | 3,814 | 4,6 |
| 23,66 | 3,757 | 9,8 |
| 24,03 | 3,7 | 52,9 |
| 24,37 | 3,649 | 26,3 |
| 25,07 | 3,549 | 11,4 |
| 25,61 | 3,475 | 5,6 |
| 25,96 | 3,43 | 5 |
| 27,62 | 3,227 | 29,7 |
| 28,12 | 3,17 | 55,7 |
| 28,49 | 3,131 | 12,2 |
| 29,52 | 3,023 | 23,1 |
| 30,27 | 2,951 | 3,7 |
| 30,64 | 2,915 | 7,9 |
| 31,31 | 2,854 | 11,8 |
| 31,7 | 2,821 | 29,6 |
| 32,16 | 2,781 | 19,2 |
| 32,81 | 2,728 | 16 |
| 33,78 | 2,652 | 7,4 |
| 34,14 | 2,625 | 5,1 |
| 35,76 | 2,509 | 16 |
| 36,94 | 2,431 | 11,6 |
| 37,58 | 2,391 | 25,6 |
| 38,03 | 2,364 | 12,5 |
| 39,22 | 2,295 | 1,9 |
Спектры порошковой рентгенограммы для D-изоглутамил-D-триптофана и его аммонийной соли показаны на фиг. 1 и фиг. 2 ниже. Следует понимать, что значения 2 тета для графика порошковой рентгенограммы могут несколько варьировать от одного прибора к другому или от одного образца к другому, то есть приведенные значения не должны рассматриваться как абсолютные.
Фиг. 3 представляет XRPD аморфной формы D-изоглутамил-D-триптофана.
Фиг. 4 представляет характерный спектр поглощения в инфракрасной (ИК) области кристаллической моноаммонийной соли D-изоглутамил-D-триптофана.
Фиг. 5 представляет характерный спектр поглощения в инфракрасной (ИК) области аморфной моноаммонийной соли D-изоглутамил-D-триптофана.
Фиг. 6 представляет характерный спектр поглощения в инфракрасной (ИК) области кристаллического D-изоглутамил-D-триптофана.
Фиг. 7 иллюстрирует вычисление идентификации состава дипептида H-D-iGlu-D-Trp-OH и его соли с использованием значений pKa для кислотных и аминных групп. LH2 представляет собой форму двухосновной кислоты пептида H-D-iGlu-D-Trp-OH, LH представляет собой соль монокарбоновой кислоты H-D-iGlu-D-Trp-OH. Примером LH является моноаммонийная соль. L обозначает форму двухосновной соли, и ее примером является динатриевая соль пептида H-D-iGlu-D-Trp-OH.
Фиг. 8 иллюстрирует вычисление идентификации состава дипептида H-D-iGlu-D-Trp-OH и его соли с использованием экспериментально определенных значений pKa для кислотных и аминных групп. LH2 представляет собой форму двухосновной кислоты пептида H-D-iGlu-D-Trp-OH, LH представляет собой соль монокарбоновой кислоты H-D-iGlu-D-Trp-OH. Примером LH является моноаммонийная соль. L обозначает форму двухосновной соли, и ее примером является динатриевая соль пептида H-D-iGlu-D-Trp-OH.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном описании термин “Boc-D-Glu(OH)-OR1” обозначает структуру:
если R1 представляет собой бензил, то с химической точки зрения соединение представляет собой альфа-бензиловый эфир 2-трет-бутоксикарбониламино-D-глутаминовой кислоты.
В данном описании термин “D-Trp-OR2” обозначает структуру:
если R2 представляет собой метил, соединение представляет собой метиловый эфир D-триптофана.
В данном описании термин “Boc-D-Glu-(γ-D-Trp-OR2)-α-OR1” обозначает структуру:
В данном описании термин “H-D-Glu-(γ-D-Trp-OR2)-α-OR1” обозначает структуру:
если R1 представляет собой бензил, R2 представляет собой метил, то соединение представляет собой
Если R1 представляет собой метил, R2 представляет собой метил, соединение представляет собой
В данном описании термин “тимодепрессин” обозначает дипептид H-D-iGlu-D-Trp-OH с химической структурой:
.
Он также может быть обозначен как H-D-Glu-(γ-D-Trp-OH)-OH.
Кислотно-аддитивная соль представляет собой соль, образованную в результате реакции амина H-D-iGlu-D-Trp-OH с неорганическими кислотами, в том числе хлороводородной кислотой, серной кислотой, бромоводородной кислотой, фосфорной кислотой и т.п., или органическими кислотами, в том числе муравьиной кислотой, уксусной кислотой, пропионовой кислотой, гликолевой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, янтарной кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, трифторуксусной кислотой, бензойной кислотой, салициловой кислотой, бензолсульфоновой кислотой и толуолсульфоновой кислотой. Она может также быть образована в результате снятия защиты с производного Boc-D-iGlu-D-Trp-OH с помощью кислоты.
Основно-аддитивная соль представляет собой соль, образованную в результате реакции карбоновой кислоты H-D-iGlu-D-Trp-OH с неорганическими основаниями, в том числе натрия гидроксидом, лития гидроксидом, калия гидроксидом и т.п.
Данное изобретение направлено на способ получения H-D-iGlu-D-Trp-OH и его аммонийной соли, свободных от неорганических солей, из кислотно-аддитивных солей H-D-iGlu-D-Trp-OH, которые предпочтительно получены из дипептида Boc-D-iGlu-D-Trp-OH. Boc-D-iGlu-D-Trp-OH получают из Boc-D-Glu(OH)-OR1 и D-Trp-OR2, где R1 выбран из группы, состоящей из бензила и C1-C4 алкила, и R2 представляет собой C1-C4 алкил, при условии что C4 алкил не представляет собой трет-бутил.
Данное изобретение также направлено на способ получения H-D-iGlu-D-Trp-OH из раствора основно-аддитивной соли H-D-iGlu-D-Trp-OH, который предпочтительно получают из кислотно-аддитивной соли дипептида H-D-Glu-(γ-D-Trp-OR2)-α-OR1, где каждый из R1 и R2 независимо выбран из группы, состоящей из бензила и C1-C4 алкила.
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ
В пределах нескольких аспектов данного изобретения, которое сформулировано в кратком описании изобретения, последовательность стадий способа и их относительная предпочтительность описаны ниже.
В варианте данного изобретения предлагается способ получения в водной фазе свободного от неорганических солей H-D-iGlu-D-Trp-OH, который включает:
(a) получение раствора кислотно-аддитивной соли H-D-iGlu-D-Trp-OH в водной среде, в основном не содержащей органического растворителя; или получение раствора основно-аддитивной соли H-D-iGlu-D-Trp-OH в водной среде, в основном не содержащей органического растворителя;
(b) коррекцию pH до pH, соответствующего преобладающей форме, для двухосновной формы с помощью раствора гидроксида щелочного металла или неорганической кислоты, чтобы вызвать осаждение H-D-iGlu-D-Trp-OH;
(c) выделение осажденного H-D-iGlu-D-Trp-OH; и
(d) вакуумную сушку продукта, полученного на стадии (c), с образованием H-D-iGlu-D-Trp-OH.
В другом варианте данного изобретения предлагается кристаллическая форма H-D-iGlu-D-Trp-OH, представляющая собой D-изоглутамил-D-триптофан, который характеризуется XRPD, представленной в описании фигур.
В другом варианте данного изобретения предлагается кристаллический H-D-iGlu-D-Trp-OH, представляющий собой D-изоглутамил-D-триптофан, который характеризуется XRPD, проиллюстрированной на фиг. 1.
В другом варианте данного изобретения предлагается способ получения моноаммонийной соли H-D-iGlu-D-Trp-OH, свободной от неорганических солей, где способ включает следующие стадии:
(a) получение раствора кислотно-аддитивной соли H-D-iGlu-D-Trp-OH в водной среде, в основном не содержащей органического растворителя;
(b) коррекция pH до pH, соответствующего преобладающей форме, для формы одновалентной соли с помощью раствора гидроксида металла;
(c) обработка раствора со стадии (b) ионообменной смолой и элюирование водой для обмена иона металла из соли в растворе на ион водорода до тех пор, пока pH не составит от приблизительно 5,7 до приблизительно 7,0;
(d) контакт ионообменной смолы с регенерирующим раствором на основе аммиака, который осуществляет обмен ионов в растворе на целевой H-D-iGlu-D-Trp-OH, содержащийся в ионообменной смоле, с образованием, таким образом, элюата регенерирующего раствора, содержащего аммонийную соль H-D-iGlu-D-Trp-OH;
(e) выпаривание растворителя из раствора со стадии (d) с получением сырой аммонийной соли;
(f) растворение аммонийной соли со стадии (e) в воде и медленное добавление изопропанола таким образом, что образуется осадок моноаммонийной соли; и
(g) вакуумная сушка продукта со стадии (f) с образованием кристаллической формы аммонийной соли H-D-iGlu-D-Trp-OH (1:1).
Альтернативно вместо стадий (f) и (g) способ включает следующие стадии:
(h) обработка материала со стадии (d) хроматографией на силикагеле с использованием изопропанола и раствора аммиака в качестве элюента; и
(i) лиофильная сушка продукта со стадии (h) с образованием аморфной формы аммонийной соли H-D-iGlu-D-Trp-OH (1:1).
В другом варианте данного изобретения предлагается способ получения моноаммонийной соли H-D-iGlu-D-Trp-OH из кристаллического H-D-iGlu-D-Trp-OH, свободного от неорганических солей, где способ включает следующие стадии:
(a) добавление H-D-iGlu-D-Trp-OH к менее чем одному эквиваленту раствора гидроксида аммония;
(b) коррекция pH до 6-7 с помощью гидроксида аммония;
(c) выпаривание растворителя с образованием масла; добавление изопропанола при перемешивании, чтобы вызвать осаждение моноаммонийной соли;
(d) выделение осажденной аммонийной соли H-D-iGlu-D-Trp-OH и
(e) вакуумная сушка продукта, полученного на стадии (c), с получением моноаммонийной соли H-D-iGlu-D-Trp-OH.
В другом варианте данного изобретения предлагается кристаллическая аммонийная соль H-D-iGlu-D-Trp-OH (1:1), которая характеризуется XRPD, представленной в описании фигур.
В другом варианте данного изобретения предлагается кристаллическая аммонийная соль H-D-iGlu-D-Trp-OH (1:1), которая характеризуется XRPD, представленной на фиг. 2.
В другом варианте данного изобретения предлагается аморфная аммонийная соль H-D-iGlu-D-Trp-OH (1:1), которая характеризуется спектром ИК-ФП (ИК), показанным на фиг. 5.
В другом варианте данного изобретения предлагается способ получения кислотно-аддитивной соли D-изоглутамил-D-триптофана, где соль представляет собой H-D-iGlu-D-Trp-OH гидрохлорид и где способ включает:
(i) основный гидролиз соединения формулы I:
,
где R1 выбран из группы, состоящей из C1-C4 алкила и бензила, и R2 представляет собой C1-C4 алкил, при условии что C4 алкил не является трет-бутилом,
с помощью гидроксида металла в воде и инертном растворителе в присутствии метанола с образованием Boc-D-iGlu-D-Trp-OH, свободного от других диастереомеров;
(ii) снятие с помощью хлороводорода защиты с Boc-D-iGlu-D-Trp-OH со стадии (i) в инертном органическом растворителе; и выпаривание растворителя с образованием гидрохлорида H-D-iGlu-D-Trp-OH.
В другом варианте данного изобретения предлагается способ получения раствора кислотно-аддитивного гидрохлорида H-D-iGlu-D-Trp-OH, где способ включает:
(a) гидрирование соединения формулы II:
,
где R1 представляет собой бензил, и R2 выбран из группы, состоящей из бензила и водорода,
с использованием палладия на угле в метаноле или этаноле;
(b) очистку сырого H-D-iGlu-D-Trp-OH со стадии (а) хроматографией на силикагеле с использованием изопропанола и воды в качестве элюента и
(c) обработку материала со стадии (b) хлороводородной кислотой в воде с образованием раствора гидрохлорида H-D-iGlu-D-Trp-OH в воде.
В упомянутых выше двух способах получение кислотно-аддитивной соли D-изоглутамил-D-триптофана из соединения формулы I является предпочтительным по сравнению с получением из соединения формулы II с точки зрения стоимости промежуточных химических соединений.
В другом варианте данного изобретения предлагается способ получения раствора основно-аддитивной соли H-D-iGlu-D-Trp-OH, где способ включает:
(a) снятие с помощью кислоты защиты с дипептида N-Boc-D-Glu-(γ-D-Trp-OR2)-α-OR1, где каждый из R1 и R2 независимо выбран из группы, состоящей из C1-C4 алкила и бензила;
(b) основный гидролиз продукта со стадии (a) с помощью гидроксида металла в воде и инертном растворителе в присутствии метанола, где гидроксид металла выбран из группы, состоящей из гидроксида натрия, гидроксида калия и гидроксида лития;
(c) экстракцию материала со стадии (b) растворителем, не смешивающимся с водой, и отделение водной фракции;
(d) коррекцию pH водной фракции со стадии (c) до значений в интервале от приблизительно 6 до приблизительно 7 и
(e) выпаривание растворителя из раствора со стадии (d) для образования раствора, содержащего соотношение приблизительно одной части растворенного вещества на менее чем приблизительно 8 частей воды, где растворенное вещество представляет собой основно-аддитивную соль D-изоглутамил-D-триптофана.
В другом варианте данного изобретения предлагается новое диэфирное производное H-D-Glu-(γ-D-Trp-OR2)-α-OR1 гидрохлорид, где каждый из R1 и R2 независимо выбран из группы, состоящей из бензила и C1-C4 алкила.
Соединения H-D-Glu-(γ-D-Trp-OR2)-α-OR1 неизвестны в предыдущем уровне техники. Указанные соединения могут быть использованы как промежуточные соединения для получения дипептида D-изоглутамил-D-триптофана. Альтернативно H-D-Glu-(γ-D-Trp-OR2)-α-OR1 гидрохлорид может быть использован в фармацевтическом препарате, где гидролиз эфира происходит in situ, с получением D-изоглутамил-D-триптофана при изготовлении препарата.
В варианте данного изобретения предлагается график идентификации состава, проиллюстрированный на фиг. 8, для выделения H-D-iGlu-D-Trp-OH при pH от приблизительно 2,5 до приблизительно 3,0.
СПОСОБ ПОЛУЧЕНИЯ
В данном изобретении предлагается, как изображено ниже на Схеме 5, надежная методика синтеза чистого N-(трет-бутоксикарбонил)-D-изоглутамил-D-триптоф