Cdh3-пептид и включающее его лекарственное средство
Иллюстрации
Показать всеИзобретение относится к области иммунологии. Предложены варианты пептида (А) или (В) с аминокислотной последовательностью SEQ ID NO:1 или 2, соответственно, представленной в описании. Пептид обладает активностью индуцирования цитотоксической Т-клетки, при его презентировании АПК, несущей HLA-A2 (А*0201). Описаны варианты антител к указанному пептиду, полученные путем иммунизации соответствующим пептидом. Предложены: агент; способы индуцирования: цитотксической (киллерной) Т-клетки; АПК; иммунитета против рака, экспрессирующего CDH3; а также способ лечения рака, экспрессирующего CDH3, - на основе пептида. Предложена изолированная цитотоксическая Т-клетка, индуцированная указанным способом на основе пептида. Описаны: АПК-клетка и экзосома, презентирующие комплекс, включающий пептид и HLA-A2 (А*0201). Использование изобретения может найти применение в терапии рака, экспрессирующего CDH3. 13 н. и 2 з.п. ф.-лы, 5 ил., 2 табл., 5 пр.
Реферат
Область техники
Настоящее изобретение относится к новым пептидам, пригодным в качестве вакцин против раковых заболеваний, при которых высоко экспрессируется P-кадгерин (CDH3), таких как рак поджелудочной железы, холангиоцеллюлярный рак, рак желудочно-кишечного тракта, рак толстой кишки и рак легкого, а также настоящее изобретение относится к фармацевтическим агентам, включающим пептид для лечения и предотвращения рака.
Уровень техники
На долю рака поджелудочной железы приходится приблизительно 2-3% от всех злокачественных опухолей. Каждый год примерно 200000 людей по всему миру умирает от рака поджелудочной железы, и по количеству погибших рак поджелудочной железы занимает пятое место по массовости среди злокачественных опухолей. В Японии ежегодно умирает примерно 20000 человек. Факторы риска для развития рака поджелудочной железы включают диабет, хронический панкреатит, курение и им подобные, а также было опубликовано, что семейный анамнез также является одним из факторов риска. Совершались различные попытки с целью ранней диагностики заболевания, включающие улучшение диагностической визуализации; однако у большинства пациентов заболевание диагностировалось на поздних стадиях, когда они демонстрировали устойчивость к химиотерапии. Таким образом, их пятилетняя выживаемость составляет примерно 9,7%, и даже в случаях хирургического удаления опухоли только примерно 13%. Как результат при раке поджелудочной железы дается наиболее неблагоприятный прогноз среди раковых заболеваний пищеварительной системы. Благодаря этой трудности диагностирования наблюдается постепенное увеличение случаев рака поджелудочной железы в качестве причины смерти от рака, особенно в развивающихся странах. Хотя проводятся многоплановые лечения, первичное хирургическое удаление, и другие типы лечения, такие как лучевая терапия и химиотерапия, они не обладают кардинально улучшающими терапевтическими эффектами, и существует экстренная необходимость разработки новых терапевтических стратегий.
На долю холангиоцеллюлярного рака приходится примерно 10% из первичного рака печени, и он представляет собой второе наиболее распространенное раковое заболевание после печеночно-клеточного рака. Это заболевание демонстрирует слабые клинические характеристики, и во многих случаях рак детектируют на поздних стадиях, сопровождающихся метастазированием в лимфатических узлах, внутрипеченочный метастазированием и им подобными. Пятилетняя выживаемость составляет примерно 20%, и 35% в случаях хирургического удаления, но очень слабая, только 7,4% в случаях отсутствия хирургического удаления. Хотя хирургическое удаление представляет собой единственную терапию, которая, как может ожидаться, приводит к длительному выживанию, многие пациенты в момент детектирования уже находятся в неоперабельном состоянии (процент случаев хирургического вмешательства: 66%, процент инкурабельного удаления: 20%). Оба параметра, чувствительность к противораковым лекарственным средствам и радиочувствительность пациентов, являются очень низкими и поэтому является желательным создание терапии для неоперабельных случаев, включающих случаи инкурабельного удаления.
По сравнению с Западными странами уровень заболеваемости раком желудочно-кишечного тракта является высоким среди стран Азии, таких как Япония и Китай. Раннее детектирование рака желудочно-кишечного тракта стало возможным благодаря распространению диагностических тестов и развитию инструментов эндоскопии пищеварительной системы и методов контроля, вследствие чего количество пациентов уменьшилось. Однако рак желудочно-кишечного тракта все еще остается второй ведущей причиной смерти от злокачественных новообразований среди японцев, и его процент среди причин смерти все еще остается высоким. Рак толстой кишки представляет собой второе наиболее распространенное раковое заболевание в Западных странах и является третьей наиболее распространенной причиной смерти от злокачественных новообразований в Японии. Рак желудочно-кишечного тракта и рак толстой кишки лечат, главным образом, с помощью хирургического удаления, а также с помощью химиотерапии, лучевой терапии и им подобных. Иммунотерапия, которая подавляет развитие рака путем повышения иммунитета имеющего рак пациента, привлекает внимание в качестве новой терапии для метастазирующего рака и трудноизлечимого рака, против которого невозможно применение ранее упомянутых терапий.
Заболеваемость раком легкого в последние годы постоянно увеличивается в мире, и в настоящее время примерно один миллион людей в год умирает от рака легкого. Смертность от рака легкого также постоянно увеличивается в Японии и, как считают, в 2015 году достигнет 123000 человек. Он является ведущей причиной смерти от злокачественных новообразований в Японии. Количество пациентов, как считают, увеличивается по мере увеличения возраста популяции. Раннее детектирование и раннее лечение являются важными при лечении рака легкого. Однако недавно было отмечено, что обычная рентгенография грудной клетки и тесты мокроты, проводимые при медицинском осмотре, имеют слабый эффект на раннее детектирование рака легкого и не приводят к уменьшению смертности от рака. Так как количество смертей от рака легкого, как считают, постоянно увеличивается, разработка новой терапевтической стратегии представляется экстренной задачей.
С одной стороны, разработки молекулярной биологии и иммунологии опухолей выявили, что цитотоксические Т-клетки (Т-киллеры) и клетки Т-хелперы распознают пептиды, генерируемые при деградации белков, которые специфично и на высоком уровне экспрессируются в раковых клетках и которые представлены на поверхности раковых клеток или антиген-представляющих клеток посредством HLA-молекул, и Т-клетки вызывают иммунную реакцию, которая разрушает раковые клетки. Кроме того, было идентифицировано много белков опухолевых антигенов и пептидов, полученных из них, которые стимулируют такие иммунные реакции, которые поражают раковые заболевания, и в настоящее время находится в стадии разработки клиническое применение антиген-специфических иммунотерапий опухолей.
Молекула HLA класса I экспрессируется на поверхности всех содержащих ядро клеток организма. Она экспрессируется на клеточной поверхности путем связывания с пептидами, генерированными при внутриклеточной деградации белков, продуцируемых в цитоплазме или в ядре. На поверхности нормальной клетки пептиды, полученные из ее нормальных белков, связываются с молекулами HLA класса I, и Т-клетки иммунной системы не идентифицируют их для разрушения клетки. С другой стороны, в процессе развитие раковой опухоли раковые клетки иногда экспрессируют большое количество белков, которые едва или очень слабо экспрессируются в нормальных клетках. Когда молекулы HLA класса I связываются с пептидами, генерированными при внутриклеточной деградации белков, которые специфично или на высоком уровне экспрессируются в раковых клетках и затем экспрессируются на поверхности раковых клеток, то клетки Т-киллеры будут распознавать их и будут разрушать только раковые клетки. Кроме того, при введении индивидууму таких опухолеспецифичных антигенов или пептидов, то иммунный ответ, который разрушает раковые клетки и подавляет развитие рака, может индуцироваться без вреда для нормальных клеток. Это называется иммунотерапией рака с использованием опухолеспецифичных антиенов. Молекулы HLA класса II, главным образом, экспрессируются на поверхности антиген-представляющих клеток. Молекулы HLA класса II связываются с пептидами, полученными из опухолеспецифичных антигенов, которые генерируются с помощью внутриклеточной деградации опухолеспецифичных антигенов, инкорпорированных в антиген-представляющие клетки извне клеток, и затем экспрессируются на клеточной поверхности. Затем, после их распознавания, активируются клетки Т-хелперы и индуцируют или усиливают иммунную реакцию против опухолей путем продуцирования различных цитокинов, которые активируют другие иммунокомпетентные клетки.
Соответственно, если разработать иммунотерапию, мишенью которой являются антигены, которые специфично и на высоком уровне экспрессируются в этих раковых клетках, то такая терапия может эффективно ликвидировать только раковые клетки, не оказывая какого-либо опасного эффекта на собственные нормальные органы. Также ожидается, что терапия может использоваться для пациентов с любой конечной стадией рака, для которых не следует применять другого лечения. Кроме того, путем предварительного введения опухолеспецифичного антигена и пептида в качестве вакцины индивидуумам с высоким риском развития таких раковых заболеваний, развитие рака может быть предотвращено.
Хотя существуют различные терапии для лечения рака поджелудочной железы, прогноз развития рака является очень неблагоприятным по сравнению с другими типами раковых заболеваний. Это связано с тем, что рак поджелудочной железы трудно детектировать на ранней стадии, он быстро прогрессирует и, таким образом, часто детектируется только очень поздних стадиях. Хотя в настоящее время хирургическое удаление является наиболее обещающим радикальным лечением, операбельные случаи составляют только примерно 20% от общего количества. Хирургия поджелудочной железы также является высоко инвазивной, и поздние стадии демонстрируют очень неблагоприятный прогноз даже после хирургического удаления. Не удаляемые случаи подвергают лечению с помощью химиотерапии, в которой, главным образом, используется гемцитабин, и с помощью лучевой терапии. Однако многие случаи демонстрируют устойчивость к лечению и обладают слабыми циторедуктивными эффектами, что является одной из причин того, почему рак поджелудочной железы является трудноизлечимым. Соответственно, если разработать иммунотерапию, мишенью которой является антиген, который специфично и на высоком уровне экспрессируется в раковых клетках при раке поджелудочной железы, то такая терапия сможет эффективно ликвидировать только раковые клетки, не оказывая какого-либо опасного эффекта на собственные нормальные органы. Также ожидается, что она станет терапией, которая может быть применена для любого пациента с конечной стадией рака. Кроме того, так как рак поджелудочной железы часто рецидивирует на ранней стадии после удаления, то ожидается также, что терапия будет применяться в качестве послеоперационной смежной терапии.
Заявители настоящего изобретения ранее проводили широкогеномный анализ генной экспрессии 27648 генов человека с помощью анализа с использованием кДНК-микрочип для определения профилей их экспрессии в 16 случаях рака поджелудочной железы, в фетальных органах и в различных нормальных органов взрослого человека. В результате они обнаружили, что P-кадгерин (CDH3) высоко экспрессируется в раковых клетках в большинстве случаев рака поджелудочной железы, в то время как он едва экспрессируется в нормальных органах взрослого человека. Кроме того, CDH3, как наблюдалось, также имеет высокий уровень экспрессии в раковых клетках в большинстве случаев холангиоцеллюлярного рака, рака желудочно-кишечного тракта, рака толстой кишки, немелкоклеточного рака легкого, рака яичка, рака шейки матки, остеосаркомы, саркомы мягкой ткани и им подобных. Этот факт предполагает, что CDH3 может представлять собой опухолеспецифичный антиген многих раковых заболеваний.
HLA-A2 часто наблюдается в популяции людей независимо от расы, и примерно 30% Японцев являются носителями HLA-A2. Таким образом, если может быть идентифицирован пептид, представленный клеткам Т-киллерам с помощью HLA-A2, то он может широко применяться не только среди Японцев, но также среди западноевропейцев и им подобных. Соответственно, идентификация пептидов опухолевых антигенов, представленных клеткам Т-киллерам с помощью HLA-A2, является важной задачей. Может быть в высокой степени полезным применение таких пептидов опухолевых антигенов для иммунотерапии рака легкого, чьи показатели распространенности и смертности являются высокими по всему миру.
Информация о документах известного уровня техники, имеющих отношение к изобретению, раскрытому в настоящей заявке, продемонстрирована ниже.
[Непатентный документ 1] Nakamura, T., et al., Oncogene 23: 2385-2400 (2004)
[Непатентный документ 2] Obama, K., et al., Hepatology 41: 1339-1348 (2005)
[Непатентный документ 3] Taniuchi, K., et al., Cancer Res 65: 3092-3099 (2005)
[Непатентный документ 4] Soler, A. P., et al., Cancer 86: 1263-1272 (1999)
[Непатентный документ 5] Paredes, J., et al., Clin Cancer Res 11: 5869-5877 (2005)
[Непатентный документ 6] Ingunn, M., et al., J Clin Oncol 22: 1242-1252 (2004)
[Непатентный документ 7] Glenn, L., et al., J Cell Biol 139: 1025-1032 (1997)
[Непатентный документ 8] Bauer, R., et al., Exp. Mol. Pathol. 81: 224-230 (2006)
[Непатентный документ 9] Muzon-Guerra, M.F., et al. Cancer 103: 960-969 (2005)
[Непатентный документ 10] Marck, V.V., et al., Cancer Res. 65: 8774-8783 (2005)
Описание изобретения
[Задачи, решаемые с помощью изобретения]
Цель, которую следует достичь с помощью настоящего изобретения, представляет собой разработку способов для реализации иммунотерапии, которая подавляет развитие рака путем повышения иммунитета имеющих рак пациентов, в качестве новой терапии для метастазирующих и трудноизлечимых раковых заболеваний, которые с трудом подвергаются лечению с помощью хирургических способов лечения, с помощью химиотерапии и лучевой терапии, которые используются для лечения рака поджелудочной железы, холангиоцеллюлярного рака, рака желудочно-кишечного тракта, рака толстой кишки, немелкоклеточного рака легкого и им подобных. В настоящем изобретении предлагается идентифицированные пептиды, которые получены из белков, которые специфично и на высоком уровне экспрессируются в раковых клетках, и представляются клеткам Т-киллерам с помощью HLA-A2. Это дает возможность иммунотерапии, которая может применяться примерно для 30% пациентов Японцев, имеющих различные виды раковых заболеваний, раковые клетки которых экспрессируют на высоком уровне CDH3.
[Способы решения задач]
Заявители настоящего изобретения с помощью анализа тканей рака поджелудочной железы с использованием кДНК-микрочипа идентифицировали CDH3 (Регистрационный No. GenBank NM_001793) в качестве гена, который высоко экспрессируется в клетках рака поджелудочной железы. С целью определения индуцируется или нет противоопухолевый иммунитет с помощью CDH3-специфичных клеток Т-киллеров, использовали трансгенных по HLA-A2 мышей, экспрессирующих HLA-A2, носителями которого являются примерно 30% Японцев. Конкретно, трансгенных по HLA-A2 мышей иммунизировали с помощью полученных из костного мозга дендритных клеток, стимулированных с помощью человеческого CDH3-пептида, содержащего мотив связывания с HLA-A2, для того, чтобы определить будут ли индуцироваться HLA-A2-рестриктированные пептидоспецифичные клетки Т-киллеры. Метод ELISPOT использовали для детектирования γ-интерферона (IFN-γ), продуцируемого клетками Т-киллерами, которые активировались путем распознавания пептида, представленного HLA-A2, и таким образом определяли, индуцируются или нет в клетках селезенки иммунизированных мышей клетки Т-киллеры, специфичные к CDH3-пептиду. В результате заявители настоящего изобретения идентифицировали два новых CDH3-пептида, применимых для иммунотерапии для HLA-A2-положительных имеющих рак пациентов. Кроме того, было обнаружено, что CDH3-респонсивные клетки ЦТЛ (CTL), индуцированные путем использования этих пептидов, обладают цитотоксичностью, специфичной к раковым клеткам, экспрессирующим эндогенные молекулы CDH3 и HLA-A2, и что клетки ЦТЛ распознавали клетки-мишени с помощью рестрикции по HLA-класса I. Кроме того, также было обнаружено, что рост опухолей, трансплантированных мышам NOD/SCID, значительно подавлялся с помощью внутривенной инъекции CD8-положительных клеток, индуцированных пептидами (метод ЦТЛ-адоптивного иммунитета).
Более конкретно, в настоящем изобретении предлагается:
(1) пептид, соответствующий (A) или (B):
(A) пептид, включающий аминокислотную последовательность SEQ ID NO: 1 или 2;
(B) пептид, включающий аминокислотную последовательность SEQ ID NO: 1 или 2, где одна, две или несколько аминокислот заменены, делетированы, вставлены и/или добавлены и где пептид обладает активностью индуцирования цитотоксической (Т-киллера) T-клетки;
(2) пептид по п. 1, где вторая аминокислота от N-конца представляет собой лейцин или метионин;
(3) пептид по п. 1, где C-концевая аминокислота представляет собой валин или лейцин;
(4) агент для индуцирования иммунитета против рака, включающий в качестве активного ингредиента один или более пептидов по п. 1;
(5) агент для лечения и/или предотвращения рака, включающий в качестве активного ингредиента один или более пептидов по п. 1;
(6) агент для индуцирования антиген-представляющей клетки, обладающей активностью индуцирования цитотоксической Т-клетки (Т-киллера), включающий в качестве активного ингредиента один или более пептидов по п. 1;
(7) агент для индуцирования антиген-представляющей клетки, обладающей активностью индуцирования цитотоксической Т-клетки (Т-киллера), включающий в качестве активного ингредиента один или более полинуклеотидов, кодирующих пептид по п. 1;
(8) агент для индуцирования цитотоксической Т-клетки (Т-киллера), включающий в качестве активного ингредиента один или более пептидов по п. 1;
(9) антитело к пептиду по п. 1;
(10) клетка Т-хелпер, цитотоксическая Т-клетка (Т-киллер) или группа иммуноцитов, включающих эти клетки, которые индуцируются путем применения пептида по п. 1;
(11) антиген-представляющая клетка, которая представляет комплекс, включающий пептид по п. 1 и HLA-антиген;
(12) антиген-представляющая клетка по п. 11, которая индуцируется агентом по п. 6 или 7;
(13) экзосома, которая представляет комплекс, включающий пептид по п. 1 и HLA-антиген;
(14) экзосома по п. 13, где HLA-антиген представляет собой HLA-A2 (HLA-A2*0201);
(15) способ индуцирования антиген-представляющей клетки, обладающей активностью индуцирования цитотоксической Т-клетки (Т-киллера), включающий стадию контактирования антиген-представляющей клетки с пептидом по п. 1;
(16) способ индуцирования антиген-представляющей клетки, обладающей активностью индуцирования цитотоксической Т-клетки (Т-киллера), включающий стадию трансфекции полинуклеотида, кодирующего пептид по п. 1, в антиген-представляющую клетку;
(17) способ индуцирования цитотоксической Т-клетки (Т-киллера), включающий стадию контактирования Т-клетки с пептидом по п. 1;
(18) способ индуцирования иммунитета против рака, включающий стадию введения субъекту пептида по п. 1;
(19) способ лечения и/или предотвращения рака, включающий стадию введения субъекту пептида по п. 1;
(20) применение пептида по п. 1 для получения агента, предназначенного для индуцирования иммунитета против рака;
(21) применение пептида по п. 1 для получения лекарственного средства, предназначенного для лечения и/или предотвращения рака.
Краткое описание чертежей
На Фиг. 1 продемонстрирована схема идентификации CDH3-пептидов, распознаваемых HLA-A2-рестриктированных клеток Т-киллеров. (День, в который были изолированы клетки селезенки из иммунизированных мышей, представлен как “День 0”).
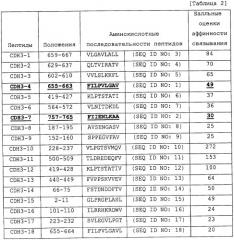
На Фиг. 2 изображен график, демонстрирующий результат анализа ELISPOT для 18 CDH3-пептидов. Анализ ELISPOT использовали для определения могут ли клетки Т-киллеры, полученные из иммунизированных мышей, специфично реагировать с клетками, стимулированными с помощью CDH3-пептидов, и продуцировать IFN-γ. Клетки Т-киллеры, индуцированные с помощью CDH3-4-пептида или CDH3-7-пептида, специфично распознавали клетки КМ-ДК (BM-ДК), стимулированные с помощью CDH3-пептидов, и продуцировали IFN-γ; однако клетки T-киллеры, индуцированные с помощью других пептидов, не демонстрировали CDH3-специфичного иммунного ответа. Таким образом, пептиды CDH3-4 и CDH3-7, как подтвердилось, представляют собой эпитопные пептиды, способные индуцировать CDH3-специфичные HLA-A2-рестриктированные клетки Т-киллеры. Номера CDH3-пептидов, продемонстрированные на Фигуре 2, соответствуют пептидным номерам, продемонстрированным в колонке “положение” в Таблице 2, а не номерам последовательностей SEQ ID NO, описанным в настоящей заявке.
На Фиг. 3 изображены фотографии, демонстрирующие результаты анализа ELISPOT, детектирующего IFN-γ, продуцированного клетками Т-киллерами, активированными посредством специфичного распознавания CDH3-пептидов. CD4-отрицательные клетки селезенки продемонстрировали 283,7±40 пятен/на лунку в ответ на клетки КМ-ДК, стимулированные с помощью пептида CDH3-4655-663 (слева в A и выше в B), при этом они демонстрировали 48,7±11,9 пятен/на лунку в ответ на клетки КМ-ДК в отсутствие пептидного стимула (справа в A и нижний ряд B) (P<0,05). Подобным образом, CD4-отрицательные клетки селезенки продемонстрировали 79,3±3,2 пятен/на лунку в ответ на клетки КМ-ДК, стимулированные с помощью пептида CDH3-7757-765 (верхний ряд в C), при этом они демонстрировали 42,7±2,5 пятен/на лунку в ответ на клетки КМ-ДК в отсутствии пептидного стимула (нижний ряд в C) (P<0,05).
Анализ проводили дважды и получали такие же результаты.
На Фиг. 4 изображены линейные графики, демонстрирующие результат индуцирования CDH3-специфичных человеческих клеток ЦТЛ из клеток мононуклеаров периферической крови МКПК (PBMC) HLA-A2-положительных здоровых доноров и пациентов, имеющих рак. A: клетки ЦТЛ, реактивные к CDH3-пептиду, индуцировали из клеток МКПК HLA-A2-положительных здоровых доноров. После стимулирования три раза с помощью аутологичных, полученных из моноцитов дендритных клеток ДК (DC), стимулированных с помощью пептида CDH3-4655-663 (выше) или CDH3-7757-765 (ниже), оценивали цитотоксичность против клеток T2 (HLA-A2-положительных, TAP-дефицитных), стимулированных или не стимулированных каждым пептидом, с помощью стандартного анализа высвобождения 51Cr. Клетки ЦТЛ продемонстрировали цитотоксичность к клеткам T2, стимулированным пептидом CDH3-4655-663 (выше) или CDH3-7757-765 (ниже), но не продемонстрировали цитотоксичность к клеткам T2, не стимулированным с помощью пептида. B: Клетки ЦТЛ продемонстрировали цитотоксичность к CDH3+ HLA-A2+ клеткам клеточной линии HCT116 человека, и к клеткам плоскоклеточного рака полости рта клеточной линии HSC3, а также к клеткам PANC1/CDH3, которые представляют собой CDH3- HLA-A2+ клетки клеточной линии PANC1 рака поджелудочной железы человека, трансформированные геном CDH3. Однако клетки ЦТЛ не демонстрируют цитотоксичность к CDH3- HLA-A2+ клеткам клеточной линии SKHep1 рака печени человека, к клеткам PANC1, и к CDH3+ HLA-A2- клеткам клеточной линии PK8 рака поджелудочной железы человека. C: CDH3-реактивные клетки ЦТЛ, индуцированные из клеток МКПК HLA-A2-положительных пациентов, имеющих рак поджелудочной железы (PC), и пациентов, имеющих рак желудочно-кишечного тракта (GC), демонстрировали цитотоксичность к клеткам HCT116 и PANC1/CDH3, но не демонстрировали цитотоксичность к клеткам PANC1 и PK8. D: Продемонстрировано ингибирование цитотоксичности с помощью моноклонального антитела к HLA класса I. После инкубирования клеток-мишеней, SKHep1/CDH3 и HSC3, с моноклональным антителом к HLA класса I (W6/32, IgG2a) или с моноклональным антителом к HLA-DR (H-DR-1, IgG2a) в течение часа, добавляли клетки ЦТЛ, индуцированные из клеток МКПК здоровых доноров, стимулированные с помощью пептида CDH3-4655-663 (слева, середина) или CDH3-7757-765 (справа). Продуцирование IFN-γ (слева и справа, IFN-γ-ELISPOT-анализ) и цитотоксичность (середина, анализ высвобождения 51Cr) заметно ингибировались с помощью W6/32, но не ингибировались с помощью H-DR-1.
На Фиг. 5 изображена in vivo-противоопухолевая активность клеток ЦТЛ, индуцированных с помощью CDH3, против раковых клеток человека, трансплантированных мышам NOD/SCID. A: Ингибирование роста клеток клеточной линии HCT116 (CDH3+, HLA-A2+) рака ободочной и прямой кишки, привитых мышам NOD/SCID, после трансплантации клеток ЦТЛ. Когда размер опухоли достигает 25 мм2 на 7 день после подкожной имплантации опухоли, то инокулировали внутривенно человеческие клетки ЦТЛ, реактивные к пептиду CDH3-4655-663 (□) и к пептиду CDH3-7757-765 (■). На 14 день клетки ЦТЛ инокулировали снова таким же способом. Контрольные CD8+ T-клетки, стимулированные с помощью HLA-A2-рестриктированного HIV-пептида, не демонстрировали цитотоксичности (◊). Продемонстрированы размеры опухолей у мышей NOD/SCID, которые получали два введения CDH3-реактивных клеток ЦТЛ (n=7), контрольных CD8+ T-клеток (n=7), или индивидуально PBS (○, n=7), на 7 и на 14 день. Размеры опухолей выражены в квадратных миллиметрах. B: Размер опухоли в каждой группе продемонстрирован со стандартным отклонением ± SD (n=7).
Способ осуществления изобретения
Термины “a”, “an” и “the” при использовании в настоящей заявке обозначают “по меньшей мере, один” до тех пор, пока не определено по-другому.
До тех пор, пока не определено по-другому, все технические и научные термины, используемые в настоящей заявке, имеют такое же значение, какое является общепринятым среди специалистов в данной области, к которой принадлежит настоящее изобретение.
Пептид согласно настоящему изобретению представляет собой эпитоп, рестриктированный по HLA-A2, который представляет собой аллель HLA, как правило, обнаруживаемый в популяциях Японцев и Европейцев. Конкретно, кандидаты HLA-A2-связывающих пептидов, полученных из CDH3, были выбраны с использованием в качестве показателя их аффинности связывания с HLA-A2. Выбранные пептиды оценивали путем тестирования того, будут ли индуцироваться клетки Т-киллеры в организме трансгенной по HLA-A2 мыши с помощью дендритных клеток, полученных из клеток костного мозга (КМ-ДК) трансгенной по HLA-A2 мыши, стимулированных с помощью выбранного пептида. Клетки Т-киллеры индуцировались с помощью CDH3-4 (FILPVLGAV (SEQ ID NO: 1)) и CDH3-7 (FIIENLKAA (SEQ ID NO: 2)), в организме трансгенной по HLA-A2 мыши. Клетки Т-киллеры, индуцированные с помощью этих пептидов, демонстрировали иммунный ответ на клетки КМ-ДК, к которым добавляли эти пептиды. Однако эти клетки Т-киллеры не демонстрировали иммунного ответа на клетки КМ-ДК, к которым пептиды не добавлялись. Эти результаты демонстрируют, что пептиды, полученные из CDH3, пригодны для использования в качестве пептидов для индуцирования иммунной реакции против CDH3-представляющих клеток, и что пептиды, полученные из CDH3, представляют собой HLA-A2-рестриктированные эпитопные пептиды. CDH3 имеет высокий уровень экспресси в раковых клетках в большинстве случаев раковых заболеваний, таких как рак поджелудочной железы, холангиоцеллюлярный рак, рак желудочно-кишечного тракта, рак толстой кишки, немелкоклеточный рак легкого, рак яичка, рак шейки матки, остеосаркома и опухоли мягких тканей. Это выявляет, что CDH3 пригоден для использования в качестве мишени для иммунотерапии при многих раковых заболеваниях.
(1) Пептиды согласно настоящему изобретению и агенты для индуцирования иммунитета против рака, содержащие эти пептиды
Пептид согласно настоящему изобретению представляет собой любой из следующих пептидов:
(A) пептид, включающий аминокислотную последовательность SEQ ID NO: 1 или 2;
(B) пептид, включающий аминокислотную последовательность SEQ ID NO: 1 или 2, где одна, две или несколько аминокислот заменены, делетированы, вставлены и/или добавлены и где пептид обладает активностью индуцирования клеток Т-киллеров;
(C) пептид (B), в котором вторая аминокислота из N-конца представляет собой лейцин или метионин; и
(D) пептид (B), в котором C-концевая аминокислота представляет собой валин или лейцин.
Пептид согласно настоящему изобретению представляет собой эпитопный пептид, содержащий менее чем 40 аминокислот, предпочтительно менее чем 20 аминокислот, более предпочтительно, менее чем 15 аминокислот, который включает аминокислотную последовательность SEQ ID NO: 1 или 2, и обладает активностью индуцирования клеток Т-киллеров. Альтернативно, эпитопный пептид может включать пептид, включающий аминокислотную последовательность of SEQ ID NO: 1 или 2, где одна, две или несколько аминокислот заменены, делетированы, вставлены и/или добавлены при условии сохранения активности индуцирования клеток Т-киллеров. Количество замененных, делетированных, вставленных и/или добавленных остатков составляет, как правило, 5 аминокислот или менее, предпочтительно 4 аминокислоты или менее, более предпочтительно 3 аминокислоты или менее, и еще более предпочтительно 1 аминокислоту или 2 аминокислоты.
Вариант-специфичные пептиды (т.e. пептиды, включающие аминокислотные последовательности, полученные путем изменения исходных аминокислотных последовательностей с помощью замены, делеции, вставки и/или добавления одной, двух или нескольких аминокислотных остатков), как известно, сохраняют исходные биологические активности (Mark DF et al., (1984) Proc Natl Acad Sci USA 81: 5662-6; Zoller MJ and Smith M, (1982) Nucleic Acids Res 10: 6487-500; Dalbadie-McFarland G et al., (1982) Proc Natl Acad Sci USA 79: 6409-13). Аминокислотные изменения предпочтительно сохраняют свойства исходных аминокислотных боковых цепей. Примеры свойств аминокислотных боковых цепей представляют собой гидрофобные аминокислоты (A, I, L, M, F, P, W, Y, V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S, T), и боковые цепи, обладающие следующими функциональными группами или совокупными характеристиками: алифатическими боковыми цепями (G, A, V, L, I, P); боковыми цепями, содержащими гидроксильные группы (S, T, Y); боковыми цепями, содержащими атом серы (C, M); боковыми цепями, содержащими карбоновые кислоты и амиды (D, N, E, Q); боковыми цепями, содержащими основания (R, K, H); и боковыми цепями, содержащими компонент ароматического ряда (H, F, Y, W), где буквы в скобках обозначают буквенные коды аминокислот.
В предпочтительном варианте осуществления изобретения, пептиды по настоящему изобретению (иммуногенные пептиды) представляют собой нонапептиды (9-меры) или декапептиды (10-меры).
В настоящей заявке пептид, обладающий активностью индуцирования клеток Т-киллеров, обозначает пептид, обладающий активностью индуцирования клеток Т-киллеров, который стимулирует клетки Т-киллеры (цитотоксические Т-клетки/ЦТЛ).
С целью получения пептидов с высокой аффинностью связывания и активностью индуцирования клеток Т-киллеров аминокислотная последовательность неполного пептида природного CDH3 может быть изменена с помощью замены, делеции или добавления одной, двух или нескольких аминокислот. В настоящей заявке термин “несколько” обозначает 5 или менее, предпочтительно 3 или менее, более предпочтительно 2 или менее. Кроме того, так как известна закономерность пептидных последовательностей, обладающих высокой аффинностью к HLA-антигенам (Kubo RT, et al., (1994) J. Immunol., 152: 3913-24; Rammensee HG, et al., (1995) Immunogenetics. 41: 178-228; Kondo A, et al. (1995) J.Immunol. 155: 4307-12), то пептиды по настоящему изобретению (эпитопные пептиды) могут быть изменены с целью улучшения их аффинности к HLA-антигенам на основе известной закономерности. Например, пептиды, обладающие высокой аффинностью связывания с HLA-2, могут быть получены путем замены второй аминокислоты с N-конца на лейцин или метионин. Подобным образом, пептиды с высокой аффинностью связывания с HLA-2, также могут быть получены путем замены C-концевой аминокислоты на валин или лейцин.
Когда последовательность эпитопного пептида является такой же, как часть аминокислотной последовательности эндогенного или экзогенного белка, имеющего отличную функцию, то этим могут быть вызваны побочные эффекты, такие как аутоиммунные расстройства или аллергические симптомы против специфического вещества. С целью избежания таких побочных эффектов, измененный эпитопный пептид не должен быть идентичен аминокислотным последовательностям известных белков. Для этой цели необходимо проводить поиск гомологий с использованием баз данных для подтверждения того, что не существует эндогенного или экзогенного белка с отличной функцией, который бы демонстрировал 100%-гомологию с измененным эпитопным пептидом. Таким способом можно избежать рисков, вызванных вышеупомянутым изменением аминокислотной последовательности для увеличения аффинности связывания с HLA-антигеном и/или для увеличения активности индуцирования клеток Т-киллеров.
Хотя вышеописанные пептиды, обладающие аффинностью связывания с HLA-антигенами, как ожидается, являются высокоэффективными в качестве вакцин против рака, кандидатные пептиды, выбранные с использованием в качестве показателя высокой аффинности, должны быть исследованы на предмет того, действительно ли они обладают активностью индуцирования клеток Т-киллеров. Активность индуцирования клеток Т-киллеров может быть подтверждена с помощью: индуцирования антиген-представляющих клеток, имеющих человеческий MHC-антиген (например, B-лимфоцитов, макрофагов и дендритных клеток), или, более конкретно, с помощью индуцирования дендритных клеток, полученных из мононуклеарных лейкоцитов периферической крови человека; с помощью стимулирования их с помощью пептида, представляющего интерес; затем смешивания их с CD8-положительными клетками; измерения цитотоксической активности против клетки-мишени. В качестве реакционной системы могут быть использованы трансгенные животные, которые экспрессируют человеческий HLA-антиген (как описано, например, в публикации BenMohamed L, et al., (2000) Hum. Immunol. 61 (8): 764-79, Родственные статьи, Книги и библиотека Linkout). Например, клетки-мишени могут быть радиоактивно меченными с помощью 51Cr или подобным образом, и цитотоксическая активность может рассчитываться исходя из радиоактивности, высвобождающейся из клеток-мишеней. Альтернативно, клетки-мишени могут быть исследованы с помощью: измерения IFN-γ, продуцированного и высвобожденного из клеток Т-киллеров в присутствии антиген-представляющих клеток, имеющих иммобилизованный пептид; и визуализации зоны продуцирования IFN-γ на культуральной среде с использованием моноклонального антитела к IFN-γ.
Как продемонстрировано в Примерах, результат исследования пептидной активности индуцирования клеток Т-киллеров демонстрирует, что пептиды, обладающие высокой аффинностью связывания с HLA-антигеном, необязательно обладают высокой активностью индуцирования клеток Т-киллеров. Однако пептиды, содержащие аминокислотную последовательность CDH3-4 (FILPVLGAV (SEQ ID NO: 1)) или CDH3-7 (FIIENLKAA (SEQ ID NO: 2)), демонстрируют особенно высокую активность индуцирования клеток Т-киллеров.
Как описано выше, в настоящем изобретении предлагаются пептиды, обладающие активностью индуцирования клеток Т-киллеров, более конкретно, пептиды, включающие аминокислотную последовательность SEQ ID NO: 1 или 2, или их варианты (т.e., аминокислотные последовательности, в которых одна, две или несколько аминокислот заменены, делетированы, вставлены и/или добавлены). Аминокислотные последовательности пептидов, содержащие девять аминокислот SEQ ID NO: 1 или 2, или их варианты предпочтительно не являются идентичными последовательностям других эндогенных белков. Особенно пептиды с высокой аффинностью связывания HLA-A2 могут быть получены путем замены второй аминокислоты от N-конца на лейцин или метионин и/или путем замены C-концевой аминокислоты на валин или лейцин.
Пептиды по настоящему изобретению могут включать модификации, такие как гликозилирование, окисление в боковой цепи и фосфорилирование, если только пептиды не теряют их активности индуцирования клеток Т-киллеров. Другие модификации включают, например, D-аминокислоты или другие аналоги аминокислот, которые могут использоваться для увеличения периода полужизни пептидов в сыворотке.
Методы получения и производства пептидов по настоящему изобретению особо не ограничены. Пептиды могут быть химически синтезированными или рекомбинантными, полученными с помощью генно-рекомбинантной технологии.
Химически синтезированные пептиды по настоящему изобретению могут быть синтезированы согласно методам химического синтеза, таким как Fmoc-метод (метод, использующий флуоренилметилоксикарбонил) и t-Boc-метод (метод, использующий трет-бутилоксикарбонил). Пептиды по настоящему изобретению также могут быть синтезированы с применением различных коммерчески доступных пептидных синтезаторов.
Пептиды по настоящему изобретению могут быть произведены в виде рекомбинантных белков путем получения молекул ДНК, содержащих нуклеотидные последовательности, кодирующие пептиды, или их варианты или гомологи, и путем их введения в подходящие экспрессирующие системы.