Полипептид, имеющий nadh-зависимую hmf-редуктазную активность
Иллюстрации
Показать всеИзобретение относится к области биохимии. Представлен выделенный полипептид, имеющий NADH-зависимую HMF-редуктазную активность, где указанный полипептид на 80% гомологичен аминокислотной последовательностью SEQ ID NO: 2, имеющейся в описании, который имеет замены в положениях, соответствующих положениям a) Y295C, б) Y295C и S117L, в) Y295C и S110P, или г) Y295C и S110P и S117L в SEQ ID NO: 2. Описаны нуклеиновая кислота, кодирующая указанный полипептид, экспрессионный вектор, содержащий указанную нуклеиновую кислоту, и клетка-хозяин, содержащая указанный вектор и предназначенная для экспрессии полипептида с NADH-зависимой HMF-редуктазной активностью. Предложено применение указанных полипептида, нуклеиновой кислоты, вектора или клетки-хозяина в производстве крупнотоннажных химикатов из лигноцеллюлозного сырья и фурансодержащего материала. Изобретение позволяет получить NADH-зависимую HMF-редуктазу с увеличенной специфичной активностью. 5 н. и 13 з.п. ф-лы, 6 табл., 4 ил., 7 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к выделенному полипептиду, имеющему NADH-зависимую HMF-редуктазную активность (NADH - никотинамид-аденин-динуклеотид, HMF - 5-гидроксиметилфурфурол), где указанный полипептид демонстрирует 80% гомологию с аминокислотной последовательностью, показанной в SEQ ID NO: 2, и отличается от SEQ ID NO: 2 тем, что по меньшей мере имеет замены S117L и Y295 или S110, к нуклеотидной последовательности, кодирующей указанный полипептид, вектору, содержащему указанный полипептид или нуклеотидную последовательность, хозяину, содержащему указанную нуклеотидную последовательность или вектор, а также применению полипептида для восстановления фурановых или карбонильных соединений в лигноцеллюлозном материале или любом фуран- или карбонилсодержащем материале.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Получение биоэтанола из возобновляемого сырья с помощью пекарских дрожжей Saccharomyces cerevisiae стало привлекательной альтернативой ископаемому топливу. Однако ожидают, что доступность крахмального или сахарозного сырья, такого как кукурузные зерна или сахарный тростник, будет недостаточной, чтобы удовлетворить будущую всемирную потребность в биоэтаноле (Gray et al., 2006. Bioethanol. Current Opinion Chemical Biology. 10(2): 141-146). Предсказуемое решение представляет собой утилизацию лигноцеллюлозного сырья, такого как грубые корма из кукурузы, солома пшеницы, жмых сахарного тростника, древесина и так далее (Hahn-Hägerdal et al., 2006. Bioethanol - the fuel of tomorrow from the residues of today. Trends Biotechnol. 24(12): 549-556). Это требует решения новых проблем, связанных с утилизацией этих смешанных видов сырья.
Одна из этих проблем затрагивает присутствие ингибирующих соединений, таких как небольшие алифатические низкомолекулярные кислоты, производные фурана, карбонильные соединения и фенолы, которые высвобождаются во время предварительной обработки и гидролиза лигноцеллюлозного сырья (Almeida et al., 2007. Increased tolerance of inhibitors in lignocellulosic hydrolysates by Saccharomyces cerevisiae. J Chem Technol Biotechnol, 82: 340-349). Среди этих соединений присутствие производного фурана 5-гидроксиметилфурфурола (HMF), который образуется при дегидратации гексоз, приводит, как сообщают, к снижению выработки этанола во время ферментации лигноцеллюлозных гидролизатов дрожжами S.cerevisiae (Taherzadeh et al. 2000. Physiological effects of 5-hydroxymethyl furfural on Saccharomyces cerevisiae. Appl Microbiol Biotechnol. 53(6): 701-708). При сравнении в эквимолярных количествах с фурфуролом, другим ингибирующим производным фурана, найденным в гидролизатах, и объемная выработка этанола, и скорость потребления сахара клетками ниже в случае HMF (Larsson et al., 1999. The generation of fermentation inhibitors during dilute acid hydrolysis of softwood. Enzyme Microbial Technology 24: 151-159). Следовательно, удаление HMF и/или усиление клеточной HMF детоксикации являются ключевыми для промышленного процесса ферментации, основанного на лигноцеллюлозном сырье.
В WO 03072602 раскрыт полипептид, имеющий серин в положении 295. Однако у этого полипептида отсутствует лейцин в положении 117.
Nilsson et al., Applied and Environmetal Microbiology, Dec 2005, vol 71, page 7866-7871, обнаружили, что клеточные экстракты из устойчивого к лигноцеллюлозному гидролизату штамма ТМВ3000 показали ранее неизвестную NADH-зависимую HMF-редуктазную активность, которая отсутствовала у менее устойчивого штамма CBS 8066.
Абсолютно необходимое условие для развития процессов ферментации, основанных на лигноцеллюлозном сырье, представляет собой развитие и оптимизацию микроорганизмов, которые устойчивы к ингибирующим соединениям, упомянутым выше, или штамма, который может утилизировать/разлагать ингибирующие соединения. Установлено, что штаммы S.cerevisiae восстанавливают HMF и фурфурол (Larsson et al., 1999. The generation of fermentation inhibitors during dilute acid hydrolysis of softwood. Enzyme Microbial Technology 24: 151-159) до 2,5-диметанола (2,5-бис-гидроксиметилфурана) и 2-фуранметанола, соответственно, однако скорость восстановления мала и зависит от штамма. Штамм ТМВ3000 (Lindén et al., 1992. Isolation and characterization of acetic acid-tolerant galactose-fermenting strains of Saccharomyces cerevisiae from a spent sulfite liquor fermentation plant. Applied Environmental Microbiology. 58(5): 1661-1669) пока представляется наиболее устойчивым штаммом, который может расти на неразбавленных гидролизатах древесины (Brandberg et al., 2005. Continuous fermentation of undetoxified dilute acid lignocellulose hydrolysate by Saccharomyces cerevisiae ATCC 96581 using cell recirculation. Biotechnology progress, 21(4): 1093-1101).
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение относится к выделению нового полипептида, имеющего NADH-зависимую HMF-редуктазную активность, где указанный полипептид обладает способностью восстанавливать несколько соединений. Один пример полипептида содержит мутантную алкогольдегидрогеназу (ADH1) из Saccharomyces cerevisiae, которая в нативной форме не может восстанавливать HMF, а когда мутирована - может восстанавливать HMF. Полипептид по изобретению может быть использован в нескольких способах получения крупнотоннажных и платформных (platform) химикатов из лигноцеллюлозного материала, такого как лигноцеллюлозное сырье, где существует необходимость детоксикации HMF, или других фуранов либо их производных, или карбонильных соединений. Примеры биотоплива, крупнотоннажных и платформных химикатов включают этанол, бутанол, лактат, 1,4-дикарбоновые кислоты (янтарная, фумаровая, яблочная), глицерин, сорбит, маннит, ксилит/арабинит, L-аскорбиновая кислота, ксилит, газообразный водород, 2,5-фурандикарбоновая кислота, 3-гидроксипропионовая кислота, аспарагиновая кислота, глутаровая кислота, глутаминовая кислота, итаконовая кислота, левулиновая кислота и 3-гидроксибутиролактон, жирные кислоты, молекулы, являющиеся производными жирных кислот, изопреноиды, молекулы, являющиеся производными изопреноидов, алканы, изопентанол, изоамилацетат. При использовании нового полипептида вследствие более быстрого удаления из среды ингибирующих фурановых соединений и карбонильных соединений будет достигнута увеличенная специфичная производительность (грамм продукта от грамма клеток и за час).
В одном аспекте изобретение относится к выделенному полипептиду, имеющему NADH-зависимую HMF-редуктазную активность, где указанный полипептид демонстрирует 80% гомологию с аминокислотной последовательностью, показанной в SEQ ID NO: 2, и отличается от SEQ ID NO: 2 тем, что по меньшей мере имеет замену S117L и Y295 или S110. Путем включения единичной замены в SEQ ID NO: 2 и в то же время сохранения L в положении получают усовершенствованный полипептид, который эффективно восстанавливает HMF и фурфурол.
Во втором аспекте изобретение относится к выделенному полипептиду, описанному выше, где указанный полипептид отличается от SEQ ID NO: 2 тем, что по меньшей мере имеет замену Y295C, или Y295S, или Y295T, или S110P.
В третьем аспекте изобретение относится к нуклеотидной последовательности, кодирующей полипептид, описанный выше.
В четвертом аспекте изобретение относится к вектору, содержащему нуклеотидную последовательность.
В пятом аспекте изобретение относится к клетке-хозяину, содержащей нуклеотидную последовательность или вектор.
В шестом аспекте изобретение относится к применению полипептида, имеющего NADH-зависимую HMF-редуктазную активность, нуклеотидной последовательности, вектора или клетки-хозяина для получения крупнотоннажных химикатов из лигноцеллюлозного сырья, такого как сырье, упомянутое выше. При применении усовершенствованных полипептидов возрастают скорость потребления сахара и скорость роста, а также, если хозяина используют для получения этанола, возрастает скорость выработки этанола микроорганизмом по сравнению с применением нативного полипептида.
При предоставлении нового полипептида, как показано в SEQ ID NO: 2, имеющего NADH-зависимую HMF-редуктазную активность, впервые возможно восстанавливать фурановые соединения, или карбонильные соединения, или производные фурана, такие как 6-гидроксиметил-2-фуральдегид (HMF), используя NADH в качестве кофактора. Сообщали, что HMF уменьшает и рост клеток, и выработку этанола в пекарских дрожжах, в большинстве случаев используемых для промышленного производства этанола. Эти две проблемы будут уменьшены или устранены сейчас, когда новый выделенный полипептид будет включен в способ или новая выделенная нуклеотидная последовательность будет перенесена в клетку-хозяина, которую используют в способе, в котором обычно есть проблема с HMF.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
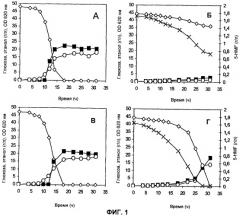
На Фиг.1 представлено потребление субстрата и HMF и образование основного продукта в штаммах ТМВ3280 (пустая плазмида) (А, Б) и ТМВ3206 (мутантная ADH1) (В, Г) в аэробных условиях. А, В = без добавления HMF; Б, Г = с добавлением 20 мМ HMF. Обозначения: ◇ глюкоза, ○ OD620 (OD - оптическая плотность), х HMF, ■ этанол.
На Фиг.2 представлено потребление субстрата и HMF и образование основного продукта в штаммах ТМВ3280 (пустая плазмида) (А, Б) и ТМВ3206 (мутантная ADH1) (В, Г) в анаэробных условиях. А, В = без добавления HMF; Б, Г = с добавлением 20 мМ HMF. Обозначения: ◇ глюкоза, ○ OD620 (OD - оптическая плотность), Δ HMF, ■ этанол.
На Фиг.3 представлен ферментационный профиль контрольного штамма ТМВ3280 (А) и штамма ТМВ3206 с повышенной экспрессией мутантного гена ADH1 из ТМВ3000 (Б) в импульсном эксперименте с еловым гидролизатом. Штаммы сначала выращивают на питательной среде определенного состава, затем через 15-20 часов добавляют еловый гидролизат. Обозначения: Фурфурол (◇), HMF (Δ), Глюкоза (•), Этанол (▲), скорость выделения CO2, или CER (―).
На Фиг.4 представлено потребление субстрата и HMF и образование этанола в штаммах ТМВ3290 (пустая плазмида) (А) и ТМВ3291 (ADH1-S110P-Y295C) (Б) в анаэробных условиях. Обозначения: (■) глюкоза, (▲) ксилоза, (◇) HMF, (□) этанол.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В контексте данной заявки и изобретения употребляются следующие определения.
Термин "нуклеотидная последовательность" обозначает последовательный отрезок из трех и более областей нуклеотидных последовательностей. Нуклеотиды могут быть из геномной ДНК, комплементарной ДНК (кДНК), РНК, полусинтетическими или синтетическими или их смесью. Термин включает одно- и двухцепочечные формы ДНК или РНК.
Термин "их аналог" обозначает, что часть или весь полипептид с SEQ ID NO: 2 основаны на небелковых аминокислотных остатках, таких как аминоизомасляная кислота (Aib), норвалин гамма-аминомасляная кислота (Abu) или орнитин. Примеры других небелковых аминокислотных остатков можно найти на http://www.hort.purdue.edu/rhodcv/hort640c/polyam/po00008.htm.
Термин "гомология" полипептида следует понимать как степень идентичности двух последовательностей, указывающая на происхождение первой последовательности от второй. Гомология может быть подходящим образом определена посредством компьютерных программ, известных в уровне техники, таких как GAP, входящих в программный пакет GCG (Program Manual for the Wisconsin Package, Version 8, August 1994, Genetics Computer Group, 575 Science Drive, Madison, Wis., USA 53711) (Needleman, S.B. and Wunsch, C.D., (1970), Journal of Molecular Biology, 48, 443-453. Используют следующие установки для сравнения аминокислотных последовательностей: штраф за создание пробела 3,0 и штраф за удлинение пробела 0,1. Релевантная для определения гомологии часть аминокислотной последовательности представляет собой зрелый полипептид.
Термин "вектор", как он использован здесь, относится к молекуле нуклеиновой кислоты или одно-, или двухцепочечной, которая выделена из встречающегося в природе гена или которая модифицирована так, что она содержит сегменты нуклеиновых кислот таким образом, что иначе не существует в природе. Термин "вектор" синонимичен термину "кассета экспрессии", когда вектор содержит регуляторные последовательности, необходимые для экспрессии кодирующей последовательности по настоящему изобретению. Термин "вектор" также синонимичен термину "интегрированная конструкция нуклеиновой кислоты" или "интегрированный фрагмент", когда конструкцию следует использовать для интеграции конструкции/фрагмента в геном хозяина.
Термин "регуляторные последовательности" определен здесь как включающий все компоненты, которые необходимы или полезны для экспрессии полинуклеотида, кодирующего полипептид по настоящему изобретению. Каждая регуляторная последовательность может быть нативной или чужеродной по отношению к нуклеотидной последовательности, кодирующей полипептид. Такие регуляторные последовательности включают последовательность полиаденилирования, пропептидную последовательность, промотор и терминатор транскрипции, но не ограничены ими. Как минимум регуляторные последовательности включают промотор и транскрипционные и трансляционные стоп-сигналы. Регуляторные последовательности могут быть обеспечены линкерами с целью введения специфических сайтов рестрикции, облегчающих лигирование регуляторных последовательностей с кодирующей областью нуклеотидной последовательности, кодирующей полипептид.
Термин "клетка-хозяин", как он использован здесь, включает любой тип клеток, который восприимчив к трансформации, трансфекции, трансдукции и подобному нуклеиновой кислотой.
В данном контексте названия аминокислот и названия атомов используют так, как определено Банком Данных Белка (PNB) (www.pdb.org). который основан на номенклатуре IUPAC (IUPAC Nomenclature and Symbolism for Amino Acids and Peptides (residue names, atom names etc.), Eur J Biochem., 138, 9-37 (1984) вместе с поправками в Eur J Biochem., 152, 1 (1985)). Термин "аминокислота" предназначен для обозначения аминокислоты из группы, состоящей из аланина (Ala или А), цистеина (Cys или С), аспарагиновой кислоты (Asp или D), глутаминовой кислоты (Glu или Е), фенилаланина (Phe или F), глицина (Gly или G), гистидина (His или Н), изолейцина (IIe или I), лизина (Lys или К), лейцина (Leu или L), метионина (Met или М), аспарагина (Asn или N), пролина (Pro или Р), глутамина (Gin или Q), аргинина (Arg или R), серина (Ser или S), треонина (Thr или Т), валина (Val или V), триптофана (Trp или W) и тирозина (Tyr или Y) или их производных.
Терминология, использованная для идентификации положений аминокислот, иллюстрирует следующее: S110 показывает, что положение 110 занято сериновым остатком в аминокислотной последовательности, показанной в SEQ ID NO: 2. S110P показывает, что сериновый остаток в положении 110 был заменен на пролиновый остаток.
Полипептид
Изобретение относится к новому полипептиду, имеющему NADH-зависимую HMF-редуктазную активность, где указанный полипептид демонстрирует 80% гомологию с аминокислотной последовательностью, показанной в SEQ ID NO: 2, по меньшей мере 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99%, или он такой же, как SEQ ID NO: 2. Полипептид по изобретению имеет несколько уникальных свойств, поскольку фермент использует NADH в качестве кофактора для восстановления HMF и других фурановых соединений и карбонильных соединений, таких как те, которые вырабатываются во время переработки лигноцеллюлозного материала.
Другое свойство выделенного полипептида состоит в том, что аминокислотный остаток в положении 295 или 110 SEQ ID NO: 2 заменен. Однако эта отдельная аминокислота может быть изменена, например, путем замены на другой аминокислотный остаток, такой как небольшой незаряженный аминокислотный остаток. Примеры представляют собой Y295C, или Y295S, или Y295T, или S110P.
В дополнение в полипептиде, показанном в SEQ ID NO: 2, аминокислотный остаток S117 должен быть заменен на L. Замена аминокислотного остатка, присутствующего в положении 295, важна и усиливает фурфуролредуктазу, а замещение обоих аминокислотных остатков, присутствующих в положениях 295 и 110, для получения этанола.
Один пример полипептида показан в SEQ ID NO: 2, в которой аминокислотные остатки 295 представляют собой С или S, 110 представляет собой Р. Другой конкретный пример представляет собой ситуацию, когда аминокислотный остаток 59 представляет собой Т, 210 представляет собой Р, 148 представляет собой Е, 152 представляет собой V и 295 представляет собой С или S в SEQ ID NO: 2. Полипептид, имеющий новую активность, то есть имеющий NADH-зависимую HMF-редуктазную активность, можно вследствие этого использовать в способе, в котором есть необходимость детоксикации фурановых соединений и карбонильных соединений. Также будет возросшей специфичная выработка вследствие того, что восстановление фуранов и карбонильных соединений, токсические эффекты которых замедляют весь процесс, будет более быстрым. Полипептид может быть синтетическим частично или полностью, пока сохранена активность.
Полипептид также может быть гибридным полипептидом. Термин "гибридный фермент" или "гибридный полипептид" предназначен для обозначения, например, тех полипептидов по изобретению, которые содержат первый набор аминокислотных последовательностей, содержащих аминокислотные остатки от приблизительно 110 до приблизительно 295, как показано в SEQ ID NO: 2, слитый/связанный со вторым набором аминокислотных остатков и, таким образом, создавая полностью синтетическую нуклеотидную последовательность, основанную на знании подходящих аминокислотных последовательностей, таких как линкеры, гомологичные аминокислотные последовательности и так далее.
Полипептид по изобретению клонировали из штамма дрожжей Saccharomyces cerevisiae TMB3000 (АТСС96581), у которого выявили наличие уникальной NADH-зависимой HMF-редуктазной активности. Во время исследования полипептида обнаружили, что этот полипептид похож на ADH1 полипептид, который обычно не может восстанавливать HMF. Единичное введение нескольких мутаций в этот полипептид изменило активность этого полипептида, и неожиданно обнаружили, что этот полипептид имел NADH-зависимую HMF-редуктазную активность. Однако полипептид можно получить из любого источника или даже создать путем синтеза при условии, что полипептид имеет свойства, как охарактеризованный полипептид.
Нуклеотидная последовательность
Также в задачу изобретения входит нуклеотидная последовательность, показанная в SEQ ID NO: 1, или нуклеотидная последовательность, имеющая по меньшей мере 60, 65, 70, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% гомологию с нуклеотидной последовательностью, показанной в SEQ ID NO: 1, кодирующая полипептид, имеющий NADH-зависимую HMF-редуктазную активность. Нуклеотидную последовательность можно получить с помощью стандартных методов клонирования, используемых в генной инженерии для перемещения последовательности ДНК из ее естественного местоположения в другое, где она будет воспроизведена. Методы клонирования могут включать вырезание и выделение требуемого фрагмента ДНК, содержащего последовательность ДНК, кодирующую интересующий полипептид, вставку фрагмента в векторную молекулу и введение рекомбинантного вектора в клетку-хозяина, где будут реплицированы множественные копии или клоны последовательности ДНК. На выделенную последовательность ДНК можно воздействовать разными путями для обеспечения экспрессии интересующего полипептида. Манипуляции с последовательностью ДНК до ее включения в вектор могут быть желательны или необходимы в зависимости от вектора. Методики модифицирования последовательностей ДНК с использованием методов рекомбинантных ДНК хорошо известны в данной области техники.
Нуклеотидную последовательность для введения в ДНК клетки-хозяина можно интегрировать в векторы, содержащие нуклеотидную последовательность, функционально связанную с одной или более чем одной регуляторной последовательностью, которая управляет экспрессией кодирующей последовательности в подходящей клетке-хозяине в условиях, совместимых с регуляторными последовательностями. На нуклеотидную последовательность, кодирующую полипептид, можно воздействовать разными путями для обеспечения экспрессии полипептида.
Регуляторная последовательность может представлять собой подходящую промоторную последовательность, нуклеотидную последовательность, которая отвечает в клетке-хозяине за экспрессию нуклеотидной последовательности. Промоторная последовательность содержит транскрипционные регуляторные последовательности, которые опосредуют экспрессию полипептида. Промотор может представлять собой любую нуклеотидную последовательность, которая проявляет транскрипционную активность в предпочтительной клетке-хозяине, включающую нативные, мутантные, усеченные и гибридные промоторы, и может быть получена из генов, кодирующих внеклеточные и внутриклеточные полипептиды или гомологичные, или гетерологичные по отношению к клетке-хозяину. Промотор может быть слабым или сильным промотором, который является конститутивным или регулируемым в используемом хозяине.
Примеры подходящих промоторов для управления транскрипцией конструкций из нуклеиновых кислот в бактериях по настоящему изобретению описаны в "Useful proteins from recombinant bacteria" in Scientific American, 1980, 242: 74-94; и в Sambrook J et al., 1989 Molecular Cloning: A Laboratory Manuel. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, выше.
Примеры подходящих промоторов для управления транскрипцией конструкций из нуклеиновых кислот по настоящему изобретению в клетках-хозяевах нитчатых грибов представляют собой промоторы, полученные из генов ТАКА амилазы Aspergillus oryzae, аспарагиновой протеиназы Rhizomucor miehei, нейтральной альфа-амилазы Aspergillus niger, кислотоустойчивой альфа-амилазы Aspergillus niger, глюкоамилазы (glaA) Aspergillus niger или Aspergillus awamori, липазы Rhizomucor miehei, щелочной протеазы Aspergillus oryzae, триоза-фосфатизомеразы Aspergillus oryzae, ацетамидазы Aspergillus nidulans и трипсиноподобной протеазы Fusarium oxysporum (WO 96/00787), a также NA2-tpi промотор (гибрид промоторов из генов нейтральной альфа-амилаза Aspergillus niger и триоза-фосфатизомеразы Aspergillus oryzae) и мутантные, усеченные и гибридные промоторы.
В дрожжевом хозяине пригодные промоторы можно получить, например, из генов енолазы (ENO1) Saccharomyces cerevisiae, галактокиназы (GAL1) S.cerevisiae, алкогольдегидрогеназы 2 (ADH2), глицеральдегид-3-фосфат-дегидрогеназы (TDH1) S.cerevisiae, глицеральдегид-3-фосфат-дегидрогеназы (TDH3) S.cerevisiae (Bitter and Egan. Expression of heterologous genes in Saccharomyces cerevisiae from vectors utilizing the glyceraldehyde-3-phosphate dehydrogenase gene promoter. (1984) Gene 32: 263-274), алкогольдегидрогеназы 1 (ADH1) S.cerevisiae, 3-фосфоглицерат-киназы (PGK1) S.cerevisiae или цитохрома С (CYC1) S.cerevisiae (Karhumaa et al. Investigation of limiting metabolic steps in the utilization of xylose by recombinant Saccharomyces cerevisiae using metabolic engineering. (2005) Yeast 5: 359-68). Другой пример дрожжевого промотора представляет собой конститутивный усеченный промотор НХТ7 (Hauf et al. Enzym Microb Technol (2000) 26: 688-698). Другие подходящие векторы и промоторы для применения в дрожжевой экспрессии описаны в документе ЕР А-73657 (Hitzeman), который включен сюда посредством ссылки.
Настоящее изобретение также относится к векторам, как определено выше, которые могут содержать последовательность ДНК, кодирующую полипептид, промотор и транскрипционные и трансляционные стоп-сигналы, а также другие последовательности ДНК. Вектор содержит разнообразные ДНК и регуляторные последовательности, известные специалисту в данной области техники, которые можно соединять вместе для создания вектора, который может содержать один и более удобных сайтов рестрикции, чтобы сделать возможной вставку или замену последовательности ДНК, кодирующей полипептид, в таких сайтах. В качестве альтернативы последовательность ДНК по настоящему изобретению можно экспрессировать посредством вставки последовательности ДНК или конструкции ДНК, содержащей последовательность, в подходящий вектор экспрессии. При создании вектора кодирующая последовательность расположена в векторе так, что кодирующая последовательность функционально связана с подходящими регуляторными последовательностями для экспрессии и, возможно, секреции.
Вектор может представлять собой любой вектор (например, плазмидный, вирусный или интеграционный вектор), который можно легко подвергнуть методикам рекомбинантных ДНК и который может осуществить экспрессию последовательности ДНК. Выбор вектора обычно будет зависеть от совместимости вектора с клеткой-хозяином, в которую вводят вектор. Векторы могут быть линейными или замкнутыми кольцевыми плазмидами. Вектор может быть автономно реплицирующимся вектором, то есть вектором, который существует в виде внехромосомного объекта, репликация которого является независимой от репликации хромосомы, например плазмидой, внехромосомным элементом, минихромосомой, космидой или искусственной хромосомой. Вектор может содержать любые ресурсы, обеспечивающие саморепликацию. В качестве альтернативы вектор может быть одним из тех, которые, будучи введены в клетку-хозяина, интегрируются в геном и реплицируются вместе с хромосомой(ами), в которую интегрировались. Векторная система может быть единичным вектором или плазмидой или двумя и более векторами или плазмидами, которые вместе содержат всю ДНК, вводимую в геном клетки-хозяина, или транспозоном. Вектор также может быть интеграционным вектором, содержащим только ген или часть гена для интеграции.
Векторы по настоящему изобретению предпочтительно содержат один или более селектируемых маркеров, которые позволяют легко отобрать трансформированные клетки. Селектируемый маркер представляет собой ген, продукт которого обеспечивает биоцидную или вирусную устойчивость, устойчивость к тяжелым металлам, прототрофность для ауксотрофов и подобное.
Полезные для эукариотических хозяев векторы экспрессии включают, например, векторы, содержащие регуляторные последовательности из SV40 (вируса обезьян 40), вируса папилломы быка, аденовируса или цитомегаловируса. Специфичные векторы представляют собой, например, pCDNA3.1(+)Hyg (Invitrogen, Carlsbad, Calif, U.S.A.) и pCl-neo (Stratagene, La Jolla, Calif., U.S.A.). Полезные векторы экспрессии для дрожжевых клеток включают, например, 2µ (микрон) плазмиду и ее производные, векторы YIp, YEp и YCp, описанные Gietz и Sugino (1988, "New yeast vectors constructed with in vitro mutagenized yeast genes lacking six-base pair restriction sites", Gene 74: 527-534), векторы, описанные в Mumberg et al (Mumberg, Muller and Funk, 1995, "Yeast vectors for the controlled expression of heterologous proteins in different genetic backgrounds." Gene 156: 419-422), вектор YEplac-HXT (Karhumaa et al, 2005. Investigation of limiting metabolic steps in the utilization of xylose by recombinant Saccharomyces cerevisiae using metabolic engineering. Yeast. 22(5): 359-68)), вектор РОТ1 (патент США №4931373), вектор pJSO37, описанный в Okkels, Ann. New York Acad. Sci. 782, 202-207, 1996, векторы pPICZ А, В или С (Invitrogen). Полезные для клеток насекомых векторы включают pVL941, pBG311 (Gate et al., "Isolation of the Bovine and Human Genes for Mullerian Inhibiting Substance and Expression of the Human Gene in Animal Cells", Cell, 45, pp.685-98 (1986)), pBluebac 4.5 и pMelbac (оба доступны от Invitrogen). Полезные векторы экспрессии для бактериальных хозяев включают известные бактериальные плазмиды, такие как плазмиды из Е. coli, включая pBR322, рЕТ3а и рЕТ12а (обе от Novagen Inc., Wis., U.S.A.), плазмиды с более широким спектром хозяев, такие как RP4, ДНК фагов, например множество производных фага лямбда, например NM989, и других ДНК-фагов, таких как М13 и нитевидные одноцепочечные ДНК фаги. Примеры подходящих вирусных векторов представляют собой аденовирусные векторы, аденоассоциированные вирусные векторы, ретровирусные векторы, лентивирусные векторы, герпес-векторы и цитомегаловирусные векторы.
Векторы по настоящему изобретению могут содержать элемент(ы), который(е) дает(ют) возможность стабильной интеграции вектора в геном клетки-хозяина или автономной репликации вектора в клетке, независимой от генома клетки. Векторы по настоящему изобретению можно интегрировать в геном клетки-хозяина при введении в клетку-хозяина. Для интеграции вектор может быть основан на последовательности ДНК, кодирующей интересующий полипептид, или любом другом элементе вектора для стабильной интеграции вектора в геном с помощью гомологичной или негомологичной рекомбинации.
В качестве альтернативы вектор может содержать дополнительные последовательности ДНК для управления интеграцией в геном клетки-хозяина с помощью гомологичной рекомбинации. Дополнительные последовательности ДНК дают возможность вектору интегрироваться в геном клетки-хозяина в определенном(ых) месте(ах) в хромосоме(ах). Чтобы увеличить вероятность интеграции в определенное место, интеграционные элементы предпочтительно должны содержать достаточное количество нуклеотидов, такое как 100-1500 пар оснований, предпочтительно 400-1500 пар оснований и наиболее предпочтительно 800-1500 пар оснований, которые высоко гомологичны соответствующей последовательности-мишени, чтобы увеличить возможность гомологичной рекомбинации. Интеграционные элементы могут быть любой последовательностью, которая гомологична последовательности-мишени в геноме клетки-хозяина. Кроме того, интеграционные элементы могут быть некодирующими или кодирующими последовательностями ДНК. С другой стороны, вектор можно интегрировать в геном клетки-хозяина с помощью негомологичной рекомбинации. Эти последовательности ДНК могут быть любыми последовательностями, которые гомологичны последовательности-мишени в геноме клетки-хозяина, и, кроме того, могут быть некодирующими или кодирующими последовательностями. Более одной копии последовательности ДНК, кодирующей интересующий полипептид, можно ввести в клетку-хозяина, чтобы усилить экспрессию последовательности ДНК.
Выделенная клетка-хозяин
Изобретение также относится к выделенной клетке-хозяину, которая содержит нуклеотидную последовательность, как описано выше, или в векторе, таком как вектор экспрессии, или в качестве альтернативы имеет нуклеотидную последовательность, интегрированную в геном, например, с помощью гомологичной или гетерологичной рекомбинации. Нуклеотидная последовательность может быть представлена в виде одной копии или множества копий.
Клеткой-хозяином может быть любая подходящая прокариотическая или эукариотическая клетка, например бактериальная клетка, клетка нитчатых грибов, дрожжевая клетка, растительная клетка или клетка млекопитающего. Любую подходящую клетку-хозяина можно использовать для сохранения и получения вектора по изобретению, такую как эукариотическая или прокариотическая клетка, например бактериальная, грибная (включая дрожжи), растительная клетка, клетка насекомого, млекопитающего или другие подходящие клетки или линии клеток животных, а также трансгенные животные или растения. Клетка-хозяин может быть клеткой-хозяином, принадлежащей линии клеток, сертифицированной согласно Правилам организации производства и контроля качества лекарственных средств (GMP), такой как линия клеток млекопитающих.
Примеры бактериальных клеток-хозяев включают Escherichia coli, Zymomonas sp. и Klebsiella sp.
Примеры подходящих клеток-хозяев нитчатых грибов включают Aspergillus sp., например A.oryzae, A.niger или A.nidulans, Fusarium sp. или Hypocrea (ранее Trichoderma) sp.
Примеры подходящих дрожжевых клеток-хозяев включают Saccharomyces sp., например S.cerevisiae, S.bayanus или S.carlsbergensis, Schizosaccharomyces sp., такие как Sch. pombe, Kluyveromyces sp., такие как К.lactis, Pichia sp., такие как Р.stipitis, P.pastoris или Р.methanolica, Hansenula sp., такие как H.polymorpha, Candida sp., такие как С.Shehatae, или Yarrowia sp.. Примеры штаммов S.cerevisiae представляют собой DBY746, AH22, S150-2B, GPY55-15Bα, CEN.PK, USM21, TMB3500, TMB3400, VTT-A-63015, VTT-A-85068, VTT-c-79093) и их производные, а также Saccharomyces sp.1400, 424А (LNH-ST), 259A (LNH-ST) и их производные.
Примеры подходящих клеток-хозяев насекомых включают линию клеток Lepidoptora, таких как Spodoptera frugiperda (Sf9 или Sf21) или клетки Trichoplusioani (High Five) (патент США №5077214).
Примеры подходящих клеток-хозяев млекопитающих включают линии клеток яичников китайских хомячков (СНО) (например, СНО-К1; АТСС CCL-61 (АТСС - Американская коллекция типовых культур)), линии клеток зеленых мартышек (COS) (например, COS 1 (АТСС CRL-1650), COS 7 (АТСС CRL-1651)), клетки мышей (например, NS/O), линии клеток почки детенышей хомяков (ВНК) (например, АТСС CRL-1632 или АТСС CCL-10) и клетки человека (например, НЕК 293 (АТСС CRL-1573)), а также растительные клетки в культуре ткани.
Полипептид, нуклеотидную последовательность, вектор или клетку-хозяина по изобретению можно использовать в производстве биотоплива, крупнотоннажных и платформных химикатов, таких как этанол, бутанол, лактат, 1,4-дикарбоновые кислоты (янтарная, фумаровая, яблочная), глицерин, сорбит, маннит, ксилит/арабинит, L-аскорбиновая кислота, ксилит, газообразный водород, 2,5-фурандикарбоновая кислота, 3-гидроксипропионовая кислота, аспарагиновая кислота, глутаровая кислота, глутаминовая кислота, итаконовая кислота, левулиновая кислота и 3-гидроксибутиролактон, жирные кислоты, молекулы, являющиеся производными жирных кислот, изопреноиды, молекулы, являющиеся производными изопреноидов, алканы, изопентанол, изоамилацетат. Общая схема способа превращения лигноцеллюлозного сырья в крупнотоннажные химикаты, такие как этанол, может включать такие стадии, как предварительная обработка или стадия фракционирования, на которой измельченное сырье подвергают воздействию нейтрального, кислого или щелочного pH при высокой температуре с добавлением воздуха/кислорода или без него так, что фракция гемицеллюлозы частично гидролизуется до мономерных и олигомерных сахаров, приводя целлюлозную фракцию в состояние восприимчивости к гидролизу, или на которой измельченное сырье подвергают воздействию органического растворителя, такого как ацетон, этанол и подобные, при высокой температуре, так что фракция лигнина растворяется и ее экстрагируют, что приводит целлюлозную и гемицеллюлозную фракции в состояние восприимчивости к гидролизу. Гидролиз предварительно обработанного и фракционированного материала можно осуществлять с помощью концентрированных или разбавленных кислот или с помощью смесей целлюлозолитических и гемицеллюлозолитических ферментов.
Следующие примеры предназначены для иллюстрации, но не для ограничения изобретения любым способом или формой, явно или неявно.
ПРИМЕРЫ
ПРИМЕР 1
Идентификация NADH-зависимой HMF-редуктазы
Очистка NADH-зависимой HMF-редуктазы
Промышленный штамм ТМВ3000 (АТСС96581) (Lindén et al., 1992, Isolation and characterization of acetic acid-tolerant galactose-fermenting strains of Saccharomyces cerevisiae from a spent sulfite liquor fermentation plant. Applied Environmental Microbiology 58(5): 1661-1669) выращивали на богатой среде, содержащей 10 г/л экстракта дрожжей, 20 г/л пептона и 20 г/л глюкозы, дополненной 10% гидролизатом ели (Nilvebrant et al., 2003, Limits for alkaline detoxification of dilute-acid lignocellulose hydrolysates. Applied Biochemistry Biotechnology. 105-108: 615-628), доведенной до pH 5,5. Гидролизат центрифугировали в течение 10 минут при 5000 g и надосадочную жидкость пропускали через 2µ фильтр (Sarstedt, Nümbrecht, Germany) перед добавлением к автоклавированной среде. Рост происходил в 1 л качалочных колбах (без перегородки), содержащих 250 мл среды, при 200 об/мин и 30°C. Посев из 5 мл ночной предварительной культуры на богатую среду (без гидролизата) имел оптическую плотность при 620 нм (OD620), равную 0,1, и клетки собирали через 24 часа при OD620 примерно 4.
Клетки собирали и промывали два раза дважды дистиллированной водой перед ресуспендированием в детергенте Y-PER (Pierce, Rockford, IL) 1 мл на 0,6 г клеток. После легкого встряхивания при комнатной температуре в течение 50 минут суспензию центрифугировали в течение 20 минут при 15000 g. Надосадочную жидкость собирали и использовали для ферментативных анализов и дополнительных стадий очистки. Кумасси-реагент для анализов белков (Pierce, Rockford, IL) использовали в анализе по Брэдфорду для определения концентрации белка согласно рекомендациям производителя. Измерения NADH-зависимого восстановления фурана проводили согласно Wahlbom и Hahn-Hägerdal (2002, Furfural, 5-hydroxymethyl furfural, and acetoin act as external electron acceptors during anaerobic fermentation of xylose in recombinant Saccharomyces cerevisiae. Biotechnology and Bioengineering. 78(2): 172-178) со следующей модификацией: концентрацию NADH устанавливали 200 мкМ. Все измерения были выполнены при 30°C на спектрофотометре U-2000 (Hitachi, Tokyo, Japan).
Для идентификации фермента, ответственного за NADH-зависимое HMF-восстановление, белковый раствор фракционировали, используя осаждение сульфатом аммония, эксклюзионную и аффинную хроматографию согласно следующему протоколу: клеточный экстракт (15 мл) смешивали с 10 мл насыщенного раствора сульфата аммония до конечной концентрации 40%. После 1 час легкого встряхивания при 4°C смесь центрифугировали при 15000 g в течение 20 минут. Осадок хранили на льду для немедленного использования или при -20°C для более позднего использования (назвали 40% осадок), в то время как надосадочную жидкость смешивали с равным объемом так, что получился 70% раствор сульфата аммония. После 3 часов легкого встряхивания при 4°C повторили центрифугирование при 15000 g в течение 20 минут. Осадок снова хранили на льду или при -20°C (назвали 70% осадок), в то время как надосадочную жидкость (приблизительно 40 мл) диализировали в течение ночи против 12 л дистиллированной воды при 4°C, используя мембранные трубки Spectra/Рог (Номинальное Отсечение по Молекулярной Массе (MWCO) 12 кДа - 14 кДа) от Spectrum Laboratories, CA, USA. Эксклюзионную хроматографию осуществляли, используя колонку HiLoad 16/60 Superdex 200 (Amersham Pharmacia Biotech, Uppsala, Sweden). Буфер содержал 100 мМ Tris-HCl и 0,5 М NaCl (pH повышали до 6,7 NaOH), оба от Merck, Darmstadt, Germany. Скорость потока установили на 1 мл/мин, используя систему жидкостной экспресс-хроматографии белков (FPLC) (Amersham Pharmacia Biotech, Uppsala, Sweden), управляемую контроллером LCC-501 Plus. 50 мл набухшего красной сефарозы CL-6B поместили в колонку ХК50, оба от Amersham Pharmacia Biotech, Uppsala, Sweden. Связывающий буфер содержал 20 мМ