Набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для субтипоспецифичной идентификации рнк вируса денге на основе мультиплексной пцр в реальном времени
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии. Предложен набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для субтипоспецифичной идентификации РНК вируса денге на основе мультиплексной ПЦР в реальном времени. Изобретение может быть использовано в медицине в качестве средства для субтипоспецифичной идентификации РНК вируса денге. 2 ил., 3 табл., 2 пр.
Реферат
Изобретение относится к средствам диагностики РНК субтипов вируса денге и может быть использовано в биотехнологии, в частности в генетической инженерии, а также в медицине для выявления генетического материала (РНК) вируса денге 4-х субтипов в клинических или секционных пробах с целью постановки диагноза или коррекции лечения, а также для решения научно-исследовательских задач по изучению свойств флавивирусов, созданию диагностических, профилактических или лечебных препаратов против флавивирусов. При помощи набора диагностических праймеров возможно одновременное выявление генетического материала (РНК) вируса денге 4-х субтипов в исследуемом образце с возможностью дифференциации субтипа.
Вирусы денге входят в семейство флавивирусов (Flaviviridae). Семейство Filoviridae в соответствии с последними решениями Международного Таксономического Комитета включает в себя четыре рода: Flavivirus, Pestivirus, Hepacivirus и unassigned viruses (http://www.ictvdb.org/Ictv/fs_flavi.htm#Genus1).
Вирусы денге входят в семейство флавивирусов (Flaviviridae). Семейство Filoviridae в соответствии с последними решениями Международного Таксономического Комитета, включает в себя четыре рода: Flavivirus, Pestivirus, Hepacivirus и unassigned viruses (http://www.ictvdb.org/Ictv/fs_flavi.htm#Genus1).
В род Flavivirus входит dengue virus group, в которую включены:
Вирусы денге
Вирус денге субтип 1 (Dengue virus 1, DENV-1);
Вирус денге субтип 2 (Dengue virus 2, DENV-2);
Вирус денге субтип 3 (Dengue virus 3, DENV-3);
Вирус денге субтип 4 (Dengue virus 4, DENV-4).
Вирус Кедогоу (Kedougou virus, KEDV)
Заболевание лихорадкой денге возникает при заражении одним из 4-х субтипов вируса денге. На ранней стадии инфекции дифференциальная диагностика лихорадки денге затруднительна. Кроме того, на ранней стадии нельзя спрогнозировать тяжесть заболевания и развитие осложнений, поэтому от своевременной диагностики зависит комплекс лечебных, профилактических и противоэпидемических мероприятий [1]. Перенесенное заболевание, вызванное одним из 4-х субтипов вируса денге, не защищает от повторного заражения другим субтипом. Необходимость диагностировать субтипы друг от друга вызвана возникновением тяжелых геморрагических осложнений при повторном заражении другим субтипом [2]. Высокая летальность наблюдается у лиц, повторно заболевших лихорадкой денге, вызванной субтипом 1, раннее переболевших лихорадкой денге, вызванной субтипом 2 [3].
Известен набор праймеров для диагностики вируса денге 4 типа (патент CN 101240350, МПК C12N15/11, C12Q1/68, опубл. 13.08.2008 г.)[4]. Primer and probe sequence for detecting dengue virus IV type nucleic acid fragment:
GAAAGGACCCTTACGGATGGT
AGAATCCCTGCTGTTGGTGG
TCATCACGTTTTTGCGAGTCCTTTCCA
Известен набор праймеров для диагностики вируса денге 4 типа (патент CN 101139638 , МПК C12N15/11, C12Q1/68, опубл. 12.03.2008 г.) [5]. Primer and probe sequence for detecting dengue virus III nucleotides fragment:
GGAAAACCGTCTATCAATATGCTG
TCCTCTTGAGAATCTCTTCGCC
CGCGTGAGAAACCGTGTGTCAACTG
Известен набор праймеров для диагностики вируса денге 4 типа (патент CN 101240349 , МПК C12N15/11, C12Q1/68, опубл. 13.08.2008 г.) [6]. Primer and probe sequence for detecting dengue virus II type nucleic acid fragment:
TTCATGGCCCTGGTGGC
TGATTTTTTRATTGTTCCCCATCT
CGTTTCCTAACAATCCCACCAACAGC
Известен набор праймеров для диагностики вируса денге 4 типа (патент CN 101139637, МПК C12N15/11, C12Q1/68, опубл. 12.03.2008 г.) [7]. Primer and probe sequence for detecting dengue virus 1 nucleotides fragment:
TGTTTTCTTTGCATTTGCTCCA
CGAAYCCAACTATAGAAGAAGGAAGAAC
CCTCTGAGCCATGGTTCCACCATCTT
Однако детальный анализ вышеприведенных аналогов (праймеров и олигонуклеотидных зондов) показал, что в ряде случаев данные наборы могут не обеспечить надежной идентификации вируса денге, поскольку в последние четыре года были выявлены геноварианты вируса, для которых вышеназванные наборы праймеров и зондов не обладают достаточной специфичностью, чтобы обеспечить надежный синтез целевых фрагментов ДНК. В ходе анализа была выявлена недостаточная субтипоспецифичность данных наборов, в ряде случаев возможно возникновение перекрестной реакции на другие субтипы вируса денге, это может привести к неправильной идентификации субтипов вируса денге.
Наиболее близким аналогом (прототипом) являются праймеры и зонды, используемые в однораундовой ПЦР тест-системе для выявления РНК вируса денге методом обратной транскрипции в режиме реального времени. Использованные в данной тест-системе праймеры и зонд рассчитаны на 3'UTR (Huhtamoa E, Hasua E, Uzcateguia N, Errab E, Nikkaric S, Kanteleb A, Vapalahtia O, Piiparinena H. Early diagnosis of dengue in travelers: Comparison of a novel real-time RT-PCR, NS1 antigen detection and serology // J. of Clinical Virol. - 2010. - Vol. 47. - P. 49-53) [8].
Однако данная тест-система не позволяет определить субтип вируса денге. Накопленные данные по геномному разнообразию субтипов вируса денге и детальный анализ этих данных показали, что этот набор праймеров в ряде случаев может не обеспечить надежной идентификации вируса денге, поскольку в последние пять лет были выявлены геноварианты вируса, для которых вышеназванный набор праймеров не обладает достаточной специфичностью, чтобы обеспечить надежный синтез целевых фрагментов ДНК.
Техническим результатом изобретения является создание средства для субтипоспецифичной идентификации РНК вируса денге на основе мультиплексной ПЦР в реальном времени
Указанный технический результат достигается тем, что создан набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для субтипоспецифичной идентификации РНК вируса денге на основе мультиплексной ПЦР в реальном времени, включающий:
универсальные праймеры на четыре субтипа вируса денге:
5΄→3΄ 5΄ CTAGYGGTTAGAGGAGACCCCT 3΄
3΄←5΄ 5΄ GAGACAGCAGGATCTCTGGTCT 3΄
специфические зонды на 1 субтип вируса денге:
FAM- AGGGGAAGCTGTACCITGGTGGTAAG - BHQ1
специфические зонды на 2 субтип вируса денге:
ROX- CCCAAGGIGAGATGAAGCTGTAITC - BHQ2
специфические зонды на 3 субтип вируса денге:
RG6- CCGAGCACTGAGGGAAGCTGTACCT - BHQ2
специфические зонды на 4 субтип вируса денге:
Cy5- AGGAGGAAGCTGTACITCTGGTGGAA -BHQ2
На основе заявляемого набора создан лабораторный вариант мультиплекс тест-системы, основанной на методе ОТ-ПЦР в режиме реального времени, для идентификации генетического материала вируса денге с возможностью дифференциации субтипа в клинических образцах и биологических жидкостях, образцах внешней среды и других вируссодержащих пробах (культуральная вируссодержащая жидкость и др.).
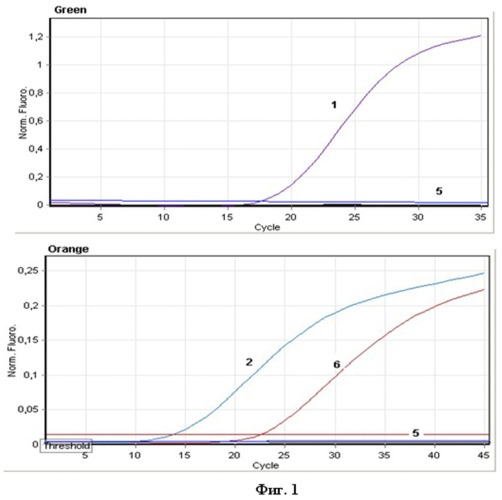
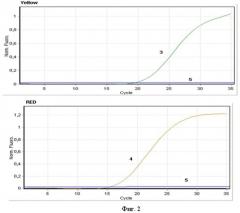
На фиг. 1 и 2 приведены кривые флуоресценции на четырех оптических каналах амплификатора Rotor Gene 6000 (Corbett Research, Австралия). Положительные контрольные образцы (кривая 1-4), отрицательный контрольный образец (кривая 5), образец, содержащий генетический материал вируса денге (кривая 6).
Описание конструирования диагностических праймеров и флуоресцентно-меченых зондов.
На консервативную область 3'UTR; конструирования рекомбинантной плазмидной ДНК pCR 2.1 (TOPO), несущей специфический для каждого из субтипов вируса денге участок ДНК-матрицы; оптимизации концентраций компонентов реакционной смеси и условий проведения ПЦР.
На начальном этапе был проведен поиск и определение наиболее консервативных участков генома вируса денге по известным нуклеотидным последовательностям штаммов четырех субтипов вируса денге, представленным в базе данных NCBI Mega BLAST (http://www.ncbi.nlm.nih.gov/). В качестве мишени для диагностических праймеров был выбран нетранслируемый регион UTR3 вирусной РНК.
Последовательности праймеров и зондов, температуры их отжига и размеры продуктов амплификации представлены в таблице 1 и 2.
Подбор и анализ свойств олигонуклеотидных праймеров и зондов проводился с использованием программного обеспечения Vector NTI 9.0.0 (InforMax).
Таблица 1
Праймеры для детекции вируса денге.
| Вирус денге | Зонды | Структура олигонуклеотидной последовательности | Т отжига (0 С) | Размер ампликона |
| Субтип 1-4 | F10552 | CTAGYGGTTAGAGGAGACCCCT | 54,8 | 170 |
| R10722 | GAGACAGCAGGATCTCTGGTCT | 54,8 |
Таблица 2
Зонды для детекции 4-х субтипов вируса денге.
| Вирус денге | Зонды | Структура олигонуклеотидной последовательности | Т отжига (0 С) |
| Субтип 1 | Z10617 | FAM - AGGGGAAGCTGTACCITGGTGGTAAG - BHQ1 | 64,9 |
| Субтип 2 | Z1607 | ROX - CCCAAGGIGAGATGAAGCTGTAITC - BHQ2 | 63,1 |
| Субтип 3 | Z10609 | RG6 - CCGAGCACTGAGGGAAGCTGTACCT - BHQ2 | 64,1 |
| Субтип 4 | Z10616 | Cy5 - AGGAGGAAGCTGTACITCTGGTGGAA -BHQ2 | 61,4 |
Пример 1. Проверка аналитической чувствительности набора праймеров и зондов.
Для контроля амплификации были получены положительные контрольные образцы, представляющие собой рекомбинантные плазмиды, несущие вирусспецифические вставки, являющиеся матрицей для амплификации вирусспецефических ДНК-фрагментов.
Для проведения ПЦР в режиме реального времени в качестве анализируемых образцов использовали рекомбинантную плазмидную ДНК, включающую вставку ДНК, соответствующую детектируемым участкам геномов каждого субтипа вируса денге.
Условия проведения амплификации оптимизировались по следующим параметрам: концентрация ионов магния в реакционной смеси; концентрация праймеров и зондов в реакционной смеси; температура отжига праймеров.
Для определения чувствительности набора из концентрированного раствора плазмидной ДНК были приготовлены последовательные 10-кратные разведения. Определение концентрации ДНК в разведениях при исследовании чувствительности праймеров осуществляли при помощи флуориметра QUBIT (Invitrogen, США) и наборов реагентов производителя.
ПЦР в режиме реального времени и регистрацию результатов проводили в приборе Rotor Gene 6000 (Corbett Research, Австралия) по каналам Green (470 nm / 510 nm) для субтипа 1 вируса денге, Orange (585 nm / 620 nm) для субтипа 2 вируса денге, Yellow (530 nm / 555 nm) для субтипа 3 вируса денге и Red (640 nm / 670 nm) для субтипа 4 вируса денге.
В результате выполненных экспериментов была определена аналитическая чувствительность тест-системы в формате мультиплекс. Она составила 30 - 40 геномных эквивалентов (плазмидной ДНК, содержащей вирусспецифическую вставку каждого субтипа вируса денге) на 30 мкл реакционной смеси.
Для определения аналитической чувствительности моновариантов систем «праймеры-зонд» для детекции каждого субтипа вируса денге из концентрированных растворов положительных контрольных образцов были приготовлены последовательные 10-кратные разведения. Определение концентрации ДНК в разведениях при исследовании чувствительности праймеров осуществляли при помощи коммерческого набора «Quant-iT dsDNA, HS» («Invitrogen», США) и флуориметра QUBIT («Invitrogen», США). Минимальное количество ДНК-матриц, детектируемое с применением наших праймеров и зондов после оптимизации условий проведения реакции, выраженное в ГЭ (геномных эквивалентах) в 30 мкл реакционной смеси, представлено в таблице 3.
Таблица 3.
Аналитическая чувствительность моновариантов систем «праймеры-зонд»
| Вирус денге | Аналитическая чувствительность (ГЭ) |
| Субтип 1 | 20 |
| Субтип 2 | 30 |
| Субтип 3 | 30 |
| Субтип 4 | 40 |
Пример 2. Определение РНК вируса денге в клиническом образце.
Инактивацию образцов и выделение РНК проводили в условиях, регламентированных Методическими указаниями МУ 1.3. 2569 -09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности».
Процедуру выделения РНК из исследуемого материала проводили с использованием набора реагентов «Рибо-сорб» (ФГУН ЦНИИЭ Роспотребнадзора) в соответствии с инструкцией по применению.
Реакцию обратной транскрипции проводили с использованием набора реагентов «Реверта-L» (ФГУН ЦНИИЭ Роспотребнадзора) в соответствии с инструкцией по применению.
ПЦР в режиме реального времени проводили с праймерами F10552 и R10722, фланкирующими участок ДНК в 170 п.н., в реакционной смеси следующего состава (на 1 исследование):
| кДНК | 2 мкл |
| 10×Taq буфер без Mg2+ | 3 мкл |
| 100 mM раствор MgCl2 | 1 мкл |
| 5 mM раствор dNTP | 1 мкл |
Смесь праймеров
| (концентрация каждого 10-15 мкмол/л) | 2 мкл |
| Зонд (концентрация 5-10 мкмол/л) | 1 мкл |
| Hot Start Taq DNA-Полимераза 5 ед/ мкл | 0,3 мкл |
| Вода для ПЦР | 16,7 мкл |
__________________________________________
| Общий объем | 30 мкл |
В качестве отрицательного контрольного образца в реакционную смесь добавляли ТЕ-буфер.
ПЦР в режиме реального времени и регистрацию результатов проводили в приборе Rotor Gene 6000 (Corbett Research, Австралия) по следующей программе:
| Температура (0С) | Время (минуты:секунды) | Количество циклов |
| 95 | 05:00 | 1 |
| 95 | 00:15 | 45 |
| 55 | 00:20 | |
| 72 | 00:15 |
Измерение флуоресценции проводили на приборе “Rotor Gene 6000” по каналам Green (470 nm / 510 nm) для субтипа 1 вируса денге, Orange (585 nm / 620 nm) для субтипа 2 вируса денге, Yellow (530 nm / 555 nm) для субтипа 3 вируса денге и Red (640 nm / 670 nm) для субтипа 4 вируса денге, при температуре 55 °С.
Результаты интерпретировали на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, что соответствует наличию (или отсутствию) значения порогового цикла Ct в соответствующей графе в таблице результатов. Результат считали положительным в случае, если кривая накопления флуоресценции для соответствующего образца имела характерную «сигмовидную» форму и пересекала пороговую линию. При этом значение Ct для данного образца было не больше 40 (Фиг. 1 и 2).
Таким образом, на основе приведенных выше примеров подтвержден заявленный технический результат.
Источники научно-технической и патентной информации
1. WHO. Dengue and dengue haemorrhagic fever // Factsheet No 117, revised May 2008. Geneva. World Health Organization, 2008 (http://www.who.int/mediacentre/factsheets/fs117/en/).
2. World Health Organization. Dengue: guidelines for diagnosis, treatment, prevention and control - New edition // WHO/HTM/NTD/DEN - 2009.1.
3. Sierra B, Kouri G, Guzman MG. Race: a risk factor for dengue hemorrhagic fever // Arch. Virol. - 2007. - Vol. 152. - P. 533-542.
4. Патент CN,101240350, МПК C12N15/11, C12Q1/68, опубл. 13.08.2008 г.
5. Патент CN 101139638 , МПК C12N15/11, C12Q1/68, опубл. 12.03.2008 г.
6. Патент CN 101240349 , МПК C12N15/11, C12Q1/68, опубл. 13.08.2008 г.
7. Патент CN 101139637, МПК C12N15/11, C12Q1/68, опубл. 12.03.2008 г.
8. Huhtamoa E, Hasua E, Uzcateguia N, Errab E, Nikkaric S, Kanteleb A, Vapalahtia O, Piiparinena H. Early diagnosis of dengue in travelers: Comparison of a novel real-time RT-PCR, NS1 antigen detection and serology // J. of Clinical Virol. - 2010. - Vol. 47. - P. 49-53.
Приложение
Перечень последовательностей
универсальные праймеры на четыре субтипа вируса денге:
5΄→3΄ 5΄ CTAGYGGTTAGAGGAGACCCCT 3΄
3΄←5΄ 5΄ GAGACAGCAGGATCTCTGGTCT 3΄
специфические зонды на 1 субтип вируса денге:
FAM- AGGGGAAGCTGTACCITGGTGGTAAG - BHQ1
специфические зонды на 2 субтип вируса денге:
ROX- CCCAAGGIGAGATGAAGCTGTAITC - BHQ2
специфические зонды на 3 субтип вируса денге:
RG6- CCGAGCACTGAGGGAAGCTGTACCT - BHQ2
специфические зонды на 4 субтип вируса денге:
Cy5- AGGAGGAAGCTGTACITCTGGTGGAA -BHQ2.
Набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для субтипоспецифичной идентификации РНК вируса денге на основе мультиплексной ПЦР в реальном времени, включающий:универсальные праймеры на четыре субтипа вируса денге:5'→3' 5' CTAGYGGTTAGAGGAGACCCCT 3'3'←5' 5' GAGACAGCAGGATCTCTGGTCT 3'специфические зонды на 1 субтип вируса денге:FAM- AGGGGAAGCTGTACCITGGTGGTAAG - BHQ1специфические зонды на 2 субтип вируса денге:ROX- CCCAAGGIGAGATGAAGCTGTAITC - BHQ2специфические зонды на 3 субтип вируса денге:RG6- CCGAGCACTGAGGGAAGCTGTACCT - BHQ2специфические зонды на 4 субтип вируса денге:Су5- AGGAGGAAGCTGTACITCTGGTGGAA -BHQ2