Способ дифференциальной диагностики хронической обструктивной болезни легких и бронхиальной астмы
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к пульмонологии, и может быть использовано для дифференциальной диагностики хронической обструктивной болезни легких (ХОБЛ) и бронхиальной астмы (БА) при сомнительной клинико-рентгенологической симптоматике. Для этого проводят вентиляционно-перфузионную сцинтиграфию легких. Далее определяют альвеолярно-капиллярную проницаемость радиоактивного аэрозоля, апикально-базальный градиент перфузии (U/L-q) и апикально-базальный градиент вентиляции (U/L-v). При этом альвеолярно-капиллярную проницаемость радиоактивного аэрозоля определяют на 30-й мин исследования из обоих легких. При повышенной до 25% и более проницаемости ингалируемого радиоактивного аэрозоля и при величине апикально-базального градиента вентиляции (U/L-v) 0,6 и ниже - диагностируют БА. При равномерно замедленной альвеолярно-капиллярной проницаемости радиоактивного аэрозоля из обоих легких и при величине апикально-базального градиента перфузии (U/L-q) свыше 0,8 - диагностируют ХОБЛ. Способ обеспечивает более точную диагностику ХОБЛ и БА на ранних стадиях развития данных заболеваний. 6 ил., 2 пр.
Реферат
Изобретение относится к медицине, конкретно к респираторной медицине, и может быть использовано в медицинских учреждениях, оснащенных радиодиагностическими лабораториями.
Дифференциальная диагностика хронической обструктивной болезни легких (ХОБЛ) и бронхиальной астмы (БА) чрезвычайно важна на ранних стадиях развития указанных заболеваний, когда клинические проявления данных патологических состояний могут быть весьма сходными [1]. Как известно, ХОБЛ и БА относятся к наиболее распространенным заболеваниям человека. Так например, в России по результатам подсчетов с использованием эпидемиологических маркеров предположительно около 11 млн больных, а по официальной медицинской статистике - около 1 млн страдают ХОБЛ. Это разночтение связано с тем, что заболевание диагностируется в поздних стадиях, когда лечение не позволяет затормозить неуклонно прогрессирующий патологический процесс в легких [1, 2]. При этом по данным Европейского респираторного общества только 25% случаев заболевания диагностируется своевременно [3].
Смертность от обструктивных болезней легких в нашей стране составляет 35,3 на 100000 население. При этом в 80% причиной смерти и более чем в 50% причиной инвалидности среди заболеваний бронхолегочной системы оказалась хроническая обструктивная болезнь легких и ее осложнения [1, 2].
В связи с широким распространением ХОБЛ прямые медицинские и непрямые расходы, связанные с заболеваемостью и преждевременной смертностью, могут представлять серьезную экономическую и социальную проблему для общества, населения и органов здравоохранения [4].
По экспертной оценке академика А.Г.Чучалина, основанной на сопоставлении результатов эпидемиологических исследований и данных медицинской статистики по обращаемости, общее число больных бронхиальной астмой в России приближается к 7 млн человек, тогда как по официальной статистике - в пределах 1 млн [1]. Заболеваемость БА имеет стойкую тенденцию роста: только с 1998 по 2002 гг. заболеваемость возросла на 28,2% [5]. Анализ результатов эпидемиологических исследований свидетельствует о гиподиагностике врачами БА. При этом подчеркивается, что неадекватная диагностика ведет и к неадекватному лечению данного заболевания.
Известно, что дифференциальная диагностика БА и ХОБЛ основана на интеграции основных данных клиники, результатов функциональных и лабораторных тестов. К сожалению, до настоящего времени нет лабораторного маркера, надежно дифференцирующего эти две болезни. Основной акцент в дифференциальной диагностике делается на установлении главных признаков, определяющих сущность болезни: для БА - волнообразность и обратимость симптоматики, а для ХОБЛ - неуклонное прогрессирование и отсутствие обратимости, однако, эти позиции можно проследить только во времени, т.е. при продолжительном динамическом наблюдении за больным [1, 6].
Основным функциональным синдромом при ХОБЛ и БА, прежде всего, является нарушение бронхиальной проходимости, которое выявляется при исследовании функции внешнего дыхания. Общепринятыми методами регистрации бронхиальной обструкции являются спирометрия и пневмотахометрия, проведенные во время форсированного экспираторного маневра. Обладая высокой степенью воспроизводимости, данные параметры позволяют документально зарегистрировать у пациента наличие обструкции и в дальнейшем следить за состоянием бронхиальной проходимости и ее изменчивостью. Однако недостатком данного способа является то, что имеется многообразие причин снижения объема форсированного выдоха (ОФВ1), в частности, его снижение может быть обусловлено внелегочными причинами: изменениями нервной и мышечно-скелетной систем, кожи и подкожных тканей, вдыхаемого газа и др. [3, 7].
В качестве способа дифференциальной диагностики заболеваний легких известен способ неинвазивной диагностики легочной патологии с помощью вентиляционно-перфузионной пульмоносцинтиграфии, с определением вентиляционно-перфузионного соответствия и альвеолярно-капиллярной проницаемости (АКП) легких [8]. Для этого после ингалирования пациентом радиоактивного аэрозоля проводят запись сцинтиграфичесих изображений легких в динамическом режиме, течение 30 мин, затем статическую пульмоносцинтиграфию в четырех стандартных проекциях. После этого внутривенно вводится радиофармпрепарат (РФП) - макроагрегаты альбумина, меченные 99m-Технецием (99mTc-МАА), и проводят перфузионную сцинтиграфию легких по общепринятой методике [9, 10].
Данный способ является наиболее близким к заявляемому по технической сущности и достигаемому результату и выбран в качестве прототипа. Недостатком его применительно к дифференциальной диагностике БА и ХОБЛ являются отсутствие единых методических приемов проведения исследования, обработки получаемой информации и, как следствие этого, неоднозначная трактовка результатов, вследствие чего применительно к дифференцированию указанных заболеваний данная методика не нашла своего применение.
Цель изобретения - повышение точности диагностики хронической обструктивной болезни легких и бронхиальной астмы на ранних стадиях развития указанных заболеваний.
Указанная цель достигается путем проведения вентиляционно-перфузионной сцинтиграфии легких, определения верхушечно-базального градиентов перфузии и вентиляции, оценки альвеолярно-капиллярной проницаемости из всего как правого, так и левого легкого в статическом режиме в заднепрямой проекции и при повышенной до 25% и более проницаемости ингалируемого радиоактивного аэрозоля из обоих легких на 30-й мин исследования, а также при одновременном увеличении апикально-базального градиента перфузии (U/L-q) свыше 0,8 и снижении апикально-базального градиента вентиляции (U/L-v) до 0,6 и ниже диагностируют бронхиальную астму, а при равномерно замедленной альвеолярно-капиллярной проницаемости радиоактивного аэрозоля из обоих легких по сравнению с контрольными показателями курящих здоровых лиц и при величине апикально-базального градиента перфузии (U/L-q) свыше 0,8 диагностируют хроническую обструктивную болезнь легких.
Новым в предлагаемом способе является регистрация и расчет альвеолярной проницаемости из всего легкого в статическом режиме в заднепрямой проекции на 1-й и 30-й мин исследования, определение раздельно в каждом легком доли аккумуляции ингалированного и перфузируемого радиофармпрепаратов в верхней, средней и нижней зонах с последующим расчетом апикально-базального градиентов перфузии и вентиляции.
Комплексное радионуклидное исследование легких позволяет оценить легочную вентиляцию и перфузию, а также диффузию газов через альвеолярно-капиллярную мембрану. При различных заболеваниях легких и, в частности, при БА и ХОБЛ в разной степени нарушаются звенья этого сложного физиологического механизма.
Тот факт, что клиническое проявление и рентгенологические данные указанных патологических состояний на ранних этапах развития заболевания во многом идентичны, то применение комплексного радионуклидного исследования легких позволит дифференцировать БА от ХОБЛ. Подобное предположение обусловлено тем, что ключевым звеном в патогенезе бронхиальной астмы является повышенная реактивность бронхиального дерева, обусловленная нарушением вегетативной регуляции тонуса гладких мышц и действием медиаторов воспаления, что приводит к периодической обратимой обструкции бронхов, которая проявляется повышением сопротивления дыхательных путей, перерастяжением легких, гипоксемией, вызванной очаговой гиповентиляцией и несоответствием между вентиляцией и перфузией легких, то при ХОБЛ патологический процесс начинается в слизистой бронхов: изменение функции секреторного аппарата, с последующим присоединением инфекции и повреждению бронхов, бронхиол и прилегающих альвеол, следовательно, сцинтиграфические показатели, отражающие микроциркуляторные и вентиляционные нарушения в легких (апикально-базальный градиент перфузии и вентиляции, альвеолярно-капиллярная проницаемость) при указанных патологических состояниях, будут иметь существенные различия.
Новые признаки проявили в заявляемой совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области и не являющиеся очевидными для специалиста.
Идентичной совокупности признаков не обнаружено в патентной и научно-медицинской литературе.
Предлагаемый способ может быть использован в здравоохранении для повышения качества диагностики легочных заболеваний.
Исходя из вышеизложенного, следует считать предлагаемое изобретение соответствующим критериям «Новизна», «Изобретательский уровень», «Промышленная применяемость».
Изобретение будет понятно из следующего описания и предложенных к нему рисунков.
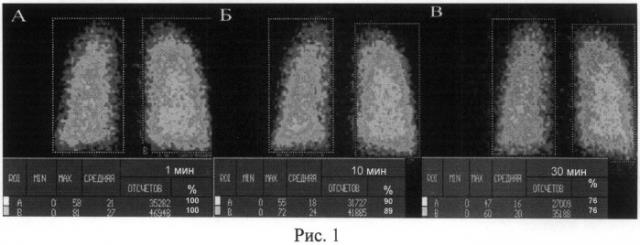
На рис.1 представлен способ математической обработки сцинтиграмм легких для оценки альвеолярно-капиллярной проницаемости. А - левое легкое; В - правое легкое.
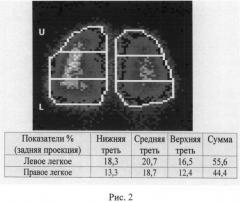
На рис.2 представлен способ математического расчета апикально-базального градиентов перфузии (вентиляции). Как следует из рисунка, включение РФП в верхней трети левого легкого (U) составило 16,5%, нижней (L) - 18,3%, следовательно, U/L градиент левого легкого (16,5/18,3) составляет 0,9. Включение РФП в верхней трети правого легкого (U) составило 12,45%, нижней (L) - 13,3%, следовательно, U/L градиент правого легкого (16,5/18,3) составляет 0,93.
На рис.3 представлен сравнительный анализ апикально-базального градиентов перфузии перфузии больных бронхиальной астмой (на рис.3 как бронхиальная астма, цифра 1 - для левого легкого, 2 - для правого легкого) и вентиляции (на рис.3 как бронхиальная астма, цифра 3 - для левого легкого, 4 - для правого легкого) и здоровых лиц (на рис.3 как контроль, цифра 5 означает апикально-базальный градиент перфузии; цифра 6 означает апикально-базальный градиент вентиляции); p - уровень статистической значимости сравниваемых групп (p<0,05).
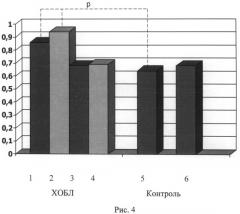
На рис.4 представлен сравнительный анализ апикально-базального градиентов перфузии перфузии больных с хронической обструктивной болезнью легких (на рис.4 как ХОБЛ, цифра 1 - для левого легкого, 2 - для правого легкого) и вентиляции (на рис.4 как ХОБЛ, цифра 3 - для левого легкого, 4 - для правого легкого) и здоровых курящих лиц (на рис.4 как контроль, цифра 5 означает апикально-базальный градиент перфузии; цифра 6 означает апикально-базальный градиент вентиляции); p - уровень статистической значимости сравниваемых групп (p<0,05).
На рис.5 представлен сравнительный анализ альвеолярно-капиллярной проницаемости больных бронхиальной астмой (на рис.5 цифра 1 - правое легкое, цифра 2 - левое легкое) и здоровых некурящих лиц (на рис.5 цифра 3); p - уровень статистической значимости сравниваемых групп (p<0,05).
Контрольная группа из некурящих лиц была определена тем, что курящих пациентов с признаками БА относят в группу больных с хроническими заболеваниями легких [1].
На рис.6 представлен сравнительный анализ альвеолярно-капиллярной проницаемости больных с хронической обструктивной болезнью легких (на рис.6 - цифра 1 - правое легкое, цифра 2 - левое легкое) и здоровых курящих лиц (на рис.6 цифра 3); p - уровень статистической значимости сравниваемых групп (p<0,05). Контрольная группа из курящих здоровых лиц была определена тем, что более 90% больных с ХОБЛ являются курящими [1].
Способ осуществляется следующим образом:
- для приготовления аэрозоля, в небулайзер помещают радиофармпрепарат ДТПА (99mTc-Пентатех, «Диамед»), меченный 99mТехнецием в объеме 3 мл с удельной активностью 74-111 МБк/мл (555-740 МБк в 3 мл);
- продолжительность ингаляции составляет не более 5-7 мин при обычном для пациента ритме и глубине дыхания и подаче ингалируемой смеси под давлением 0,5-0,7 МПа;
- полипозиционную статическую сцинтиграфию легких начинают непосредственно после окончания ингаляции аэрозоля,
- регистрацию сцинтиграфических изображений проводят в заднепрямой (POST) - 1-я мин после ингаляции, затем - передне-прямой (ANT) и боковых проекциях (LL 900, RL 900) после этого пациенту повторно проводят статическую сцинтиграфию легких лишь в заднепрямой проекции через 30 мин после ингаляции;
- запись нативных изображений осуществляют в матрицу 128×128 за интервал времени 2 мин на каждую проекцию.
После ингаляционной сцинтиграфии проводят перфузионную сцинтиграфию легких по общепринятой методике [10].
После завершения исследования проводят качественный анализ полученных сцинтиграфических изображений легких на предмет выявления ингаляционных и (или) перфузионных нарушений накопления РФП, после чего проводят математический анализ ингаляционных сцинтиграмм легких, выполненных в заднепрямой проекции через 1, 10 и 30 мин после ингаляции. Для этого выделяют «зоны интереса» левого и правого легких и вычисляется количество импульсов в указанных областях (рис.1). Счет импульсов от каждого легкого на первой минуте принимается за 100%, на 10 и 30 мин после ингаляции - за X1% и Х2%. На рис.1 количество импульсов (обозначено как отсчетов) на 1-й мин после ингаляции от левого легкого составило 35282 (100%), от правого - 46948 (100%), на 10 мин после ингаляции - 27009 (Х2%), 35188 (Х2%) соответственно. Простой математический расчет позволяет определить процент проницаемости радиоаэрозоля в кровяное русло легких на 10-й и 30-й мин после ингаляции:
1 мин левое легкое 35282 - 100%
10 мин 31727 - X1% X1=(31727×100):35282=90%;
100%-90%=10%.
Таким образом, через 10 мин после ингаляции 10% радиоаэрозоля проникло из воздухоносных путей левого легкого в кровь. Точно таким же образом рассчитывается альвеолярная проницаемость РФП через 30 мин после ингаляции как для левого, так и правого легкого.
Определение апикально-базального градиентов перфузии (U/L-q) и вентиляции (U/L-v) проводится следующим способом: для этого как на вентиляционных, так и на перфузионных сцинтиграммах в передне-задней проекции каждое легочное поле делится на три равные зоны. Счет со всех 6 зон принимают за 100%, затем вычисляют процентное распределение счета по каждой зоне. Для того чтобы избежать ошибок при выборе границ легких и его зон применяют алгоритм и математическую программу, позволяющую автоматически устанавливать границы органа и разделение его на 6 зон интереса по три симметричных зоны в каждом легком. Подобный метод обработки избавляет от ошибок, связанных с наложением зон интереса друг на друга. Затем процент включения РФП верхней зоной каждого легкого по отдельности делят на процент включения РФП нижней зоны. Полученное соотношение отражает апикально-базальный градиент перфузии (при проведении перфузионной пульмоносцинтиграфии) и вентиляции (при проведении вентиляционной пульмоносцинтиграфии).
Клинический пример 1: пациент С., 48 лет, госпитализирован в терапевтическое отделение многопрофильного стационара с жалобами на кашель с отделением слизисто-гнойной мокроты, повышение температуры до 37,3°C, одышку преимущественно экспираторного характера при значительной физической нагрузке, общую слабость. Считал себя ранее здоровым, к врачам не обращался, жалоб на одышку и кашель не предъявлял. Активное выявление наличия у пациента респираторных симптомов позволило установить, что в течение последних 5 лет по утрам и редко днем он отмечал кашель с отделением в небольшом количестве светлой мокроты, что связывал с курением. Заболел остро, 3 дня назад, после переохлаждения, когда появились вышеперечисленные жалобы. Обратился в поликлинику по месту жительства, был направлен по скорой помощи в дежурный терапевтический стационар и госпитализирован с предварительным диагнозом ХОБЛ, обострение.
Из вредных привычек больной отмечает курение в течение 20 лет до 1 пачки сигарет в день (индекс курящего - 20). Алкоголь употребляет редко.
По данным физического исследования над всеми отделами легких определялся легочный перкуторный звук, жесткое везикулярное дыхание и рассеянные высокотональные сухие хрипы, преимущественно на выдохе, количество которых увеличивалось в клиностатическом положении пациента.
Больному было проведено обследование: общий анализ крови, общий анализ мочи, ряд биохимических показателей крови, рентгенография органов грудной клетки, ЭКГ, ЭХОКГ, спирография, бодиплетизмография и вентиляционно-перфузионная пульмоносцинтиграфия. В анализе периферической крови обнаружен нейтрофильный лейкоцитоз (9,2·109/л). При рентгенологическом исследовании органов грудной клетки обнаружен прикорневой пневмофиброз. Результаты ЭХОКГ: расширения, гипертрофии отделов сердца нет, клапаны сердца не изменены. По данным спирометрии: снижение объема форсированного выдоха за 1-ю сек (ОФВ1) - до 71,8% должной величины, при проведении бронходилатационного теста зарегистрированы постбронходилатационные значения ОФВ1 - 82,3% должной величины, ОФВ1/ФЖЕЛ - 68,8% должной величины, при проведении бодиплетизмография (с помощью прибора «Masterlab pro» фирмы «E.Jaeger», Германия) зарегистрировано повышение бронхиального сопротивления - до 0,44 кПа·сек/л, что составило 146% должной величины. Таким образом, исследования, выполненные согласно стандартам диагностики ХОБЛ, подтвердили ее наличие и соответствовали I стадии заболевания, и у пациента была впервые диагностирована ХОБЛ.
По результатам перфузионной пульмоносцинтиграфии перфузия носила умеренно неравномерный характер. U/L градиент перфузии левого и правого легких были повышены - 0,94 и 0,86 соответственно. По результатам вентиляционной пульмоносцинтиграфии U/L градиент вентиляции правого и левого легких соответствовал нормальным величинам - 0,68 и 0,66. Вентиляционно-перфузионное соотношение в правом легком соответствовало нормальным значения - 0,97, а в левом было повышено - 1,03. АКП левого легкого составила на 10-й мин - 7,50%, на 30-й мин - 21,34%, правого легкого - на 10-й мин - 8,43%, на 30-й мин - 22,54%, что свидетельствовало о ее замедлении по сравнению с нормальными величинами как на 10-й, так и на 30-й мин исследования в обоих легких.
Окончательный диагноз: ХОБЛ, I стадия, обострение.
Клинический пример 2: больная В., 38 лет, была госпитализирована в терапевтическое отделение многопрофильного стационара в порядке скорой помощи с предварительным диагнозом бронхиальная астма. Предъявляла жалобы на приступы экспираторного удушья 3-4 раза в день, малопродуктивный кашель, повышение температуры до 37,2°C.
В течение последних 3 лет отмечала приступы удушья в основном весной, в связи с переохлаждением, а также при приеме аспирина. Приступы удушья купировала ингаляцией беродуала. Ухудшение состояния в течение 5 последних дней после переохлаждения.
В течение последних 5 лет не курит, ранее в течение 6 лет курила по 2-3 сигареты в день. Алкоголь не употребляет.
По данным физического исследования: над всеми отделами легких определялся легочный перкуторный звук, жесткое везикулярное дыхание. В передне-верхних отделах грудной клетки рассеянные высокотональные сухие хрипы, преимущественно на выдохе, в клиностатическом положении их количество увеличивалось.
Больной были выполнены: общий анализ крови, общий анализ мочи, ряд биохимических показателей крови, рентгенография органов грудной клетки, ЭКГ, спирография, бодиплетизмография и вентиляционно-перфузионная сцинтиграфия легких.
В анализе периферической крови: лейкоцитоз (9,5·109/л). На рентгенограмме органов грудной клетки определялось усиление сосудистого рисунка в прикорневых зонах. По данным спирометрии было зарегистрировано: ОФВ1 - 72,1% должной величины, обратимость бронхиальной обструкции - 22%. При проведении бодиплетизмографии было отмечено повышение бронхиального сопротивления до 0,44 кПа·сек/л, что составило 152% должной величины. В результате у больной была впервые диагностирована бронхиальная обструкция. С помощью метахолинового теста у нее была выявлена гиперреактивность бронхов.
По данным перфузионной пульмоносцинтиграфии U/L градиент перфузии как правого, так и левого легкого был повышен и составил в левом легком - 1,1, в правом легком - 0,82.
По результатам вентиляционной пульмоносцинтиграфии U/L градиент вентиляции как правого, так и левого легкого был снижен: в левом легком - 0,57, в правом легком - 0,55.
В левом легком АКП составляла на 10-й мин - 8%, на 30-й мин - 34%, в правом легком - на 10-й мин - 10%, на 30-й мин - 33%, что свидетельствовало о повышении АКП как в правом, так и в левом легких на 30-й мин исследования.
Окончательный диагноз: Бронхиальная астма, персистирующее течение, средней степени тяжести, обострение.
Результаты проведенных исследований представлены на рис.3, 4, 5, 6.
Предлагаемый способ позволяет с высокой точностью провести дифференциальную диагностику больных с хронической обструктивной болезнью легких и бронхиальной астмой на ранних этапах развития заболевания.
ЛИТЕРАТУРА
1. Респираторная медицина в 2 т. / под ред. А.Г.Чучалина. - М.: ГЭОТАР-Медиа, 2007 - T.1. - С.632-635.
2. Шмелев Е.И. Хроническая обструктивная болезнь легких: рекомендации для врачей. М., 2003. - 111 с.
3. Пульмонология / под ред. А.Г.Чучалина. - 2-е изд., испр. и доп. - М.: ГЭОТАР-Медиа, 2009. - 336 с. - (Серия «Клинические рекомендации»).
4. Бремя хронической обструктивной болезни легких и проект ВОЗ GARD в России. Consium medicum. - Экстравыпуск. - 2010. - С.19-24.
5. Чучалин А.Г. Белая книга. Пульмонология // Пульмонология. - 2004. - №1. - С.7-36.
6. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких: пересмотр 2003 года: пер. с англ. / Всемирная организация здравоохранения (Женева), Национальный институт сердца, легких и крови. - М.: Атмосфера, 2003. - 96 с.
7. Исследование функции аппарата внешнего дыхания. Основы клинической физиологии дыхания. Основы клинической физиологии дыхания: учебное пособие, 2-е изд., доп. и испр. Ф.Ф.Тетенев, Т.Н.Бодрова, К.Ф.Тетенев и др. - Томск: Печатная мануфактура, 2008. - 164 с.
8. Рубин М.П. Радионуклидные методы диагностики функциональных нарушений легких в амбулаторных условиях // Терапевтический архив, 2008. - №1. - С.10-16.
9. Радионуклидная диагностика для практических врачей / под. ред. Ю.Б.Лишманова, В.И.Чернова. - Томск: STT, 2004. - С.138-157.
10. Рубин М.П. Радионуклидная перфузионная сцинтиграфия легких: методика исследования и интерпретации результатов / М.П.Рубин, О.Д.Кулешова, Р.Е.Чечурин // Радиология - Практика. 2002. - №4. - С.16-21.
Способ дифференциальной диагностики хронической обструктивной болезни легких и бронхиальной астмы, заключающийся в проведении при сомнительной клинико-рентгенологической симптоматике вентиляционно-перфузионной пульмоносцинтиграфии с последующим определением альвеолярно-капиллярной проницаемости радиоактивного аэрозоля, отличающийся тем, что дополнительно определяют апикально-базальные градиенты перфузии и вентиляции и при наличии вентиляционно-перфузионных нарушений и повышенной до 25% и более проницаемости ингалируемого радиоактивного аэрозоля из обоих легких на 30-й мин исследования, и при величине апикально-базального градиента вентиляции (U/L-v) 0,6 и ниже диагностируют бронхиальную астму, а при равномерно замедленной альвеолярно-капиллярной проницаемости радиоактивного аэрозоля из обоих легких, по сравнению с контрольными показателями курящих здоровых лиц, и при величине апикально-базального градиента перфузии (U/L-q) свыше 0,8 диагностируют хроническую обструктивную болезнь легких.