Противовоспалительная композиция
Иллюстрации
Показать всеПредложены 3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-он (I), (S)-3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-он (I') и фармацевтические композиции, приготовленные с применением указанного соединения или его изомера, а также их применение для изготовления лекарственного средства, направленного на предотвращение или лечение воспалительных состояний, и соответствующий способ лечения. Показано преимущество соединений по отношению к другим ингибиторам хемокинов широкого спектра действия (BSCI) в отношении противовоспалительной активности, фармакокинетических, токсикологических свойств и параметров фармакологической безопасности: (S)-3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-он в 5-25 раз более активен, чем (R)-изомер. 7 н. и 6 з.п. ф-лы, 10 ил., 9 табл.
Реферат
Настоящее изобретение описывает 3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-он и фармацевтические композиции, приготовленные с применением указанного соединения, а также применение указанного соединения для приготовления лекарственного препарата, направленного на предотвращение или лечение воспалительных состояний.
Воспаление является важным компонентом физиологической иммунной защиты организма. Однако существует множество исследований, показывающих, что неправильная пространственно-временная регуляция воспалительной реакции играет роль при широком спектре заболеваний, включая те, в которые явным образом вовлечены лейкоциты (таких как аутоиммунные заболевания, астма или атеросклероз), а также при заболеваниях, которые традиционно не связывали с активностями лейкоцитов (такие как остеопороз или болезнь Альцгеймера).
Хемокины являются большим семейством сигнальных молекул, гомологичных интерлейкину-8, которые задействованы в регуляции перемещения лейкоцитов как при физиологических, так и при патологических состояниях. Более пятидесяти лигандов и двадцати рецепторов, задействованных в сигнальной системе с участием хемокинов, обеспечивают организацию путей передачи информации, достаточную для того, чтобы направлять лейкоциты посредством сложных иммунных регуляторных процессов из костного мозга к периферии, а затем обратно, через вторичные лимфоидные органы. Однако сложность данной системы хемокинов в первое время затрудняла развитие фармакологических подходов к модулированию воспалительных ответов через блокаду рецепторов хемокинов. Оказалось сложным определить, который из рецепторов хемокинов должен (должны) быть ингибирован(ы) для того, чтобы вызвать благоприятное терапевтическое действие при конкретном воспалительном нарушении.
Недавно было описано семейство агентов, которые одновременно блокируют передачу сигнала широким спектром хемокинов (Reckless et al., 1999 // Biochem J. 340, 803-811). Первым подобным агентом является пептид, называемый "пептид 3", для которого показано, что он ингибирует миграцию лейкоцитов, индуцированную пятью различными хемокинами, в то время как миграция, которая возникает в ответ на другие хемоаттрактанты (такие как fMLP или TGF-beta), не изменяется. Соединения данной группы, включающей данный пептид и его аналоги, такие как NR58-3.14.3 (т.е. SEQ ID NO №1, c(DCys-DGl-DIle-DTrp-DLys-DGIn-DLys-DPro-DAsp-DLeu-DCys)-NH2), были названы "Ингибиторы хемокинов широкого спектра действия" (Broad Spectrum Chemokine Inhibitors, BSCl). Grainger et al. (2003, Biochem. Pharm. 65, 1027-1034) в дальнейшем показали на ряде моделей болезней на животных, что BSCl обладают потенциально полезной противовоспалительной активностью. Интересным является тот факт, что одновременная блокада множества хемокинов не имеет очевидной связи с развитием острой или хронической токсичности, и это позволяет предположить, что данный подход может являться полезной стратегией для развития новых противовоспалительных лекарственных средств, которые будут обладать преимуществами стероидных препаратов, но обладать меньшим побочным действием.
Однако пептиды и производные пептидов, такие как NR58-3.14.3, могут не быть оптимальными при применении in vivo. Синтез данных веществ является достаточно дорогостоящим, и они характеризуются относительно неблагоприятными фармакокинетическими и фармакодинамическими свойствами. Например, соединение NR58-3.14.3 не обладает биодоступностью при оральном применении, а период полувыведения из плазмы крови после внутривенного введения составляет менее 30 минут.
Были приняты две параллельные стратегии для идентификации новых препаратов, которые сохраняют противовоспалительные свойства пептида 3 и NR58-3.14.3, но имеют улучшенные характеристики для использования в качестве фармацевтических препаратов. Во-первых, был разработан ряд аналогов пептидов, некоторые из которых характеризуются более продолжительным периодом полувыведения из плазмы, чем NR58-3.14.3, и синтез которых значительно дешевле. Во-вторых, был проведен анализ структура/активность данных пептидов для того, чтобы определить фармакофоры и предложить низкомолекулярные соединения непептидной природы, которые сохраняют полезные свойства исходного пептида.
При втором подходе было получено несколько серий различных по своей структуре веществ, которые сохраняли противовоспалительные свойства указанных пептидов, включая 16-амино- и 16-аминоалкил-производные алкалоида йохимбина, а также ряд N-замещенных 3-аминоглутаримидов (см: Fox et al., (2002) / J. Med. Chem. 45, 360-370; WO 99/12968 и WO 00/42071). Все эти вещества являются ингибиторами хемокинов широкого спектра действия, которые сохраняют избирательность по сравнению с отличными от хемокинов хемоаттрактантами, и показано, что некоторые из них блокируют острое воспаление in vivo.
Наиболее сильным и избирательным действием из указанных веществ обладает S-3-(ундек-10-еноил)-аминоглутаримид (NR58.4), который ингибирует индуцированную хемокинами миграцию in vitro с ED50 равной 5 нМ. Однако при проведении дальнейших исследований было показано, что могло происходить ферментативное расщепление аминоглутаримидного кольца в сыворотке крови. Следовательно, в некоторых случаях (например, если воспаление, которое подвергают лечению, является хроническим, как в случае аутоиммунных заболеваний) свойства данных соединений могут быть не оптимальными, и более стабильное вещество со сходными противовоспалительными свойствами может оказаться более эффективным.
В качестве подхода для идентификации подобных стабильных аналогов провели исследование стабильности в сыворотке крови различных производных S-3-(ундек-10-еноил)-аминоглутаримида. Одно из таких производных, 6-дезоксо-аналог S-3-(ундек-10-еноил)-тетрагидропиридин-2-она, полностью стабильно в сыворотке крови человека в течение периода не менее 7 дней при 37°С, но характеризуется значительно меньшей активностью по сравнению с исходной молекулой.
Одним из таких семейств стабильных ингибиторов хемокинов широкого спектра действия являются 3-амино-капролактамы с семичленным монолактамным кольцом (см., например, WO 2005/053702 и WO 2006/016152). Однако в дальнейшем полезные противовоспалительные вещества были получены также из других 3-аминолактамов с различным размером кольца (см., например, WO 2006/134385). При осуществлении других модификаций лактамного кольца, включая введение гетероатомов и конструирование систем из двух лактамных колец, также были получены вещества, обладающие активностью ингибиторов хемокинов широкого спектра действия (см., например, WO 2006/018609 и WO 2006/085096).
К настоящему времени идентификация широких классов действующих веществ, обладающих активностью ингибиторов хемокинов широкого спектра действия и, следовательно, противовоспалительными свойствами in vivo, была основана на оптимизации активности ингибиторов хемокинов широкого спектра действия. Например, по результатам предыдущих наблюдений было показано, что двойное замещение по положению 2 (по альфа- или центральному атому углерода в боковой ацильной цепи ацил-3-аминолактамов) приводит к существенному увеличению активности в качестве BSCl как in vitro, так и in vivo в моделях острого воспаления, в случае, когда двузамещенная по положению 2 ацильная группа представляет собой открытую цепь (см. WO 2005/053702), один цикл (см. WO 2006/134384) или полициклическую систему (см. WO 2006/016152).
Однако сила желаемого фармакологического действия является хотя и важным, но только одним из факторов, которые определяют, будет ли вещество полезным фармацевтическим препаратом для человека. В особенности, фармакокинетические параметры (или показатели распределения действующего вещества внутри организма) являются наиболее важными при определении полезности отдельного действующего вещества. Фармакокинетика, определяемая в самом широком смысле, как исследование действия организма на лекарственное вещество (напротив, фармакодинамика изучает воздействие лекарственного вещества на организм), зависит от сложных физиологических процессов в организме, без ограничения включая: абсорбцию, стабильность в плазме, объем распределения (и, особенно, скорость установления равновесной концентрации в тканях-мишенях), метаболические превращения (включая метаболические процессы в печени, такие как окисление под действием цитохрома Р450 и метаболические реакции фазы II, такие как сульфатирование и глюкуронирование, а также метаболические процессы, проходящие за пределами печени, такие как модификации под действием ферментов сыворотки крови) и экскрецию (такую как почечный клиренс и выведение с испражнениями). Данные процессы часто совместно называют "ADME" свойствами действующего вещества (от ADME: Absorption, Distribution, Metabolism and Excretion - «всасывание, распределение, метаболизм и выведение»).
Другим важным фактором при определении полезности действующего вещества в качестве лекарственного средства при применении на человеке является его безопасность. Многие, если не все, используемые вещества оказывают множество воздействий на организм человека, среди которых благоприятное фармакологическое действие обычно является только одним из эффектов. Другие действия могут приводить к повреждениям (токсическое действие) или неудобству (побочные явления) для пациента. Изучение данных свойств потенциальных компонентов фармацевтических препаратов называют токсикология или фармакологические исследования безопасности. Нежелательные воздействия можно, в целом, отнести к двум типам. Эффекты Класса тесно связаны с желательным фармакологическим действием и (в большей или меньшей степени) являются неизбежным следствием воздействия на выбранную молекулярную мишень. Например, вещества, предназначенные для предотвращения патологического воспаления, могут, в некоторой степени, подавлять иммунную систему организма и приводить к повышенному риску развития инфекции. Это происходит потому, что повреждение ткани вследствие воспаления и инфекция зависят от степени активности иммунной системы. В результате все молекулы, которые направлены на одну и ту же фармакологическую мишень, будут в меньшей или большей степени обладать сходными эффектами класса. Напротив, Специфичные эффекты связаны с особенной структурой соединения и обусловлены результатом взаимодействия (обычно непредвиденного) с мишенью, отличной от предполагаемой фармакологической цели. В принципе, возможно найти другую молекулу, обладающую таким же предполагаемым фармакологическим действием, но полностью лишенную специфичного побочного действия. Некоторые специфичные активности соединений являются общими (такие, как взаимодействие со hERG калиевыми каналами сердца, которое может привести к опасной пролонгации QT-интервала во время кардиостимуляции, которая приводит к потенциально фатальной сердечной аритмии), в то время как другие специфичные активности могут, по всей видимости, быть уникальными для каждого вещества.
Важно то, что, несмотря на десятилетия накопленного опыта в области разработки фармацевтических агентов, до сих пор не существует общепринятого способа предсказания, как фармакокинетических, так и токсикологических свойств агента или его фармакологической безопасности. По этой причине проведение исследований с применением модельных систем in vitro (таких, как клеточные линии, экспрессирующие hERG), затем испытания на животных и, наконец, проведение фазы I клинических исследований на человеке являются распространенным по всему миру нормативным требованием при разработке нового фармацевтического препарата.
Были описаны способы для предсказания определенных фармакокинетических свойств на основании изучения структуры молекулы и очевидно, что квалифицированные специалисты в области медицинской химии могут правильным образом исключить многие соединения, руководствуясь только теоретическими соображениями. Примером такого "эмпирического правила" является предложенное Липински "правило пяти", основанное на том наблюдении, что большинство одобренных фармацевтических препаратов отвечают определенным критериям, к которым относятся молекулярный вес, число связей, вокруг которых возможно вращение, и полярность. Аналогичным образом, хорошо известно, что молекулы с крупными гидрофобными группами с большей вероятностью окажут нежелательное действие на hERG калиевые каналы.
Такие общие предписания, даже при одновременном применении, могут быть полезными для исключения неподходящих молекул, но большое количество очень неподходящих (по разным причинам) молекул, тем не менее, не сможет быть отсеяно. В настоящее время никто не будет выбирать вероятное лекарственное вещество из класса активных соединений только на основании теоретических соображений. Поэтому выбор определенного соединения из класса веществ, которые характеризуются благоприятными ADME, фармакокинетическими и токсикологическими свойствами, а также свойствами фармакологической безопасности, требует проведения обширной практической экспериментальной работы среди перспективных соединений, обеспечивающей новую информацию, которая не может быть предсказана даже специалистами в данной области.
В данной заявке авторы настоящего изобретения описывают новое соединение - 3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-он (I), которое ранее не было описано:
Данное соединение принадлежит к обширному классу ингибиторов хемокинов широкого спектра действия (BSCl), которые были описаны ранее (см., например, WO 2006/134385). Однако авторы настоящего изобретения при экспериментальном сравнении с другими веществами, принадлежащими к тому же классу соединений, показали, что в то время как все молекулы, принадлежащие к указанному классу, обладают BSCl активностью, соединения формулы (I) обладают значительными преимуществами при применении в качестве фармацевтического препарата для человека в результате сочетания их ADME, фармакокинетических и токсикологических свойств и параметров фармакологической безопасности.
Атом углерода в положении 3 лактамного кольца является ассиметричным, и, следовательно, данные соединения в соответствии с настоящим изобретением могут существовать в виде двух различных форм, которые представляют собой "R" и "S" конфигурации соединений. Данное изобретение охватывает обе указанные энантиомерные формы и все комбинации этих форм, включая рацемические "RS" смеси. Для простоты, когда в структурной формуле не отражено никакой специфической конфигурации, следует понимать, что представлены две указанные различные энантиомерные формы и их смеси. Поскольку структурные различия между энантиомерами не оказывают никакого влияния на ключевые ADME свойства, которые определяют преимущества соединений согласно настоящему изобретению (и, кроме того, оказывают только незначительное действие на активность исследуемого соединения в качестве BSCl), обе энантиомерные формы, а также их смеси представляют собой конкретные примеры, которые обладают существенными преимуществами по отношению к другим представителям указанного класса соединений.
Предпочтительно соединение согласно настоящему изобретению, описываемое формулой (I), представляет собой соединение формулы (I')
Данное соединение (I'), имеющее S-конфигурацию стереоцентра, является в 5-25 раз более активным в качестве ингибитора хемокинов широкого спектра действия, чем R-энантиомер.
Настоящее изобретение также обеспечивает фармацевтические композиции, которые в качестве действующего вещества содержат соединение, описываемое общей формулой (I) или (I'), или фармацевтически приемлемую соль данного соединения и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество и/или носитель.
Под фармацевтически приемлемой солью понимают, в частности, соли, полученные присоединением неорганических кислот, такие как гидрохлориды, гидробромиды, йодгидраты, сульфаты, фосфаты, дифосфаты и нитраты, или органических кислот, такие как ацетаты, малеаты, фумараты, тартараты, сукцинаты, цитраты, лактаты, метансульфонаты, р-толуенсульфонаты, пальмоаты и стеараты. Также в объем настоящего изобретения, когда они могут быть использованы, входят соли, образованные основаниями, такими как гидроксид натрия или гидроксид калия. Другие примеры фармацевтически приемлемых солей представлены в работе: "Salt selection for basic drugs", Int. J. Pharm. (1986), 33: 201-217.
Фармацевтическая композиция может быть представлена в твердой лекарственной форме, например в виде порошков, гранул, таблеток, желатиновых капсул, липосом или суппозиториев. В качестве подходящих твердых наполнителей могут быть использованы, например, фосфат кальция, стеарат магния, тальк, сахара, лактоза, декстрин, крахмал, желатин, целлюлоза, метилцеллюлоза, натрия карбоксиметилцеллюлоза, поливинилпирролидон и воск. Другие фармацевтически приемлемые вспомогательные вещества и/или наполнители известны специалистам в данной области.
Данные фармацевтические композиции в соответствии с данным изобретением также могут быть представлены в жидкой форме, например в виде растворов, эмульсий, суспензий или сиропов. В качестве подходящих жидких наполнителей можно применять воду, органические растворители, такие как глицерин или гликоли, а также их смеси с водой, приготовленные в разных пропорциях.
Данное изобретение также охватывает применение соединения формулы (I) или (I') или фармацевтически приемлемой соли указанного соединения для приготовления лекарственного средства, предназначенного для лечения воспалительного состояния.
Настоящее изобретение включает соединения, композиции и их применение, как определено в данном описании, в случае, когда указанное соединение находится в гидратированной или сольватированной форме.
Преимущество настоящего изобретения по сравнению с уровнем техники основано на том, что неожиданно оказалось, что 3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-он обладает лучшими ADME свойствами по сравнению с общими классами лактамных BSCl, которые были описаны ранее (см., например, международные заявки, перечисленные выше). Хотя было известно, что подобные соединения обладают фармацевтически приемлемыми фармакодинамическими свойствами (что означает, что они обладают сильным противовоспалительным действием in vivo как результат их BSCl активности), и было сделано предположение, что одни должны обладать приемлемыми фармакокинетическими и, следовательно, ADME-свойствами, прямая оценка ADME-свойств неожиданно показала, что 3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-он обладает значительными преимуществами (см. примеры, приведенные ниже).
В частности, хотя, как следует из литературных данных (см., например, Fox et al. J. Med. Chem. 2005 48:867-74), предшествующие исследования стабильности в сыворотке крови in vitro указывали на то, что лактамные BSCl были значительно лучше, чем ранее описанные имидные BSCl (см., например, WO 99/12968), теперь ясно, что многие (или, возможно, все) представители класса лактамных BSCl подвергаются нежелательному воздействию метаболических реакций in vivo. Авторы настоящего изобретения синтезировали и протестировали более двенадцати BSCl, принадлежащих к аминолактамному классу, и показали, что все протестированные к настоящему времени лактамные BSCl, кроме 3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-она, подвергаются быстрому метаболическому превращению в печени (гидроксилирование при действии цитохрома Р450, и/или реакции фазы II метаболизма).
Как минимум частично вследствие сниженного метаболизма in vivo, общий клиренс 3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-она является заметно более низким, чем общий клиренс других протестированных лактамных BSCl. В результате воздействие 3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-она после введения единичной оральной дозы более чем в 10 раз выше. Таким образом, 3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-он является более пригодным для применения в качестве фармацевтического препарата для применения у человека, чем большинство (если не все) ранее описанные лактамные BSCl, особенно в том случае, если для достижения эффективного воздействия требуется постоянное оральное применение.
Пептиды, известные из уровня техники (такие как NR58-3.14.3), характеризуются следующими недостатками: (а) высокая стоимость и необходимость проведения твердофазного синтеза (как минимум для более длинных молекул), (b) быстрое выведение через почки и (с) в целом, значительно меньшая активность (более чем в 25 раз менее сильное действие in vitro и более чем в 10000 раз in vivo).
Известные из уровня техники аминоглутаримиды являются более дешевыми, не выводятся быстро через почки и оказывают более сильное действие in vitro, НО они чрезвычайно нестабильны в сыворотке крови (как результат открывания имидного кольца под действием ферментов; см., например, Fox et al. J. Med. Chem. 2005 48:867-74). Поэтому действие аминоглутаримидных BSCl, таких как S-3-(ундек-10-еноиламино) глутаримид, как минимум в 250 раз менее сильное in vivo, чем действие 2',2'-диметилпропаноиламино)-тетрагидропиридин-2-она, даже при применении в моделях острого воспаления (таких, как эндотоксикоз, индуцированный липополисахаридами с характерной системной продукцией TNF-α, где влияние стабильности соединения и ADME свойств менее выражено).
Другие структурно родственные (но функционально сильно различающихся) соединения, которые описаны в литературных источниках, представляют собой бактериальные автоиндукторы, и, как правило, в основе их структуры лежит 6-членный гомосеринлактон, обычно с 3-оксоацильной боковой цепью (см., например, публикацию Bycroft et al. US 5,969,158, в которой заявлен широкий спектр таких веществ). Несмотря на то что подобные публикации раскрывают общие формулы, которые охватывают как лактамы и лактоны, только небольшое число примеров описанных соединений (если вообще такие имеются), обладающих свойствами автоиндукторов бактерий, имеют лактамные концевые группы. Известно, что все подобные соединения (в особенности те, которые имеют концевую лактонную и/или 3-оксоацильную группу) относительно нестабильны, что ограничивает возможности их применения в качестве медицинских препаратов.
Преимущества 3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-она, описанные в данном документе, состоят в том, что синтез данного соединения является дешевым (и приведенный в данном описании способ позволяет осуществлять прямой синтез даже в количествах, измеряемых килограммами), и в том, что данное соединение характеризуется высокой метаболической стабильностью не только в изолированной сыворотке крови in vitro (свойство, которое относится ко всему классу описанных ранее лактамных BSCl), но также in vivo. Исходя из вышесказанного, соединения согласно настоящему изобретению (по сравнению с соединениями, широко исследованными к настоящему времени), по эффективности, силе воздействия и фармацевтическим свойствам, таким как ADME, фармакокинетическим, токсикологическим свойствам и параметрам фармакологической безопасности, являются уникальным образом оптимизированными для лечения воспалительных заболеваний у человека.
В соответствии с настоящим изобретением воспалительные нарушения, которые можно предотвращать или лечить с применением соединений, описываемых формулами (I) или (I'), или фармацевтически приемлемых солей указанных соединений, или фармацевтических композиций, содержащих данные соединения в качестве активных компонентов, включают следующие заболевания:
- аутоиммунные заболевания, например, такие, как рассеянный склероз, ревматоидный артрит, обыкновенная волчанка, синдром раздраженного кишечника, болезнь Крона;
- заболевания сосудов, включая нарушения мозгового кровообращения (инсульт), ишемическую болезнь сердца, инфаркт миокарда, нестабильную стенокардию, атеросклероз или воспаление кровеносных сосудов, например синдром Бехчета, гигантоклеточный артериит, ревматическую полимиалгию, гранулематоз Вегенера, синдром Черджа-Стросс, пурпуру Геноха-Шенлейна и болезнь Кавасаки;
- вирусную инфекцию или репликацию вируса, например инфекции, вызываемые вирусами или размножением вирусов, включая поксвирус, вирус герпеса (например, Herpesvirus samiri), цитомегаловирус (ЦМВ), вирусы гепатита или лентивирусы (включая ВИЧ);
- астму и сопутствующие нарушения со стороны дыхательной системы, такие как аллергический ринит и хроническое неспецифическое заболевание легких;
- остеопороз (низкая плотность минерального вещества кости);
- рост опухоли;
- отторжение трансплантированных органов и/или задержку в функционировании трансплантата или органа, например, у пациентов, подвергнувшихся трансплантации почки;
- нарушения, характеризующиеся повышением уровня TNF-α;
- псориаз;
- повреждения кожи и другие фиброзные нарушения, включающие гипертрофические рубцы (келоидные образования), формирование спаек после общей или гинекологической хирургии, фиброз легкого, фиброз печени (включая алкогольную болезнь печени) или фиброз почки, неясной этиологии или получившие развитие как следствие основной болезни, такой как диабет (диабетическая нефропатия);
- нарушения, вызванные внутриклеточными паразитами, такие как малярия и туберкулез;
- нейропатическая боль (такие, как постоперативные фантомные боли в конечностях, постгерпетическая невралгия и другие);
- аллергические реакции или
- болезнь Альцгеймера.
В соответствие с настоящим изобретением к прочим воспалительным нарушениям относятся:
- боковой амиотрофический склероз;
- ответная реакция, вызванная присутствием антигенов; подавление иммунного ответа.
Данные клинические показания в широком понимании относятся к воспалительным нарушениям или нарушениям, характеризующихся повышением уровня TNF-α.
Для того чтобы исключить неправильное толкование, следует отметить, что первичной мишенью действия BSCl, включая соединения, описанные в данной заявке, является иммунная система. Следовательно, заявленные благоприятное воздействие на заболевания, такие как вирусная инфекция и/или репликация вируса и рост опухоли (состояния, которые сами по себе не являются первичными заболевания иммунной системы), является следствием модулирования иммунной системы на фоне инфекции и/или репликации вируса или роста и распространения опухоли. Поскольку BSCl, включая соединения согласно настоящему изобретению, в целом, прямым образом не влияют на репликацию вирусов или рост опухоли, следует ожидать, что они не будут оказывать никакого воздействия в изолированной системе (например, на инфицированную in vitro клеточную линию или на линию пролиферирующих опухолевых клеток), где отсутствует целостная и функционирующая иммунная система. Следовательно, известные данные, имеющие отношение к действию любых соединений в таких изолированных системах, не могут предоставить сведения для разработки BSCl, оказывающих действие на иммунную систему.
В том случае, если это разрешено законом, настоящее изобретение также можно применять для лечения, улучшения состояния или профилактики симптомов воспалительного заболевания (включая неблагоприятную воспалительную реакцию, которая возникла в ответ на любой агента) путем введения пациенту соединения, композиции или медикамента согласно настоящему изобретению в количестве, обеспечивающем противовоспалительное действие.
Введение медикамента в соответствии с настоящим изобретением можно осуществлять локальным, оральным, парентеральным путями, посредством внутримышечной инъекции и другими способами.
Вводимая доза, предполагаемая для лекарственного средства в соответствии с настоящим изобретением, составляет от 0,1 мг до 10 г в зависимости от состава препарата и способа введения.
В соответствии с настоящим изобретением соединения общей формулы (I) или (I') можно синтезировать с применением процессов, описание которых приведено ниже.
Получение соединений общей формулы (I) или (I')
Все соединения общей формулы (I) или (I') можно легко получить с применением общих способов, известных специалистам в данной области.
Соединение (I) представляет собой бесцветное кристаллическое вещество, которое может быть получено из орнитина и 2,2-диметилпропионилхлорида. Для синтеза соединения (I') используют чистый энантиомер S-орнитин. Можно осуществить замыкание кольца при воздействии на орнитин или его метиловый эфир. Данная аминокислота может быть этерифицирована в сухом метиловом спирте при in situ образовании хлористоводородной кислоты с применением триметилсилилхлорида. Альтернативно, можно осуществить замыкание кольца изолированного эфира с применением триэтиламина. Полученный неочищенный продукт можно затем ацилировать после обмена растворителя.
Ацил-лактамный продукт (I) характеризуется значительной растворимостью в воде, и вследствие этого условия ацилирования, используемые для более гидрофобных родственных продуктов (см., например, WO 2006/134385), были неудовлетворительными. Применение трех эквивалентов натрия карбоната в качестве основания привело к значительной преципитации побочного продукта натрия гидрокарбоната, несмотря на то, что использовали большое количество воды (более 4 мл/ммоль орнитина). При использовании данных концентраций экстракция продукта дихлорметаном является неэффективной. Поэтому три эквивалента натрия карбоната заменили на 2,5 эквивалента калия гидроксида (который нейтрализует 2,5 эквивалента триэтиламина гидрохлорида, получаемого на этапе замыкания кольца). С применением данного основания можно использовать значительно меньшее количество воды (менее 1 мл/ммоль орнитина) (конечное значение pH составляет от 8 до 9). При экстракции водного слоя этиловым эфиром уксусной кислоты (3×2 мл/ммоль орнитина) и повторной кристаллизации из этилацетата (0,5 мл/ммоль, горячий) и 40-60 петролейного эфира (5 мл/ммоль) первичный выход продукта составил 43% (4,25 г из 50 ммоль орнитина).
Следует отметить, что если во время выделения продукта реакции значение pH водного слоя слишком низкое, то в слой этилового эфира уксусной кислоты экстрагируются небольшие количества триэтиламина гидрохлорида. При промывании данного раствора этилацетата водой происходит экстракция значительного количества лактамного продукта (I) вместе с амина гидрохлоридом. Этого можно избежать повышением pH водного слоя до 12 (например, добавлением приблизительно одного эквивалента калия гидроксида по отношению к кислому хлориду) до проведения экстракции этиловым эфиром уксусной кислоты, тогда вместе с лактамным продуктом (I) экстрагируется только свободное основание триэтиламина, которое будет легче удалить путем выпаривания или в процессе повторной кристаллизации.
Ниже представлен следующий предпочтительный путь синтеза:
S-орнитина моногидрохлорид (50 ммоль) суспендируют в 100% метиловом спирте (100 мл) при добавлении триметилсилила хлорида (75 ммоль). Реакционную смесь нагревают в колбе с обратным холодильником в течение 24 часов. Затем добавляют триэтиламин (150 ммоль) и полученную смесь нагревают в колбе с обратным холодильником в течение 48 часов. Метиловый спирт затем удаляют при пониженном давлении (при желании можно на поздних стадиях добавить толуол, для того чтобы облегчить удаление спирта), полученный осадок растворяют в воде (20 мл) с добавлением калия гидроксида (125 ммоль).
Полученную смесь охлаждают до 0°С, затем медленно добавляют 2,2-диметилпропионилхлорид (50 ммоль) и реакционную смесь перемешивают в течение 18 часов при нагревании до комнатной температуры. Затем добавляют твердый гидроксид калия (50 ммоль) и после того, как он растворится, реакционную смесь экстрагируют этиловым эфиром уксусной кислоты (3×100 мл). Комбинированные органические слои быстро высушивают над смесью К2СО3 и Na2SO4 при пониженном давлении. Полученный твердый осадок затем подвергают повторной кристаллизации этиловым эфиром уксусной кислоты (25 мл) / 40-60 петролейного эфира (200-250 мл), чтобы получить лактам (I') в виде кристаллического твердого вещества (выход составляет более 50%).
Подлинность и чистоту (более 95%) данного продукта затем подтверждали способом протонной ЯМР-спектроскопии (δН (400 МГц, CDCl3) 6,63 (1Н, br s, NH); 6,01 (1Н, br s, NH); 4,20 (1Н, dt, J 11, 5.5, CHNH); 3,40-3,31 (2H, m, CH2NH); 2,61 (1H, dq, J 13, 4.5, CH2); 1,97-1,88 (2H, m, CH2); 1,50 (1H, dddd, J 13, 12, 9.5, 7.5, CH2); 1,22 (9H, s, 3×CH3).
ОПРЕДЕЛЕНИЯ
Термин "приблизительно" относится к промежутку вокруг рассматриваемого значения. Как использовано в приложении к данному описанию, "приблизительно X" означает интервал от значения X минус 10% от значения X до X плюс 10% от значения X и предпочтительно интервал от X минус 5% от значения X до X плюс 5% от значения X.
Использование числовых значений в данном описании направлено на то, чтобы однозначно включить в объем данного описания все индивидуальные значения в заданном диапазоне и все комбинации верхних и нижних предельных значений в границах данного интервала. Соответственно, например, промежуток от 0,1 мг до 10 г, определенный в отношении (inter alia) дозы 3-(2',2'-диметилпропаноиламино)-тетрагидропиридин-2-она, предназначенной для применения, введен для того, чтобы включить все дозы между 0,1 мг и 10 г и все более узкие интервалы, определяемые каждой комбинацией верхних и нижних предельных значений, вне зависимости от того, приведены примеры явным образом или нет.
В данном документе, термин "включает/содержит" следует понимать как "включающий" и как "состоящий из". Следовательно, если изобретение относится к "фармацевтической композиции, которая включает/содержит активный компонент", данная терминология предназначена для того, чтобы описать как составы, в которых могут присутствовать другие активные компоненты, так и составы, которые состоят только из одного активного компонента, как определено.
Если не определено иное, все технические и научные термины, использованные при составлении данного документа, имеют то же значение, которое обычно понимается обычным специалистом в области, к которой относится изобретение. Так же все публикации, приложения к патентам, все патенты и все прочие ссылки, упомянутые в тексте, включены в данное описание посредством ссылок (в тех случаях, когда это дозволено законом).
Следующие примеры представлены для того, чтобы проиллюстрировать вышеописанные процедуры и никаким образом не ограничивают сферу применения данного изобретения.
ФИГУРЫ
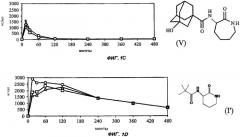
На Фиг.1 (части А-Е) представлены графики зависимости концентрации от времени для пяти исследуемых соединений от (I') до (V) после орального введения крысам единичной дозы 3 мг/кг в 1% растворе карбоксиметилцеллюлозы. Три линии для каждого соединения соответствуют трем повторениям опыта (три экспериментальных животных). На оси Y представлены концентрации в единицах измерения нг/мл (0-3000); на оси X представлено время в минутах (0-480).
На Фиг.2 показаны основные метаболиты, идентифицированные с применением способа жидкостной хроматографии/тандемной масс-спектрометрии (при сканировании в полном диапазоне) в моче, которую собирали через 24 часа у крыс, получивших при оральном введении единичной дозы в количестве 3 мг/кг в 1% растворе карбоксиметилцеллюлозы каждого из пяти исследуемых соединений от (I') до (V). Примечательно, что основной метаболит соединения (IV) был идентифицирован, но его структура не была определена при сравнении с паттернами фрагментации/перестройки в общедоступных базах данных по метаболитам. Хотя концентрации отдельных метаболитов не были определены, приведен порядок их количественного содержания в моче, в левой части каждого ряда приведены виды метаболитов, присутствующие в наибольшем количестве.
На Фиг.3 (части А-F) представлены графики зависимости тока от времени для клеток, экспрессирующих продукт гена hERG при воздействии носителя или одного из пяти соединений от (I') до (V), каждого в отдельном эксперименте. В каждом эксперименте дополнительные клетки подвергали действию соединения, взятого в качестве положительного контроля, которое полностью блокирует ток, проводимый по каналам hERG. На оси Y представлен ток в нА; по оси X представлено время в секундах. В части рисунка G показан hERG сле