Применение лиофилизированного препарата аллофибробластов для лечения заболеваний, вызванных вирусом герпеса
Иллюстрации
Показать всеИзобретение относится к области медицины и ветеринарии и предназначено для лечения заболеваний, вызванных вирусом герпеса. В качестве противовирусного средства для лечения заболеваний применяют лиофилизированный препарат аллофибробластов. Заявленное изобретение эффективно для лечения вируса герпеса человека и позвоночных животных. 7 табл., 4 пр.
Реферат
Изобретение относится к области медицины и ветеринарии, а именно к созданию средств для лечения человека и животных от заболеваний, вызванных вирусами герпеса.
Семейство вирусов герпеса, которых сейчас насчитывается более 100, включает в себя вирусы не только человека, но и различных позвоночных животных (обезьян, лошадей, крупного рогатого скота, свиней, кроликов, кошек, собак, мышей и т.д.). Герпесвирусы животных не патогенны для человека, за исключением герпесвируса В обезьян. Патогенностью для человека обладают 8 вирусов герпеса, наиболее распространенными из которых являются вирус простого герпеса 1-го типа, (ВПГ-1) и вирус простого герпеса 2-го типа (ВПГ-2). Следствием инфицирования человека ВПГ-1 являются, как правило, различные поражения кожных и слизистых покровов. ВПГ-2 вызывает поражения половых органов, в частности генитальный герпес, тяжелые заболевания новорожденных. По некоторым оценкам вирусом простого герпеса поражено до 90% населения земли.
При герпетических поражениях слизистых оболочек и кожных покровов в инфекционный процесс вовлекаются не только клетки эпителия и дермы, но и регионарная лимфатическая система. Заболевание сопровождается выраженной местной воспалительной реакцией - в дерме наблюдается отек сосочкового слоя и инфильтраты, состоящие преимущественно из лимфоцитов и нейтрофилов, в ядрах дегенерированных клеток обнаруживаются ацидофильные включения. Иммунологический ответ развивается как на вирусный антиген, так и на клеточные антигены, что нередко приводит к формированию аутоиммунных заболеваний кожи и слизистых оболочек [В.А.Исаков, Е.И.Архипова, Д.В.Исаков. Герпесвирусная инфекция человека. - СПб.: 2006; М.А.Самгин, А.А.Халдин. Простой герпес (дерматологические аспекты). М.: 2002].
Клиническая картина герпетических заболеваний глаз в 61,7% случаев осложняется сопутствующей инфекцией, в 55,4% - метаболическим поражением ткани глаза, повышением внутриглазного давления и вторичной глаукомой - в 16,8% случаев, нарушением прозрачности хрусталика и развитием катаракты - в 12,7%.
В основе поражения глазной стромы, при герпетических заболеваниях глаз, с последующим ее разрушением и рубцеванием лежит неадекватный ответ иммунной системы на вирусный и роговичный антиген [Майчук Ю.Ф. Герпесвирусные заболевания глаз. - М.: 2000].
Препараты, применяемые в настоящее время для лечения герпесвирусных инфекций исходя из особенностей патогенеза заболевания делятся на 2 группы: комплекс противовирусных препаратов на основе ацикловира и иммунотропные препараты (миелопид, тактивин, иммуноглобулин, интерфероны и др.).
Ацикловир (зовиракс, ганцикловир) являются синтетическим аналогом чистого нуклеозида с высокой активностью против герпесвирусов человека. Препарат блокирует репродукцию вируса в процессе его репликации в клетке. Наружное применение препаратов на основе ацикловира также требует длительного применения - в течение 7-12 дней 5 раз в сутки - что связано с низкой проникающей способностью ацикловира в роговицу и кожу. При длительном его применении возможно возникновение вариантов вируса малочувствительных к действию ацикловира.
Показанием для назначения иммунотропных препаратов является иммунологическая недостаточность, проявляющаяся снижением одного из показателей Т-звена и/или моноцитарно-макрофагального звена, а также снижение функциональной активности фагоцитарных клеток. Иммунотропные препараты целесообразно сочетать с противовирусной терапией для предотвращения появления резистентных к ацикловиру вариантов вируса. Препараты группы интерферона (реаферон, ά-интерферон, роферон, лейкинферон, виферон) применяется при герпетических заболеваниях любой локализации.
К недостаткам известных препаратов следует отнести привыкание и побочные эффекты, такие как чувство жжения, боли, дискомфорта, шелушения от мазей.
Например, известно противовирусное средство в форме геля, содержащее в 1 г смеси: интерферон концентрированный 5000-10000 ME, нипагин 0,002-0,004 г, 2%-ный раствор сополимера стирола с малеиновым ангидридом - остальное [Патент RU 2302881, МПК А61К 38/21, А61К 9/06, А61Р 31/12, 2007].
Также известна фармацевтическая композиция для лечения и профилактики генитального герпеса, хронической папилломовирусной инфекции и профилактики рака шейки матки, содержащая в 1 г: интерферон 100000-1000000 ME; С-аминокапроновую кислоту - 0,1-0,5; поливинилпирролидон - 0,005-0,15; окись алюминия - 0,5-1,5; ланолин - до 100,0 [Патент RU 2180593, МПК А61К 38/19, А61К 38/21, А61К 45/00, А61К 31/197, А61К 9/02, А61К 9/06, А61Р 31/22, А61Р 35/00, 2002].
Известно также иммунокорригирующее противовирусное лекарственное средство, содержащее на 1 г: интерферон человеческий рекомбинантный альфа и/или бета, и/или гамма - 100 МЕ-20 млн ME, токоферола ацетат или производные токоферола - 0,010-0,07 г, аскорбат натрия или кальция или аскорбил пальмитат - 0,010-0,05 г, кальция пантотенат - 0,010-0,3 г, антивирусный компонент - 0,01-0,4 г, формообразующие и вспомогательные вещества - остальное [Патент RU 2411039, МПК А61К 38/21, А61К 31/355, А61К 31/475, А61К 31/522, А61К 47/00, А61К 9/02, А61К 9/06, А61К 9/08, А61Р 31/12, 2011].
Для лечения герпетических заболеваний используют также составы из растительного сырья. Например, известен противовирусный препарат "Алпизарин", полученный из травы копеечника альпийского и копеечника желтеющего или из листьев манго, и выпускающийся в виде таблеток и мази [М.Д.Машковский. Лекарственные средства. - М.: Медицина, 1993, т.II, с.401]. Кроме того, известна спиртовая настойка цветов и листьев боярышника кроваво-красного и молодых листьев клена платановидного при их соотношении 2-4:1-2 и при соотношении сырья и спирта 1:3 [Патент RU 2196598, МПК А61К 35/78, А61К 9/06, 2003].
Недостатком известных препаратов из растительного сырья является недостаточная противовирусная активность.
Известны и другие комплексные препараты на основе различных действующих веществ, таких как, например, фуллерен-полигидрополиаминокапроновая кислота [Патент RU 2333752, МПК А61К 31/195, А61К 33/44, А61К 9/06, А61Р 31/12, 2008], гидрохлориды (3-R-1-адамантил)-1-этиламинов [Патент RU 2247714, МПК С07С 215/14, А61К 31/14, А61Р 31/16, А61Р 31/22, 2005] и на основе других веществ, которые имеют побочное действие и не обладают достаточным регенерирующим действием на клетки, поврежденные вирусом.
Лечение животных от герпетических заболеваний также является важной задачей.
Для лечения вульвовагинита крупного рогатого скота, например, используют вакцины, приготовленные на основе штамма вируса герпес, вызывающего данное заболевание [Патент RU 2279474, МПК C12N 7/00, А61К 39/265, C12R 1/93, 2006; Патент RU 2111011, МПК А61К 39/295, А61К 39/15, А61К 39/155, А61К 39/265, 1998]. Кроме того, известно применение внутриматочных средств, например свечей, содержащих на одну свечу, г: виватон - 1,0; ланолин, хч - 1,0; АСД-2ф - 0,5; масло какао - 8,0 [Патент RU 2375067, А61К 35/12, А61К 35/32, А61К 35/34, А61К 36/00, А61Р 15/00, А61Р 15/02, 2009].
Большинство перечисленных известных средств и составов против герпесвирусной инфекции имеют побочные эффекты. Кроме того, почти все известные препараты не вызывают регенерацию поврежденных вирусом клеток.
Цель настоящего изобретения - расширение ассортимента эффективных иммунобиологических препаратов для лечения заболеваний человека и животных, вызванных вирусом герпеса, обладающих высокими регенерирующими свойствами и отсутствием побочных эффектов.
Поставленная задача решается тем, что для лечения герпесвирусных заболеваний человека и животных предлагается применять лиофилизированный препарат из аллофибробластов, а именно клеток штамма ЛЭЧ-4(81).
Аллофибробласты - это аллогенные (культивированные) фибробласты.
Фибробласты (от лат. fibra - волокно и греч. blastos - зародыш, росток) - основная клеточная форма соединительной ткани организма позвоночных животных и человека. Фибробласты формируются в процессе эмбриогенеза из стволовых клеток мезенхимного происхождения.
Фибробласты вырабатывают волокна и основное вещество соединительной ткани. Например, известно, что фибробласты могут продуцировать коллагены I и II типов и компоненты внеклеточного матрикса: ламинин, нидоген, тинасцин, хондроитин-4-сульфат, протеогликан, фибронектин, а также цитокины, под которыми понимают разнообразные факторы роста, интерфероны, хемокины и интерлейкины. Цитокины, в основном, играют регулирующую роль в межклеточных взаимодействиях, активируя или ингибируя активность определенных клеток, в том числе клеток, участвующих в воспалении, регенерации и развитии иммунного ответа. Локальность действия цитокинов связана с их способностью соединяться с большим количеством рецепторов на поверхности клеток.
В настоящее время культуры аллофибробластов широко используются, как правило, для лечения поверхностных поражений кожи и слизистых оболочек, в частности тяжелых ожогов, трофических язв и других поверхностных поражений кожных и слизистых покровов. Клеточные системы составляют центральный элемент клеточных терапевтических технологий, используемых в кардиологии, неврологии, гематологии, гепатологии, стоматологии, эндокринологии и для целей ревитализации.
Известно применение аллофибробластов, а именно клеток штамма ЛЭЧ-4(81), в качестве клеточной культуры для заместительной терапии, которую используют в виде взвеси или в виде клеток на синтетической подложке для лечения ожоговых больных, больных с травмами опорно-двигательного аппарата, при восстановлении и коррекции функций поврежденных тканей и органов [Патент RU 2213775, МПК C12N 5/08, А61К 35/12, C12N 5/08, C12R 1:91, 2003].
Известно применение аллофибробластов в хирургическом лечении пародонтита и в дентальной имплантации [Патент RU 2204332, МПК А61В 17/00, А61К 35/48, С12Т 7/00, 2003; «Использование аллофибробластов при дентальной имплантации» и «Новые биотехнологии при хирургическом лечении пародонтита», авторы - С.Н.Федотов, С.Г.Шуневич, Н.А.Соловьев, Материалы VII Всероссийского научного форума с международным участием «Стоматология 2005», Москва-2005, с.279-281]. Также известно применение аллофибробластов в хирургии повреждений лицевого черепа [«Клеточные культуры в хирургии повреждений лицевого черепа», М.В.Турунцев, Н.Л.Кузнецова, С.А.Мальцев, www.medline.ru, том 8, Хирургия, май 2007].
По настоящему изобретению клеточные препараты штамма ЛЭЧ-4(81) в лиофилизированной форме предлагается применять для лечения герпетической инфекции у животных и человека.
Исследования Екатеринбургского НИИ вирусных инфекций (ЕНИИВИ) показали, что лиофилизированный препарат из аллофибробластов (АФБ), а именно клеток штамма ЛЭЧ-4(81), позволяет сокращать сроки лечения и тяжесть течения герпесвирусного заболевания не только человека, но и позвоночных млекопитающих. Таким образом, обнаружено, что АФБ воздействуют не только на вирусы герпеса человека (ВПГ-1 и ВПГ-2), но и на вирусы герпеса, патогенные для животных. При применении заявляемого препарата побочных эффектов не выявлено.
Штамм ЛЭЧ-4(81) представляет собой штамм диплоидных клеток, получен ЕНИИВИ (А.С. СССР №1147748), сертифицирован Минздравом России (регистрационное удостоверение Р №001402/01 2002), зарегистрирован в качестве оригинального и сохраняется в низкотемпературном банке-музее разработчика (заявителя).
Клеточная культура из штамма ЛЭЧ-4(81) представляет собой морфологически однородную популяцию клеток с ограниченным.сроком жизни определенного тканевого происхождения, сохраняющую стабильный кариотип (2n не менее 75% клеток), свободную от посторонних агентов, онкогенно безопасную, культивируемую на искусственных питательных средах в стандартных бутылках для кровезаменителей.
Клетки штамма ЛЭЧ-4(81) лишены антигенов гистосовместимости, что позволяет применять их, в том числе, для лечения животных.
Результаты исследований ЕНИИВИ показали, что аллофибробласты ЛЭЧ-4(81) в дополнение к ранее известному регенерирующему, иммуномоделирующему и антибактериальному действию, проявили новые свойства - противовирусное действие при лечении кожных и слизистых покровов, пораженных вирусом герпеса.
Противовирусное действие заявляемого препарата может быть связано с увеличением количества цитокинов в лиофилизированном препарате ЛЭЧ-4(81), обнаруженное в результате исследований ЕНИИВИ.
Лиофилизированную форму штамма ЛЭЧ-4(81) получают способом, описанном в патенте RU 2398873, 2009 г. В качестве исходного сырья используют криоконсервированные диплоидные клеточные культуры согласно нормативной документации («Выделение, культивирование и контроль штаммов диплоидных клеток». Методические указания. Министерство здравоохранения СССР. - М., 1979 г., с.16-22). В качестве исходного сырья могут быть использованы клеточные культуры, полученные из эмбриональной ткани млекопитающих, преимущественно ткани эмбрионов свиньи, овцы. Для проведения заявленного способа наиболее предпочтительными являются эмбриональные ткани первой половины срока беременности (4-6 недель). Клетки, полученные из эмбриональной ткани такого раннего возраста, менее дифференцированы, что положительно влияет на качество и количество конечного продукта. В качестве источника эмбриональной ткани могут быть использованы эмбрионы второй половины срока беременности (10-12 недель), однако в этом случае качество клеток ухудшается, а время эффективного культивирования существенно уменьшается.
Приготовление клеточной культуры включает использование предварительно измельченной эмбриональной ткани млекопитающего, промытой ферментным раствором при температуре 25-37°С, с последующей трипсинизацией ткани путем многократной обработки кусочков ткани при перемешивании раствором трипсина, сливы отделившихся клеток обрабатывают питательной средой и центрифугируют, образовавшийся осадок ресуспендируют и культивируют в монослое в ростовой среде на основе среды Игла, инкубируют с последующим пассированием в течение не менее пяти раз, целевой продукт обрабатывают ферментным раствором с целью съема с поверхности матраса, полученную взвесь центрифугируют, а полученную клеточную массу используют для получения препарата после ее криоконсервации.
Для культивирования в монослое используется ростовая среда на основе среды Игла, в качестве которой может быть использована среды, состоящая предпочтительно из равных количеств среда роста Игла MEM и 0,5% раствора гидролизата лактальбумина (ГЛА) с 10% эмбриональной сыворотки телят (ЭТС) или смесь среды роста Игла MEM и среды 199 или иные известные ростовые среды, содержащие среду роста Игла.
Использование указанных сред обеспечивает сохранение жизнеспособности клеточных культур и их максимальный выход.
Съем клеток производят смесью растворов 0,25% трипсина и 0,02% Версена с последующим добавлением среды Игла или ГЛА. Режим съема клеток обеспечивает максимальное количество и качество снимаемой клеточной суспензии, а последующее центрифугирование - качественное осаждение клеточной массы.
Получение сухого препарата осуществляют путем лиофилизации предварительно обработанной клеточной культуры. Обработку клеточной культуры ведут следующим образом. Восстановленную клеточную культуру культивируют в монослое в вышеуказанной ростовой среде на основе среды Игла, предпочтительно, в течение 4-5 суток, после чего производят съем клеточной культуры и ее отделение от кондиционированной ростовой среды. Последнюю отбирают во флаконы, а снятый клеточный пласт отмывают центрифугированием, полученную клеточную взвесь доводят до требуемой концентрации и разливают во флаконы. Пробы на стерильность берут из флаконов с кондиционированной ростовой средой и из флаконов с клеточной взвесью. Флаконы с кондиционированной ростовой средой и флаконы с клеточной взвесью подвергают сначала замораживанию до температуры не ниже -20°С, а потом оттаиванию при температуре +20°С - +25°С. Замороженные флаконы с клеточной взвесью и кондиционированной ростовой средой хранят до проведения бактериологических анализов, но не более 3-х недель. После оттаивания содержимое флаконов стерильно разливают во флаконы для лекарственных средств, после чего замораживают в открытых флаконах в стерильных кассетах для лиофильной сушки при температуре не выше минус 50°С, выдерживают в замороженном состоянии не менее 48 часов с последующей лиофилизацией в две стадии, на первой стадии ведут десорбцию в течение не менее 20 часов при температуре минус 50°С÷0°С, а на второй стадии ведут сублимацию в течение не менее 20 часов при температуре 0°С÷30°С при давлении не выше 15 Па флаконы с сухим целевым продуктом стерильно закрывают.
Полученный препарат стабилен при хранении при температуре +4°С в течение не менее 12 месяцев.
В качестве примеров конкретного выполнения приводим результаты исследований действия аллофибробластов на организмы человека, крыс, коров.
Пример 1. Исследование реакции беспородых белых мышей на введение лиофилизированного препарата диплоидных клеток ЛЭЧ-4(81), а именно - влияния препарата на показатели гуморального иммунитета белых мышей.
Исследования проводились на беспородых белых мышах обоего пола, весом 18,0-22,0 г (648 особей). Мыши содержались в стандартных условиях вивария с одинаковым пищевым рационом. Работа с мышами проводилась в соответствии с «Правилами проведения работ с использованием экспериментальных животных», утвержденными приказом МЗ СССР №75 от 12.08.1977 г.
Влияние препарата на иммуногенез изучали in vivo. Исследуемый препарат вводили животным внутрибрюшинно в количестве 0,5 мл в различных разведениях в физиологическом растворе (0,9% раствор NaCl). Соответственно условиям эксперимента животные были разделены на следующие группы:
I группа - животные, которым вводили 0,5 мкг/кг;
II группа - животные, которым вводили 5,0 мкг/кг;
III группа - животные, которым вводили 50,0 мкг/кг;
IV группа - животные, которым вводили 500,0 мкг/кг;
V группа - животные, которым вводили 5000,0 мкг/кг
VI группа (контрольная) - животные, которым вводился физиологический раствор в количестве, равном объему исследуемого препарата.
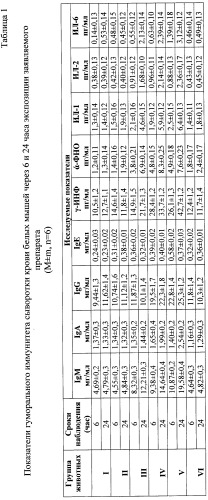
Исследования гуморального иммунитета проводили через 6 и 24 часа после экспозиции растворов исследуемого препарата путем оценки следующих количественных показателей крови:
- титр иммуноглобулинов М (IgM), мг·см-3;
- титр иммуноглобулинов G (IgG), мг·см-3;
- титр иммуноглобулинов A (IgA), мг·см-3;
- титр иммуноглобулинов Е (IgE), мг·см-3;
- титр γ-интерферона (γ-ИФН), пг·см-3;
- титр α-фактора некроза опухоли (α-ФНО), пг·см-3;
- титр интерлейкина-1 (ИЛ-1), пг·см-3;
- титр интерлейкина-2 (ИЛ-2), пг·см-3;
- титр интерлейкина-6 (ИЛ-6), пг·см-3.
Количественное определение титров иммуноглобулинов и цитокинов в сыворотке крови проводили с помощью тест-систем, основанных на классическом твердофазном двуступенчатом «сэндвич» методе иммуноферментного анализа на микропланшетах (Таблица 1).
Состояние форменных элементов периферической крови у экспериментальных мышей регистрировали на гематологическом автоматическом анализаторе Digicell - 500+ (Австрия) через 24 часа после введения препарата (Таблица 2).
Статистическую обработку полученных экспериментальных данных проводили согласно общепринятым методам с расчетом среднего арифметического значения (М) и доверительного интервала (m). Оценку достоверности различий определяли по критерию Стьюдента.
По результатам проведенных исследований достоверно установлено следующее.
Заявляемый препарат обладает выраженным иммуномоделирующим действием. Стимулирующее влияние отмечено для дозы препарата 500 мк/кг и выше при внутрибрюшинном способе введения. В первую очередь активируется выработка α-ФНО, ИЛ-1 и ИЛ-2. Подавление синтеза ИЛ-6 выражено в течение короткого времени (срок наблюдения 6 часов) и нивелируется спустя 24 ч (Таблица 1).
Заявляемый препарат не оказывает сенсибилизирующего действия на макроорганизм, т.к. уровень IgE во всех группах подопытных животных оставался близким к значениям величин в контрольной группе животных.
Повышение уровня концентраций IgM и IgG в дозах, превышающих 500 мкг/кг, по-видимому является следствием неспецифической воспалительной реакции при внутрибрюшинном введении испытуемого препарата, содержащего ксеногенный белок.
Показатели количественного состава форменных элементов периферической крови (Таблица 2) свидетельствуют о том, что при внутрибрюшинном введении препарат не оказывает влияния на гемопоэз экспериментальных животных - через 24 часа показатели форменных элементов крови оставались подобными показателям, полученным у мышей контрольной группы при введении физиологического раствора.
Пример 2. Изучение действия заявляемого препарата на модели офтальмогерпеса.
Модель воспроизводится на крысах путем заражения на скарифицированную роговицу глаза.
Цель эксперимента - определение защитных свойств заявляемого препарата при локализованном очаге инфекции.
Препарат разводили инъекционной водой (5 мл на флакон). В 0,025 мл раствора содержится 5 тысяч клеток (при расчете лиофилизации).
Лабораторных крыс (18 особей) весом 180-200 г под эфирным наркозом заражали нанесением суспензии ВПГ-1 (с инфекционным титром 4,5lg ТЦД50/мл) на скарифицированную роговицу глаза (в объеме 0,025 мл).
После инфицирования крыс разделили на 3 группы по 6 особей:
I группа - «Контроль вируса»;
II группа - «Эксперимент»;
III группа - «Ацикловир».
Шести крысам группы «Эксперимент» через 24 часа после инфицирования провели двукратную аппликацию раствора заявляемого препарата с 3-часовым интервалом между манипуляциями. Указанную процедуру проводили в течение 3 суток с момента заражения. Шесть крыс группы «Контроль вируса» лечения не получали.
Шести крысам группы «Ацикловир» через 24 часа после инфицирования двукратно наносили глазную мазь «Ацикловир Гексал» с 3-часовым интервалом между манипуляциями. Указанную процедуру проводили в течение 5 суток.
Шесть крыс группы «Контроль вируса» лечения не получала.
Наблюдение за развитием клинического процесса (Таблица 3) осуществляли следующими методами:
- Определение показателя защищенности (ПЗ)
П З = 100 * ( И Э − 1 ) И Э
И Э = P 1 P 2
ИЭ - индекс эффективности;
P1 - показатель летальных случаев в группе «Контроль вируса» (в %);
Р2 - показатель летальных случаев в группе «Эксперимент» или «Ацикловир» (в %);
- Выявление и сравнение инфекционного титра ВПГ-1 между группами экспериментальных животных в смывах со слизистой роговицы (Таблица 4).
Результаты исследования:
У группы «Контроль вируса» наблюдалось развитие герпетического конъюктивита в период 2-5 суток, которое сопровождалось выраженной общей интоксикацией. На фоне конъюктивита у 4 особей развился герпетический стоматит, у 1 крысы отмечены симптомы поражения ЦНС. К 12 суткам у 3 крыс зарегистрировано помутнение роговицы глаза (Таблица 3). У крыс группы «Эксперимент» развитие герпетических поражений глаз отмечено только у 2 крыс, при этом инфекционный процесс имел слабо выраженный характер, длительность заболевания составила менее 3 суток. Симптомы интоксикации и поражения ЦНС отсутствовали. У крыс группы «Ацикловир» герпетические поражения глаз наблюдались у 3 особей. К 15-м суткам у 1 животного выявлены помутнение роговицы и симптомы интоксикации.
Показатель защищенности (ПЗ) при использовании «Лиофилизированного клеточного препарата АФБ» в лечении экспериментального офтальмогерпеса на крысах составил 66,6%, что сравнимо с высокоактивными химическими препаратами типа Ацикловир. Показатель защищенности при использовании глазной мази «Ацикловир Гексал» в нашем исследовании составлял 67,4%.
Использование смывов со слизистой роговицы глаз крыс, инфицированных ВПГ-1, показало, что у животных группы «Контроль вируса» наблюдается продукция вируса (Таблица 4). В период с 1 по 7 сутки отмечали рост инфекционного титра ВПГ, что свидетельствовало о развитии заболевания с соответствующей клинической картиной (Таблица 1). Наличие инфекционно активного ВПГ у животных этой группы регистрировалось до 25 суток включительно.
У инфицированных крыс, получавших лечение препаратом «Ацикловир Гексал», максимальный инфекционный титр вируса определялся на 3 сутки после заражения и составлял 1,33 lg ТЦД50/мл. К 20-м суткам инфекционно активный вирус в смывах со слизистой роговицы глаз выделить не удалось.
У инфицированных крыс группы «Эксперимент» максимальный инфекционный титр вируса составлял 1,0 lg ТЦЦ50/мл определялся на 1-3 сутки после заражения, а к 9-м суткам инфекционно активный вирус в смывах со слизистой роговицы глаз выделить не удалось.
Предварительные выводы по использованию «Лиофилизированного препарата АФБ» в лечении экспериментального офтальмогерпеса на крысах.
Заявляемый препарат обладает многофункциональным действием, которое суммарно выражается в селективном ингибировании клеточных антигенов, что снижает остроту воспалительной реакции и ускоряет процессы регенерации слизистой оболочки роговицы глаза, а также подавляет репродукцию вируса.
1) Локальное действие содержащихся в заявляемом препарате цитокинов активирует выработку провоспалительных ИЛ-1, ИЛ-2 и ά-ФНО, ингибируя синтез ИЛ-6 (см. пример 1), что регулирует процессы воспаления тканей глаза. Процессы регенерации обусловлены как прямым, так и индуцирующим действием компонентов внеклеточного матрикса, входящего в состав заявляемого препарата.
2) Подавление репродукции вируса тканях слизистой оболочки роговицы глаза происходит в результате активации транскрипции ИНФ-ά, ИНФ-γ, ИНФ-1λ в клетках моноцитарно-макрофагального звена компонентами заявляемого препарата - мРНК ИНФ-ά, ИНФ-γ, ИНФ-1λ, ИНФ-1β, ИНФ-2λ. О подавлении репродукции вируса свидетельствует снижение инфекционного титра и отсутствие патологических изменений тканей глаза, которые формируются в результате активного инфекционного процесса.
Пример 3. Лечение коров с пустулезным вульвитом (синонимы: инфекционный ринотрахеит, пустулезный вульвовагинит) клеточным препаратом БАВ-С.
Возбудитель - Herpesvirus bovis 1.
Исследование проводили сотрудники отдела инфекционной патологии животных ГНУ «Мезенское», Белоярский район.
Цель исследования - изучение возможности применения заявляемого препарата для лечения генитальной формы инфекционного ринотрахеита коров в период стельности.
Диспансеризация коров проводилась во второй половине стельности. Были сформированы 3 группы коров (по 6 особей в каждой группе) с пустулезной сыпью в вульве интенсивностью не менее 75%: 1 группа (опытная) и 2 группы (контрольных). У всех коров групп перед лечением проводилась обработка наружной поверхности половых губ теплым слаборозовым раствором перманганата калия. Лечение в группах проводили по схемам:
1 группа (опытная): обработка раствором фурацилина, затем линиментом из тизоля и заявляемого препарата. Обработки проводились 1 раз в 3 дня.
2 группа (контрольная): обработка раствором фурацилина и тизолем. Трехкратно с интервалом в 2-3 дня.
3 группа (контрольная): обработка только раствором фурацилина. Трехкратно с интервалом в 2-3 дня.
Препараты готовили ex tempore непосредственно перед обработкой животных. Препарат тизоль, обладающий гидрофильными свойствами, применяли в качестве протектора.
Учет результатов лечения проводился ежедневно по результатам клинического осмотра и через 2 дня после последней обработки. При осмотре учитывали наличие пустулезных образований, гиперемии и количество слизи на поверхности преддверия влагалища (Таблица 5). По результатам клинических наблюдений рассчитывали индекс эффективности применения (ИЭ):
И Э = P 1 P 2
Р1 - показатель выраженности клинических проявлений пустулезного вульвита в группе 3 (в %);
Р2 - показатель выраженности клинических проявлений пустулезного вульвита в группе 1 или группе 2 (в %).
При анализе полученных данных установлено, что применение линимента из тизоля и Заявляемого препарата приводит к купированию воспалительного процесса: у всех коров группы 1 после трехкратной обработки снижалась отечность и гиперемия слизистой оболочки преддверия влагалища; отмечено уменьшение интенсивности пустулезной сыпи на 25-50%, что свидетельствует об ингибировании репродукции вируса. Индекс эффективности применения препарата составил 3,34.
У коров второй (контрольной) группы при обработке тизолем выраженных изменений не наблюдалось: у одной коровы понизилась инфильтрация тканей преддверия влагалища и у двух коров снизилось количество пустул на 25%. Индекс эффективности применения препарата - >1.
В третьей (контрольной) группе после обработки фурацилином выраженных изменений не наблюдалось.
Действие заявляемого препарата суммарно выражается в селективном ингибировании клеточных антигенов, что уменьшает воспалительную реакцию и ускоряет процессы регенерации и, что особенно важно, - усиливает прямой противовирусный эффект за счет экспрессии генов цитокинов.
Пример 4. Использование заявляемого препарата для лечения больных хроническим генитальным герпесом при поверхностной обработке поражений кожных и слизистых покровов.
Исследование проводилось на базе Свердловского областного кожно-венерологического диспансера.
В группу обследования входило 17 мужчин в возрасте от 20 до 43 лет, находящихся на диспансерном учете. Длительность заболевания составляла 2-5 лет, количество рецидивов - 3-5 в год. Основные клинические проявления во время рецидива - множественные мелкие эрозии и/или слившиеся в более крупные очаги на слизистых оболочках и коже полового органа, мошонки и промежности сопровождались отечностью и гиперемией половых, болезненным мочеиспусканием, жжением, зудом, субфебрильной температурой, расстройством сна и общей психологической подавленностью. Клинический диагноз «Генитальный герпес» был подтвержден лабораторно путем определения антигена ВПГ в соскобах и мазках-отпечатках из уретрального канала и в осадке мочи методом флюоресцирующих антител, а также выделением вируса на чувствительных клеточных культурах (ЛЭЧ и Vero) из крови, мочи и соскобов из уретрального канала.
1. Контрольная группа (9 человек): для лечения применяли препарат «Ацикловир» в течение 5 дней по 200 мг 5 раз в сутки per os и пяти кратную обработку поражений антивирусным препаратом «Ацикловир Гекса»;
2. Опытная группа (8 человек): в период рецидива пациенты принимали per os препарат «Ацикловир» в течение 5 дней по 200 мг 5 раз в сутки; для лечения герпетических эрозий кожи и слизистых оболочек полового органа применяли заявляемый препарат из расчета 50 тыс клеток на 1 см2 пораженной поверхности, 2 раза в сутки в течение 5 дней.
Для получения наибольшего терапевтического эффекта лечение начинали не позднее 72 часов от начала клинических проявлений.
Клинический осмотр пациентов проводили на 1, 3, 7 и 10 день лечения. При осмотре учитывали наличие: 1) везикулезных и пустулезных элементов, эрозий и изъязвлений; 2) гиперемии и отека тканей; 3) повышенной температуры; 4) болезненного мочеиспускания, жжения, зуда; 5) расстройства сна и общей психологической подавленности. Интенсивность клинических проявлений выражали в процентах (таблица 6).
Выявление антигена ВПГ в мазках-отпечатках со слизистой урогенитального тракта и эрозивных поражений проводили в реакции непрямой иммунофлюоресценции на тест-системах «ГерпесФлюоСкрин» (НПО «Ниармедик плюс», Москва) в день обращения, на 3, 7 и 10 день лечения (Таблица 6).
Начало рецидива регистрировали при появлении иммуноглобулинов класса М (Ig М) к ВПГ в сыворотке крови, которые выявляли методом ИФА на тест-системах «Герпес-скрин» производства ЗАО «Биосервис» (Москва).
Клинический анализ крови от больных осуществляли с помощью гематологического автоанализатора «System 9020» в день обращения и на 10 день лечения.
В качестве оценки выраженности воспалительного процесса использовали лейкоцитарный индекс интоксикации (ЛИИ) - по формуле Я.Я.Кальф-Калифа с учетом всех клеточных элементов лейкограммы:
Л И И = ( 4 м ц + 3 ю + 2 n + с ) × ( п л + 1 ) ( л + м о ) × ( э + 1 ) ,
где в процентном содержании - мц - миелоцитов, ю - юных метамиелоцитов, п - палочкоядерных нейтрофилов, с - сегментоядерных нейтрофилов; пл - плазматических клеток, л - лимфоцитов, мо - моноцитов, э - эозинофилов; 1, 2, 3, 4 - коэффициенты.
Уровень провоспалительных (ИЛ-1β, ИЛ-6 и ФНО-ά) и противовоспалительного (ИЛ-4) цитокинов в сыворотке крови определяли по стандартной методике с использованием тест-систем «ProCon» (OOO «Протеиновый контур» Санкт-Петербург) в день обращения и на 10 день лечения (таблица 7).
Статистическую обработку данных проводили с использованием стандартных методов, программа «Statsoft Windows», версия 4.0 (США).
Результаты исследований
У пациентов в день обращения клинические проявления рецидива генитальной герпесвирусной инфекции регистрировались в 100% случаях. В сыворотке крови пациентов методом ИФА были диагностированы иммуноглобулины класса М (Ig М) к ВПГ, что подтверждает начало рецидива. Антиген ВПГ методом ИФ выявлялся в клетках слизистой оболочки урогенитального тракта и/или эрозивных поражений в 100% случаях.
При рецидиве генитального герпеса у больных наблюдался лейкоцитоз (до 17,5±0,49·109/л), ускорение СОЭ (до 28,7±1,53 мм/ч) и изменение процентного соотношения клеточных элементов крови в лейкоцитарной формуле (нейтрофилов до 69,7±3,41%, лимфоцитов 24,18±0,05%). Полученные данные показали, что при рецидиве у всех 17 больных ЛИИ увеличился почти в 5 раза по сравнению с аналогичным показателем у практически здоровых пациентов (0,61±0,09) и составлял 3,01±0,18, что свидетельствует о выраженном воспалительном процессе.
Исследование сывороток крови от больных в день обращения показало, что уровень ИЛ-1β и ФНО-ά не увеличивался более чем в 2 раза по сравнению с нормальными показателями. В то же время отмечен прогрессивный рост уровня ИЛ-6. Концентрация противовоспалительного цитокина ИЛ-4 в сыворотке крови у всех больных во время рецидива ГВИ в 2,2 раза превышала уровень нормальных значений (таблица 6). Одним из патологических воздействий высоких концентраций ИЛ-6 (медиатора локального воспаления) является увеличение проницаемости эндотелия сосудов, что приводит к развитию отека, который наблюдался у всех пациентов. При этом несбалансированные концентрации цитокинов ИЛ-1β, ФНО-ά и ИЛ-4 сами по себе носят негативный, повреждающий характер, усугубляющий патологические изменения. Нарушение синтеза ИЛ-1β оказывает иммуносупрессивное действие на функциональную активность фагоцитирующих клеток, существенно снижая их способность элиминировать вирус из организма и способствуя расширению очага инфицирования. В результате чего в инфекционный процесс вовлекаются не только эпителиальные клетки, но клетки соединительной ткани и кожи (таблица 7).
У пациентов группы 1, получавших только антивирусный препарат «Ацикловир Гекса», снижение остроты клинических проявлений рецидива генитального герпеса наблюдалось на 7-е сутки в 33,3% случаев, эпителизация эрозивных повреждений кожи полового органа и промежности - на 10-е сутки в 66,6% случаев. Антиген ВПГ методом ИФ выявлялся в клетках слизистой оболочки урогенитального тракта и/или эрозивных поражений на 10-е сутки у 44,4%. Анализ результатов исследований гематологических показателей и уровня цитокинов ИЛ-1β, ил-6, ФНО-ά, ИЛ-4 в сыворотке крови выявил положительную динамику изменений, характерную для стадии окончания рецидива.
У пациентов группы 2 к 7-м суткам клинические проявления рецидива генитального герпеса на