Содержащие галактоза-альфа-1,3-галактозу n-гликаны в гликопротеиновых продуктах, полученных из клеток сно
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано в фармацевтической промышленности. Множество популяций клеток яичника китайского хомячка (СНО) подвергают скринингу на способность продуцировать гликопротеины, которые включают гликаны, содержащие терминальные остатки галактоза-альфа-1-3-галактозы. Способ скрининга предусматривает оценку уровня гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы, во множестве популяций клеток яичника китайского хомячка (СНО) и выбор популяций, продуцирующих указанные гликаны на целевом уровне. На предмет наличия указанных гликанов анализируют гликопротеиновые композиции, продуцированные клетками яичника китайского хомячка (СНО). Способ оценки гликопротеиновой композиции включает измерение количества терминальной галактоза-альфа-1-3-галактозы. Использование изобретения позволяет отслеживать и контролировать содержание терминальных остатков галактоза-альфа-1-3-галактозы при использовании клеток СНО как продуцентов терапевтических гликопротеиновых продуктов. 2 н. и 26 з.п. ф-лы, 7 ил., 2 табл., 1 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001] Данное изобретение относится к способам и материалам для обнаружения особых гликановых структур в белках, экспрессированных из клеточных систем экспрессии млекопитающих.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0002] Многие рекомбинантные терапевтические биофармацевтические продукты получают в культурах клеток млекопитающих, таких как клетки яичника китайского хомячка (СНО). Культуры клеток млекопитающих являются предпочтительными по сравнению с другими системами экспрессии, такими как дрожжевые и прокариотические системы, для продуцирования рекомбинантных гликопротеинов, главным образом, из-за того, что культуры клеток млекопитающих продуцируют гликопротеины с паттернами гликозилирования, которые, в основном, распознаются и переносятся людьми.
[0003] Известны потенциально неблагоприятные эффекты терминальных связей альфа-связанной галактозы (gal-α-1,3-gal), Chung et al., N Engi J Med, 358: 11 (2008). Ранее сообщалось, что такие терминальные связи альфа-галактозы не присутствуют в рекомбинантных гликопротеинах, продуцируемых клетками яичника китайского хомячка (СНО). Например, в то время, как анти-CDw52 антитело, кэмпас, продуцируемое в NSO, клеточной линии миеломы, развивающейся у мышиных, включает потенциально иммуногенные гликоформы, имеющие нередуцирующие терминальные остатки альфа-связанной галактозы, кэмпас (Campath), продуцируемый из клеток СНО, содержал, главным образом, три гликоформы, которые соответствуют нормальному IgG человека. Sheeley et al., Analytical Biochemistry 247: 102-110 (1997).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0004] Данное изобретение основано, частично, на открытии того, что гликопротеины, полученные из рекомбинантных клеток СНО, содержат гликановые структуры с терминальными связями галактоза-α-1,3-галактозы, которые могут иметь вредные эффекты при применении таких гликопротеинов для терапевтических целей. Например, введение гликопротеинов с терминальными альфа-gal связями людям для терапевтических целей может привести к образованию моноклональных антител к рекомбинантному гликопротеину у пациентов так, что последующие введения будут менее эффективными или даже будут вызывать неблагоприятные реакции гиперчувствительности у пациента.
[0005] В отличие от такой предыдущей идеи, Заявители неожиданно обнаружили, что существенная фракция рекомбинантных гликопротеинов, продуцированных в культурах клеток СНО, может проявлять присутствие терминальных gal-α-1,3-gal связей, представляя потенциал для неблагоприятных реакций на белковые и пептидильные продукты, введенные пациентам.
[0006] Данное изобретение обеспечивает соединения и способы, которые являются пригодными для продукции и анализа рекомбинантных гликопротеинов из клеток СНО, и композиции, содержащие такие гликопротеины, где гликопротеины включают модулированные (например, сниженные или, в некоторых случаях, увеличенные) уровни терминальных gal-α-1,3-gal связей.
[0007] Таким образом, в первом аспекте данное изобретение включает способы для оценки популяции клеток яичника китайского хомячка (СНО). В определенных вариантах осуществления способ испытания включает:
(a) обеспечение одной или более клеток СНО из популяции; и
(b) измерение гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы, продуцированные указанными клетками, где клетки СНО не были генетически сконструированы, чтобы экспрессировать последовательность, кодирующую альфа-галактозилтрансферазу.
[0008] Этап измерения может включать любое из следующих: (а) выделение гликопротеинов, продуцированных клетками, и измерение гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы на гликопротеинах, (b) выделение специфической гликопротеиновой композиции, продуцированной клетками, и измерение гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы, в выделенной гликопротеиновой композиции, (с) выделение гликанов из гликопротеинов, продуцированных клетками, и измерение гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы из выделенных гликанов, (d) отщепление моносахаридов от гликанов, присутствующих на гликопротеине или одной или более клеток СНО, и выявление терминальных высвобожденных альфа-галактозных остатков из отщепленных моносахаридов, (е) обеспечение, по меньшей мере, одного пептида из гликопротеина, продуцированного клетками, и измерение гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы на, по меньшей мере, одном пептиде, (f) измерение относительного уровня гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы, на гликопротеине путем измерения гликанов на клеточной поверхности одной или более клеток СНО. Методика, используемая для измерения терминальных gal-α-1,3-gal связей, может включать один или более из следующих способов и комбинации любых из этих способов: хроматографические способы, способы масс-спектрометрии (MS), электрофоретические способы (такие как капиллярный электрофорез), способы ядерного магнитного резонанса (NMR), моносахаридный анализ, флюоресцентные способы, поглощение в УФ и видимой областях спектра, ферментные способы и применение детекторной молекулы (такой как антитело или лектин).
[0009] Источник гликанов для измерения этапа 2 может быть выбран из группы, включающей следующее: популяция клеток СНО; гликопротеины или гликаны, экспрессированные на поверхности клеток СНО; пептиды, полученные от отщепления белков, присутствующих на поверхности клеток популяции клеток СНО; гликаны, присутствующие на поверхности популяции клеток СНО; гликопротеины, секретированные или экспрессированные популяцией клеток СНО, выделенный из гликопротеинового продукта экспрессии, экспрессированного из клетки СНО или популяции клеток СНО; пептиды, полученные из выделенного белкового продукта экспрессии, экспрессированного из клетки СНО или популяции клеток СНО; или гликаны, полученные из выделенного белкового продукта экспрессии, экспрессированного из клетки СНО или непосредственно из популяции клеток СНО. В некоторых вариантах осуществления способ включает обработку источника гликанов или гликопептидов одной или более экзогликозидаз, включая фермент альфа-галактозидазу, с последующим анализом гликановой популяции.
[0010] В некоторых вариантах осуществления используемый способ обеспечивает количественное измерение гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы. В некоторых вариантах осуществления используемый способ обеспечивает качественное измерение.
[0011] В некоторых вариантах осуществления способ также включает получение гликопротеинового препарата из культуры клеток СНО, отщепление одного или более гликанов из гликопротеинового препарата (например, с помощью одной или более гликозидаз, таких как α-1,3-галактозидазы; α-1,4-галактозидазы или α-1,6-галактозидазы), и измерение гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы.
[0012] В определенных вариантах осуществления способ проводят в ходе производственного цикла для терапевтического гликопротеина путем получения образца из культуры клеток СНО производственной линии, например, чтобы контролировать гликановую структуру в ходе производства. В определенных вариантах осуществления этап измерения повторяют, по меньшей мере, один раз, с течением времени, например, этап измерения повторяют, по меньшей мере, один, два, три раза или более, в течение периода времени культивирования клеток СНО. В других вариантах осуществления способ проводят на гликопротеиновом продукте, продуцированном из клеток СНО, например, как часть испытания качества или высвобождения гликопротеинового продукта.
[0013] В некоторых вариантах осуществления этап измерения включает сравнение уровня гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы, в первом препарате гликопротеина, продуцируемого из первой популяции клеток СНО, с уровнем гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы, во втором препарате гликопротеина, продуцированной из второй популяции клеток СНО. В некоторых таких вариантах осуществления определяют и сравнивают гликаны гликопротеинового препарата из популяций клеток СНО, культивируемых при различных условиях культивирования.
[0014] В некоторых вариантах осуществления способ может дополнительно включать этап сравнения уровня гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы, с эталонным уровнем (например, контрольным уровнем или диапазоном, или значением в спецификации продукта).
[0015] В определенных вариантах осуществления способа этап измерения включает применение детекторной молекулы, которая способна обнаружить присутствие или отсутствие терминальных альфа-галактозильных остатков. В определенных вариантах осуществления детекторная молекула включает антитело, которое способно связываться с терминальными альфа-галактозильными эпитопами. В других вариантах осуществления изобретения детекторная молекула включает лектин. В некоторых вариантах осуществления детекторная молекула может содержать флюоресцентную часть или радиоизотопную часть.
[0016] Популяция клеток СНО может включать клональную клеточную популяцию. Популяция клеток СНО может быть в культуре, например, или образцом из клеточной культуры в биореакторе для производства терапевтического гликопротеина. В определенных вариантах осуществления популяция клеток СНО будет трансформирована, по меньшей мере, с одним вектором, кодирующим терапевтический гликопротеин. Терапевтический гликопротеин может быть человеческого, нечеловеческого или синтетического происхождения. Терапевтический гликопротеин может быть предназначен для лечения людей или ветеринарных назначений.
[0017] В некоторых вариантах осуществления способ дополнительно включает этап оценки биологической активности гликопротеина, продуцированного клеткой, например, оценка присутствия или уровня иммуногенного потенциала гликопротеина, например, in vitro или in vivo, например, на животной модели.
[0018] Во втором аспекте данное изобретение включает способы скрининга одной или более клеток яичника китайского хомячка (СНО) на способность продуцировать гликаны, содержащие терминальные остатки галактоза-альфа-1-3-галактозы на гликопротеине, причем способ включает:
(a) обеспечение множества популяций клеток СНО, где ни одна из множества не была генетически сконструированной, чтобы продуцировать терминальные остатки альфа-галактозила на гликанах (например, не была генетически сконструированной, чтобы экспрессировать последовательность, кодирующую альфа-галактозилтрансферазу);
(b) культивирование каждого из множества клеток СНО при условиях, пригодных для экспрессии гликопротеинового продукта экспрессии;
(c) измерение гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы, продуцируемые каждой из множества клеток СНО, и
(d) выбор одного или более из множества препаратов клеток СНО на основе присутствия целевого уровня терминальных остатков галактоза-альфа-1-3-галактозы, продуцированных выбранным препаратом клеток СНО.
[0019] Гликаны, содержащие терминальные остатки галактоза-альфа-1-3-галактозы, могут быть получены и измерены из гликопротеинов, продуцированных препаратами клеток СНО, из выделенного гликопротеинового продукта экспрессии препаратов клеток СНО, из пептидов, полученных из гликопротеинового продукта экспрессии препаратов клеток СНО, из гликанов клеточной поверхности препаратов клеток СНО или из препаратов гликанов, полученных из препаратов клеток СНО или из их гликопротеинового продукта экспрессии. В определенных вариантах осуществления способ скрининга дополнительно включает этап выделения гликопротеинового продукта экспрессии из клеточной культуры и измерения терминальных остатков галактоза-альфа-1-3-галактозы на гликопротеине, продуцированном клетками на этапе (с). В определенных вариантах осуществления способ скрининга клеток дополнительно включает этап количественной оценки количества остатков альфа-галактозила, присутствующих на гликопротеиновом продукте экспрессии. В определенных вариантах осуществления этап (b) способа скрининга клеток имеет место в биореакторе.
[0020] Каждое из множества популяций клеток СНО может содержать различную популяцию СНО штаммов, различную клональную клеточную популяцию или различные образцы (например, образцы, взятые с течением времени) из клеточной культуры в производственной линии для терапевтического гликопротеина. В определенных вариантах осуществления популяция клеток СНО будет трансформирована с, по меньшей мере, одним вектором, кодирующим терапевтический гликопротеин, например терапевтический гликопротеин человека. В определенных вариантах осуществления способа скрининга клеток гликопротеиновый продукт экспрессии представляет собой секретированный гликопротеин, экспрессированный из клеток СНО.
[0021] Этап измерения способа скрининга может включать любую методику, раскрытую в данном описании для определения и/или количественной оценки терминальных остатков альфа-галактозила на гликопротеине.
[0022] В третьем аспекте изобретение включает способ оценки гликопротеиновой композиции, продуцированной в клетке-хозяине СНО. Способ включает измерение количества терминальной галактоза-альфа-1-3-галактозы, присутствующей в гликопротеиновой композиции, где гликопротеиновая композиция была продуцирована в клетках-хозяевах СНО, где клетки-хозяева СНО не были генетически сконструированные, чтобы экспрессировать последовательность, кодирующую альфа-галактозилтрансферазу.
[0023] В одном варианте осуществления способ включает запись уровня терминальной галактоза-альфа-1-3-галактозы, присутствующей в гликопротеиновой композиции, в печатном виде или на машиночитаемом носителе.
[0024] В некоторых вариантах осуществления способ также включает сравнение измеренного уровня терминальной галактоза-альфа-1-3-галактозы, присутствующей в гликопротеиновой композиции, с эталонным уровнем, таким как контроль или эталонная спецификация. Эталонный уровень может быть спецификацией (например, инструкция FDA или вкладыш для врача) или качественным критерием для фармацевтического препарата, содержащего гликопротеиновую композицию.
[0025] В одном варианте осуществления эталонный уровень или качественный критерий составляет не более чем 5% терминальной галактоза-альфа-1-3-галактозы, присутствующей в гликопротеиновой композиции, например, не более чем 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,5%, 1%, 0,5%, 0,25%, 0,2%, 0,1% или меньше. Уровень галактоза-альфа-1-3-галактозы, присутствующей в гликопротеиновой композиции может быть измерен как уровень гликанов, содержащих галактоза-альфа-1-3-галактозу, относительно общего количества гликанов в образце, таком как гликопротеиновый препарат.
[0026] В одном варианте осуществления методика, используемая для измерения терминальных gal-α-1,3-gal связей, включает хроматографический способ.
[0027] В одном варианте осуществления методика, используемая для измерения терминальных gal-α-1,3-gal связей, включает способы масс-спектрометрии (MS).
[0028] В одном варианте осуществления методика, используемая для измерения терминальных gal-α-1,3-gal связей, включает электрофоретические способы (такие как капиллярный электрофорез).
[0029] В одном варианте осуществления методика, используемая для измерения терминальных gal-α-1,3-gal связей, включает способы ядерного магнитного резонанса (NMR).
[0030] В одном варианте осуществления методика, используемая для измерения терминальных gal-α-1,3-gal связей, включает моносахаридный анализ.
[0031] В одном варианте осуществления методика, используемая для измерения терминальных gal-α-1,3-gal связей, включает флюоресцентные способы.
[0032] В одном варианте осуществления методика, используемая для измерения терминальных gal-α-1,3-gal связей, включает поглощение в УФ и видимой областях спектра.
[0033] В одном варианте осуществления методика, используемая для измерения терминальных gal-α-1,3-gal связей, включает ферментные способы.
[0034] В одном варианте осуществления методика, используемая для измерения терминальных gal-α-1,3-gal связей, включает и использование детекторной молекулы (такой как антитело или лектин).
КРАТКОЕ ОПИСАНИЕ ФИГУР
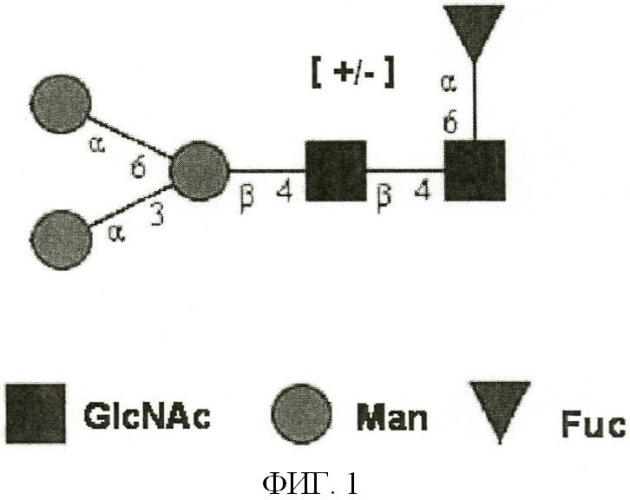
[0035] Фигура 1 представляет собой изображение корового пентасахарида, общего для N-гликановых структур.
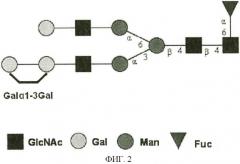
[0036] Фигура 2 представляет собой изображение нередуцирующей концевой N-гликановой структуры, имеющей терминальную gal-α-1,3-gal связь.
[0037] Фигура 3 представляет собой флюоресцентную хроматограмму фракции гликанов, полученных из абатацепта, показывающую выявление гликановых видов с композицией HexNAc4Hex6Fuc1, которая могла бы соответствовать структуре, содержащей галактоза-α-1-3 связанную галактозу.
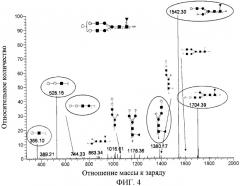
[0038] Фигура 4 иллюстрирует MS спектры гликановых видов, полученных из абатацепта с композицией HexNAc4Hex6Fuc1. Спектры коррелируют с гликановой структурой, содержащей нередуцирующую концевую галактоза-α1-3-галактозу.
[0039] Фигура 5 представляет собой флюоресцентную хроматограмму фракции гликанов, полученных из абатацепта и контрольного белка (также содержащего гликан с композицией HexNAc4Hex6Fuc1) до и после обработки α-галактозидазой.
[0040] Фигура 6 представляет собой MS2 спектры видов с композицией HexNAc4Hex5Fuc1, образованных от обработки гликановой фракции, полученной из абатацепта, альфа-галактозидазой.
[0041] Фигура 7 иллюстрирует MALDI-MS спектры фракции гликанов, полученных из абатацепта, обработанного различными экзогликозидазами.
ОПРЕДЕЛЕНИЯ
[0042] Если ниже не определено иное, все выражения, применяемые в данном описании, используются в их обычном значении, что будет понятно специалисту в данной области техники.
[0043] Приблизительно, около, примерно: Как используется в данном описании, выражения "приблизительно", "около" или "примерно", как применяется к одному или более значениям интереса, относятся к значению, которое подобно установленному эталонному значению. В определенных вариантах осуществления выражения "приблизительно", "около" или "примерно", относятся к диапазону значений, которые попадают в пределы 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или меньше установленного эталонного значения.
[0044] Обнаружение, выявление: Как используется в данном описании, выражения "выявление", "обнаружение" и "средство выявления" используются взаимозаменяемо для обозначения определения того, присутствует или отсутствует определенная химическая часть, такая как терминальный остаток альфа-1,3-галактозила, в или на соединении, композиции, клетке или клеточной популяции. Средство выявления может включать селектируемый маркер, или идентифицируемый признак, такой как флюоресцентная или радиоактивная часть, и может включать мечение реагента, соединения, клетки или клеточной популяции. Выявление может также относится к анализу соединения, композиции, клетки или клеточной популяции с использованием таких методик, как масс-спектрометрия или связанные способы, электрофоретические способы, ядерный магнитный резонанс, хроматографические способы или комбинации перечисленных выше, для определения присутствия или отсутствия химической части в или на соединении, композиции, клетке или клеточной популяции. Выявление также может включать количественную оценку абсолютных или относительных уровней химической части, которая подлежит выявлению.
[0045] Гликан: Как известно из уровня техники и используется в данном описании, "гликаны" представляют собой сахара. Гликаны могут быть мономерами или полимерами остатков сахара, но типично содержат, по меньшей мере, три сахара, и могут быть линейными или разветвленными. Гликан может включать остатки натуральных сахаров (например, глюкозы, N-ацетилглюкозамина, N-ацетилнейраминовой кислоты, галактозы, маннозы, фукозы, гексозы, арабинозы, рибозы, ксилозы и т.д.) и/или модифицированных сахаров (например, 2'-фторрибозы, 2'-дезоксирибозы, фосфоманнозы, 6'сульфо-N-ацетилглюкозамина и т.д.). Выражение "гликан" включает гомо- и гетерополимеры остатков сахаров. Выражение "гликан" также охватывает гликановый компонент гликопротеина (например, гликопротеина, гликолипида, протеогликана и т.д.). Выражение также охватывает свободные гликаны, включая гликаны, которые были отщеплены или высвобождены иным образом из гликопротеина.
[0046] Гликановый препарат: Выражение "гликановый препарат", как используется в данном описании, относится к набору гликанов, полученных согласно определенному способу получения. В некоторых вариантах осуществления "гликановый препарат" относится к набору гликанов, полученных из гликопротеинового препарата (смотри определение гликопротеинового препарата ниже). В некоторых вариантах осуществления гликановый препарат включает гликопротеины. В некоторых вариантах осуществления гликановый препарат включает высвобожденные гликаны.
[0047] Гликопротеин: Как используется в данном описании, выражение "гликопротеин" относится к "белку" (как определенно в данном описании), который содержит пептидный скелет, ковалентно связанный с одной или более частями сахара (т.е., гликанами). Как понятно специалистам в данной области техники, пептидный скелет типично содержит линейную цепь аминокислотных остатков. Часть(части) сахара может быть в форме моносахаридов, дисахаридов, олигосахаридов и/или полисахаридов. Часть(части) сахара может содержать одну неразветвленную цепь остатков сахара или может содержать одну или более разветвленных цепей. В определенных вариантах осуществления части сахара могут включать сульфатные и/или фосфатные группы. Альтернативно или дополнительно, части сахара могут включать ацетил-, гликолил-, пропил- или другие алкил-модификации. В определенных вариантах осуществления гликопротеины содержат О-связанные части сахара; в определенных вариантах осуществления гликопротеины содержат N-связанные части сахара.
[0048] Гликопротеиновый препарат: "Гликопротеиновый препарат", как это выражение используется в данном описании, относится к набору отдельных молекул гликопротеина, каждая из которых содержит полипептид, имеющий определенную аминокислотную последовательность (где аминокислотная последовательность включает, по меньшей мере, один сайт гликозилирования) и, по меньшей мере, один гликан, ковалентно присоединенный, по меньшей мере, к одному сайту гликозилирования. Отдельные молекулы определенного гликопротеина в гликопротеиновом препарате типично имеют идентичные аминокислотные последовательности, но могут отличаться по занятости, по меньшей мере, одного из сайтов гликозилирования и/или по идентичности гликанов, связанных, по меньшей мере, с одним из сайтов гликозилирования. То есть, гликопротеиновый препарат может содержать только одну гликоформу определенного гликопротеина, но более типично содержит множество гликоформ. Различные препараты одного и того же гликопротеина могут отличаться по идентичности присутствующих гликоформ (например, гликоформа, которая присутствует в одном препарате, может отсутствовать в другом) и/или по относительным количествам различных гликоформ.
[0049] Гликозидаза: Выражение "гликозидаза", как используется в данном описании, относится к средству, которое расщепляет ковалентную связь между последовательными сахарами в гликане или между сахаром и частью скелета (например, между сахаром и пептидным скелетом гликопротеина). В некоторых вариантах осуществления гликозидаза является ферментом. В определенных вариантах осуществления гликозидаза является белком (например, белковый фермент), содержащий одну или более полипептидных цепей. В определенных вариантах осуществления гликозидаза представляет собой химическое средство отщепления, например, гидразин.
[0050] N-гликан: Выражение N-гликан", как используется в данном описании, относится к полимеру сахаров, который был высвобожден из гликопротеина, но ранее был связан с гликопротеином посредством азотного мостика (смотри определение N-связанного гликана ниже),
[0051] N-связанные гликаны: TV-связанные гликаны представляют собой гликаны, которые связаны с гликопротеином посредством азотного мостика. Существует разновидный набор N-связанных гликанов, но типично основан на общем коровом пентасахариде (Man)3(GlcNAc)(GlcNAc).
[0052] О-гликан: Выражение "О-гликан", как используется в данном описании, относится к полимеру сахаров, который был высвобожден из гликоконъюгата, но ранее был связан с гликоконъюгатом посредством кислородного мостика (смотри определение О-связанного гликана ниже).
[0053] О-связанные гликаны: О-связанные гликаны представляют собой гликаны, которые связаны с гликоконъюгатом посредством кислородного мостика. О-связанные гликаны типично присоединены к гликопротеинам посредством N-ацетил-D-галактозамина (GalNAc) или посредством N-ацетил-D-глюкозамина (GlcNAc) к гидроксильной группе серина (Ser) или L-треонина (Thr). Некоторые О-связанные гликаны также имеют модификации, такие как ацетилирование и сульфатация.
[0054] Модулировать: Выражение "модулировать", как используется в данном описании, относится к способности объекта контроль, в заданных пределах, величины параметра, такого как уровень остатков альфа-галактозы, присутствующих в гликопротеиновой композиции. Таким образом, в некоторых вариантах осуществления уровень остатков альфа-галактозы может быть смодулирован так, чтобы он оставался в заданных пределах. В некоторых вариантах осуществления уровень остатков альфа-галактозы может быть смодулирован так, чтобы он не превышал более чем 5,0%, 1,0%, 0,5%, 0,1%, 0,05% или 0,01% общих TV-гликанов, присутствующих в гликопротеиновой композиции. В других вариантах осуществления уровень остатков альфа-галактозы может быть смодулирован так, чтобы он не изменялся на более чем 10,0%, 5,0%, 1,0%, 0,5% или 0,1% заданного или желаемого уровня.
[0055] Протеаза: Выражение "протеаза", как используется в данном описании, относится к средству, которое расщепляет пептидную связь между последовательными аминокислотами в полипептидной цепи. В некоторых вариантах осуществления протеаза представляет собой фермент (т.е. протеолитический фермент). В определенных вариантах осуществления протеаза представляет собой белок (например, белковый фермент), содержащий одну или более полипептидных цепей. В определенных вариантах осуществления протеаза представляет собой химическое средство отщепления.
[0056] Обеспечение: Выражение "обеспечение", как используется в данном описании, относится к субъекту, получающему рассматриваемый объект, такой как СНО клетка, препарат клеток СНО или гликопротеиновый препарат, из любого источника, включая, но без ограничения, получением с помощью собственного производства субъекта или с помощью получения субъекта от другой стороны. Например, препарат клеток СНО обеспечивается, если он произведен или получен с помощью любой машины, человека или юридического лица. В некоторых вариантах осуществления препарат клеток СНО может быть получен с помощью машины, которая может затем проводить одно или более испытаний, процессов или доработок гликопротеинового препарата. В некоторых вариантах осуществления препарат клеток СНО может быть получен человеком. В некоторых вариантах осуществления препарат клеток СНО может быть получен из посторонним юридическим лицом. В некоторых вариантах осуществления препарат клеток СНО может быть получен человеком или фирмой, выполняющих услуги определения характеристик для второго лица или компании.
[0057] Терминальный остаток α-1,2-галактозы; терминальная gal-α-1,3-gal связь: Выражения "терминальный остаток α-1,3-галактозы", "терминальные gal-α-1,3-gal связи" и "нередуцирующий концевой остаток α-1,3 связанной галактозы", как используется в данном описании, взаимозаменяемо описывают гликановую структуру, проиллюстрированную на Фигуре 2, в которой гликановая структура, которая может быть присоединена к пептиду или белку, заканчивается двумя остатками галактозы, которые связаны друг с другом на остатках, обозначены как 1 и 3 остатки, соответственно, на молекулах галактозы.
ДЕТАЛЬНОЕ ОПИСАНИЕ ОПРЕДЕЛЕННЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0058] Хотя клетки-хозяева, используемые для синтеза рекомбинантных гликопротеинов, обладают внутриклеточным аппаратом, чтобы производить сложное гликозилирование, эти клетки не всегда обладают таким же набором ферментов, как клетки, в которых гликопротеин экспрессирован естественным образом. Клональная селекция клеточных линий и изменения в условиях производства могут также производить гетерогенность в гликопротеинах, экспрессированных в культивированных клетках. Функциональная роль гликозилирования в активности гликопротеина делает необходимым точное определение характеристик терапевтических продуктов, продуцированных в клеточных линиях.
[0059] Ранее сообщалось, что терминальные gal-α-1,3-gal связи не присутствуют в рекомбинантных гликопротеинах, продуцируемых клетками яичника китайского хомячка (СНО). Chung et al., N Engi J Med, 358: 11 (2008). Данное раскрытие основано, по меньшей мере, частично, на неожиданном открытии того, что терминальные остатки а-1,3-галактозы могут быть обнаружены на гликопротеинах, продуцированных СНО клетками, и таким образом, важно определить, отследить и контролировать этот аспект гликановой структуры при использовании клеток СНО для продуцирования терапевтических продуктов.
[0060] Данное раскрытие обеспечивает способы анализа композиции гликанов на гликопротеинах, продуцируемых СНО клетками. Согласно данному раскрытию гликаны из гликопротеиновых препаратов, продуцированных в клетках СНО, могут быть проанализированы для определения того, включают ли они терминальные остатки α-1,3-галактозы. Данное раскрытие обеспечивает способы выявления таких модификаций и способы продуцирования гликопротеинов, которые включают или не включают такие модификации.
Гликановые препараты
[0061] Данное раскрытие обеспечивает способы анализа структуры и/или композиции отдельных гликанов в гликановом препарате, например, оценки гликанов, содержащих терминальные остатки галактоза-альфа-1-3-галактозы, продуцированные клетками СНО, например, оценки терминальных остатков альфа-галактозила на гликопротеинах, продуцированных клетками СНО, Гликановый препарат может быть получен из клеточного препарата или из гликопротеина с помощью любого способа, доступного в области техники. В общем, получение гликанового препарата включает этапы (1) получения клетки или гликопротеинового препарата; и (2) необязательно высвобождение гликанов из клетки или гликопротеинового препарата. В некоторых вариантах осуществления получение гликанового препарата необязательно включает мечение гликанового препарата обнаруживаемой меткой.
Гликопротеиновые препараты
[0062] Описаны способы рекомбинантного продуцирования гликопротеинов. Гликопротеины, секретированные культивируемыми клетками, могут быть выделены и очищены любыми доступными способами, такими как анионообменная хроматография, обращенно-фазовая хроматография, гель-фильтрация, иммуноаффинная хроматография и их комбинации.
N-связанный гликановый препарат
[0063] В некоторых вариантах осуществления TV-гликановый препарат получают путем обеспечения популяции гликопротеина и удаления N-связанных гликанов из гликопротеинов в популяции.
[0064] В некоторых вариантах осуществления TV-связанные гликаны удаляют из гликопротеинов (например, гликопротеины) ферментативным гидролизом. В целом, гликаназы, пригодные для использования согласно данному раскрытию, расщепляют между GlcNAc-Asn, GlcNAc-GlcNAc или Man-GlcNAc остатками кора. Иллюстративные ферменты, которые могут быть использованы для удаления TV-связанных гликанов из гликопротеинов, включают, но не ограничиваются, TV-гликаназу F и/или TV-гликаназу-А, О-гликаназу и/или Endo Н.
[0065] В некоторых вариантах осуществления TV-связанные гликаны удаляют из гликопротеинов химическим расщеплением. В качестве нескольких примеров, гидразин, боргидрид натрия и/или трифторметансульфоновая кислота (TFMS) могут быть использованы для удаления гликанов из гликопротеина.
О-связанный гликановый препарат
[0066] В некоторых вариантах осуществления О-связанный гликановый препарат получают путем обеспечения популяции гликопротеина (например, гликопротеин) и удаления О-связанных гликанов из гликопротеинов в популяции.
[0067] В некоторых вариантах осуществления О-связанные гликаны удаляют из гликопротеинов (например, гликопротеины) путем b-элиминанирования. В некоторых вариантах осуществления O-связанные гликаны удаляют из гликопротеинов (например, гликопротеины) путем восстановительного b-элиминирования. В некоторых вариантах осуществления O-гликаны удаляют из гликопротеинов (например, гликопротеины) путем невосстановительного b-элиминирования.
[0068] В некоторых вариантах осуществления О-связанные гликаны удаляют из гликопротеинового препарата (например, гликопротеина) путем инкубации препарата в растворе, который включает щелочной тетрагидроборат. В некоторых вариантах осуществления тетрадейтериоборат используется, например, чтобы встроить дейтериевую метку, чтобы облегчить выявление О-связанных гликанов. В различных иллюстративных способах препарат гликопротеина инкубируют в растворе, содержащем 0,8-1,0 М NaBH4 и 0,05-0,1 М NaOH при 42-45°С в течение 2-24 часов. Реакция для удаления О-связанных гликанов может быть прекращена путем добавления кислоты (например, 1,0 М HCl).
[0069] В некоторых вариантах осуществления О-связанные гликаны удаляют из гликопротеинового препарата путем инкубирования препарата в растворе, который включает NaOH. В различных иллюстративных способах гликопротеин инкубируют в растворе, содержащем 50-200 мМ NaOH при 27-45°С в течение 2-48 часов. Реакция может быть прекращена путем добавления кислоты.
[0070] В некоторых вариантах осуществления О-связанные гликаны удаляют из гликопротеинового препарата путем инкубирования препарата в растворе, который включает NH4OH. В различных иллюстративных способах гликопротеин инкубируют в растворе, содержащем 25-28% NH4OH при 45-60°С в течение 2-40 часов. Реакция может быть прекращена путем удаления NH4OH в вакууме. В некоторых вариантах осуществления раствор включает карбонат аммония (например, в насыщающей концентрации). В некоторых вариантах осуществления обработанный NH4OH препарат обрабатывают кислотой (например, борной кислотой).
[0071] В некоторых вариантах осуществления О-связанные гликаны удаляют из гликопротеинового препарата путем инкубирования препарата в водном растворе, который включает этиламин (например, этиламин в концентрации около 70%) или метиламин (например, метиламин в концентрации около 40%), в течение около 4-24 часов.
[0072] В некоторых вариантах осуществления О-связанный гликановый препарат получают из гликопротеиновой популяции, из которой N-связанные гликаны были удалены.
Маркирующие гликаны
[0073] В некоторых вариантах осуществления метки могут быть связаны с гликанами до или после высвобождения из гликопротеина. TV-связанные гликаны или О-связанные гликаны (например, TV-гликаны, которые были выделены из популяции гликопротеина) могут быть связаны с одной или более выявляемыми метками. Выявляемые метки типично связаны с редуцирующими концами гликанов. В некоторых вариантах осуществления выявляемые метки представляют собой флюоресцентные части. Иллюстративные флюорофоры, которые могут быть использованы согласно данному раскрытию, включают, но не ограничиваются, 2-аминобензойную кислоту (2АА), 2-аминобензамид (2АВ) и/или 2-аминопурин (2АР). В общем, флюорофоры для использования согласно данному раскрытию характеризуются тем, что способны реагировать с редуцирующим концом олигосахарида и/или моносахарида при условиях, которые не повреждают и/или не разрушают гликан. В некоторых вариантах осуществления флюоресцентные части присоединены непосредственно к редуцирующим концам. Например, прямое присоединение может быть осуществлено путем прямой конъюгации восстановительным аминированием. В некоторых вариантах осуществления флюоресцентные части присо