Способ обнаружения лизина в смеси -аминокислот
Иллюстрации
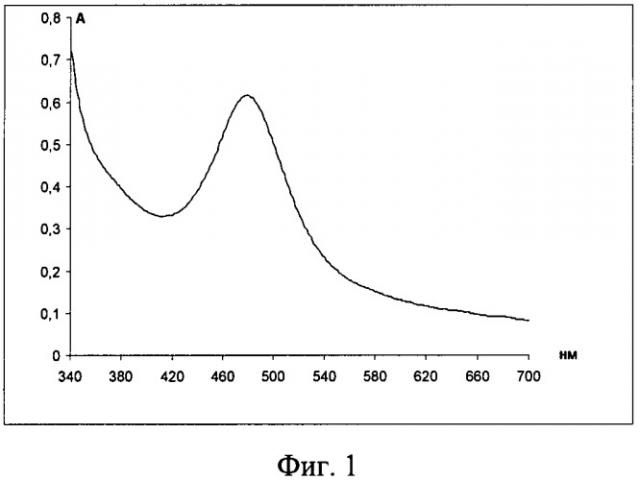
Показать всеИзобретение относится к аналитической химии, а именно к способам обнаружения биологически активного соединения - лизина, в сложных смесях. Технический результат заключается в упрощении, ускорении и удешевлении процедуры определения лизина при сохранении высоких метрологических параметров методики определения. Указанный технический результат достигается тем, что способ обнаружения лизина в смеси α-аминокислот, за исключением смеси, содержащей цистеин и пролин, включает приготовление ацетатно-аммиачного буферного раствора с рН 3,06, к которому добавляют 0,1% раствор лизина в таком количестве, чтобы в конечном готовом растворе его содержание было от 0,0004 до 0,008%; 0,2% водный раствор нингидрина в таком количестве, чтобы содержание нингидрина в конечном готовом растворе было от 0,01 до 0,03%; последующий нагрев полученного раствора на водяной бане при 95-105°С в течение 15-25 мин; добавление цетилпиридиния хлорида в количестве, обеспечивающем его содержание в растворе в концентрации после критической концентрации мицеллообразования - 0,1-0,4%; последующее измерение спектра поглощения полученного раствора; обнаружение лизина в растворе по наличию максимума на длине волны λmax=480 нм. 1 табл., 11 ил.
Реферат
Изобретение относится к аналитической химии, а именно к способам обнаружения биологически активного соединения - лизина, в сложных смесях. L-Лизин - незаменимая аминокислота, которую живой организм может получить только с пищей. Лизин является основой для построения белков живых организмов. При недостатке лизина расстраивается весь белковый обмен. Лизин влияет на прочность и эластичность связок и сухожилий, способствует усвоению кальция и его встраиванию в костную ткань, участвует в синтезе антител, гормонов, ферментов. Препараты, содержащие лизин, применяют для обогащения кормов и пищевых продуктов, парентерального питания больных. В связи с этим востребованы избирательные доступные методы экспресс-диагностики лизина в смесях аминокислот, для подтверждения подлинности препаратов. Для 20 незаменимых α-аминокислот известно немного таких реакций (таблица). Как следует из таблицы, высокоизбирательные реакции на лизин, позволяющие идентифицировать эту аминокислоту в смеси других α-аминокислот, не известны. Идентификацию лизина, наряду с другими α-аминокислотами можно провести методом высокоэффективной жидкостной хроматографии или капиллярного электрофореза, что требует дорогостоящего оборудования, высококвалифицированных специалистов, предварительной стадии дериватизации аминокислот и в связи с этим практически недоступно для рядовых клинических и химико-аналитических лабораторий, а также экономически не выгодно в том случае, если требуется подтвердить наличие в смеси лишь одной аминокислоты - лизина. В связи с этим актуально изыскание простого, дешевого, высокоизбирательного и надежного теста на лизин.
| Реакции, используемые для идентификации α-аминокислот | |||
| Реакция | Реактивы | Определяемая аминокислота | Окраска |
| Эрлиха | Диазотированная сульфаниловая кислота в щелочном растворе | Гистидин, тирозин | Красная |
| Адамкевича-Гопкинса | Глиоксиловая кислота в конц. H2SO4 | Триптофан | Сине-фиолетовая |
| Сакагучи | α-нафтол и гипобромит натрия | Аргинин | Красная |
| Нитропруссидная | Щелочь и нитропруссид натрия | Цистеин, метионин | Красная |
| Салливана | 1,2-Нафтохинон-4-сульфонат натрия и бисульфит натрия | Цистеин | Красная |
| Ксантопротеиновая (Мульдера) | Кипящая конц. HNO3 | Фенилаланин, тирозин | Желтая |
| Фолина | Фосфомолибденово-вольфрамовая кислота | Тирозин, триптофан | Синяя |
| Фоля | Кипячение с NaOH и CH3COONa | Цистеин, цистин | Черная |
| Шульце-Распайля | Фруктоза в сильнокислой среде | Триптофан | Вишнево-красная |
| Миллона | Раствор нитратов ртути (I) и (II) в HNO3 с примесью HNO2 | Тирозин | Красная |
| Мульдера | Кипящая конц. HNO3 и 30%-ный NaOH | Тирозин (мешает триптофан) | Оранжевая |
Известен способ определения лизина в водном растворе (см. патент на изобретение RU 2299433, G01N 31/16, G01N 27/48). Способ характеризуется тем, что готовят водный раствор лизина с концентрацией 0,01-0,1 мг/мл, добавляют к нему высаливатель - кристаллический сульфат лития в количестве 25 мас.%, раствор перемешивают, затем добавляют смесь гидрофильных растворителей, которую готовят из 50-60 мас.% изопропилового спирта и 40-50 мас.% этилацетата, экстракт отделяют, определяют в нем содержание лизина путем потенциометрического титрования экстракта, строят дифференциальную кривую зависимости потенциала среды от объема титранта, степень извлечения (R, %) лизина рассчитывают по формуле: R=D100/D+r, где D - коэффициент распределения лизина между смесью растворителей и водно-солевым раствором, r - соотношение равновесных объемов водной и органической фаз. Достигается возможность определения лизина в водном растворе с применением высаливателя и смеси гидрофильных растворителей.
Однако способ относится к водному раствору одного лизина при отсутствии других аминокислот и таким образом не является избирательным. Приводимый патент ориентирован не на избирательную идентификацию лизина в смеси аминокислот, а на возможность выделения из водного раствора путем экстракции лизина, как и других α-аминокислот, гидрофильными растворителями. Таким образом, поставленная задача в данном патенте не решается.
Известен способ определения содержания свободных аминокислот - лизина и/или метионина в кормовых средствах (см. патент на изобретение RU 2263307, МПК G01N 33/02, С12Р 13/08, С12Р 13/12). Способ определения содержания свободных аминокислот в кормовых средствах заключается в отборе пробы анализируемого кормового средства, приготовлении ее раствора, определении содержания аминокислот в приготовленном анализируемом растворе, расчете содержания аминокислоты в анализируемом кормовом средстве по полученным данным. Аминокислоту в приготовленном растворе превращают в ее дансильное производное путем взаимодействия с раствором дансилхлорида, а содержание аминокислоты в анализируемом растворе определяют методом капиллярного электрофореза по содержанию в нем ее дансильного производного.
Однако метод сложен, малодоступен в силу дороговизны, требует высокой квалификации специалиста, его использование экономически неоправданно для серийных анализов объектов на содержание лизина.
Наиболее близким к заявленному является колориметрический способ определения доступного лизина в пищевых продуктах (см. заявку на изобретение RU 2009112437, C12Q 1/04). Способ включает приготовление навесок проб исследуемого пищевого продукта, причем первая проба содержит гистидин + аргинин + лизин, а вторая - гистидин + аргинин. Навески проб продукта помещают в конические колбы, приливают в каждую колбу дистиллированную воду и оставляют на 9-10 мин, проводят блокирование свободных С-аминогрупп лизина, добавляют в обе пробы раствор красителя «Оранж-Ж» с последующим вычислением содержания доступного лизина в продукте. Блокирование свободных С-аминогрупп лизина проводят уксусным ангидридом. Навеску первой пробы берут в количестве 15 мг гистидин + аргинин + лизин, а второй 15 мг гистидин + аргинин, во вторую колбу вносят 0,4 см3 уксусного ангидрида и помещают ее на лабораторный встряхиватель на 14-15 мин. Обработку первой и второй пробы проводят одновременно, добавляют по 40 см3 раствора красителя «Оранж-Ж», встряхивают в течение 85-90 мин, затем содержимое колб фильтруют через стеклянные фильтры, отбирают пипеткой по 1 см3 каждого фильтрата и вносят в мерные цилиндры, доводят объем в цилиндрах по 75 см3 дистиллированной водой и тщательно перемешивают. Затем растворы проб колориметрируют, обрабатывают данные результатов, находящиеся в пределах от 0,2 до 0,6 единицы оптической плотности, на основании которых по градуировочному графику устанавливают количество несвязанного красителя в ммолях при рН 2,2 и вычисляют массовую долю доступного лизина в мг/100 г продукта.
Однако данный способ также не решает поставленную задачу избирательного обнаружения лизина в неизвестном растворе, содержащем наряду с лизином и другие аминокислоты. В данном способе содержание лизина должно быть заранее известно, что является весьма частной задачей и не предполагается в заявленном способе.
Задачей предлагаемого изобретения является разработка доступного клиническим и производственным лабораториям простого, экспрессного, дешевого и экологически чистого способа идентификации и определения содержания лизина в смесях α-аминокислот, основанного на особых условиях лизина с нингидрином в присутствии ПАВ.
Технический результат заключается в упрощении, ускорении и удешевлении процедуры определения лизина при сохранении высоких метрологических параметров методики определения.
Для решения поставленной задачи использовали специфику взаимодействия лизина с нингидрином, при определенных условиях. Данный подход основан на специфике взаимодействия лизина с нингидрином в кислой среде, отмеченной авторами данного изобретения. Поставленная задача решается тем, что для избирательного обнаружения лизина применяют композицию, состоящую из буферного ацетатно-аммиачного раствора рН 3,06, 0,2% водного раствора нингидрина и 0,01М цетилпиридиния хлорид (ЦПХ), а также подбора определенных условий: t° нагревания = 100°С, время нагрева, равное 20 мин.
Указанный технический результат достигается тем, что вначале готовят раствор, содержащий:
CH3COOH - от 0,6 до 0,9%,
NH3·H2O - от 0,002 до 0,004%,
исследуемый лизинсодержащий раствор - от 0,0004 до 0,008%,
нингидрин - от 0,01 до 0,03%,
вода - остальное.
Затем нагревают полученный раствор на водяной бане при 95-105°С в течение 15-25 мин. В результате нагревания происходит химическая реакция, приводящая к образованию оранжевого окрашивания выпадению осадка. Для растворения осадка добавляют ЦПХ в количестве, обеспечивающем его содержание в растворе в концентрации после ККМ (критической концентрации мицелообразования) - 0,1-0,4%. После этого измеряют спектр поглощения полученного раствора и по наличию максимума на длине волны λmax=480 нм делают вывод о присутствии лизина в растворе.
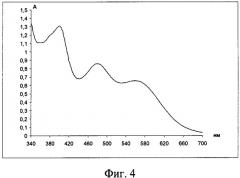
Изобретение иллюстрируется чертежами, где на фиг.1 приведен электронный спектр поглощения системы ацетатно-аммиачный буферный раствор (рН 3,06) - лизин-нингидрин-ЦПХ, на фиг.2 показан электронный спектр поглощения системы ацетатно-аммиачный буферный раствор (рН 3,06) - лизин (свежеприготовленный) - нингидрин - ЦПХ: 1-1 мл лизина, 2-0,5 мл лизина, 3-0,1 мл лизина, на фиг.3 представлен электронный спектр поглощения системы ацетатно-аммиачный буферный раствор (рН 3,06) - лизин-нингидрин-ЦПХ: 1-4,2 мл нингидрина (0,2%), 2-1,4 мл нингидрина (0,2%), на фиг.4 изображен электронный спектр поглощения системы ацетатно-аммиачный буферный раствор (рН 4,75) - лизин - нингидрин, на фиг.5 приведен электронный спектр поглощения системы ацетатно-аммиачный буферный раствор (рН 3,06) - гистидин-нингидрин, на фиг.6 показан электронный спектр поглощения системы ацетатно-аммиачный буферный раствор (рН 3,06) - аргинин-нингидрин, на фиг.7 изображен продукт реакции смеси ацетатно-аммиачный буферный раствор (рН 3,06) - лизин-гистидин-аргинин-нингидрин - ЦПХ, на фиг.8 представлен электронный спектр поглощения продукта реакции смеси ацетатно-аммиачный буферный раствор (рН 3,06) - лизин-гистидин-аргинин-нингидрин-ЦПХ, на фиг.9 приведен электронный спектр поглощения продукта реакции смеси ацетатно-аммиачный буферный раствор (рН 3,06) - цистеин-нингидрин-ЦПХ и электронный спектр поглощения продукта реакции смеси ацетатно-аммиачный буферный раствор (рН 3,06) - пролин-нингидрин-ЦПХ, на фиг.10 показан электронный спектр поглощения продукта реакции смеси ацетатно-аммиачный буферный раствор (рН 3,06) - лизин-гистидин-аргинин-нингидрин-ЦПХ: 1-19,86 мкг/л; 2-29,84 мкг/л; 3-39,71 мкг/л; 4-49,64 мкг/л; 5-59,57 мкг/л, на фиг.11 представлен градуировочный график смеси ацетатно-аммиачный буферный раствор (рН 3,06) - лизин-гистидин-аргинин-нингидрин-ЦПХ.
Реакцию проводили следующим образом: к 15 мл ацетатно-аммиачного буферного раствора рН 3,06 добавляли 1,25 мл 0,1% раствора лизина и 2,8 мл 0,2% водного раствора нингидрина. Нагревали на водяной бане при температуре 100°С в течение 20 минут. В ходе этой реакции образовался осадок. С целью растворения осадка, добавляли 2,5 мл 0,1М ЦПХ. Раствор после нагревания становился оранжевым. Затем раствор охлаждали, разбавляли в мерной колбе ацетатно-аммиачным буферным раствором до 25 мл и регистрировали спектр поглощения. Буферный раствор, для идентификации лизина, готовится следующим образом: 99,3 мл 2Н раствора СН3СООН смешивается с 59,7 мл 2Н раствора NH3·H2O и доводится в мерной колбе дистиллированной водой до 1 литра. Буферный раствор имеет рН 3,06. В качестве реагента применяется специально приготовленный раствор нингидрина:
Исследовалось также взаимодействие других α-аминокислот, гистидина и аргинина в ацетатно-аммиачном буферном растворе (рН 3,06), они не дают окрашивания, следовательно, не реагируют в данных условиях.
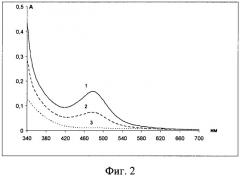
Пример 1. Была установлена минимально фиксируемая концентрация лизина. Для этого поочередно в систему ацетатно-аммиачный буферный раствор (рН 3,06) - лизин-нингидрин-ЦПХ, добавляли 1 мл, 0,5 мл и 0,1 мл 0,1% раствора лизина (фиг.2).
Как следует из фиг.2, интенсивность снижается по мере уменьшения концентрации лизина. При добавлении 0,1 мл лизина поглощение продукта реакции обнаружить не удается. Предел обнаружения составил 3,94 мкг/л.
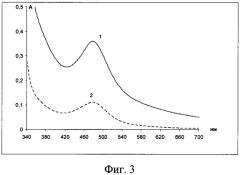
Пример 2. Исследовалось влияние концентрации нингидрина в системе на аналитический эффект. Для этого в систему ацетатно-аммичный буферный раствор (рН 3,06) - лизин-нингидрин-ЦПХ поочередно прибавляли 4,2 мл и 1,4 мл 0,2% водного раствора нингидрина (фиг.3).
Как следует из фиг.3, увеличение концентрации нингидрина приводит к увеличению оптической плотности от 0,15 до 0,38, что повышает чувствительность реакции.
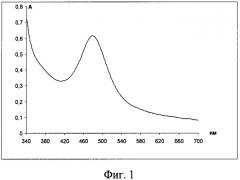
Пример 3. Система лизин-нингидрин-ацетатно-аммиачный буферный раствор исследовалась нами также и при рН 4,75. Реакцию проводили аналогично: к 15 мл ацетатно-аммиачного буферного раствора рН 4,75 добавляли 1,25 мл 0,1% раствора лизина и 2,8 мл 0,2% водного раствора нингидрина. Нагревали на водяной бане при температуре 100°С в течение 20 минут. Раствор после нагревания становился красно-оранжевым. Затем раствор охлаждали, разбавляли в мерной колбе ацетатно-аммиачным буферным раствором до 25 мл и регистрировали спектр поглощения (фиг.4).
Как следует из фиг.4, в спектре наблюдается наличие трех полос поглощения с λ=400 нм, 563 нм и ранее наблюдаемой полосой с λmax=480 нм. Отсюда следует вывод: лизин образует с нигидрином при рН 4,75 два окрашенных продукта (λmax=480 нм и λmax=563 нм). Наличие второго продукта мешает количественному определению лизина, однако качественная идентификация еще возможна.
Пример 4. Исследовалось взаимодействие другой основной α-аминокислоты, гистидина в ацетатно-аммиачном буферном растворе (рН 3,06), согласно следующей методике: к 15 мл ацетатно-аммиачного буферного раствора рН 3,06 добавляли 1,25 мл 0,1% раствора гистидина и 2,8 мл 0,2% водного раствора нингидрина. Нагревали на кипящей водяной бане в течение 20 мин. Раствор после нагревания становился бледно-желтым. Затем раствор охлаждали, разбавляли в мерной колбе ацетатно-аммиачным буферным раствором до 25 мл и регистрировали спектр поглощения (фиг.5).
Как следует из фиг.5, спектр поглощения системы ацетатно-аммиачный буферный раствор (рН 3,06) - гистидин-нингидрин не обнаруживает заметного поглощения в области 400-700 нм и, следовательно, не мешает обнаружению лизина.
Пример 5. Исследовалась возможность протекания реакции аргинина в ацетатно-аммиачном буферном растворе (рН 3,06) согласно следующей методике: к 15 мл ацетатно-аммиачного буферного раствора рН 3,06 добавляли 1,25 мл 0,1% раствора аргинина и 2,8 мл 0,2% водного раствора нингидрина (водяная баня, 20 мин). Раствор после нагревания оставался бесцветным (фиг.6).
Из полученных данных следует, что при данных условиях аргинин не мешает обнаружению лизина.
Пример 6. Избирательное определение лизина и его идентификация в смеси с двумя другими основными аминокислотами: к 13 мл ацетатно-аммиачного буферного раствора рН 3,06 прибавляли 1,25 мл 0,1% раствора аргинина, 1,25 мл 0,1% раствора лизина, 1,25 мл 0,1% раствора гистидина и 2,8 мл 0,2% нингидрина. Нагревали на водяной бане в течение 20 минут при температуре 100°С. Затем раствор охлаждали и добавляли 2,5 мл 0,1 М ЦПХ, доводили в мерной колбе ацетатно-аммиачным буферным раствором до 25 мл и регистрировали спектр поглощения. Образующийся оранжевый продукт реакции с λmax=480 нм свидетельствует о присутствии лизина в смеси (фиг.7).
Как следует из фиг.8, спектр поглощения состоит из одной полосы с λ=480 нм, что является характерной полосой поглощения для лизина.
Пример 7. Исследовалась возможность протекания реакции остальных из 20 аминокислот в ацетатно-аммиачном буферном растворе (рН 3,06) согласно следующей методике: к 15 мл ацетатно-аммиачного буферного раствора рН 3,06 добавляли 1,25 мл 0,1% раствора аминокислоты (пролин, цистеин, глутаминовая кислота, аспарагиновая кислота, аспарагин, метионин, глутамин, лейцин, изолейцин, фенилаланин, серин, треонин, тирозин, триптофан, глицин, аланин, валин) и 2,8 мл 0,2% водного раствора нингидрина (водяная баня, 20 мин). Растворы после нагревания оставались бесцветными. Исключение составили пролин и цистеин, образовывалось оранжевое окрашивание (фиг.9).
Данные две аминокислоты являются мешающими.
Пример 8. Для построения градуировочного графика в систему ацетатно-аммиачный буферный раствор (рН 3,06) - лизин-нингидрин-ЦПХ, раствор лизина поочередно добавляли 0,5 мл (19,86 мкг/л), 0,75 мл (29,84 мкг/л), 1 мл (39,71 мкг/л), 1,25 мл (49,64 мкг/л), 1,5 мл (59,57 мкг/л) и регистрировали спектры поглощения (фиг.11).
Наличие линейной зависимости и ее повторяемость свидетельствуют о стабильности данных, полученных с помощью предлагаемого способа идентификации, а также свидетельствует о пригодности применения полученной линейной зависимости максимума в спектре поглощения от концентрации лизина для количественного определения лизина.
Способ обнаружения лизина в смеси α-аминокислот, за исключением смеси, содержащей цистеин и пролин, включающий приготовление ацетатно-аммиачного буферного раствора с рН=3,06, к которому добавляют 0,1%-ный раствор лизина в таком количестве, чтобы в конечном готовом растворе его содержание было от 0,0004 до 0,008%; 0,2%-ный водный раствор нингидрина в таком количестве, чтобы содержание нингидрина в конечном готовом растворе было от 0,01 до 0,03%; последующий нагрев полученного раствора на водяной бане при 95-105°С в течение 15-25 мин; добавление цетилпиридиния хлорида в количестве, обеспечивающем его содержание в растворе в концентрации после критической концентрации мицеллообразования, 0,1-0,4%; последующее измерение спектра поглощения полученного раствора; обнаружение лизина в растворе по наличию максимума на длине волны λmax=480 нм.