Способ диагностики амилоидоза при болезни альцгеймера
Иллюстрации
Показать всеИзобретение относится к методам лабораторной диагностики, в частности к способу диагностики амилоидоза при болезни Альцгеймера. Способ диагностики амилоидоза при болезни Альцгеймера заключается в том, что выявляют разницу количества мономеров нано β-амилоида Аβ (1-42) и/или Аβ (1-40) в опытной и контрольной аликвотах образца плазмы крови, причем в опытной аликвоте диссоциацию олигомерных образований до мономеров нано β-амилоида Аβ (1-42) и/или Аβ (1-40) осуществляют путем воздействия на аликвоту ультразвуком при определенных условиях. Использование заявленного способа обеспечивает более высокую чувствительность диагностики амилоидоза при болезни Альцгеймера. 2 ил., 1 табл, 1 пр.
Реферат
Изобретение относится к области медицины, биотехнологии и молекулярной биологии и предназначено для диагностики амилоидоза и связанных с ним нейродегенеративных заболеваний (НДЗ).
Термин амилоидоз относится к различным заболеваниям, общей характеристикой которых является тенденция к агрегации специфических белков (в том числе амилоидов) в виде нерастворимых фибрилл, волокон и бляшек. Отложения белков в форме амилоидных волокон и бляшек - признак заболеваний, для которых характерны дегенеративные процессы в центральной нервной системе, других органах и тканях [Stefani M., Dobson С.М. Mol. Med. 2003, 81, №11, 678-699].
Все амилоидные болезни распознаются, как правило, в старческом возрасте и относятся к возрастным нарушениям здоровья. Все НДЗ имеют ряд характерных общих черт. Отложение белков - характерное свойство более чем 20 дегенеративных расстройств, влияющих на ЦНС и ряд периферических тканей. Общеизвестными амилоидными болезнями являются такие НДЗ, как болезнь Альцгеймера (БА), болезни Паркинсона и Гентингтона, синдромы Дауна, Стиля-Ричардсона-Олжевски и Рейе, болезнь телец Леви, сосудистая деменция, деменция в отсутствии отличительной гистопатологии, болезнь Пика, прогрессирующий надъядерный паралич, кортикобазальная дегенерация, множественная системная атрофия, миотропный латеральный склероз, эпилепсия и другие. Все они характеризуются амилоидозами - отложением амилоидных белков в тканях мозга. Поскольку эти патологии включают несколько форм фатальных системных амилоидозов и, по меньшей мере, одно расстройство, связанное с медицинским вмешательством (гемодиализом), то амидоидозы являются необычно важными в контексте установления точного диагноза.
Наиболее известной из нейродегенеративных заболеваний является болезнь Альцгеймера, которая по данным ВОЗ в Америке в 2006 году вышла на 4 место по количеству больных и по летальным исходам.
Первопричиной БА общепризнано накопление растворимых β-амилоидных белков (β-амилоид) в мозге по мере старения организма, которые при определенной концентрации включают каскад событий, приводящих к гибели нейрона [Мальцев А.В. и др. Альманах «Геронтология и гериатрия», Москва, 2003, Вып.2, с.78-83; Мальцев А.В. и др. Альманах «Геронтология и гериатрия», Москва, 2004, Вып.3, с.230-232]. В 90-93% случаев БА возникает как спорадическое заболевание и около 10% - как наследственное.
Таким образом, стоит задача как можно более ранней диагностики амилоидоза.
Известен способ диагностики амилоидоза (патент US 6365414) путем сравнения количества β-амилоидных формирований в цельной и ряде разведений спинномозговой жидкости (СМЖ) больного человека с количеством β-амилоидных формирований в цельной и ряде разведений спинномозговой жидкости здорового человека, которые определяют по реакции с цинком при добавлении пептида, включающего с 6-ой по 28-ую аминокислоты амилоидного β-пептида (β-амилоида).
Также известен способ диагностики амилоидоза (патент US 6114133), включающий определение количества β-амилоида (1-42) в образце спинномозговой жидкости пациента, и сравнение его с заранее предопределенной величиной, при этом количество β-амилоида измеряют при захватывании растворимого β-амилоида из исследуемого образца с помощью одного антитела с последующим определением захвата с помощью другого антитела с энзиматической меткой, т.е. методом ферментного иммуносорбентного анализа, например ELISA.
Недостатком указанных выше способов является необходимость использовать спинномозговую жидкость пациента, которую желательно брать только при наличии серьезных подозрений на нейродегенеративное заболевание или по жизненным показаниям. В то же время при попытке использования других жидкостей, например, крови, сыворотки крови, или лимфы известные способы являются недостаточно чувствительными.
Кроме того, было показано [Clark CM. et.al., Arch Neurol, 2003, 60(12), p.1696-1702; Burkhard PR. et.al., Clin Chem Lab Med.., 2004, 42(4), p.396-407], что количество β-амилоида в СМЖ в контрольных группах здоровых пациентов колеблется в широких пределах, что снижает достоверность вышеуказанных способов, т.к. для этих способов требуется сравнение со здоровым организмом.
Наиболее близким по технической сущности к предлагаемому нами способу является взятый нами за прототип способ диагностики амилоидоза при болезни Альцгеймера (патент РФ 2356058, опубликованный 10.06.2008), заключающийся в определении количества мономерного β-амилоида в контрольной и опытной аликвотах образца биологической жидкости, причем в контрольной аликвоте определяют физиологические мономеры β-амилоида, а в опытной аликвоте определяют также и мономеры β-амилоида, образующиеся в результате диссоциации олигомеров β-амилоида, и при обнаружении разницы количества мономеров β-амилоида в опытной и контрольной аликвотах делают вывод о наличии амилоидоза, при этом предварительно в опытной аликвоте олигомерные образования β-амилоида диссоциируют с помощью химических средств до мономеров.
Однако способ по патенту РФ 2356058 является недостаточно чувствительным, что не позволяет достоверно определять латентные стадии болезни Альцгеймера.
Техническая задача, на решение которой направлено предлагаемое изобретение, состоит в повышении чувствительности способа.
Поставленная задача решена тем, что в известном способе диагностики амилоидоза при болезни Алцгеймера, по выявлению разницы количества мономеров β-амилоида в опытной и контрольной аликвотах образца жидкой биологической среды, в частности плазмы крови, согласно изобретению, в опытной аликвоте диссоциацию олигомерных образований β-амилоида до мономеров осуществляют путем воздействия на аликвоту ультразвуком при рН 8,3-9,1.
В качестве β-амилоида преимущественно определяют β-амилоид (1-42) и (1-40).
Обработку опытной аликвоты ультразвуком осуществляют в течение 30-60 мин при частоте 20-25 кГц и 45 Вт в режиме 5-7 мин озвучивания и 1-2 мин отключения и температуре образца около +4°С.
Определение количества мономеров β-амилоида проводят, например, методом ферментного иммуносорбентного анализа, например ELISA, или методом высокоэффективной жидкостной хроматографии (ВЭЖХ), или с помощью двумерного электрофореза.
Сущность изобретения заключается в том, что экспериментальным путем подобраны описанные в настоящей заявке условия, позволяющие проводить в опытной аликвоте образца биологической жидкости диссоциацию олигомерных образований патогенных нано β-амилоида до мономеров, которые обеспечили повышение чувствительности способа, позволяющее диагностировать болезнь Альцгеймера, находящуюся в латентной стадии, что не позволял делать известный способ по патенту РФ 2356058.
Предлагаемый способ прост и экономически доступен и может выполняться с использованием отечественных реактивов и оборудования. Предложенное изобретение иллюстрируется
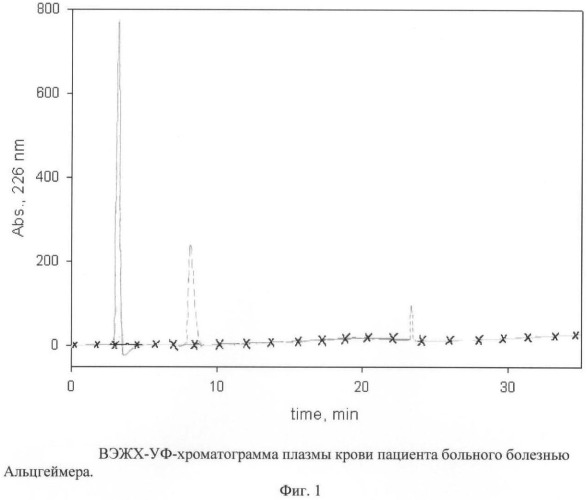
Фиг.1, на которой представлен пример хроматограммы плазмы крови больного болезнью Альцгеймера; при анализе пептидной фракции, содержащей нативные пептиды (А, линия - - - - - -), на хроматограмме выявлены два пика нативных бета-амилоидов; анализ фракции, содержащей белки и олигомеры нано бета-амилоидов (Б, линия -----------) после проведения диссоциации выявил на хроматограмме убедительный пик мономеров нано бета-амилоида (1-42); анализ хроматограммы белковой фракции, полученной до проведения диссоциации В (линия ---х---х---х---), показал отсутствие пиков мономеров нано бета-амилоидов.
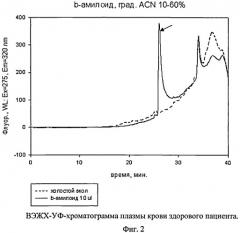
На фиг.2 представлен пример хроматограммы плазмы крови здорового добровольца. Анализ хроматограммы пептидной фракции А (линия -----------) показал присутствие нативных бета-амилоидов и остатков хи ферментативного гидролиза; анализ хроматограммы белковой фракции Б (линия - - - - - -), в которой могут содержаться олигомеры нано бета-амилоидов, после проведения операций по диссоциации олигомеров нано бета-амилоидов, показал отсутствие мономеров нано бета-амилоидов. Следовательно, в плазме крови здорового человека отсутствуют олигомеры нано бета-амилоидов.
Из анализа хроматограмм на фиг.1 видно, что увеличение площади пика мономеров нано бета-амилоидов на хроматограмме Б после диссоциации олигомеров нано бета-амилоидов по сравнению с пиком на хроматограмме А указывает на процесс амилоидоза нейронов и ранней стадии болезни Альцгеймера. На фиг.2 видно, что на хроматограмме А имеется пик пептидов, содержащих бета-амилоиды, на хроматограмме Б после диссоциации отсутствует пик, в котором могут быть мономеры нано бета-амилоидов.
Изобретение также иллюстрируется следующим примером:
Для отбора образцов крови пациентов и выделения плазмы при подготовке проб для анализа могут быть применены стандартные приемы и оборудование, применяемое в клиниках.
У пациентов из группы риска с предполагаемым диагнозом латентной формы БА брали по 9 мл крови стандартным способом при соблюдении современных требований [Балаховский С.Д., Балаховский И.С. Методы химического анализа крови. Москва, Медгиз, 1953, с.143].
Для получение плазмы крови использовали специальные центрифужные пробирки VACUTEST® с литий-гепариновым покрытием (9 мл), в которые собирали кровь из вены пациента. Основное требование на последующих этапах подготовки исследуемых образцов - сохранность биомаркеров в пробе крови, в качестве которых выступают мономеры бета-амилоидов и их олигомеры.
Для этой цели образцы крови доводили до рН 6,7 цитратным буфером рН 5,0 на рН-метре Меттлер Толедо, встряхивали и охлаждали до температуры +4°С, затем центрифугировали 15 мин при 1600 g при комнатной температуре. При наличии холодильника, очевидно, что центрифугирование лучше проводить при температуре +4°С. Надосадок - образец плазмы крови сливали в стерильную пробирку с крышкой и хранили в холодильнике при 0°+4°С до 2 суток. При необходимости хранения на более длительный срок образцы плазмы можно замораживать до -20°С. К месту анализа образцы плазмы доставляли в термосе при температуре не выше 5°С.
Далее образец плазмы делили на две части. Одна часть плазмы - контрольная аликвота предназначена для выявления нативных (физиологических) мономеров бета-амилоидов (А), другая - опытная - для определения мономеров нано бета-амилоидов после диссоциации олигомеров (Б), которые были образованы в мембране нейронов из патогенных мономеров нано бета-амилоидов.
Для определения мономеров бета-амилоидов в контрольной аликвоте эту часть образца плазмы (А) концентрировали при +4° на холоде, пропуская через фильтровальный шприц с фильтрами «Миллипор», и проводили измерение с помощью ВЭЖХ, для чего концентрированный образец помещали в катриджи (адсорбционные патроны) для твердофазной экстракции (Катриджи С-18 Phenomemex Strata: 8B-S001-HCH), тщательно перемешивали и раствор сливали в отходы. Промывали катриджи 0,1% ТХУ в водном растворе, сливали и подсушивали на фильтровальной бумаге. В катридж заливали около 0,5-2 мл элюента для ВЭЖХ-70% ацетонитрила, активно встряхивали и сливали в пробирку. Полученный элюат, содержащий пептиды до 60 аминокислотных остатков, использовали для определения нативных мономеров бета-амилоидов с помощью обращенно-фазовой ВЭЖХ. Для этого от полученного элюата на анализ отбирали 50 мкл пробы микрошприцом «Гамильтон» и вносили пробу в петлю объемом 20 мкл инжектора Rheodyne 7010, затем поворачивали ручку инжектора и вводили петлю в проток. При этом замыкается контакт запуска программы МультиХром. Перед внесением пробы на анализ устанавливали насос на проток 0,5 мл\мин, а спектрофотометрический детектор выводили на длину волны 226 нм. Программа Мультихром обрабатывает результаты измерений и помещает конечный результат анализа в банк данных и выводит на дисплей. При необходимости результат анализа можно распечатать на принтере в виде пиков, а также в виде цифровых показателей площади пика.
В опытной аликвоте (Б) проводили определение олигомеров нано бета-амилоидов.
Для этого в этой аликвоте (Б) доводили рН бикарбонатом натрия до рН 8,6, инкубировали при встряхивании и облучали в течение 45 мин на ультразвуковом дезинтеграторе УЗДН-2Т при частоте 22 кГц и максимальной мощности 45 Вт в режиме 5 мин озвучивания и 1 мин отключения прибора для диссоциации олигомеров на мономеры нано бета-амилоидов. Температуру образца поддерживали около +4°С. Обработанную ультразвуком опытную аликвоту плазмы концентрировали при +4°, пропуская через фильтровальный шприц с фильтрами «Миллипор». Далее определяли мономеры нано бета-амилоидов после диссоциации олигомеров в опытной аликвоте (Б) с помощью ВЭЖХ, как описано выше для контрольной аликвоты.
Результаты полученных хроматограмм представлены на фиг.1 и 2. Измерения проводили при следующем градиенте ацетонитрила:
Градиент ацетонитрила:
| Время, мин | % ацетонитрила с 0,08% ТФУ |
| 0 | 10 |
| 5 | 10 |
| 30 | 60 |
| 40 | 60 |
| 45 | 10 |
Как видно из хроматограммы, представленной на фиг.1, увеличение площади пика на хроматограмме Б по сравнению с пиком на хроматограмме А указывает на процесс амилоидоза нейронов и ранней стадии болезни Альцгеймера.
Таким образом, полученные с помощью предлагаемого способа экспериментальные результаты по косвенному определению количества олигомеров β-амилоида в образцах крови пациентов целесообразно использовать не только для проведения диагностики амилоидоза у больных болезнью Альцгеймера, но и в тех случаях, когда болезнь находится в латентной стадии.
Способ диагностики амилоидоза при болезни Альцгеймера, включающий выявление разницы количества мономеров β-амилоида Аβ (1-42) и/или Аβ (1-40) в опытной и контрольной аликвотах плазмы крови, полученных диссоциацией олигомерных образований β-амилоида до мономеров, отличающийся тем, что в опытной аликвоте диссоциацию олигомерных образований до мономеров нано β-амилоида Аβ (1-42) и/или Аβ (1-40) осуществляют путем воздействия на аликвоту ультразвуком в течение 30-60 мин при частоте 20-25 кГц и мощности 45 Вт в режиме 5-7 мин озвучивания, 1-2 мин отключения и температуре образца около +4°С, при рН 8,3-9,1.