Производные 1-амино-алкилциклогексана для лечения заболеваний, опосредованных тучными клетками
Иллюстрации
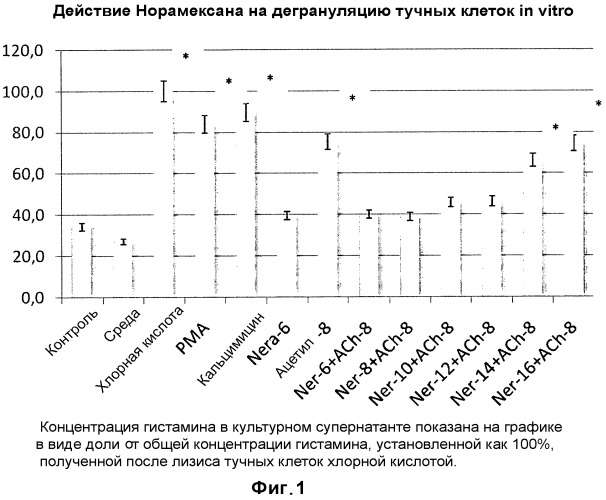
Показать всеНастоящее изобретение относится к области фармацевтики и медицины и касается средства для лечения или предупреждения заболеваний, опосредованных тучными клетками, включающего нерамексан или его фармацевтически приемлемую соль. Средство обладает высокой эффективностью в отношении лечения или предупреждения заболеваний, опосредованных тучными клетками. 2 н. и 26 з.п. ф-лы, 1 ил., 17 табл., 1 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к лечению пациента, страдающего заболеваниями, опосредованными тучными клетками, включающему введение пациенту эффективного количества производного 1-амино-алкилциклогексана.
УРОВЕНЬ ТЕХНИКИ
Данное изобретение относится к способам лечения пациентов, страдающих заболеваниями, опосредованными тучными клетками, включая крапивницу, атопический дерматит, псориаз, зуд, астму, ринит, мастоцитоз, конъюнктивит и кератоконъюнктивит.
Тучные клетки (MC) и базофилы крови являются ключевыми составными элементами приобретенной и наследственной иммунной системы человека. Различные подтипы обнаружены почти во всех тканях, наиболее обильно в коже и дыхательных путях и желудочно-кишечном тракте. Тучные клетки являются основными эффекторными клетками в воспалительных реакциях, опосредованных иммуноглобулином E (IgE), и участвуют в поддержании гомеостаза кожи и слизистых оболочек, а также в нейрогуморальных взаимосвязях, связанных с различными воспалительными процессами, как например, аллергическое воспаление. Тучные клетки задействованы в некоторых воспалительных кожных заболеваниях, таких как крапивница, кожный мастоцитоз, атопический дерматит и псориаз, и в зуде полиэтиологической природы. Тучные клетки также задействованы во внекожных заболеваниях, таких как ринит, системный мастоцитоз, аллергическая и неаллергическая бронхиальная астма, конъюнктивит и кератоконъюнктивит. Ключевым событием в стимулированных тучными клетками воспалительных процессах является дегрануляция тучных клеток, при которой в окружающую ткань доставляется обширная смесь различных цитокинов и нейротрансмиттеров (как например, серотонин и/или гистамин).
Тучные клетки дифференцируются из производных костно-мозговых миелоидных клеток-предшественников CD34+. После выхода из кровотока данные предшественники дифференцируются под влиянием местных факторов роста в тучные клетки зрелой ткани (Wedemeyer et al. 2000, Curr Opin Immunol. 2000;12(6):624-31). Тучные клетки находятся в непосредственной близости к сосудам, нервам и поверхностному эпителию. В коже человека наивысшая плотность тучных клеток может быть обнаружена вокруг волосяных фолликулов, потовых желез, сальных желез и капилляров сосочкового слоя кожи (Toruniowa, Jablonska 1988). Также сообщалось об анатомических и функциональных взаимосвязях между тучными клетками и периферическими нервами (Bienenstock et al. 1987 lnt Arch Allergy Appl Immunol 82: 238-43; Naukkarinen et al. 1996. J Pathol. 1996;180(2):200-5).
Тучные клетки имеют диаметр, равный 9-11 мкм, и характеризуются наличием многочисленных базофильных гранул. Тучные клетки являются важными эффекторами аллергических реакций. Тучные клетки играют важную роль во многих физиологических и патологических процессах вследствие их чувствительности к многочисленным активирующим факторам и их способности высвобождать избыток различных медиаторов. Тучные клетки задействованы в многочисленных заболеваниях кожи и слизистых оболочек, включая воспаление, гиперчувствительность, и заживлении тканей (Benoist и Mathis, 2002; Nature. 2002;420(6917):875-8). Тучные клетки связаны с чувствительными нервами и кровеносными сосудами посредством высвобождения гистамина, регулируя тем самым нейрогенное воспаление и зуд (Steinhoff et al., 2003, Arch Dermatol. 2003;139(11):1479-88).
Крапивница представляет собой кожное заболевание, которое вовлекает в патологический процесс активированные тучные клетки. При уртикарных поражениях тучные клетки дегранулируют, и доминирующими клиническими симптомами являются эффекты таких вазоактивных компонентов тучных клеток, как гистамин. От крапивницы, зуда и припухлости мягких тканей страдают многие пациенты. Причины крапивницы многочисленны и, действительно, существуют различные состояния, начиная с острой крапивницы как симптома аллергической анафилаксии, например, после употребления в пищу арахиса у пациентов с аллергией на арахис. Аллергии I типа являются уникальными в своем роде, поскольку для индуцирования данного действия необходимы специфический механизм и специфический агент. При других формах крапивницы, специфические пусковые механизмы либо неизвестны, либо не существуют (Maurer, et al., Hautarzt. 2003;54(2): 138-43). Крапивница также может встречаться в связи с вирусной или бактериальной инфекцией. Также известно, что нейроэндокринные факторы задействованы в приступе, например, адренергической или холинергической крапивницы, которые наблюдаются после физических упражнений (Maurer et al., Hautarzt. 2004;55(4):350-6; Mtynek et al., Curr Opin Allergy Clin Immunol. 2008;8(5):433-7).
Типичное лечение крапивницы задействует блокаду гистаминовых рецепторов H1- и, менее часто, H2-подтипов. Сообщается, что другие фармакологические агенты (как например, кромоглициевая кислота или монтелукаст) "стабилизируют" мембраны тучных клеток; однако также сообщалось, что в лечении крапивницы данные агенты менее эффективны. Более того, в тяжелых случаях для предупреждения приступа анафилаксии необходимо введение стероидов.
Одним из главных препятствий, связанных с лечением крапивницы в настоящее время, является низкая эффективность антигистаминных препаратов при тяжелых, угрожающих жизни формах острой крапивницы и при лечении хронических форм крапивницы, которые не имеют установленной причины и поэтому относятся к идиопатическим. Некоторые пациенты страдают от идиопатических форм крапивницы на протяжении нескольких лет и имеют значительно сниженное качество жизни (Mtynek et al., Curr Opin Allergy Clin Immunol. 2008;8(5):433-7).
Псориаз представляет собой полигенное наследственное мультифакториальное воспалительное кожное заболевание сложного патогенеза, которое может быть подвержено влиянию ряда факторов окружающей среды. Несмотря на значительный прогресс в плане патогенетических механизмов, задействованных в данном заболевании, многие факторы все еще остаются неизученными. Тучные клетки и макрофаги являются значимыми в начальных и развивающихся псориатических поражениях, но также обнаружены в стабильных поражениях. Несмотря на то, что последние явления, ведущие к клиническому фенотипу, являются хорошо понятными, (например, вовлечение цитокин-активированных Th1, приводящее к модели эпидермальной псориатической реакции), ранние явления, которые могли бы помочь разгадать генетические изменения и ключевые патогенетические контрольные точки, остаются неясными.
Вовлечение холинергической системы в патогенез псориаза подтверждают несколько направлений доказательств. Более чем 50 лет назад венгерская исследовательская группа лечила пациентов, страдающих псориазом, антихолинергическим веществом атропином, основываясь на предположении, что парасимпатическая нервная система должна отвечать за повышенное содержание ацетилхолина в псориатических поражениях, инициируя таким образом начало и опосредуя течение заболевания (Helmeczi, Dermatologica, 1955 110: 439-48). Тщательное обследование пациентов, представленных в исследовании Helmeczi, выявило, что на пероральное лечение атропином реагировали почти исключительно пациенты с "пятнистым псориазом", тогда как пациенты с хроническим псориазом бляшечного типа в целом не реагировали. Согласно нескольким гистологическим исследованиям первыми клетками, которые "прибывают" в псориатические поражения, являются тучные клетки и нейтрофильные гранулоциты. Действительно, было обнаружено, что количество тучных клеток значительно увеличено, особенно при каплевидном псориазе и ладонно-подошвенном псориазе (Schubert and Christophers, Arch Dermatol Res 1985; 277:352-8; Brody, J Invest Dermatol. 1984 May;82(5):460-4; Naukkarinen et al., J Pathol. 1996 Oct;180(2):200-5; Ashenagar et al., Arch Dermatol Res. 2007 Feb;298(9):421-6), тогда как при хронических поражениях домиинируют лимфоциты и макрофаги (Ghoreschi K and Rocken M; J Dtsch Dermatol Ges 2003; 1: 524-32).
Одно исследование демонстрирует значительное увеличение только тучных клеток в хронических псориатических поражениях у пациентов, жалующихся на зуд (Nakamura et al. 2003 Br J Dermatol; 149(4):718-30.), тогда как в отношении других иммунных клеток и цитокинов не была продемонстрирована какая-либо разница. В дополнение, было показано, что дегрануляция тучных клеток индуцирует экспрессию ICAM-1 в псориатическом эпидермисе, инициируя, таким образом, каскад воспаления (Ackermann and Harvima, Arch Dermatol Res. 1998 Jul;290(7):353-9). Имеется дополнительное доказательство роли тучных клеток при псориазе на модели мышей. Так называемая чешуйчатая мышь (конгенная fsn/fsn) демонстрирует диффузный эпидермальный ортокератотический гиперкератоз, сильно напоминающий псориаз. У данной мыши многочисленные тучные клетки выстраиваются в линию под эпидермисом (Sundberg et al., Eur J Immunol 1998 Apr;28(4): 1379-88). Тесное "синапсоподобное" соседство тучных клеток со свободными нервными окончаниями, содержащими избыток провоспалительных нейротрансмиттеров, наряду с их хорошо подтвержденной восприимчивостью к "стресс-гормонам", таким как CRH и урокортин, делает тучные клетки идеальной мишенью для стресс-опосредованных и нейрогенных воспалительных процессов (Arck et al., J Mol Med. 2005; 83(5):386-96), что хорошо соответствует клинической связи псориаза с эмоциональным стрессом (Singh et al., J Pharmacol Exp Ther. 1999 Mar;288(3): 1349-56). Физиологическая функция тучных клеток активно обсуждается (Maurer et al., Exp Dermatol. 2003 Dec;12(6):886-910); однако было продемонстрировано, что тучные клетки являются ключевыми клетками нейроэндокринных воспалительных процессов (Arck et al., J Mol Med. 2005; 83(5):386-96; Siebenhaar, et al., J Allergy Clin Immunol. 2008;121(4):955-61), которые могут быть вызваны большим разнообразием различных стимулов, и среди них, ацетилхолином (Fantozzi et al. 1978 Nature 273: 473-4).
Существует нескольких протоколов лечения псориаза, направленных на продукты выделения тучных клеток, в частности гистамин. Применение блокаторов H1-R и H2-R было предложено и подтверждено в немногочисленных исследованиях (Kristensen et al., Br J Dermatol. 1995 Dec;133(6):905-8; Petersen et al., Acta Derm Venereol. 1998 May;78(3): 190-3); однако, рандомизированные контролируемые исследования не показали значительных терапевтических эффектов. Данные результаты/отсутствие эффекта могут возникать вследствие использования в качестве фактора стратификации шкалы PASI, а не подтипов псориаза или остроты (Zonneveld et al., J Am Acad Dermatol. 1997 Jun;36(6 Pt 1):932-4. 7-103).
Были подтверждены некоторые изменения холинергической системы в псориатических поражениях: SLURP-2 представляет собой пептидный модулятор никотиновых холинергических рецепторов, который был обнаружен в увеличенном количестве в псориатических поражениях. Было показано, что SLURP-2 ингибирует каспазу-3 и филагрин и вследствие этого, как предполагается, задействован в псориазе посредством его роли в гиперпролиферации кератиноцитов и/или дифференциации/активации T-клеток (Tsuji et al., Genomics 2003;81(1):26-33).
Курение повышает риск возникновения псориаза, по меньшей мере, у части пациентов. Данное действие, наиболее вероятно, связано с основным сигаретным токсином, никотином, лигандом никотиновых ацетилхолиновых рецепторов (nAChR) (Arathi et al., Am J Med, 2007, 120 (11): 953-959), также активным в отношении α10 nAChR, присутствующих в тучных клетках. В дополнение, особая форма псориаза, пустулезная ладонно-подошвенная (PPP), сильно коррелирует с курением, причем PPP поражения особенно богаты тучными клетками, экспрессирующими ацетилхолинэстеразы (AChE), и гранулоцитами, экспрессирующими ChAT и α3 nAChR. (Hagforsen et al., Acta Derm Venereol 2002; 82(5):341-6).
Тучные клетки также являются ключевыми эффекторными клетками при бронхиальной астме. Антихолинергические вещества для лечения астмы, действующие на мускариновые ацетилхолиновые рецепторы (mAChR), присутствуют в продаже (тиотропиум). Предполагалось, что при воспалении слизистой оболочки в легких возможно происходит вовлечение как нейрональных, так и не нейрональных производных ACh, задействуя лимфоциты и макрофаги, тучные клетки (Wessler and Kirkpatrick, Pulm Pharmacol Ther. 2001;14(6):423-34). Данное представление оказывает непосредственное влияние на вопрос действия никотина, происходящего из табака, при легочных заболеваниях с одной стороны, и применения антимускариновых лекарственных препаратов при хронических заболеваниях дыхательных путей, с другой стороны.
Ринит вовлекает в патологический процесс воспаление и набухание слизистой оболочки носа, характеризуется насморком и нехваткой воздуха и обычно вызывается частыми простудами или аллергией.
Аллергический ринит представляет собой наиболее частую причину ринита. Он является очень частым патологическим состоянием, поражая приблизительно 20% населения. Несмотря на то, что аллергический ринит не является угрожающим жизни состоянием, могут возникнуть осложнения, и состояние может значительно ухудшить качество жизни, что приводит к ряду непрямых затрат. Как было недавно оценено, в сумме прямые и непрямые затраты на аллергический ринит составляют 5,3 миллиардов долларов в год.
Аллергический ринит вовлекает в патологический процесс воспаление слизистых оболочек носа, глаз, евстахиевых труб, среднего уха, синусов и глотки. Нос вовлекается неизменно, а другие органы поражаются у некоторых пациентов. Воспаление слизистых оболочек характеризуется сложным взаимодействием воспалительных медиаторов, но в конечном счете оно запускается иммуноглобулин E (IgE)-опосредованной реакцией на белок из окружающей среды.
Тенденция к развитию аллергических или IgE-опосредованных реакций на аллергены из окружающей среды (белки, способные вызывать аллергическую реакцию) имеет генетический компонент. У восприимчивых пациентов воздействие определенных чужеродных белков приводит к аллергической сенсибилизации, которая характеризуется выработкой специфических IgE, направленных против данных белков. Данные специфические IgE покрывают поверхность тучных клеток, которые присутствуют в слизистой оболочке носа. Когда специфический белок (например, специфическое пыльцевое зерно) вдыхается в нос, он может связаться с IgE на тучных клетках, приводя к немедленному и отсроченному высвобождению ряда медиаторов.
Медиаторы, которые высвобождаются немедленно, включают гистамин, триптазу, химазу, кинины и гепарин. Тучные клетки быстро синтезируют другие медиаторы, включая лейкотриены и простагландин D2. Данные медиаторы, посредством различных взаимосвязей, в конечном счете приводят к симптомам ринореи (т.е. гиперемии носа, чиханию, зуду, покраснению, слезоотделению, набуханию, давлению в глазах, стеканию слизи в носоглотку). Стимулируются слизистые железы, что приводит к повышенной секреции. Повышается проницаемость сосудов, приводя к экссудации плазмы. Происходит вазодилатация, ведущая к гиперемии и давлению. Стимулируются чувствительные нервы, что приводит к чиханию и зуду. Все данные явления могут возникать в течение минут; следовательно, данная реакция называется ранней или немедленной фазой реакции.
Через 4-8 часов вышеуказанные медиаторы, благодаря сложному взаимодействию явлений, приводят к поступлению в слизистую оболочку других клеток воспаления, таких как нейтрофилы, эозинофилы, лимфоциты и макрофаги. Это приводит к продолжающемуся воспалению, называемому ответом поздней фазы. Симптомы ответа поздней фазы подобны симптомам ранней фазы, но имеется тенденция возникновения меньшего чихания и зуда и большей гиперемии и продукции слизи. Поздняя фаза может продолжаться в течение часов или дней.
Атопический дерматит представляет собой заболевание, сопровождающееся зудом, неизвестного происхождения, которое обычно начинается в раннем детском возрасте (признается вариант появления у взрослых); оно характеризуется зудом, экзематозными поражениями, ксерозом (сухой кожей) и лихенификацией (утолщение кожи и усиление кожного рисунка). Атопический дерматит может быть ассоциирован с другими атопическими (иммуноглобулин E [IgE]) заболеваниями (например, астмой, аллергическим ринитом, крапивницей, острыми аллергическими реакциями на пищевые продукты). Атопический дерматит обладает значительной распространенностью и заболеваемостью и, похоже, что уровень распространености повышается.
Существенное доказательство показывает, что в развитии атопического дерматита (AD) важными являются генетические факторы, но патофизиология все еще остается малопонятной. Были предложены две основные гипотезы относительно развития воспалительных поражений. Первая выдвигает иммунную дисфункцию, приводящую к сенсибилизации IgE и вторичному повреждению эпителиального барьера. Вторая предлагает дефект в эпителиальных клетках, приводящий к проблеме нарушенного барьера, с иммунологическими аспектами, представляющими собой сопутствующие явления.
Зуд является частым проявлением кожных заболеваний, таких как крапивница, атопический дерматит и другие аллергические реакции. Эффективное лечение зуда может предотвратить вызванные экскориациями осложнения, такие как лихен простой хронический и импетиго.
Зуд порождается в свободных нервных окончаниях кожи, которые наиболее сильно концентрированы в запястьях и лодыжках. Ощущение зуда передается через C-волокна в задний рог спинного мозга и к коре головного мозга через спиноталамический тракт. Зуд вызывает спинно-мозговой рефлекторный ответ, расчесывание, который является как врожденным, так и глубоким сухожильным рефлексом. Независимо от причины, зуд часто сопровождает воспаление кожи, сухие или жаркие окружающие условия, вазодилатацию кожи и психологические стрессовые факторы.
Гистамин, который высвобождается тучными клетками у людей с крапивницей и другими аллергическими реакциями, является одним из факторов, обычно связанным с зудом.
Как отмечалось выше, существуют различные затруднения, связанные с доступными методами лечения заболеваний, опосредованных тучными клетками, как например, крапивницы, атопического дерматита, псориаза, зуда, астмы, ринита, мастоцитоза, конъюнктивита и кератоконъюнктивита. Таким образом, существует необходимость в усовершенствованных методах лечения крапивницы, атопического дерматита, псориаза, зуда, астмы, ринита, мастоцитоза, конъюнктивита и кератоконъюнктивита и других заболеваний, опосредованных тучными клетками.
Производные 1-амино-алкилциклогексана, как например, нерамексан (также известный, как 1-амино-1,3,3,5,5-пентаметилциклогексан), как было обнаружено, является пригодным в терапии различных заболеваний, особенно некоторых неврологических заболеваний, включая болезнь Альцгеймера и нейропатическую боль. Производные 1-амино-алкилциклогексана, как например, нерамексан, подробно раскрыты в Патентах США № 6034134 и 6071966, причем содержание данных патентов включено в данное описание посредством ссылки. Полагают, что терапевтическое действие 1-амино-алкилциклогексанов, как например, нерамексана, связано с ингибированием воздействия избыточного глутамата на N-метил-D-аспартат (NMDA)-рецепторы нервных клеток, в связи с чем соединения также классифицируют, как антагонисты NMDA, или антагонисты NMDA-рецепторов.
Нерамексан является также блокатором никотиновых ацетилхолиновых рецепторов α9α10. Нерамексан действует как неконкурентный антагонист. Поскольку сообщалось, что блокада нерамексаном в концентрациях выше, чем 1 мМ лишь незначительно зависит от мембранного потенциала и, как сообщалось, не изменяет уровень десенсибилизации, может быть задействован дополнительный механизм. (Plazas, Paola V. et al., European Journal of Pharmacology 2007; 566: 11-19).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу лечения и/или предупреждения заболеваний, опосредованных тучными клетками, таких как крапивница, атопический дерматит, псориаз, зуд, астма, ринит, мастоцитоз, конъюнктивит и кератоконъюнктивит, у нуждающегося в этом пациента, включающему введение пациенту эффективного количества производного 1-амино-алкилциклогексана (например, нерамексана или его фармацевтически приемлемой соли, как например, нерамексана мезилата).
Настоящее изобретение также относится к способу лечения и/или предупреждения заболеваний, опосредованных тучными клетками, таких как пищевые аллергии, у нуждающегося в этом пациента, включающему введение пациенту эффективного количества производного 1-амино-алкилциклогексана (например, нерамексана или его фармацевтически приемлемой соли, как например, нерамексана мезилата).
Дополнительный аспект изобретения относится к такому способу, в котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) вводят один раз в день, два раза в день (b.i.d.) или три раза в день.
Дополнительный аспект изобретения относится к такому способу, в котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) вводят в препаративной форме немедленного высвобождения.
Дополнительный аспект изобретения относится к такому способу, в котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) вводят в препаративной форме модифицированного высвобождения.
Дополнительный аспект изобретения относится к такому способу, в котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) вводят в препаративной для местного нанесения форме как, например, форма для промывки или постоянного нанесения.
Дополнительный аспект изобретения относится к такому способу, в котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) вводят в пероральной препаративной форме.
Дополнительный аспект изобретения относится к такому способу, в котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) вводят системно.
Дополнительный аспект изобретения относится к способу лечения и/или предупреждения заболеваний, опосредованных тучными клетками, у нуждающегося в этом пациента, включающему введение пациенту эффективного количества производного 1-амино-алкилциклогексана (например, нерамексана или его фармацевтически приемлемой соли, как например, нерамексана мезилата) и одного или более дополнительных фармацевтических средств (например, антихолинергических веществ (например, мекамиламина, кинуреновой кислоты, d-тубокурарина, гексаметониума, атропина, ипратропиума, окситропиума и тиотропиума), антигистаминных препаратов, (например, Дифенгидрамина, Лоратадина, Дезлоратадина, Меклизина, Кветиапина, Фексофенадина, Фенирамина, Цетиризина, Прометазина, Циметидина, Фамотидина, Ранитидина, Низатидина, A-349821, ABT-239, Ципроксифана, Клобенпропита, Тиоперамида, JNJ 7777120, Кромогликата, Недокромила), кортикостероидов (например, преднизона, кортизона, гидрокортизона), глюкокортикоидов (например, циклесонида, беклометазона, будесонида, флунизолида, флутиказона, мометазона и триамцинолона), модификаторов лейкотриенов (например, монтелукаста, зафирлукаста, пранлукаста и зилеутона), метилксантинов (например, теофиллина и аминофиллина), Омализумаба, Метотрексата и кетотифена), которые, как было показано, являются эффективным в лечении или предупреждении заболеваний, опосредованных тучными клетками.
Дополнительный аспект изобретения относится к такому способу, в котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) и дополнительное фармацевтическое средство (например, антихолинергические вещества (например, мекамиламин, кинуреновую кислоту, d-тубокурарин, гексаметониум, атропин, ипратропиум, окситропиум и тиотропиум), антигистаминные препараты, (например, Дифенгидрамин, Лоратадин, Дезлоратадин, Меклизин, Кветиапин, Фексофенадин, Фенирамин, Цетиризин, Прометазин, Циметидин, Фамотидин, Ранитидин, Низатидин, A-349,821, ABT-239, Ципроксифан, Клобенпропит, Тиоперамид, JNJ 7777120, Кромогликат, Недокромил), кортикостероиды (например, преднизон, кортизон, гидрокортизон), глюкокортикоиды (например, циклесонид, беклометазон, будесонид, флунизолид, флутиказон, мометазон и триамцинолон), модификаторы лейкотриенов (например, монтелукаст, зафирлукаст, пранлукаст и зилеутон), метилксантины (например, теофиллин и аминофиллин), Омализумаб, Метотрексат и кетотифен) вводят совместно.
Дополнительный аспект изобретения относится к такому способу, в котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) и дополнительное фармацевтическое средство (например, антихолинергические вещества (например, мекамиламин, кинуреновую кислоту, d-тубокурарин, гексаметониум, атропин, ипратропиум, окситропиум и тиотропиум), антигистаминные препараты, (например, Дифенгидрамин, Лоратадин, Дезлоратадин, Меклизин, Кветиапин, Фексофенадин, Фенирамин, Цетиризин, Прометазин, Циметидин, Фамотидин, Ранитидин, Низатидин, A-349821, ABT-239, Ципроксифан, Клобенпропит, Тиоперамид, JNJ 7777120, Кромогликат, Недокромил), кортикостероиды (например, преднизон, кортизон, гидрокортизон), глюкокортикоиды (например, циклесонид, беклометазон, будесонид, флунизолид, флутиказон, мометазон и триамцинолон), модификаторы лейкотриенов (например, монтелукаст, зафирлукаст, пранлукаст и зилеутон), метилксантины (например, теофиллин и аминофиллин), Омализумаб, Метотрексат и кетотифен) вводят в единой препаративной форме.
Дополнительный аспект изобретения относится к такому способу, в котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) и дополнительное фармацевтическое средство (например, антихолинергические вещества (например, мекамиламин, кинуреновую кислоту, d-тубокурарин, гексаметониум, атропин, ипратропиум, окситропиум и тиотропиум), антигистаминные препараты (например, Дифенгидрамин, Лоратадин, Дезлоратадин, Меклизин, Кветиапин, Фексофенадин, Фенирамин, Цетиризин, Прометазин, Циметидин, Фамотидин, Ранитидин, Низатидин, A-349821, ABT-239, Ципроксифан, Клобенпропит, Тиоперамид, JNJ 7777120, Кромогликат, Недокромил), кортикостероиды (например, преднизон, кортизон, гидрокортизон), глюкокортикоиды (например, циклесонид, беклометазон, будесонид, флунизолид, флутиказон, мометазон и триамцинолон), модификаторы лейкотриенов (например, монтелукаст, зафирлукаст, пранлукаст и зилеутон), метилксантины (например, теофиллин и аминофиллин), Омализумаб, Метотрексат и кетотифен) вводят в препаративной форме для местного нанесения, такой как форма для промывки или постоянного нанесения.
Дополнительный аспект изобретения относится к такому способу, в котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) и дополнительное фармацевтическое средство (например, антихолинергические вещества (например, мекамиламин, кинуреновую кислоту, d-тубокурарин, гексаметониум, атропин, ипратропиум, окситропиум и тиотропиум), антигистаминные препараты, (например, Дифенгидрамин, Лоратадин, Дезлоратадин, Меклизин, Кветиапин, Фексофенадин, Фенирамин, Цетиризин, Прометазин, Циметидин, Фамотидин, Ранитидин, Низатидин, A-349821, ABT-239, Ципроксифан, Клобенпропит, Тиоперамид, JNJ 7777120, Кромогликат, Недокромил), кортикостероиды (например, преднизон, кортизон, гидрокортизон), глюкокортикоиды (например, циклесонид, беклометазон, будесонид, флунизолид, флутиказон, мометазон и триамцинолон), модификаторы лейкотриенов (например, монтелукаст, зафирлукаст, пранлукаст и зилеутон), метилксантины (например, теофиллин и аминофиллин), Омализумаб, Метотрексат и кетотифен) вводят системно.
Дополнительный аспект изобретения относится к такому способу, в котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) и дополнительное фармацевтическое средство (например, антихолинергические вещества (например, мекамиламин, кинуреновую кислоту, d-тубокурарин, гексаметониум, атропин, ипратропиум, окситропиум и тиотропиум), антигистаминные препараты, (например, Дифенгидрамин, Лоратадин, Дезлоратадин, Меклизин, Кветиапин, Фексофенадин, Фенирамин, Цетиризин, Прометазин, Циметидин, Фамотидин, Ранитидин, Низатидин, A-349821, ABT-239, Ципроксифан, Клобенпропит, Тиоперамид, JNJ 7777120, Кромогликат, Недокромил), кортикостероиды (например, преднизон, кортизон, гидрокортизон), глюкокортикоиды (например, циклесонид, беклометазон, будесонид, флунизолид, флутиказон, мометазон и триамцинолон), модификаторы лейкотриенов (например, монтелукаст, зафирлукаст, пранлукаст и зилеутон), метилксантины (например, теофиллин и аминофиллин), Омализумаб, Метотрексат и кетотифен) вводят в пероральной препаративной форме.
Дополнительный аспект изобретения относится к производному 1-амино-алкилциклогексана (например, нерамексану или его фармацевтически приемлемой соли, как например, нерамексана мезилату) для лечения пациента, страдающего заболеваниями, опосредованными тучными клетками, как например, крапивница, атопический дерматит, псориаз, зуд, астма, ринит, мастоцитоз, конъюнктивит и кератоконъюнктивит.
Дополнительный аспект изобретения относится к производному 1-амино-алкилциклогексана (например, нерамексану или его фармацевтически приемлемой соли, как например, нерамексана мезилату) для лечения пациента, страдающего заболеваниями, опосредованными тучными клетками, такими как пищевые аллергии.
Дополнительный аспект изобретения относится к применению производного 1-амино-алкилциклогексана (например, нерамексана или его фармацевтически приемлемой соли, как например, нерамексана мезилата) для изготовления лекарственного средства с целью лечения пациента, страдающего заболеваниями, опосредованными тучными клетками, такими как крапивница, атопический дерматит, псориаз, зуд, астма, ринит, мастоцитоз, конъюнктивит и кератоконъюнктивит.
Дополнительный аспект изобретения относится к применению производного 1-амино-алкилциклогексана (например, нерамексана или его фармацевтически приемлемой соли, как например, нерамексана мезилата) для изготовления лекарственного средства с целью лечения пациента, страдающего заболеваниями, опосредованными тучными клетками, как например, пищевые аллергии.
Дополнительный аспект изобретения относится к приведенному выше производному или применению, при котором нерамексана мезилат вводят в диапазоне от приблизительно 5 мг до приблизительно 150 мг/день, или нерамексана мезилат вводят в диапазоне от приблизительно 5 мг до приблизительно 100 мг/день, или нерамексана мезилат вводят в диапазоне от приблизительно 5 мг до приблизительно 75 мг/день, или в котором нерамексана мезилат вводят приблизительно по 50 мг/день, или в котором нерамексана мезилат вводят приблизительно по 75 мг/день, например, в пероральной препаративной форме.
Дополнительный аспект изобретения относится к приведенному выше производному или применению, при котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) вводят один раз в день, два раза в день (b.i.d.) или три раза в день.
Дополнительный аспект изобретения относится к приведенному выше производному или применению, при котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) вводят в препаративной форме немедленного высвобождения или препаративной форме модифицированного высвобождения.
Дополнительный аспект изобретения относится к приведенному выше производному или применению, при котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) вводят в препаративной форме для местного нанесения, как например, форма для промывки или постоянного нанесения.
Дополнительный аспект изобретения относится к приведенному выше производному или применению, при котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) вводят в пероральной препаративной форме.
Дополнительный аспект изобретения относится к приведенному выше производному или применению, при котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) вводят системно.
Дополнительный аспект изобретения относится к приведенному выше производному или применению, при котором вводят, по меньшей мере, одно дополнительное фармацевтическое средство (например, антихолинергические вещества (например, мекамиламин, кинуреновая кислота, d-тубокурарин, гексаметониум, атропин, ипратропиум, окситропиум и тиотропиум), антигистаминные препараты, (например, Дифенгидрамин, Лоратадин, Дезлоратадин, Меклизин, Кветиапин, Фексофенадин, Фенирамин, Цетиризин, Прометазин, Циметидин, Фамотидин, Ранитидин, Низатидин, A-349821, ABT-239, Ципроксифан, Клобенпропит, Тиоперамид, JNJ 7777120, Кромогликат, Недокромил), кортикостероиды (например, преднизон, кортизон, гидрокортизон), глюкокортикоиды (например, циклесонид, беклометазон, будесонид, флунизолид, флутиказон, мометазон и триамцинолон), модификаторы лейкотриенов (например, монтелукаст, зафирлукаст, пранлукаст и зилеутон), метилксантины (например, теофиллин и аминофиллин), Омализумаб, Метотрексат и кетотифен), которое, как было показано, является эффективным при лечении или предупреждении заболеваний, опосредованных тучными клетками.
Дополнительный аспект изобретения относится к приведенному выше производному или применению, при котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) и дополнительное фармацевтическое средство (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) и дополнительное фармацевтическое средство (например, антихолинергические вещества (например, мекамиламин, кинуреновую кислоту, d-тубокурарин, гексаметониум, атропин, ипратропиум, окситропиум и тиотропиум), антигистаминные препараты, (например, Дифенгидрамин, Лоратадин, Дезлоратадин, Меклизин, Кветиапин, Фексофенадин, Фенирамин, Цетиризин, Прометазин, Циметидин, Фамотидин, Ранитидин, Низатидин, A-349821, ABT-239, Ципроксифан, Клобенпропит, Тиоперамид, JNJ 7777120, Кромогликат, Недокромил), кортикостероиды (например, преднизон, кортизон, гидрокортизон), глюкокортикоиды (например, циклесонид, беклометазон, будесонид, флунизолид, флутиказон, мометазон и триамцинолон), модификаторы лейкотриенов (например, монтелукаст, зафирлукаст, пранлукаст и зилеутон), метилксантины (например, теофиллин и аминофиллин), Омализумаб, Метотрексат и кетотифен) вводят совместно.
Дополнительный аспект изобретения относится к приведенному выше производному или применению, при котором производное 1-амино-алкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) и дополнительное фармацевтическое средство (например, нерамексан или его фармацевтически приемлемую соль, как например, нерамексана мезилат) и дополнительное фармацевтическое средство (например, антихолинергические вещества (например, мекамиламин, кинуреновую кислоту, d-тубокурарин, гексаметониум, атропин, ипратропиум, окситропиум и тиотропиум), антигистаминные препараты, (например, Дифенгидрамин, Лоратадин, Дезлоратадин, Меклизин, Кветиапин, Фексофенадин, Фенирамин, Цетиризин, Прометазин, Циметидин, Фамотидин, Ранитидин, Низатидин, A-349821, ABT-239, Ципроксифан, Клобенпропит, Тиоперамид, JNJ 7777120, Кромогликат, Недокромил), кортикостероиды (например, преднизон, кортизон, гидрокортизон), глюкокортикоиды (например, циклесонид, беклометазон, будесонид, флунизолид, флутиказон, мометазон и триамцинолон), модификаторы лейкотриенов (например, монтелукаст, зафирлукаст, пранлукаст и зилеутон), метилксантины (например, теофиллин и аминофиллин), Омализумаб, Метотрексат и кетотифен) вводят в единой препаративной форме.
Дополнительный аспект изобретения относится к приведенному выше производному или применению, при котором производное 1-амино-алкилциклогексан