Комбинация слитого белка антитело против edb фибронектина-il-2 и молекулы, связывающейся с в-клетками, предшественниками в-клеток и/или их злокачественным аналогом
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, в частности к комбинации для лечения рака, содержащей по меньшей мере 1) слитый белок, содержащий часть, специфически распознающую EDb-фибронектин, представляющую собой антитело, и часть, представляющую интерлейкин-2 и 2) молекулу, связывающуюся с В-клетками, предшественниками В-клеток и/или их злокачественным аналогом, которая является антителом или фрагментом антитела, специфически связывающимся с CD-20. Заявлено также применение указанной комбинации. Группа изобретений обеспечивает повышение эффективности в лечении опухоли. 2 н. и 21 з.п. ф-лы, 3 табл., 7 ил.
Реферат
Настоящее изобретение относится к комбинации слитого белка антитело против EDb фибронектина-IL-2 и молекулы, связывающейся с B-клетками, предшественниками B-клеток и/или их злокачественным аналогом и их применению.
B-клеточная неходжкинская лимфома (B-NHL), группа гистопатологически и клинически отличающихся злокачественных новообразований, происходящих из клеток-предшественников B-лимфоцитов, является наиболее распространенной группой гематологических злокачественных новообразований. Соответственно, злокачественные лимфоциты у пациентов с B-NHL экспрессируют характерные маркеры B-клеток на их клеточной поверхности, такие как CD20, CD23 и другие. B-NHL составляет более чем 50000 впервые диагностированных случаев и 5% связанных со злокачественными опухолями смертельных случаев в Соединенных Штатах каждый год.
Ритуксимаб (Ритуксан®; R) представляет собой химерное моноклональное антитело IgG1, которое связывается непосредственно с эпитопом на клеточной поверхности CD20, постоянно экспрессирующимся на поверхности клетки злокачественной и нормальной популяциях B-клеток. При этом ритуксимаб (a) опосредует антителозависимую клеточную цитотоксичность (ADCC), (b) вызывает гибель клеток лимфомы посредством комплементзависимого лизиса клеток (CDC) и/или комплементзависимой клеточноопосредованной цитотоксичности и (c) непосредственно вызывает апоптоз после связывания CD20 ритуксимабом. Кроме того, (d) ритуксимаб возможно обладает вакцинным действием, осуществляющимся посредством перекрестного презентирования антигенов лимфомы от уничтоженных ритуксимабом злокачественных B-клеток антигенпрезентирующими клетками и примирования антиген-специфическими цитотоксическими T-клетками лимфомы (Selenko et al, 2001).
A) ADCC: Данный механизм включает связывание Fc-участка антитела с Fcγ-рецепторами, экспрессируемыми иммунными клетками с цитотоксическими способностями, такими как моноциты, естественные клетки-киллеры и гранулоциты, которые затем приводили бы к разрушению связанных с ритуксимабом B-клеток либо фагоцитозом, либо при высвобождении цитотоксических гранул, содержащихся в иммунных эффекторных клетках. ADCC, как полагают в настоящее время, является основным механизмом действия ритуксимаба.
B) CDC: поскольку Fc-участок ритуксимаба связывается с комплементом, гибель клеток лимфомы может осуществляться посредством CDC. Однако недавние полученные данные о том, что вызванное ритуксимабом уменьшение количества B-клеток все таки происходит у мышей, генетически лишенных факторов комплемента, умерили начальный энтузиазм по поводу данного механизма действия.
C) Индукция апоптоза: Исследования in vitro показали, что взаимодействие CD20 с ритуксимабом запускает каскад внутриклеточных сигнальных процессов и избирательную понижающую регуляцию антиапоптозных факторов. Он также перемещает CD20 в липидные рафты и активирует каспазу посредством повышенной мобилизации кальция (Janas et al, 2005). У пациентов при CLL было обнаружено, что у циркулирующих B-клеток проявляется активация расщепления некоторых каспаз и полимераз поли(ADP-рибозы) сразу же после вливания ритуксимаба задолго до того, как другие возможные механизмы, такие как ADCC, могли бы запускаться in vivo (Byrd et al, 2002).
D) Вакцинное действие/T-клеточная иммунная реакция: Клинические данные о том, что лечение ритуксимабом было связано с более длительной средней продолжительностью реакции в качестве первоначального лечения, что имело место и у тех пациентов, которые отвечали на повторное лечение, противоопухолевое действие ритуксимаба сохранялось после того, как антитело было выведено из кровотока (Davis et al, 2000) убедительно указывает на определенный задействованный иммунологический механизм.
Лечение ритуксимабом в качестве единственного средства вызывает значительный, но средний и кратковременный по продолжительности ответ у пациентов почти c каждым подтипом B-клеточной лимфомы. Тем не менее, его наибольшее благоприятное действие замечено, когда его объединяли со схемами индукционной химиотерапии (Coiffier, 2006). Объединенный со стандартной химиотерапией, в особенности с CHOP (циклофосфамид, винкристин, адриамицин и преднизолон), ритуксимаб в дозе 375 мг/м2 в виде внутривенного вливания в течение 90 минут в день 1 при каждом курсе химиотерапии увеличивает показатель эффективности лечения пациентов даже с диффузной крупноклеточной В-клеточной лимфомой (DLBCL) приблизительно до 52% (Coiffier 2002, обновление данных OS GELA, ASH 2007) от 38% при одной только химиотерапии.
При медленно растущей лимфоме добавление ритуксимаба при каждой комбинации индукционной химиотерапии (FCM, CVP, CHOP, FND) приводило к значительному увеличению показателей суммарной эффективности терапии и полной ремиссии, а также задержку по времени прогрессирования заболевания (Marcus, 2005; Hiddemann 2005). Тем не менее, добавление ритуксимаба при химиотерапии не всегда приводит к улучшенным исходам заболевания. У пациентов с лимфомой мантийных клеток, лечение CHOP совместно с ритуксимабом приводило к похожей выживаемости без прогрессирования заболевания и общей выживаемости по сравнению с пациентами с одним только лечением CHOP (Lenz et al, 2005).
В дополнение к его установленной роли в качестве лечения для появления ремиссии (индукция ремиссии) у пациентов с B-NHL, монотерапию ритуксимабом также оценили в качестве поддерживающей терапии, чтобы объединить ответы или продлить ремиссию. Согласно предположению, что 25 мг ритуксимаба/мл являются самой низкой приемлемой концентрацией в сыворотке, доза ритуксимаба 375 мг/м2, вводимая каждые 3 месяца, как обнаружили, была достаточной для поддерживающей терапии ритуксимабом в проспективном фармакокинетическом исследовании (Gordan, 2005). Хотя в некоторых исследованиях показано существенное клиническое благоприятное действие при применении поддерживающей терапии ритуксимабом после начальной стандартной химиотерапии с CVP (Hoechster, 2005) или CHOP (Habermann, 2006), все еще не ясно, обеспечивает ли поддерживающая терапия ритуксимабом дополнительное благоприятное действие для тех пациентов, у которых его использовали как часть индукционной химиотерапии (например, R-CHOP).
К сожалению и несмотря на неоспоримую клиническую эффективность ритуксимаба в комбинации с химиотерапией (например, R-CHOP), большинство пациентов c B-NHL все же умирает, в конечном счете, от прогрессирующего заболевания. В дополнение, несмотря на то, что он является эффективным средством при лечении B-NHL, приблизительно 50% пациентов с рецидивирующими/не поддающимися лечению CD20+ фолликулярными лимфомами не реагируют на первоначальное лечение ритуксимабом (врожденная устойчивость; McLaughlin et al 1998), и приблизительно 60% ранее реагирующих на ритуксимаб пациентов не получат благоприятного действия при повторном лечении ритуксимабом (приобретенная устойчивость; Davis et al, 2000). В настоящее время не ясно, являются ли эти формы устойчивости к ритуксимабу следствием адаптивной способности злокачественных B-клеток или иммунного эффекторного механизма ослабленного организма-хозяина. Так или иначе устойчивость к ритуксимабу представляет собой существенное препятствие для иммунотерапии и иммунохимиотерапии B-NHL с точки зрения дальнейшего улучшенного исхода заболевания.
Хотя комбинацию ритуксимаб/химиотерапия анализировали, все еще существует большая и устойчивая необходимость в дальнейших усовершенствованиях терапии. В настоящее время придерживаются двух общих стратегий: a) конструирование новых антител против CD20 и b) создание моноклональных антител, которые нацелены на антигены B-клетки помимо CD20. Две категории новых моноклональных антител против CD20 в настоящее время подвергаются клинической оценке: a) антитела против CD20, проявляющие более высокую аффинность, чем ритуксимаб для Fc-рецептора FcγRIIIa (CD16), и b) антитела против CD20 с меньшей иммуногенностью (гуманизированные; Tbl 1). По-видимому, наиболее эффективное из данных антител, GA-101, гуманизированное антитело против CD20 с гликосконструированным фрагментом Fc и модифицированным шарнирным изгибом, приводит к 10-100-кратному увеличению ADCC в отношении клеточных линий NHL. В малочисленных исследованиях на I/II фазе с антителами против CD20 с более низкой иммуногенностью показана эффективность терапии приблизительно у 50% пациентов с рецидивирующей B-NHL (Coiffier, 2006; Hagenbeek, 2005; Morschhauser, 2005). Моноклональные антитела, направленные на поверхностные молекулы помимо CD20 при B-NHL, такие как люмиликсимаб (против CD23), эпратузумаб (против CD22), SGN-40 и HCD122 (и тот и другой против CD40), галиксимаб (против CD80), аполизумаб (Hu1D10), KRN848, 1D09C3 (все против HLA-DR), были перспективными при клинических испытаниях на ранних стадиях. Новые антитела против CD20 и антитела, направленные против не являющихся CD20 эпитопов B-клетки, должны продемонстрировать в значительной степени превосходящую эффективность по сравнению с ритуксимабом для того, чтобы считаться эффективными, однако клинические результаты на ранних стадиях с большинством из данных антител указывают только на постепенно возрастающее благоприятное действие.
Имели место попытки комбинировать ритуксимаб с неконъюгированным IL-2 (Eisenbeis et al., 2004; Gluck et al., 2004). Тем не менее, результаты недавнего испытания на II фазе указали, что «комбинированное лечение ритуксимабом совместно с rIL-2 было безопасно и, как правило, хорошо переносимо, но ответ был слабым» (Khan et al., 2006 Clin Cancer Res 2006; 12(23): 7046-7053). Также было обнаружено, что «rIL-2 увеличивает несущие FcR клеточные субпопуляции in vivo и увеличивает ADCC ритуксимаба in vitro». Однако авторы пришли к заключению, что данные результаты «напрямую не объясняют значительный клинический результат у пациентов с устойчивой к ритуксимабу NHL». Кроме того, авторы пришли к заключению, что «вероятно потребуется лучшее понимание механизма действия ритуксимаба in vivo до того, как можно будет осуществить дальнейшее усовершенствование благоприятной регуляции его противоопухолевой активности».
В дополнение к показанию к применению при злокачественном новообразовании антитела против B-клеток, в частности, ритуксимаб, разработаны для лечения аутоиммунных заболеваний, включающих ревматоидный артрит, болезнь Крона и аутоиммунную гемолитическую анемию (Assous et al., 2008).
Принимая во внимание стандартные способы лечения, а также новые варианты лечения, находящиеся в настоящее время на стадии клинической разработки, все же существует острая медицинская потребность в создании более активного лечения пациентов с B-клеточной лимфомой, которые преимущественно приводят к полной ремиссии и/или применимы для лечения устойчивой к ритуксимабу лимфомы. Существует также острая медицинская потребность в обеспечении новыми лекарственными препаратами для лечения аутоиммунных заболеваний, в частности хронических аутоиммунных заболеваний.
| Таблица 1Антитела против CD20 | |||||
| Название антитела | Тип | ADCC | CDC (комплементзависимая цитотоксичность) | Непосредственные эффекты | Ссылка |
| Ритуксимаб | Химерный IgG1 | ++ | ++ | + | Cragg et al |
| Окрелизумаб | Гуманизированный IgG1 | +++ | +/- | + | Vugmeyster et al |
| PRO131921 | Сконструированный окрелизумаб | ++++ | ++ | + | |
| Велтузумаб | Гуманизированный IgG1 | ++ | ++ | + | Stein et al |
| Офатумумаб | IgG1 человека | ++ | ++++ | + | Hagenbeck et al |
| AME-133 | Гуманизированный IgG1 | ++++ | ++ | ++ | Weiner et al |
| GA-101 | Гуманизированный IgG1 | +++++ | - | ++++ | Umana et al |
| Таблица 2Выбранные антитела против B-клетки в клинических испытаниях с пациентами с неходжкинской лимфомой | ||||
| Название антитела | Тип | DLT | Частота объективных ответов (%, количество NHL)/ клинические данные | Ссылка |
| Ритуксимаб | Химерный IgG1 | Нет | 48, рецидивирующая FL | McLaughlin et al |
| Эпратузумаб (против CD22) | Гуманизированный IgG1 | Нет | 43, рецидивирующая FL | Leonard et al (a) |
| Эпратузумаб + ритуксимаб | Комбинация | Нет | 67, рецидивирующая FL | Leonard et al (b) |
| Люмиликсимаб (против CD23) | Нет | Активен при CLL, когда объединяют с химиотерапией | ||
| Галиксимаб (против CD80) | Гуманизированный IgG1 | Нет | 11, рецидивирующая FL | Czuczman et al |
| Галиксимаб + ритуксимаб | Комбинация | Нет | 66, рецидивирующая FL | Leonard et al (c) |
| SGN-40, (против CD40) | Гуманизированный IgG1 | Высвобождение цитокинов | 0 | Advani et al |
| HCD122 (против CD40) | Происходящий в настоящее время | Происходящий в настоящее время на I фазе | ||
| Калихимицин против CD22 (CMC-544) | Гуманизированный IgG4 | Тромбоцитопе-ния | 69, рецидивирующая FL | Fayad et al |
| BL22 против CD-22, соединенный с экзотоксином синегнойной палочки | Гемолитикоуре-мический синдром | Ответы при лейкозе ворсистых клеток |
Экстрадомен B (EDB) фибронектина представляет собой один из наиболее хорошо охарактеризованных маркеров ангиогенеза, описанных на настоящий момент (Zardi et al., Embo J. 1987; 6:2337-2342; Kaspar et al., Int J Cancer. 2006; 118:1331-1339). Данный 91-аминокислотный гомологичный домен III типа может встраиваться в молекулу фибронектина во время активного реструктурирования ткани посредством механизма альтернативного сплайсинга (Zardi et al., выше). EDB по существу не детектируется в здоровых тканях взрослых людей, но в высокой степени распространен в сосудистой сети множества агрессивных солидных опухолей. Возможность направленной доставки в область опухоли высокоаффинного антитела человека L19 (Pini et al., J Biol. Chem. 1998; 273:21769-21776), специфичного для EDB, была хорошо описана как в моделях злокачественных новообразований на животных (Tarli et al., Blood. 1999; 94:192-198; Borsi et al., Int J. Cancer. 2002; 102:75-85; Berndorff et al., J Nucl Med. 2006; 47:1707-1716; Berndorff et al., Clin Cancer Res. 2005; 11:7053s-7063s; Demartis et al., Eur J Nucl Med. 2001; 28:534-53), так и у пациентов с солидными опухолями (Santimaria et al., Clin Cancer Res. 2003; 9:571-579). Недавно, экспрессию ED-B также обнаружили в большинстве образцов тканей инфильтрирующей лимфомы различных пациентов с неходжкинской лимфомой (Sauer et al., 2006).
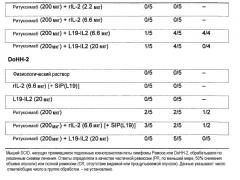
На основе существующих на сегодняшний момент знаний об основанном на антителах лечении злокачественных новообразований, в частности, при объединении с rIL-2 или похожими цитокинами, было удивительно обнаружить в экспериментах по комбинированному лечению у мышей, что комбинация ритуксимаба со слитым L19-IL2 вызывала полное уничтожение диагностированной лимфомы Рамоса у 4 из 5 мышей в группе, получавшей большую дозу L19-IL2 (L19-IL2большая доза по сравнению с физиологическим раствором: P<0,00001), причем 3 из 4 CR (полных ремиссий) достигали уже после 3 инъекций. Фактически, иммуноцитокин был заметно более активен, чем соответствующее эквимолярное количество неконъюгированного rIL-2 в сочетании с ритуксимабом (L19-IL2большая доза по сравнению с rIL2большая доза: P<0,001). В особенности, даже при самой низкой дозе L19-IL2, комбинированный с ритуксимабом, все же проявлял превосходную терапевтическую активность (L19-IL2низкая доза по сравнению с физиологическим раствором: P<0,00001; L19-IL2низкая доза по сравнению с rIL2низкая доза: P<0,00001), включая CR в 4 из 5 случаев после 4 курсов терапии, тогда как даже в трое большая доза ненаправленного цитокина, объединенного с ритуксимабом, была способна только замедлить рост опухоли (L19-IL2низкая доза по сравнению rIL2большая доза: P<0,001).
Следовательно, в одном из вариантов осуществления изобретение относится к комбинации, включающей, по меньшей мере,
i) слитый белок, содержащий антитело-часть, специфически распознающую EDb-фибронектин, и часть-интерлейкин-2 и
(ii) молекулу, связывающуюся с B-клетками, предшественниками B-клеток и/или их злокачественным аналогом.
В предпочтительном варианте осуществления молекула, связывающаяся с B-клетками, предшественниками B-клеток и/или их злокачественным аналогом, специфически связывается с CD20, CD23, CD22, CD40, CD80, HLA-DR или Hu1D10.
В предпочтительном варианте осуществления молекула, связывающаяся с B-клетками, предшественниками B-клеток и/или их злокачественным аналогом, выбрана из антитела, фрагмента антитела или миметика антитела.
Предпочтительной является молекула, специфически связывающаяся с CD20, CD23, CD22, CD40 или CD80, которая представляет собой полноразмерное антитело или фрагмент антитела или их слитый белок.
В особенно предпочтительном варианте осуществления антитело или фрагмент антитела или их слитый белок специфически связывается с CD20.
В одном из вариантов осуществления изобретение относится к комбинации, включающей по меньшей мере
(i) слитый белок, содержащий антитело-часть, специфически распознающую EDb-фибронектин, и часть-интерлейкин-2 и
(ii) молекулу, специфически связывающуюся с CD20.
В дополнительном варианте осуществления изобретение относится к комбинации, включающей по меньшей мере
(i) слитый белок, содержащий антитело-часть, специфически распознающую EDb-фибронектин, и часть-интерлейкин-2 и
(ii) молекулу, специфически связывающуюся с клетками, экспрессирующими CD20.
В особенно предпочтительном варианте осуществления молекула, специфически связывающаяся с клетками, экспрессирующими CD20, и/или специфически связывающаяся с CD20, представляет собой антитело или фрагмент антитела, специфически связывающийся с CD20.
В предпочтительном варианте осуществления часть антитело (i) специфически связывается с EDb-доменом фибронектина (FN). Такие антитела известны из предшествующего уровня техники и описаны, например, в WO 97/45544.
В другом варианте осуществления антитело, специфически распознающее EDb-фибронектин, связывается со скрытым эпитопом. Примером такого антитела является антитело BC-1.
Предпочтительно, такое антитело, которое связывается с EDb-доменом фибронектина, проявляет высокую аффинность в отношении EDb-домена FN, в частности, антитело связывается с доменом EDb фибронектина с наномолярной или субнаномолярной аффинностью. Такие антитела известны из предшествующего уровня техники и описаны, например, в WO99/58570.
В особенности предпочтительным является антитело L19.
Часть антитела, специфически распознающего EDb фибронектина, в частности антитело L19, можно применять в различных видах антител. Предпочтительные форматы антител представляют собой форматы полноразмерного IgG, Fab, (Fab')2, scFv, диатела, миниантитела или небольшого иммуноглобулина (SIP). Особенно предпочтительными являются форматы полноразмерного IgG, scFv и SIP для антитела L19. Наиболее предпочтительным является антитело L19 в формате scFv. Некоторые форматы иммуноглобулинов известны из предшествующего уровня техники, например, на основе домена CH3 или домена εs2-CH4 IgE. Предпочтительный формат SIP для L19 основан на домене εs2-CH4 IgE и L19 в формате полноразмерного IgG описаны, например, в WO03/076469.
В дополнительном предпочтительном варианте осуществления часть антитела содержит, по меньшей мере, одну последовательность CDR антитела L19.
В особенно предпочтительном варианте осуществления часть антитела содержит последовательности CDR антитела L19, в частности, она содержит последовательности согласно SEQ ID NO: 6-11.
В дополнительном предпочтительном варианте осуществления часть антитела содержит цепь VL и VH антитела L19. В предпочтительном варианте осуществления она содержит, по меньшей мере, одну цепь VH согласно SEQ ID NO: 1 или, по меньшей мере, одну цепь VL согласно SEQ ID NO: 2. В особенно предпочтительном варианте осуществления она содержит, по меньшей мере, одну цепь VH согласно SEQ ID NO: 1 и, по меньшей мере, одну цепь VL согласно SEQ ID NO: 2.
В дополнительном предпочтительном варианте осуществления часть антитела содержит одну цепь VH согласно SEQ ID NO: 1 и одну цепь VL согласно SEQ ID NO: 2. В дополнительном предпочтительном варианте осуществления часть антитела содержит две цепи VH согласно SEQ ID NO: 1 и две цепи VL согласно SEQ ID NO: 2.
В дополнительном предпочтительном варианте осуществления цепи VH и VL соединены линкером антитела.
В предпочтительном варианте осуществления линкер антитела содержит последовательность согласно SEQ ID NO: 3 или последовательность, содержащую, по меньшей мере, последовательность с 90% идентичностью согласно SEQ ID NO: 3.
Часть антитела, специфически связывающуюся с EDb-фибронектина, сливают с интерлейкином-2. Обе части можно сливать напрямую или их можно сливать посредством линкера, в частности посредством пептидного линкера слитого белка. Предпочтительно, линкер слитого белка содержит от 1 до 30 аминокислот в длину. В особенно предпочтительном варианте осуществления линкер слитого белка содержит последовательность согласно SEQ ID NO: 5.
В другом особенно предпочтительном варианте осуществления интерлейкин-2 представляет собой интерлейкин-2 человека (IL-2 человека).
Интерлейкин-2 можно получать рекомбинантно или можно выделять из ткани человека, предпочтительно, его получают рекомбинантно (rIL-2). В особенно предпочтительном варианте осуществления часть-интерлейкин-2 содержит последовательность согласно SEQ ID NO: 4 или ее функциональный вариант.
Слитый белок может быть мономерным или многомерным, например димерным. Димерные или другие мономерные формы можно получать ковалентно или нековалентно. Например, L19(scFv)-IL2 может образовать нековалентные гомодимеры.
Слитные белки предпочтительно получают рекомбинантно, используя способы, известные специалисту в данной области. В частности, можно использовать прокариотические или эукариотические экспрессирующие системы, например дрожжевые экспрессирующие системы или экспрессирующие системы млекопитающих.
Комбинация по настоящему изобретению дополнительно содержит молекулу, связывающуюся с B-клетками, предшественниками B-клеток и/или их злокачественным аналогом.
В одном из вариантов осуществления настоящего изобретения молекула, связывающаяся с B-клетками, предшественниками B-клеток и/или их злокачественным аналогом, является меченной, в частности радиоактивно меченной. Предпочтительно, мечение представляет собой ковалентное мечение.
В особенно предпочтительном варианте осуществления меченная молекула, связывающаяся с B-клетками, предшественниками B-клеток и/или их злокачественным аналогом, представляет собой радиоактивно меченное антитело против CD20. Различные радиоактивные метки используются в лекарственных препаратах.
Особенно пригодные радиоактивные изотопы для мечения антител и белков являются 90Y, 111In и 131I-меченными. В особенно предпочтительном варианте осуществления антитело против CD20 метят при помощи 90Y, 111In и 131I.
В особенно предпочтительном варианте осуществления радиоактивно меченное антитело против CD20 выбрано из Y-90-ибритумомаб-тиуксетана (Y90-Зевалин® или -Зевалин®) и I-131-тозитумомаба (Бексар®). Y-90-ибритумомаб-тиуксетан и его получение описано, например, в EP 0669836 в качестве Y2B8 (меченного иттрием-[90] 2B8-MX-DTPA).
В предпочтительном варианте осуществления комбинация по настоящему изобретению дополнительно содержит молекулу, специфически связывающуюся с CD20. В особенно предпочтительном варианте осуществления данная молекула представляет собой антитело или фрагмент антитела или их слитый белок.
Особенно предпочтительными являются антитела против CD20, которые проявляют активность ADCC.
В дополнительном предпочтительном варианте осуществления антитело против CD20 выбрано из ритуксимаба, окрелизумаба, PRO131921, велтузумаба, офатумумаба, AME-133 и GA-101.
В предпочтительном варианте осуществления изобретения антитела, специфически связывающиеся с CD20, находятся в форме полноразмерного IgG, Fab, (Fab)2, scFv, диатела, миниантитела или небольшого иммуоглобулина (SIP).
Также антитело против CD20 может быть мономерным или многомерным, например димерным. Многомерные антитела могут быть гомомерными или гетеромерными. Например, можно использовать бивалентное антитело, где одна часть специфически связывается с CD20 и другая часть связывается с другой мишенью. Также молекула, специфически связывающаяся с CD20, может содержать дополнительные эффекторы, в частности, она может быть радиоактивно меченная. В данном варианте осуществления настоящего изобретения можно использовать Зевалин® или Бексар®, как описано выше.
Особенно предпочтительное антитело против CD20 представляет собой ритуксимаб, в частности Ритуксан® (также называемый MabThera® или IDEC-C2B8). Ритуксан® представляет собой генетически сконструированное химерное мышиное/человеческое моноклональное антитело, направленное против антигена CD20, обнаруженного на поверхности нормальных и злокачественных B-лимфоцитов. Антитело представляет собой иммуноглобулин IgG1-каппа, содержащий последовательности вариабельных областей легкой и тяжелой цепи мыши и последовательности константных областей человека. Ритуксимаб описан, например, в патентах США №№ 5843439, 5776456 и 5736137.
В более предпочтительном варианте осуществления комбинация содержит ритуксимаб и L19-IL2.
В еще более предпочтительном варианте осуществления антитело L19 находится в формате scFv.
Особенно предпочтительным является L19-IL2, как описано у Carnemolla et al., Blood. 2002; 99:1659-1665.
Другой вариант осуществления настоящего изобретения относится к комбинации, как описано выше, для применения в качестве лекарственного препарата.
Дополнительный вариант осуществления настоящего изобретения относится к комбинации, как описано выше, для применения в качестве лекарственного препарата для лечения злокачественного новообразования.
В предпочтительном варианте осуществления злокачественное новообразование представляет собой лимфому, предпочтительно B-клеточную лимфому. Наиболее предпочтительным является применение комбинации по настоящему изобретению для лечения B-клеточной неходжкинской лимфомы (B-NHL).
В дополнительном предпочтительном варианте осуществления B-клеточная лимфома представляет собой не поддающуюся лечению или рецидивирующую B-клеточную лимфому или лимфому, устойчивую к монотерапии ритуксимабом.
Изобретение дополнительно относится к способу лечения злокачественного новообразования, в котором комбинацию по настоящему изобретению вводят пациенту со злокачественным новообразованием в терапевтически эффективном количестве. Предпочтительно, злокачественное новообразование представляет собой лимфому, предпочтительно B-клеточную лимфому, в частности NHL.
Дополнительный вариант осуществления настоящего изобретения относится к комбинации, как описано выше, для применения в качестве лекарственного препарата для лечения аутоиммунных заболеваний, в частности хронических аутоиммунных заболеваний.
В предпочтительном варианте осуществления аутоиммунное заболевание представляет собой ревматоидный артрит, болезнь Крона, язвенный колит или аутоиммунную гемолитическую анемию.
Пациент может представлять собой любое млекопитающее, предпочтительно, пациентом является человек.
Возможны различные способы введения, например внутривенное, подкожное или интраперитонеальное введение, где внутривенное введение является предпочтительным.
Также слитый белок, специфически распознающий EDb фибронектина, и молекулу, связывающуюся с B-клетками, предшественниками B-клеток и/или их злокачественным аналогом, можно вводить одновременно или в различные моменты времени. Кроме того, комбинацию можно вводить пациенту один или несколько раз. Также возможно, что один компонент комбинации вводят один раз и другой компонент вводят несколько раз.
Обычно, если ритуксимаб и L19-IL2 вводят в качестве комбинированного лечения, их можно вводить пациенту в одно и то же время, поскольку это позволяет упростить схемы введения. Для примеров, и ритуксимаб и L19-IL2 можно вводить в/в один или два раза в день с временными интервалами в диапазоне от нескольких дней до 3 месяцев. Также возможны один или несколько курсов лечения.
Кроме того, может изменяться вводимое количество. Например, ритуксимаб можно вводить в количестве приблизительно от 20 до 500 мг/м2, предпочтительно в количестве приблизительно от 100 до 400 мг/м2, в частности, приблизительно 375 мг/м2 ритуксимаба на введение. Типично, ритуксимаб вводят в 1 день при 2-, 3-, или 4-недельной схеме лечения с применением 6-8 курсов лечения (индукция ремиссии), хотя возможны другие схемы введения.
Терапевтические препараты активных средств, применяемых в соответствии с настоящим изобретением, получают для хранения, смешивая активное средство, обладающее требуемой степенью чистоты с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в виде лиофилизированных препаратов или водных растворов.
Иллюстративные препараты антител против CD20 описаны в WO 98/56418. В данной публикации описан жидкий препарат для многократного приема, содержащий 40 мг/мл ритуксимаба, 25 мМ ацетата, 150 мМ трегалозы, 0,9% бензилового спирта, 0,02% полисорбата 20 при величине pH 5,0, который обладает минимальным сроком годности два года хранения при 2-8°C. Другой интересующий препарат против CD20 содержит 10 мг/мл ритуксимаба в 9,0 мг/мл хлорида натрия, 7,35 мг/мл цитрат натрия двуводный, 0,7 мг/мл полисорбат 80 и стерильную воду для инъекций, величина pH 6,5. Лиофилизированные препараты, адаптированные для подкожного введения, описаны в WO 97/04801. Такие лиофилизированные препараты можно восстанавливать при помощи подходящего разбавителя до высокой концентрации белка и восстановленный препарат можно вводить подкожно пациенту, которого необходимо лечить, как описано в настоящем документе.
Также может меняться количество, которое необходимо вводить, в отношении слитого белка. Обычно, вводимое количество L19-IL2 при введении составляет приблизительно от 1 до 10 × 106 МЕ/м2, в частности, приблизительно от 5 до 50 × 106 МЕ/м2, особенно, приблизительно от 10 до 30 × 106 МЕ/м2.
Также возможно, что вводимое количество меняется с течением времени; например, количество ритуксимаба и/или L19-IL2 можно увеличить или уменьшить в течение одного или нескольких курсов введения.
Также поддерживающая терапия, в частности, с одним только ритуксимабом или L19-IL2, может следовать за фазой комбинированного лечения.
Также возможно поддерживать при помощи лечения с L19-IL2 совместно с содержащими антитело способами комбинированного лечения B-NHL, в частности, химиоиммунотерапевтическими схемами (например, R-CHOP).
Линкер антитела представляет собой любой линкер, предпочтительно, пептидный линкер, который подходит для связывания доменов Vh и Vl. Подходящие линкеры описаны, например, в Bird et al, Science, 242, 423-426, 1988; Huston et al, PNAS USA, 85, 5879-5883, 1988, EP 0573551; EP 0623679 и EP 0318554, которые введены в качестве ссылки.
Линкеры слитого белка представляют собой линкеры, подходящие для связывания антитела или фрагмента антитела и второго биологически активного белка, предпочтительно, линкер является пептидным. Подходящие линкеры описаны в EP 0573551; EP 0623679 и EP 0318554, которые введены в качестве ссылки. В особенности, подходящие линкеры описаны в EP 0623679.
«Специфически связывающийся» или «специфически распознающий» в настоящем документе относится к связыванию соответствующей мишени. Обычно, связывающаяся молекула, антитело, фрагмент антитела или миметик антитела связывается с аффинностью, по меньшей мере, приблизительно 1×10-7 M, предпочтительно, по меньшей мере, приблизительно 1×10-9 M, и связывается с предварительно определенной мишенью с аффинностью, которая, по меньшей мере, в два раза больше, чем его аффинность для неспецифической мишени (например БСА, казеин) помимо предварительно определенной мишени и близко связанной мишени.
«Антитело» в настоящем документе охватывает полноразмерные антитела, включая нативные антитела, моноклональные антитела, поликлональные антитела и полиспецифические антитела (например, биспецифические антитела), антитела человека, гуманизированные антитела, химерные антитела и полноразмерные антитела IgG, а также фрагменты антител.
Термин «фрагмент антитела» относится к части полноразмерного антитела, в которой сохранена вариабельная область или функциональная активность, а именно специфическое связывание с мишенью. Примеры фрагментов антител включают в качестве неограничивающих примеров фрагмент Fab, Fab', F(ab')2, Fd, Fv, scFv и scFv-Fc, диатело, линейное антитело, формы небольших имммуноглобулинов, одноцепочечное антитело, миниантитело, диатело, образованное из фрагментов антител, и полиспецифические антитела, образованные из фрагментов антител. Фрагменты антител обычно меньше, чем полноразмерные антитела. При этом фармакокинетика отличается и некоторые фрагменты антител содержат только одну полипептидную цепь, которая может облегчить получение. Однако такие слитные белки, содержащие фрагменты антител, часто подвержены пониженной устойчивости. Предпочтительно, фрагмент антитела находится в формате scFv, (scFv)2 или небольшого иммунопротеина. Формат небольшого иммунопротеина может представлять собой формат на основе CH3-домена (например, описанный в патенте США № 5837821) или εS2CH4-домена IgE человека (например, описанный в WO 03/076469).
Термин «моноклональное антитело» (mAb) относится к антителу, получаемому из популяции по существу гомогенных антител; т.е. отдельные антитела, содержащие популяцию, которая идентична, за исключением встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела высокоспецифичны, причем направлены против одной антигенной детерминанты, также обозначаемой как эпитоп. Модификатор «моноклональный» свидетельствует о гомогенной по существу популяции антител, направленных на идентичный эпитоп, и его не следует рассматривать как требование получения антитела никаким особым способом. Моноклональные антитела можно получить посредством любой методики или способом, известным в данной области; например, способ гибридомы, впервые описанный Koehler et al., 1975, Nature 256:495, или известные в данной области способы рекомбинантной ДНК (смотри, например, патент США № 4816567). В другом примере моноклональные антитела можно также выделить из фаговых библиотек антител, используя методики, описанные у Clackson et al., 1991, Nature 352: 624-628 и Marks et al., 1991, J. Mol. Biol. 222: 581-597.
В отличие от этого, антитела при получении поликлональных антител обычно представляют собой гетерогенную популяцию изотипов и/или классов иммуноглобулинов и также проявляют различную эпитопную специфичность.
Термин «химерное» антитело в настоящем документе обозначает тип моноклонального антитела, в котором часть или целая аминокислотная последовательность в одной или нескольких областях или доменах тяжелой и/или легкой цепи идентична, гомологична или является вариантом соответствующей последовательности в моноклональном антителе другого вида или принадлежащего к другому классу или изотипу иммуноглобулина или из консенсусной последовательности.
Определенные типы фрагментов антител можно получить при ферментативной обработке полноразмерного антитела. Расщепление папаином антитела приводит к получению двух идентичных антигенсвязывающих фрагментов, обозначаемых фрагменты «Fab», каждая с одним антигенсвязывающим участком, и оставшегося фрагмента «Fc», так называемого из-за его способности легко кристаллизоваться. Фрагмент Fab также константный домен легкой цепи и домен CH1 тяжелой цепи. Обработка пепсином приводит к образованию фрагмента F(ab')2, который содержит два антигенсвязывающих участка и все же способен к перекрестному связыванию антигена.
Фрагменты Fab' отличаются от фрагментов Fab наличием нескольких дополнительных остатков на C-конце домена CH1, включающих один или несколько цистеинов из шарнирной области антитела. Fab-SH в настоящем документе представляет собой обозначение для Fab', в котором остаток(остатки) цистеина константных доменов несут свободную тиоловую групу. Фрагменты антител F(ab')2 представляют собой пары фрагментов Fab', соединенные посредством остатков цистеина в шарнирной области. Другие химические соединения фрагментов антител также известны.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полный распознающий антиген и связывающий участок, состоящий из димера вариабел