Усовершенствованный способ получения гидразидов
Иллюстрации
Показать всеИзобретение относится к усовершенствованным способам получения гидразидного продукта из гидразина и хлорангидрида, в частности к способу получения гидразида 3-метил-3-меркаптобутановой кислоты. Способ включает стадии: (а) получения перемешиваемой по существу однородной суспензии, содержащей гидразин и инертный растворитель; и (b) непрерывного добавления хлорангидрида к указанной суспензии, при этом хлорангидрид имеет структуру:
где Р представляет собой тиолзащитную группу; каждый из R1 и R2 выбран из группы, состоящей из C1-С5 алкила; L представляет собой алкиленовый линкер, и при этом непрерывное добавление раствора хлорангидрида регулируют таким образом, чтобы температура реакции поддерживалась в интервале от -65°С до -75°С. Предложенный способ устраняет или ограничивает образование нежелательных бис-гидразидных побочных продуктов. Изобретение также относится к способу получения суспензии гидразина, включающему стадии: (а) охлаждения инертного растворителя до температуры в пределах от -68°С до -75°С; и (b) добавления гидразина по каплям к указанному холодному инертному растворителю; и к способу получения иммуноконъюгата члена семейства калихимицинов с моноклональным антителом в качестве носителя, включающему получение моноацилированного гидразида. 5 н. и 26 з.п. ф-лы, 3 ил., 15 пр., 9 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к улучшенному способу синтеза для получения гидразидов из гидразина и хлорангидридов. Полученные гидразидные продукты содержат защищенную тиольную группу, которую используют для сшивки калихимицина с моноклональными антителами.
УРОВЕНЬ ТЕХНИКИ
[0002] MYLOTARG® (гемтузумаб озогамицин), также называемый СМА-676 или просто СМА, состоит из моноклонального антитела к антигену CD33, которое связано с калихимицином с помощью гидролизующейся в кислой среде линкерной группы. Когда производное калихимицина связывается с малой бороздкой ДНК, указанное производное нарушает развитие ДНК и в итоге вызывает гибель раковых клеток. Коммерческий продукт был представлен на рынке в качестве первого химиотерапевтического агента с направленным воздействием на антитело под названием MYLOTARG®, а в настоящее время одобрен для лечения острого миелолейкоза (ОМЛ) у пациентов преклонного возраста.
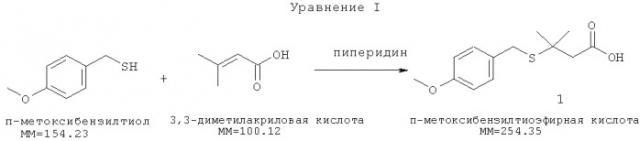
[0003] Агенты, входящие в семейство высокоактивных антибактериальных и противоопухолевых агентов, в совокупности известные как калихимицины или комплекс LL-E33288, описаны в патентах США №№4970198, 4939244 и 5079233. Входящие в указанное семейство агенты можно применять для получения терапевтически полезных иммуноконъюгатов с моноклональными антителами в качестве носителей. Указанные антитела могут представлять собой антитело к антигену CD33 (например, hp67.6), антитело к антигену CD22 (например, G544), антитело к антигену Lewis Y (например, G193), антитело к антигену 5Т4 (например, Н8) или антитело к антигену CD20 (например, ритуксимаб). Агент, принадлежащий к семейству калихимицина, предпочтительно представляет собой N-ацилированный калихимицин, преимущественно N-ацетил-гамма-калихимицин. Агенты, принадлежащие к семейству калихимицинов, содержат метилтрисульфид, который может взаимодействовать с соответствующими тиолами с образованием дисульфидов, в то же время обеспечивая введение гидразидной функциональной группы, подходящей для присоединения производного калихимицина к носителю. Примеры такой реакции с калихимицином приведены в патенте США №5053394. Калихимицингидразидное производное присоединяется к моноклональному антителу через образование гидразона. Например, общий способ присоединения гидразидных производных лекарств к окисленным антителам описан Т.Дж.МакКерном и др. (Т.J.McKearn, et al.) в патенте США №4671958. Патент США №5770701 относится к способу получения форм с направленным действием на основе бисульфидных соединений комплекса LL-E33288. Линкер, представляющий собой 4-(4-ацетил-фенокси)бутановую кислоту, вступает в реакцию конденсации с гидразидным производным калихимицина, предпочтительно N-ацетил-γ-диметилгидразидным производным калихимицина с образованием ацилгидразона, который далее подвергают действию N-гидроксисукцинимида с получением OSu эфира (N-сукцинимидилокси), пригодного для конъюгирования с выбранной биомакромолекулой. Калихимицины содержат ендииновую концевую группу, которая активируется восстановлением -S-S- связи, приводя к разрывам двунитевой ДНК. Таким образом, моноацилированные гидразины, в которых ацильная группа содержит меркаптогруппу, хорошо подходят для связывания калихимицинов с моноклональными антителами. Гидразид 3-метил-3-меркаптобутановой кислоты, также называемый DMH-линкером или CL-332258, является предпочтительным меркапто содержащим N-ацилгидразином для связывания калихимицина с моноклональными антителами и получения, например, гемтузумаб озогамицина (gemtuzumab ozogamicin) или инотузумаб озогамицина (inotuzumab ozogamicin). Производное калихимицина затем активируют для конъюгирования с гуманизированным моноклональным антителом с получением СМА-676. В настоящее время DMH-линкер может быть получен с помощью 5-стадийного процесса через образование гидразида п-метоксибензилтиоэфирной кислоты 5 в качестве промежуточного соединения (Уравнения I-V). В современных способах промышленного получения, осуществляемых в США, присоединению по Михаэлю п-метоксибензилтиола к 3,3-диметилакриловой кислоте способствует добавление пиперидина (Уравнение I).
[0004] Полученная тиоэфирная кислота (1) реагирует с оксалилхлоридом в метиленхлориде с образованием хлорангидрида п-метоксибензилтиоэфирной кислоты (2) (Уравнение II)
Хлорангидрид (2) медленно добавляют к смеси гидразина/метиленхлорида (в объемном соотношении примерно 28%) при низкой температуре (-70°С). Соответствующий гидразид п-метоксибензилтиоэфира (3) образуется с выходом примерно 74% (Уравнение III).
[0005] Тем не менее, целевой продукт, представляющий собой гидразид п-метоксибензилтиоэфира (3), обычно содержит примерно 20% нежелательного побочного продукта, представляющего собой бис-гидразид метоксибензилтиоэфира (см. Уравнение VI ниже). Удаление защитной бензильной группы в кислой среде (Уравнение IV) с последующей нейтрализацией кислой соли и очисткой (Уравнение V) приводит к получению гидразида 3-метил-3-меркаптобутановой кислоты (5) с выходом 45%.
[0006] Нежелательный побочный продукт, представляющий собой бис-гидразид метоксибензилтиоэфира (6), образуется при взаимодействии продукта, представляющего собой гидразид п-метоксибензилтиоэфир, с исходным веществом, представляющим собой хлорангидрид п-метоксибензилтиоэфирной кислоты (Уравнение VI). Образование этого побочного продукта приводит к уменьшению выхода и качества целевого продукта.
[0007] При использовании первоначального способа получения бис-гидразид метоксибензилтиоэфира (6) образуется в количестве примерно 20%. Очевидно, что присутствие такого или даже большего количества побочного продукта согласно Уравнению III представляется нежелательным. В настоящем изобретении предложен способ, позволяющий преодолеть эту проблему и уменьшить выход нежелательного побочного продукта.
ОПИСАНИЕ ФИГУР
На фигуре 1 представлена технологическая схема получения п-метоксибензилтиоэфирной кислоты (1).
На фигуре 2 представлена технологическая схема получения хлорангидрида п-метоксибензилтиоэфирной кислоты (2) и гидразида п-метоксибензилтиоэфирной кислоты (3).
На фигуре 3 представлена технологическая схема получения сшивающей группы DMH (5).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] Согласно некоторым вариантам реализации настоящего изобретения предложены способы синтеза гидразидов (например, гидразида 3-метил-3-меркаптобутановой кислоты (4)) при снижении содержания побочного продукта, представляющего собой бис-гидразид метоксибензилтиоэфира (например, (6)), с примерно 20% до примерно 3-5%. В одном из вариантов реализации изобретения раствор хлорангидрида метоксибензилтиоэфирной кислоты (2) добавляют к перемешиваемой смеси гидразин/метиленхлорид, которая является более разбавленной, чем в первоначальном способе (например, объемное соотношение составляет примерно 14% против 24-32% в первоначальном способе). Предпочтительное объемное соотношение для разбавления составляет примерно 14%. Для получения гидразинсодержащей смеси, к которой добавляют хлорангидрид, в вариантах реализации настоящего изобретения предложено возможное применение, без ограничения, других нереакционноспособных (или инертных) галогенированных растворителей, которые могут использоваться как вместо метиленхлорида, так и вместе с ним. Предпочтительные примеры таких других растворителей включают тетрахлорметан, хлороформ, этилендихлорид и хлорбензол. В некоторых вариантах реализации количество метиленхлорида (или соответствующего инертного растворителя) удвоено, что значительно уменьшает количество нежелательного побочного бис-гидразидного продукта. В некоторых вариантах реализации раствор хлорангидрида метоксибензилтиоэфирной кислоты добавляют к смеси гидразин/метиленхлорид непрерывно с постоянной скоростью, а не по частям. В некоторых вариантах реализации скорость добавления регулируют так, чтобы поддерживать температуру реакции в пределах от -68 до -75°С. В некоторых вариантах реализации применяют скорость перемешивания в пределах 300-400 об./мин в круглодонной колбе или 270 об./мин в колбе Мортона. Некоторые способы согласно настоящему изобретению обеспечивают получение гидразида п-метоксибензилтиоэфира (3) с концентрацией 91.1% и выходом 85%, а также с содержанием бис-гидразида метоксибензилтиоэфира (6) примерно 4-7%.
[0009] В другом варианте реализации изобретения было установлено, что несмотря на улучшения, достигаемые при использовании более разбавленной метиленхлоридной системы, все равно сохранялась необходимость соскабливать замерзший кристаллизовавшийся гидразин со дна и стенок реакционного сосуда. Ранее стандартной практикой было охлаждение раствора метиленхлорида/гидразина до примерно -70°С. Это приводило к значительным количествам гидразина, кристаллизовавшегося и осаждавшегося на стенках сосуда. Для обеспечения участия в реакции всего количества гидразина было необходимо соскабливать вещество со стенок сосуда, чтобы обеспечить возможность перехода указанного вещества в перемешиваемую суспензию. Для предотвращения такой ситуации согласно некоторым вариантам реализации настоящего изобретения была разработана альтернативная методика. Эта альтернативная методика включает охлаждение метиленхлорида до температуры от -68 до -75°С, предпочтительно до -70°С, с последующим медленным добавлением по каплям гидразина к охлажденному метиленхлориду с образованием однородной суспензии. При помощи этой новой методики достигается образование значительно более однородной суспензии гидразина, что минимизирует образование кристаллизовавшегося гидразина на внутренней стороне стенок колбы и уменьшает или устраняет необходимость соскабливать гидразин с колбы. При этом обеспечивается участие в реакции необходимого количества гидразина, что способствует уменьшению образования бис-гидразида метоксибензилтиоэфира (6).
[0010] В некоторых вариантах реализации изобретения предложен способ, включающий непрерывное добавление раствора хлорангидрида метоксибензилтиоэфирной кислоты (2) к сравнительно разбавленной (по сравнению с известным способом) и перемешиваемой охлажденной гетерогенной смеси гидразин/метиленхлорид (предпочтительно с концентрацией гидразина примерно 14%). Раствор хлорангидрида метоксибензилтиоэфирной кислоты добавляют к суспензии гидразин/метиленхлорид непрерывно с примерно постоянной скоростью, а не порциями. Скорость добавления регулируют так, чтобы температура реакции составляла от -68 до -75°С. Предпочтительная скорость перемешивания составляет 300-400 об./мин в круглодонной колбе или 270 об./мин в колбе Мортона. Улучшенные способы согласно некоторым вариантам реализации изобретения обеспечивают уменьшение количества побочного продукта, представляющего собой бис-гидразид метоксибензилтиоэфира (6), с ранее достигаемого уровня в 20% до примерно 3-5% или ниже. Улучшенный способ синтеза промежуточного соединения 1 обеспечивает повышение эффективности всего способа синтеза гемтузумаб озогамицина.
[0011] В некоторых вариантах реализации изобретения предложен способ получения гидразида из гидразина и хлорангидрида, включающий: а) получение перемешиваемой однородной суспензии гидразина и инертного растворителя; b) непрерывное добавление хлорангидрида к указанной смеси. В другом аспекте этого варианта реализации хлорангидрид добавляют к суспензии по существу по каплям.
[0012] В некоторых вариантах реализации изобретения предложен способ получения гидразидов из галогенангидридов и гидразинов. В данном варианте реализации получение осуществляют путем химической реакции между электрофильным ацилкарбонилом в составе хлорангидрида и нуклеофильным азотом гидразина. Конкретные заместители, присоединенные к ацилкарбонилу, подходящие для целей настоящего изобретения, могут представлять собой любые фрагменты, которые не мешают образованию гидразидной связи, включая фрагменты, содержащие защитные группы, устраняющие помехи для образования гидразидной связи. Применение и удаление защитных групп описано в работе McOmie, Protecting Groups in Organic Chemistry, Plenum Press, NY, 1973, и Greene and Wuts, Protecting Groups in Organic Synthesis, 4nd. Ed., John Wiley & Sons, NY, 2006. Например, в некоторых вариантах реализации изобретения хлорангидрид содержит защищенный тиол. Примеры защищенных тиолов включают, но не ограничиваются ими, бензилтиоэфиры.
[0013] В другом аспекте изобретения хлорангидриды имеют структуру:
,
где Р представляет собой тиолзащитную группу, каждый из R1 и R2 выбран из группы, состоящей из C1-С5 алкила, a L представляет собой алкиленовую линкерную группу. Примеры алкиленовых линкерных групп L включают, но не ограничиваются ею, линкерную группу -(СН2)n-, где n представляет собой целое число от 1 до 5. В некоторых вариантах реализации R1 и R2 являются одинаковыми и, например, представляют собой одинаковые C1-С5 алкилы. Примеры C1-С5 алкила включают, но не ограничиваются ими, метил, этил, пропил, бутил, пентил, включая как линейные, так и разветвленные изомеры указанного алкила. Примеры тиолзащитных групп включают, но не ограничиваются ею, бензильную группу, в которой фенильный фрагмент может быть замещенным. Примеры возможных заместителей включают, но не ограничиваются ею, алкоксигруппу, такую как метокси, этокси и т.д. Таким образом, в одном из вариантов реализации изобретения хлорангидрид имеет следующую структуру:
.
[0014] Другим вариантом реализации настоящего изобретения является способ получения гидразида из гидразина и хлорангидрида, включающий, на первой стадии, получение перемешиваемой по существу однородной суспензии, содержащей гидразин и инертный растворитель. В другом аспекте этого варианта реализации инертный растворитель представляет собой метиленхлорид.
[0015] Другим вариантом реализации настоящего изобретения является способ получения гидразида из гидразина и хлорангидрида. В другом аспекте этого варианта реализации гидразидный продукт имеет структуру:
,
где Р представляет собой тиолзащитную группу, a L, R1 и R2 могут быть такими, как указано выше. В еще одном аспекте этого варианта реализации Р представляет собой бензильную группу, возможно замещенную по фенольному кольцу. В другом аспекте этого варианта реализации Р представляет собой n-метоксибензильную группу, R1 и R2 выбраны из группы, состоящей из C1-С5 алкила, a L представляет собой алкиленовую линкерную группу. Примеры алкиленовых линкерных групп L включают линкерную группу -СН2-, но не ограничиваются этой группой. В одном из вариантов реализации каждый из R1 и R2 представляет собой независимо метил.
[0016] Другим вариантом реализации настоящего изобретения являются гидразидные продукты, полученные в соответствии со способами согласно настоящему изобретению. В одном варианте реализации целевой гидразид имеет структуру:
или представляет собой соответствующую соль. В еще одном варианте реализации изобретения гидразид представляет собой гидразид 3-метил-3-меркаптобутановой кислоты.
[0017] В еще одном аспекте изобретения целевой гидразид содержит менее 5% бис-гидразидного побочного продукта, имеющего структуру
,
где R и R′ представляют собой возможно замещенную алкильную, гетероалкильную или гетероалкарильную группы.
[0018] В другом аспекте этого варианта реализации каждый из фрагментов R и R′ в бис-гидразидном побочном продукте представляет собой
,
где Р представляет собой тиолзащитную группу, каждый из R1 и R2 выбран из группы, состоящей из C1-С5 алкила, a L представляет собой алкиленовую линкерную группу. Примеры алкиленовых линкерных групп L включают, но не ограничиваются ими, -СН2- группы. В другом аспекте этого варианта реализации каждый из R1 и R2 представляет собой независимо метил. В другом аспекте этого варианта реализации Р представляет собой бензильную группу, которая может быть замещена по фенильному кольцу; примеры включают, но не ограничиваются ею, п-метоксибензильную группу.
[0019] Другой вариант реализации изобретения представляет собой способ получения гидразида из гидразина и хлорангидрида, согласно которому гидразидный продукт содержит менее 5% бис-гидразидного побочного продукта, имеющего следующую структуру:
[0020] Другой вариант реализации настоящего изобретения представляет собой способ получения гидразида из гидразина и хлорангидрида, включающий на первой стадии получение перемешиваемой по существу однородной суспензии, содержащей гидразин и инертный растворитель, а на второй стадии - последующее непрерывное добавление хлорангидрида к указанной суспензии. Согласно другому аспекту этого варианта реализации непрерывное добавление раствора хлорангидрида регулируют таким образом, чтобы поддерживать температуру реакции в пределах от примерно -68°С до примерно -75°С. В еще одном аспекте этого варианта реализации суспензия гидразина по существу однородна.
[0021] В другом варианте реализации изобретения гидразидную связь получают в соответствии со способом, включающим стадии: а) охлаждения реакционного сосуда, содержащего перемешиваемый инертный растворитель, до заданной низкой температуры; b) непрерывного добавления гидразина в указанный реакционный сосуд с получением перемешиваемой по существу однородной суспензии, содержащей гидразин и инертный растворитель; с) непрерывного добавления хлорангидрида к указанной суспензии с образованием гидразидной связи. В другом аспекте этого варианта реализации инертный растворитель представляет собой метиленхлорид.
[0022] В другом варианте реализации изобретения суспензию гидразина получают по способу, включающему стадии: а) быстрого охлаждения инертного растворителя до температуры от примерно -68 до примерно -75°С и b) добавления по каплям гидразина, растворенного в инертном растворителе, к указанному охлажденному инертному растворителю. В другом аспекте этого варианта реализации инертный растворитель представляет собой метиленхлорид. В еще одном аспекте этого варианта реализации суспензию гидразина перемешивают со скоростью от примерно 270 до примерно 400 об./мин.
[0023] Другой вариант реализации изобретения представляет собой способ получения иммуноконъюгата агента, принадлежащего к семейству калихимицинов, с моноклональным антителом в качестве носителя, при этом указанный способ включает получение моноацилированного гидразина, в котором ацильная группа содержит S-защищенную меркаптогруппу, согласно предложенному способу; удаление указанной защитной группы и применение полученного гидразида для получения указанного иммуноконъюгата. Другой вариант реализации изобретения представляет собой способ получения гемтузумаб озогамицина или инотузумаб озогамицина, включающий стадии получения линкерного соединения, представляющего собой гидразид 3-метил-3-меркаптобутановой кислоты в соответствии со способом согласно изобретению и применение указанного линкера для получения гемтузумаб озогамицина или инотузумаб озогамицина.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0024] п-Метоксибензилтиол вступает в реакцию Михаэля с 3,3-диметилакриловой кислотой в пиперидине. Количества реагентов влияют на выход реакции. В одном из вариантов реализации количество n-метоксибензилтиола находится в небольшом молярном избытке относительно количества 3,3-диметилакриловой кислоты, например, в диапазоне от 0,354 кг (2,3 моль) и 0,362 кг (2,35 моль). Если количества меньше нижнего предела этого диапазона, то последующие реакции могут протекать не полностью. Если количества больше верхнего предела этого диапазона, то избыток реагентов может усложнять проведение процесса. Реакционную смесь нагревают таким образом, чтобы ее температура не превышала 98°С, в течение по меньшей мере 15 часов для предотвращения повышенного образования примесей. Пиперидин удаляют путем разбавления метиленхлоридом и промывания водной соляной кислотой, а затем водой. Поддержание температуры выше 50°С, но ниже 90°С необходимо до и во время добавления HCl, чтобы предотвратить осаждение продукта реакции. Реакционную смесь далее охлаждают, а затем экстрагируют метиленхлоридом, как указано в экспериментальной части.
[0025] Количества используемых растворителей пропорциональны масштабам реакции для достижения оптимальных результатов и очистки. Получаемый раствор продукта в CH2Cl2 сушат сульфатом магния, очищают, концентрируют под вакуумом, затем разбавляют гептаном для осаждения неочищенного промежуточного соединения, которое отфильтровывают и промывают гептаном. Очистку завершают путем повторного растворения неочищенного вещества в метиленхлориде и переосаждения в гептане. Очищенную п-метоксибензилтиоэфирную кислоту (1) выделяют фильтрованием, промывают гептаном и сушат под вакуумом.
[0026] п-Метоксибензилтиоэфирную кислоту (1) превращают в соответствующий хлорангидрид с использованием оксалилхлорида и метиленхлорида в качестве растворителя. Оксалилхлорид должен присутствовать в молярном избытке по отношению к n-метоксибензилтиоэфирной кислоте для полного протекания реакции. Хлорангидридный продукт выделяют концентрированием под вакуумом для переведения метиленхлорида и избытка оксалилхлорида в маслообразное состояние. Полученное масло разбавляют метиленхлоридом и медленно добавляют в течение примерно 3-5 часов при температуре в пределах от 65 до 75°С к разбавленной смеси гидразина и метиленхлорида.
[0027] Один из аспектов настоящего изобретения представляет собой образование однородной суспензии, содержащей гидразин и инертный растворитель, такой как метиленхлорид. В соответствии с одним вариантом реализации изобретения однородную суспензию получают медленным добавлением по каплям жидкого гидразина к метиленхлориду, предварительно охлажденному до примерно от -68 до -75°С, предпочтительно -70°С, до начала добавления гидразина. Напротив, охлаждение предварительно перемешанного раствора гидразина и метиленхлорида при той же температуре приводит к менее предпочтительному образованию кристаллического гидразина, который собирается на стенках реакционного сосуда. Не желая быть связанными какой-либо конкретной теорией, полагают, что медленное, по каплям, добавление гидразина к предварительно охлажденному метиленхлориду и контролирование максимальной концентрации гидразина в метиленхлориде приводит к образованию меньших по размеру, более однородных кристаллов гидразина, которые остаются суспендированными в перемешиваемой смеси и по существу не замерзают на стенках сосуда. Образование по существу однородной суспензии помогает обеспечивать нахождение гидразина в контакте с перемешиваемым метиленхлоридом и доступность гидразина к реакции с добавляемым раствором хлорангидрида. Образование однородной суспензии устраняет необходимость соскабливания вещества с внутренней поверхности реакционной колбы, которое требовалось в первоначальном способе. К тому же, указанное образование по существу однородной суспензии обеспечивает возможность участия в реакции требуемого количества гидразина, что также приводит к уменьшению количества образующегося бис-гидразида метоксибензилтиоэфира (6).
[0028] Концентрация гидразина в метиленхлориде влияет на количество бис-гидразида метоксибензилтиоэфира (6), который образуется в качестве побочного продукта. В известных способах концентрация гидразина/метиленхлорида составляла примерно от 24 до 32% об. Уменьшение в два раза соотношения гидразин/метиленхлорид (более разбавленный гидразин) до примерно от 12 до 16% об., предпочтительно до примерно 14%, приводит к уменьшению количества образующегося нежелательного бис-гидразида метоксибензилтиоэфира (6) (см. Таблицу 1).
| ТАБЛИЦА 1 | |||
| РЕЗУЛЬТАТЫ СПОСОБА ПОСЛЕ УЛУЧШЕНИЙ | |||
| № п/п | Концентрация гидразида* (%) | Побочный бис-гидразидный продукт (%) | Скорректированный выход гидразида (%) |
| 1.1 | 91,61 | 9,69 | 85,4 |
| 1.2 | 95,08 | 5,76 | 87,7 |
| 1.3 | 96,16 | 4,13 | 89,6 |
| 1.4 | 93,76 | 7,36 | 85,7 |
| *определено методом жидкостной хроматографии высокого давления |
[0029] В некоторых вариантах реализации изобретения раствор хлорангидрида добавляют к суспензии гидразин/метиленхлорид непрерывно с постоянной скоростью, а не порциями. Количество добавляемого хлорангидрида, как и скорость его добавления, влияют на выход целевого гидразида метоксибензилтиоэфира (3). Если добавлено слишком мало хлорангидрида, может образовываться избыточное количество побочного продукта, представляющего собой бис-гидразид метоксибензилтиоэфира (6). Также, если время добавления хлорангидрида слишком мало, составляя менее 3 часов, может образовываться избыточное количество побочного продукта, представляющего собой бис-гидразид метоксибензилтиоэфира (6). Скорость добавления регулируют для поддержания температуры реакции в пределах от -68 до -75°С. Если температура реакции возрастает до более высоких значений, также может образовываться избыточное количество бис-гидразида метоксибензилтиоэфира (6). Скорость перемешивания суспензии гидразина предпочтительно составляет от 300 до 400 об./мин в круглодонной колбе или 270 об./мин в колбе Мортона. Оба аспекта улучшенного способа, а именно: использование более разбавленной смеси гидразин/метиленхлорид и образование однородной суспензии, уменьшают количество побочного продукта, представляющего собой бис-гидразид метоксибензилтиоэфира (6), с примерно 20% до примерно от 3 до 5%. Улучшенные стадии получения гидразина увеличивают общую эффективность синтеза линкера, представляющего собой гидразид 3-метил-3-меркаптобутановой кислоты, вследствие чего также повышается общая эффективность получения MYLOTARG® (гемтузумаб озогамицина).
[0030] После завершения реакции реакционную смесь концентрируют под вакуумом и осадок обрабатывают раствором гидроксида натрия в метаноле (примерно 4-5%). Указанный раствор концентрируют под вакуумом, разбавляют метиленхлоридом, промывают водой, сушат над сульфатом магния, очищают и концентрируют под вакуумом с получением концентрата. Необходимо использовать достаточное количество сульфата магния для полного осушения продукта, чтобы на следующих стадиях не происходило разложения продукта или затруднений при его кристаллизации. Конечный концентрат разбавляют метиленхлоридом в количестве, в 1.33 раза превышающем массу п-метоксибензилтиоэфирной кислоты (1), и этот раствор добавляют к диэтиловому эфиру, взятому в количестве, в 7.6 раза превышающем массу п-метоксибензилтиоэфирной кислоты (1). Алифатический углеводородный растворитель, такой как гептан, гексан, октан или изогексан, предпочтительно гептан, добавляют к образовавшейся суспензии в количестве, в 1.83 раза превышающем массу п-метоксибензилтиоэфирной кислоты (1), для завершения осаждения. Гидразид n-метоксибензилтиоэфира (6) выделяют фильтрованием, промывают гептаном и сушат под вакуумом.
[0031] Гидразид п-метоксибензилтиоэфира (3) обрабатывают трифторметансульфокислотой в присутствии анизола, используя трифторуксусную кислоту в качестве растворителя. Необходимо следить за тем, чтобы во время добавления и последующего протекания реакции температура реакции не превышала примерно 20°С для предотвращения образования нежелательных примесей. По завершении удаления п-метоксибензильной защитной группы реакционную смесь гасят, выливая в метанол, и фильтруют для удаления твердых побочных продуктов. Фильтраты концентрируют под вакуумом, растворяют в воде, промывают метиленхлоридом и обрабатывают анионообменной смолой с получением гидразида 3-метил-3-меркаптобутановой кислоты (5). Смолу удаляют фильтрованием, затем к раствору неочищенного продукта добавляют водный раствор соляной кислоты для образования хлористоводородной соли. Полученное количество продукта концентрируют под вакуумом, растворяют в этаноле, очищают фильтрованием и концентрируют под вакуумом. Этот концентрат разбавляют этилацетатом и концентрируют под вакуумом. Затем вновь осадок разбавляют этилацетатом и выделяют фильтрованием. Влажный осадок нагревают с этилацетатом до примерно от 48 до 55°С, охлаждают, фильтруют и сушат под разрежением. Высушенную хлористоводородную соль превращают в свободное основание путем обработки анионобменной смолой в воде. Смолу удаляют фильтрованием, а фильтраты концентрируют под вакуумом. Концентрат растворяют в этаноле, концентрируют под вакуумом, суспендируют в диэтиловом эфире и концентрируют под вакуумом. В качестве окончательной очистки гидразид 3-метил-3-меркаптобутановой кислоты (5) растворяют в метиленхлориде, очищают фильтрованием и обрабатывают двуокисью кремния, которую затем удаляют фильтрованием. Очищенный продукт выделяют из раствора концентрированием под вакуумом. Согласно предпочтительному способу очистки, показанному в Примере 15, гидразид 3-метил-3-меркаптобутановой кислоты (5) растворяют в 50 частях (объем/масса) метиленхлорида при 20°С±3°С, перемешивают 30 минут и фильтруют. Полученный раствор обрабатывают 0.7-1 частями (масс./масс. относительно массы неочищенного линкерного соединения) силикагеля, перемешивают 30 минут, фильтруют и концентрируют до получения сухого остатка в роторном испарителе. Полученное твердое вещество растирают с гептаном. После выделения и сушки под вакуумом гидразид 3-метил-3-меркаптобутановой кислоты (5) получают в виде сыпучего порошка с примерно 76% выходом.
[0032] Одним из аспектов настоящего изобретения является способ получения гидразида п-метоксибензилтиоэфира с менее чем 5%-ным содержанием нежелательного побочного продукта, представляющего собой бис-гидразид метоксибензилтиоэфира (6). Этот улучшенный способ включает модифицированный способ проведения реакции сочетания хлорангидрида тиоэфирной кислоты с гидразином с образованием гидразида п-метоксибензилтиоэфира. Стадии указанного способа схематически показаны в Уравнении I. Нежелательный побочный продукт, представляющий собой бис-гидразид метоксибензилтиоэфира (6), образуется при сочетании продукта, представляющего собой гидразид n-метоксибензилтиоэфира (3), с исходным веществом, представляющим собой хлорангидрид n-метоксибензилтиоэфирной кислоты (2). Образование нежелательного бис-гидразида метоксибензилтиоэфира (6) приводит к снижению качества и выхода продукта.
[0033] Согласно другому аспекту настоящего изобретения, предложенный способ в целом может включать более широкое применение. Конкретная последовательность реакций (Уравнение III) может быть обобщена в виде Уравнения VII.
[0034] Когда в настоящем описании указано, что на одной из стадий способа добавление вещества осуществляют непрерывно, это означает, что указанное добавление осуществляют постоянно в течение некоторого времени, а не порциями и не за один раз. Примерами непрерывного добавления являются добавление жидкости по каплям или добавление жидкости непрерывным потоком. В некоторых вариантах реализации непрерывное добавление выполняется путем контролирования скорости добавления вещества, которое реагирует экзотермично, со скоростью, достаточной для поддержания температуры реакции внутри заданного температурного интервала.
[0035] Термин «суспензия» в настоящем описании относится к сочетанию твердой и жидкой фаз, которые тщательно смешивают вместе и, как правило, охлаждают до температуры, при которой присутствуют как твердая, так и жидкая фаза, при этом указанная смесь является исключительно жидкостью при температуре окружающей среды. Иногда суспензией называют смесь жидкой/твердой формы одного и того же вещества, например, смесь лед/вода, в которой лед сравнительно хорошо измельчен и перемешан с жидкой водой. В контексте настоящего изобретения к суспензии можно отнести смесь твердое вещество/ жидкость, образованную комбинацией двух веществ, таких как гидразин и растворитель, например, метиленхлорид. Полагают, что в охлажденной суспензии гидразина/метиленхлорида жидкая фаза содержит смесь метиленхлорида и гидразина, тогда как твердая фаза содержит главным образом гидразин.
[0036] Термин «алкил» включает линейные или разветвленные алкилы, состоящие из 1-10 углеродных атомов, при этом предпочтительными являются низшие алкилы, содержащие от 1 до 5 углеродных атомов. Например, алкил включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, трет-пентил, 2-метилбутил, н-гексил, изогексил, гептил, изогептил, октил, изооктил, нонил, децил и т.п. Термин «алкилен» включает линейные и разветвленные бирадикалы алканов, содержащих от 1 до 10 углеродных атомов, такие как метилен (-СН2-), этилен (-СН2СН2-), пропилен, бутилен и пентилен.
[0037] Термин «гетероалкил» относится к описанной выше алкильной группе, в которой один или более углеродных атомов замещены на гетероатом (кислород, серу, азот или фосфор) и которая может содержать дополнительные гетероатомы. Термин «гетероалкарил» относится к гетероалкильному фрагменту, описанному выше, но который дополнительно замещен арильным фрагментом, где указанный арильный фрагмент может быть замещенным. Возможно замещенный арил включает фенил и замещенный фенил. В замещенном фениле один, два или три возможных заместителя могут замещать водород в фенольном кольце и располагаться в орто-, мета- или пара-положении по отношению к метиленовой группе у бензильного атома углерода (или к другому месту присоединения). В Примере 1 метоксигруппа расположена в пара-положении к метиленовой группе. Неограничивающие примеры возможных заместителей в ариле включают C1-С5 алкил, C1-С5 алкокси, C1-С5 галогеналкил, C1-С5 галогеналкокси, в которых атомы водорода, соединенные с углеродными атомами в алкильной или алкоксигруппе, могут быть заменены на атомы галогена, например -CF3 и -OCF3.
Следующие неограничивающие примеры иллюстрируют настоящее изобретение.
ПРИМЕР 1
Первоначальное получение п-метокситиоэфирной кислоты (1)
[0038] В соответствии с Уравнением I в 5-литровую круглодонную колбу, снабженную термопарой, механической мешалкой, обратным холодильником с отверстием для подвода N2 в верхней части и 250 мл капельной воронкой с компенсатором давления, поместили 400 г, 465 мл, 4,70 моль пиперидина. 3,3-диметилакриловую кислоту (215 г, 2,15 моль) добавили порциями в 5-литровую реакционную колбу при перемешивании. Смесь энергично перемешивали в атмосфере N2. Во время добавления температуру реакции поддерживали ниже 35-40°С (Примечание: сильно экзотермично, газовыделение). п-Метоксибензилтиол (386 г, 323 мл, 2,32 моль) добавили с помощью капельной воронки с компенсатором давления в течение 15 минут в (5-литровую) реакционную колбу. Смесь нагрели до 82-88°С при перемешивании в атмосфере N2. Температуру реакции поддерживали в этом интервале в течение 15 минут. Примечание: экзотермично. Прозрачную желтую смесь нагрели до 92-95°С и перемешивали в атмосфере N2 по меньшей мере в течение 15 часов. Для проведения ВЭЖХ взяли 1 мл пробу. Реакцию считали завершенной, когда оставалось менее 3% 3,3-диметилакриловой кислоты, как определяли по площади пика. Реакционную смесь охладили до 70-75°С, убрав колбонагреватель.
[0039] 3М раствор соляной кислоты (1900 мл, 2090 г) добавили через литровую капельную воронку с компенсатором давления к перемешиваемому желтому раствору,