Соединения и композиции, ингибирующие parp, и способы их применения
Иллюстрации
Показать всеИзобретение относится к тетраазафенален-3-оновым соединениям, в частности к соединению формулы 37
которые ингибируют поли(АДФ-рибоза)полимеразу (PARP) и могут использоваться для химиосенсибилизации в отношении противораковых химиотерапевтических средств, а также для повышения эффективности химиотерапевтических средств и при лечении раковых заболеваний, характеризующихся дефектами репарации ДНК. 2 н. и 11 з.п. ф-лы, 2 табл., 6 ил., 3 пр.
Реферат
Настоящее изобретение относится к тетраазафенален-3-оновым соединениям, которые ингибируют поли(АДФ-рибоза)полимеразу (PARP).
Настоящее изобретение относится к ингибиторам ядерного фермента поли(аденозин-5'-дифосфорибоза)полимеразы ["поли(АДФ-рибоза)полимераза" или "PARP", который также называют ADPRT (NAD:белок (АДФ-рибозилтрансфераза (полимеризующая)), и PARS (поли(АДФ-рибоза)синтетаза) и предлагает соединения и композиции, содержащие раскрытые соединения. Кроме того, настоящее изобретение относится к способам применения раскрытых ингибиторов PARP для лечения рака.
Большое внимание уделяется разработке ингибиторов PARP в качестве химиосенсибилизирующих средств, для применения в противораковой терапии и для ограничения повреждения клеток после ишемии или эндотоксического стресса. В частности, усиление цитотоксичности темозоломида, наблюдаемое в доклинических исследованиях с использованием активных ингибиторов PARP-1, связано с ингибированием восстановления удаленных оснований, и последующая цитотоксичность обусловлена неполным процессингом N7-метилгуанина и N3-метиладенина. Существующая в настоящее время совокупность результатов доклинических исследований демонстрирует, что цитотоксичность темозоломида усиливается при совместном введении ингибитора PARP как in vitro, так и in vivo. Plummer, et al, Clin. Cancer Res., 11(9), 3402 (2005).
Темозоломид, ДНК-метилирующее средство, вызывает повреждение ДНК, которое исправляется O6-алкилгуаниналкилтрансферазой (ATазой) и путем поли(АДФ-рибоза)полимераза-1 (PARP-1)-зависимой репарации удаленных оснований. Темозоломид представляет собой монофункциональное ДНК-алкилирующее средство, которое может усваиваться после перорального введения и используется для лечения глиом и злокачественной меланомы. Темозоломид быстро абсорбируется и подвергается спонтанному разрушению с образованием активного монометилтриазена, 5-(3-метил-1-триазено)имидазол-4-карбоксамида. Монометилтриазен дает несколько продуктов метилирования ДНК, среди которых преобладают N7-метилгуанин (70%), N3-метиладенин (9%) и O6-метилгуанин (5%). Если O6-метилгуанин не подвергается репарации под действием O6-алкилгуаниналкилтрансферазы, он является цитотоксичным вследствие неспособности спариваться с тимином в процессе репликации ДНК. Данное нарушение комплементарности распознается на дочерней цепи белками, осуществляющими репарацию ошибочно спаренных оснований, затем вырезается тимин. Однако если исходный нуклеотид O6-метилгуанин в родительской цепи не подвергается репарации в результате опосредованного AT-азой удаления метил-содержащего аддукта, может осуществляться повторная вставка тимина. Повторяющиеся безрезультатные циклы вырезания тимина и вставки на противоположной цепи нерепарированного нуклеотида O6-метилгуанина вызывают состояние непрерывно возобновляющегося разрыва цепи, и ветвь MutS системы репарации ошибочно спаренных оснований сигнализирует о прекращении клеточного цикла на стадии G2-M и инициации апоптоза. Количественно более значимые продукты алкилирования нуклеотидов N7-метилгуанин и N3-метиладенин, образующиеся под действием темозоломида, подвергаются быстрой репарацией путем вырезания оснований. Plummer, et al, Clin. Cancer Res., 11(9), 3402 (2005).
Химиосенсибилизация под действием ингибиторов PARP не ограничивается темозоломидом. Цитотоксичные лекарственные средства или облучение, как правило, могут вызывать активацию PARP-1, и ингибиторы PARP-1, как показано, могут усиливать разрушение ДНК и цитотоксические эффекты химиотерапии и облучения. Kock, et al, 45 J. Med. Chem. 4961 (2002). PARP-1-опосредованная репарация ДНК в ответ на средства, повреждающие ДНК, олицетворяет механизм устойчивости опухолей к лекарственным средствам, и показано, что ингибирование данного фермента повышает активность ионизирующего облучения и некоторых цитотоксичных противоопухолевых средств, включая темозоломид и топотекан. Suto et al, в патенте США 5177075, раскрывают некоторые изохинолины, используемые для усиления летального действия ионизирующего облучения или химиотерапевтических средств на опухолевые клетки. Weltin et al, "Effect of 6(5H)-Phenanthridinone, an Inhibitor of Poly(ADP-ribose) Polymerase, on Cultured Tumor Cells", Oncol. Res., 6:9, 399-403 (1994), описывают ингибирование активности PARP, уменьшение пролиферации опухолевых клеток и значительный синергический эффект при совместной обработке опухолевых клеток алкилирующим средством. Таким образом, PARP-1 является потенциально важной терапевтической мишенью для повышения эффективности ДНК-повреждающих противораковых терапий.
Ингибиторы PARP также могут ингибировать рост клеток, имеющих дефекты в пути репарации двухцепочечной ДНК посредством гомологичной рекомбинации (HR). См. Bryant et al, "Specific killing of BRCA2-deficient tumours with inhibitors of Poly(ADP-ribose) Polymerase," Nature 434, 913 (2005); Farmer et al, "Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy," Nature 434, 917 (2005). Данный эффект реализуется в отсутствии химиосенсибилизирующих средств. Id. Известные состояния, связанные с дефектами HR, включают дефекты BRCA-1, дефекты BRCA-2 и раковые заболевания, ассоциированные с анемией Фанкони. McCabe et al., "Deficiency in the Repair of DNA Damage by Homologous Recombination and Sensitivity to Poly(ADP-ribose) Polymerase Inhibition," Cancer Res. 66. 8109 (2006). Белки, которые были идентифицированы как ассоциированные с анемией Фанкони, включают FANCA, FANCB, FANCC, FANCD2, FANCE, FANCF, FANCG, FANCL и FANCM. Id. Обзор можно найти у Zaremba et al., в "PARP Inhibitor Development for Systemic Cancer Targeting," Anti-Cancer Agents in Medicinal Chemistry 7, 515 (2007) и Lewis et al., "Clinical Poly(ADP-Ribose) Polymerase inhibitors for the treatment of cancer," Curr. Opin. Investigational Drugs 8, 1061 (2007).
Большое число известных ингибиторов PARP описано у Banasik et al., в "Specific Inhibitors of Poly(ADP-Ribose) Synthetase and Mono(ADP-Ribosyl)-Transferase", J. Biol. Chem., 267:3, 1569-75 (1992), а также в Banasik et al., "Inhibitors and Activators of ADP-Ribosylation Reactions", Molec. Cell. Biochem., 138, 185-97 (1994). Однако эффективное применение указанных ингибиторов PARP в описанных выше способах ограничено вследствие присутствия нежелательных побочных эффектов. См. Milam et al., "Inhibitors of Poly(Adenosine Diphosphate-Ribose) Synthesis; Effect on Other Metabolic Processes," Science, 223, 589-91 (1984).
В дополнение к вышесказанному, ингибиторы PARP были раскрыты и описаны в следующих международных патентных заявках: WO 00/42040; WO 00/39070; WO 00/39104; WO 99/11623; WO 99/11628; WO 99/11622; WO 99/59975; WO 99/11644; WO 99/11945; WO 99/11649 и WO 99/59973. Исчерпывающий обзор состояния данной области был опубликован Li and Zhang в IDrugs 2001, 4(7): 804-812 (PharmaPress Ltd ISSN 1369-7056).
Способность ингибиторов PARP усиливать летальное действие цитотоксических средств путем химиосенсибилизации опухолевых клеток к цитотоксическим эффектам химиотерапевтических средств была описана, в числе прочего, в US 2002/0028815; US 2003/0134843; US 2004/0067949; White AW, et al., 14 Bioorg. и Med. Chem Letts. 2433 (2004); Canon Koch SS, et al., 45 J. Med. Chem. 4961 (2002); Skalitsky DJ, et al, 46 J. Med. Chem. 210 (2003); Farmer H, et al, 434 Nature 917 (14 April 2005); Plummer ER, et al., 11(9) Clin. Cancer Res. 3402 (2005); Tikhe JG, et al., 47 J. Med. Chem. 5467 (2004); Griffin R.J., et al, WO 98/33802; и Helleday T, et al, WO 2005/012305.
Индукция периферической невропатии является основной причиной ограничения использования химиотерапевтических средств. Quasthoff and Hartung, J. Neurology, 249, 9-17 (2002). Индуцированная химиотерапией невропатия представляет собой побочный эффект, наблюдающийся после применения многих традиционных (таких как таксол, винкритин, цисплатин) и новых химиотерапевтических средств (таких как велкад, эпотилон). В зависимости от используемого вещества, может развиваться чистая сенсорная и болезненная невропатия (при использовании цисплатина, оксалиплатина, карбоплатина) или смешанная сенсомоторная невропатия, необязательно с участием автономной нервной системы (при использовании винкристина, таксола, сурамина). Нейротоксичность зависит от суммарной дозы и типа используемого лекарственного средства. В отдельных случаях невропатия может развиваться даже после однократного применения препарата. Излечение симптомов часто бывает неполным и для восстановления функции требуется длительный период регенерации. До настоящего времени существовало только небольшое число лекарственных средств, позволяющих надежно предотвращать или лечить невропатию, индуцированную химиотерапией.
Таким образом, остается потребность в эффективных и сильнодействующих ингибиторах PARP, которые могут усиливать летальное действие химиотерапевтических средств на опухолевые клетки, вызывая при этом минимальные побочные эффекты.
В дополнение, сообщалось, что ингибиторы PARP эффективно сенсибилизируют гипоксические опухолевые клетки к облучению и эффективно предотвращают восстановление опухолевых клеток после потенциально летального повреждения ДНК под действием лучевой терапии, предположительно, благодаря их способности предотвращать репарацию ДНК. Патенты США 5032617; 5215738 и 5041653.
Последние публикации позволяют предположить, что ингибиторы PARP убивают раковые клетки, дефицитные по ассоциированным с раком молочной железы генам 1 и 2 (BRCA1/2). Данные исследования позволяют предположить, что с помощью ингибиторов PARP можно эффективно лечить BRCA1/2-ассоциированный рак молочной железы. [Farmer et al., Nature 2005, 434, 917; DeSoto and Deng, Intl. J. Med. Sci. 2006, 3, 117; Bryant et al., Nature, 2005, 434, 913.]
Таким образом, остается потребность в эффективных и сильнодействующих ингибиторах PARP, которые могут усиливать летальное действие ионизирующего облучения и/или химиотерапевтических средств на опухолевые клетки, или ингибировать рост клеток, имеющих дефекты пути репарации двухцепочечной ДНК посредством гомологичной рекомбинации (HR), вызывая при этом минимальные побочные эффекты.
Настоящее изобретение относится к описанным в данном описании соединениям, их производным и их применению для ингибирования поли(АДФ-рибоза)полимеразы ("PARP"), композициям, содержащим данные соединения, а также способам получения указанных ингибиторов PARP и способам их применения для лечения последствий описанных выше состояний.
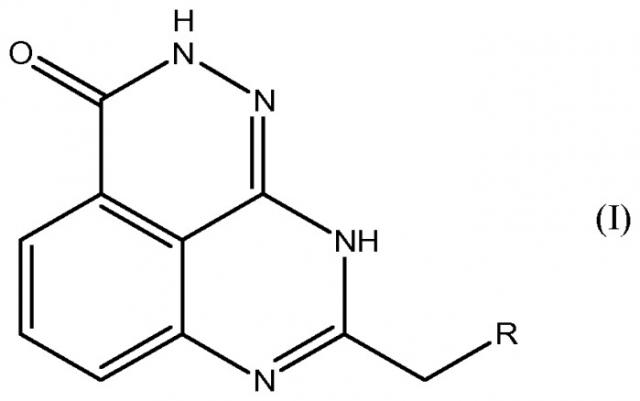
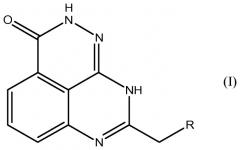
Настоящее изобретение также относится к тетраазафенален-3-оновому соединению формулы (I) или его фармацевтически приемлемой соли:
где R означает
(a) NR1R2, где R1 выбирают из группы, включающей водород, C1-C6алкил с линейной или разветвленной цепью, C2-C6алкенил с линейной или разветвленной цепью, C3-C8циклоалкил, C1-C6алкокси, C2-C6алкенилокси, фенил, фенокси, бензилокси, NRARB(C1-C6алкил с линейной или разветвленной цепью), NRARB(C2-C6алкенил с линейной или разветвленной цепью), (C1-C6алкил с линейной или разветвленной цепью)карбонил, (C2-C6алкенил с линейной или разветвленной цепью)карбонил, (C3-C8циклоалкил)карбонил, (C1-C6алкил с линейной или разветвленной цепью)оксикарбонил, (C2-C6алкенил с линейной или разветвленной цепью)оксикарбонил, (C3-C8циклоалкил)оксикарбонил, арилкарбонил, сульфонил, арилсульфонил, арил(C1-C6алкил с линейной или разветвленной цепью), арил(C2-C6алкенил с линейной или разветвленной цепью), арил(C3-C8циклоалкил), (C1-C6алкил с линейной или разветвленной цепью)арил, (C2-C6алкенил с линейной или разветвленной цепью)арил, (C3-C8циклоалкил)арил, арил, гетероциклил, гетероциклил(C1-C6алкил с линейной или разветвленной цепью) и гетероциклил(C2-C6алкенил с линейной или разветвленной цепью); где каждый гетероциклил содержит от 1 до 7 гетероатомов, независимо выбранных из O, N или S, и где каждый из RA и RB независимо выбирают из группы, включающей водород, C1-C6алкил с линейной или разветвленной цепью, C2-C6алкенил с линейной или разветвленной цепью и C3-C8циклоалкил;
и R2 выбирают из группы, включающей C1-C6алкил с линейной или разветвленной цепью, C2-C6алкенил с линейной или разветвленной цепью, C3-C8циклоалкил, C1-C6алкокси, C2-C6алкенилокси, фенил, фенокси, бензилокси, NRXRY(C1-C6алкил с линейной или разветвленной цепью), NRXRY(C2-C6алкенил с линейной или разветвленной цепью), (C1-C6алкил с линейной или разветвленной цепью)карбонил, (C2-C6алкенил с линейной или разветвленной цепью)карбонил, (C3-C8циклоалкил)карбонил, (C1-C6алкил с линейной или разветвленной цепью)оксикарбонил, (C2-C6алкенил с линейной или разветвленной цепью)оксикарбонил, (C3-C8циклоалкил)оксикарбонил, арилкарбонил, сульфонил, арилсульфонил, арил(C1-C6алкил с линейной или разветвленной цепью), арил(C2-C6алкенил с линейной или разветвленной цепью), арил(C3-C8циклоалкил), (C1-C6алкил с линейной или разветвленной цепью)арил, (C2-C6алкенил с линейной или разветвленной цепью)арил, (C3-C8циклоалкил)арил, арил, гетероциклил, гетероциклил(C1-C6алкил с линейной или разветвленной цепью) и гетероциклил(C2-C6алкенил с линейной или разветвленной цепью); где каждый гетероциклил содержит от 1 до 7 гетероатомов, независимо выбранных из O, N или S, и где каждый из RX и RY независимо выбирают из группы, включающей водород, C1-C6алкил с линейной или разветвленной цепью, C2-C6алкенил с линейной или разветвленной цепью и C3-C8циклоалкил;
где R1 и R2 независимо замещены 0-4 заместителями, каждый из которых независимо выбирают из галогена, C1-C6алкила с линейной или разветвленной цепью, C2-C6алкенила с линейной или разветвленной цепью, C1-C6алкокси, трифторметила, трифторэтила и амино; при условии, что R1 и R2, оба не являются метилом, и R2 не является (фенил)проп-1-илом, если R1 означает водород; или
(b) арилокси, замещенный 0-4 заместителями, каждый из которых независимо выбирают из группы, включающей галоген, C1-C6алкокси, трифторметил, трифторэтил, C1-C6алкил с линейной или разветвленной цепью, C2-C6алкенил с линейной или разветвленной цепью, C3-C8циклоалкил, NRCRD, NRCRD(C1-C6алкил с линейной или разветвленной цепью) и NRCRD(C2-C6алкенил с линейной или разветвленной цепью), где каждый из RC и RD независимо выбирают из группы, включающей водород, C1-C6алкил с линейной или разветвленной цепью, C2-C6алкенил с линейной или разветвленной цепью и C3-C8циклоалкил; и если более чем один заместитель представляет собой NRCRD, каждый из RC и RD независимо выбирают из группы, включающей водород, C1-C6алкил с линейной или разветвленной цепью, C2-C6алкенил с линейной или разветвленной цепью и C3-C8циклоалкил; или
(c) гетероциклил, содержащий от 1 до 7 гетероатомов, независимо выбранных из O, N или S; и от 0 до 4 заместителей, независимо выбранных из группы, включающей галоген, галогеналкил, гидроксил, нитро, трифторметил, трифторэтил, C1-C6алкил с линейной или разветвленной цепью, C2-C6алкенил с линейной или разветвленной цепью, C1-C6алкокси, C2-C6алкенилокси, фенил, фенокси, бензилокси, амино, тиокарбонил, циано, имино, NRERF(C1-C6алкил с линейной или разветвленной цепью), NRERF(C2-C6алкенил с линейной или разветвленной цепью)сульфгидрил, тиоалкил, диоксаспироэтил, (C1-C6алкил с линейной или разветвленной цепью)карбонил, (C2-C6алкенил с линейной или разветвленной цепью)карбонил, (C1-C6алкил с линейной или разветвленной цепью)оксикарбонил, (C2-C6алкенил с линейной или разветвленной цепью)оксикарбонил, арилкарбонил, сульфонил, арилсульфонил, арил(C1-C6алкил с линейной или разветвленной цепью), арил(C2-C6алкенил с линейной или разветвленной цепью), арил(C3-C8циклоалкил), (C1-C6алкил с линейной или разветвленной цепью)арил, (C2-C6алкенил с линейной или разветвленной цепью)арил, (C3-C8циклоалкил)арил, арил, гетероциклил, гетероциклил(C1-C6алкил с линейной или разветвленной цепью) и гетероциклил(C2-C6алкенил с линейной или разветвленной цепью), где каждый гетероциклил содержит от 1 до 7 гетероатомов, независимо выбранных из O, N или S, где каждый из RE и RF независимо выбирают из группы, включающей водород, C1-C6алкил с линейной или разветвленной цепью, C2-C6алкенил с линейной или разветвленной цепью и C3-C8циклоалкил; и если более чем один заместитель представляет собой NRERF, каждый из RE и RF независимо выбирают из группы, включающей водород, C1-C6алкил с линейной или разветвленной цепью, C2-C6алкенил с линейной или разветвленной цепью и C3-C8циклоалкил; где каждый из указанных 0-4 заместителей независимо замещен 0-4 дополнительными заместителями, и каждый из указанных дополнительных заместителей независимо выбирают из галогена, C1-C6алкила с линейной или разветвленной цепью, C2-C6алкенила с линейной или разветвленной цепью, C3-C8циклоалкила, C1-C6алкокси, трифторметила, трифторэтила и амино; при условии, что R содержит по меньшей мере один заместитель, если R означает N-пиперидинильную, N-пирролидинильную или N-морфолинильную группу.
В некоторых вариантах осуществления размер каждого кольца всех гетероциклилов формулы (I) независимо составляет 5-7 атомов.
Некоторые варианты осуществления содержат один, два или три атома азота по меньшей мере в одном кольце гетероциклила формулы (I).
В некоторых вариантах осуществления гетероциклил формулы (I) содержит 1-3 кольца. В некоторых вариантах осуществления гетероциклил содержит 1-7 гетероатомов, независимо выбранных из O, N и S. В некоторых вариантах осуществления гетероциклил содержит 1-2 кольца. В некоторых вариантах осуществления гетероциклил содержит одно кольцо. В некоторых вариантах осуществления разные варианты гетероциклила формулы (I) независимо содержат 1-3 кольца. В некоторых вариантах осуществления разные варианты гетероциклила формулы (I) независимо содержат 1-2 кольца. В некоторых вариантах осуществления разные варианты гетероциклила формулы (I) независимо содержат одно кольцо.
В некоторых вариантах осуществления гетероциклил формулы (I) выбирают из группы, включающей пиперидинил, пиперазинил, пиредазинил, дигидропиридил, тетрагидропиридил, пиридинил, пиримидинил, дигидропиримидинил, тетрагидропиримидинил, гексагидропиримидинил, дигидропиразинил, тетрагидропиразинил, пирролидинил, имидазолидинил, пиразолидинил, пирролил, дигидропирролил, имидазолил, дигидроимидазолил, пиразолил, дигидропиразолил, азепанил, [1,2]диазепанил, [1,3]диазепанил, [1,4]диазепанил, индолил, дигидроиндолил, изоиндолил, дигидроизоиндолил, дигидрохинолил, тетрагидрохинолил, дигидроизохинолил и тетрагидроизохинолил; или их подгруппы.
Настоящее изобретение также относится к фармацевтической композиции, содержащей (i) терапевтически активное количество соединения формулы (I) и (ii) фармацевтически приемлемый носитель.
Настоящее изобретение относится к соединениям, которые ингибируют полимеразную активность поли(АДФ-рибоза)полимеразы (PARP) in vitro и/или in vivo, а также композициям, содержащим раскрытые соединения.
Настоящее изобретение относится к способам ингибирования, ограничения и/или подавления полимеразной активности поли(АДФ-рибоза)полимеразы (PARP) in vitro и/или in vivo в растворах, клетках, тканях, органах или системах органов. В одном варианте осуществления настоящее изобретение предлагает местные или системные способы ограничения или ингибирования активности PARP у млекопитающего, такого как человек.
В одном варианте осуществления изобретение относится к способу лечения рака посредством химиосенсибилизации, включающему приведение раковых клеток в контакт с усиливающим цитотоксичность соединением формулы (I), тетраазафенален-3-оном, или его фармацевтически приемлемой солью, а также приведение опухолевых или раковых клеток в контакт с противораковым средством.
Вариант осуществления настоящего изобретения предлагает способ химиосенсибилизации, где, для обеспечения эффективного уровня химиосенсибилизации, нуждающемуся в этом пациенту однократно или многократно вводят первую дозу по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемой соли, и через некоторый промежуток времени указанному пациенту однократно или многократно вводят вторую дозу по меньшей мере одного химиотерапевтического средства.
Аспект настоящего изобретения предлагает фармацевтическую композицию, содержащую соединение формулы (I) в форме, выбранной из группы, состоящей из перечисленных ниже неограничивающих примеров таких химиотерапевтических средств, их фармацевтически приемлемых свободных оснований, солей, гидратов, сложных эфиров, сольватов, стереоизомеров и их смесей. В соответствии с другим аспектом, фармацевтическая композиция дополнительно содержит фармацевтически приемлемый носитель и, необязательно, химиотерапевтическое средство. Следующие варианты осуществления служат только для иллюстрации и не предназначены для какого-либо ограничения объема настоящего изобретения. В одном варианте осуществления фармацевтическая композиция настоящего изобретения содержит соединение настоящего изобретения и фармацевтически приемлемый носитель. В другом варианте осуществления фармацевтическая композиция настоящего изобретения содержит фармацевтически приемлемую соль соединения настоящего изобретения и фармацевтически приемлемый носитель. В следующем варианте осуществления фармацевтическая композиция настоящего изобретения содержит соединение настоящего изобретения, одно или несколько химиотерапевтических средств и фармацевтически приемлемый носитель. В другом варианте осуществления фармацевтическая композиция настоящего изобретения содержит фармацевтически приемлемую соль соединения настоящего изобретения, одно или несколько химиотерапевтических средств и фармацевтически приемлемый носитель. Неограничивающие примеры таких химиотерапевтических средств приведены ниже.
В соответствии с дополнительными аспектами настоящего изобретения химиосенсибилизирующее соединение и химиотерапевтическое средство вводят практически одновременно.
В соответствии с одним аспектом настоящего изобретения химиотерапевтическое средство выбирают из группы, включающей темозоломид, адриамицин, камптотецин, карбоплатин, цисплатин, даунорубицин, доцетаксел, доксорубицин, интерферон-альфа, интерферон-бета, интерферон-гамма, интерлейкин 2, иринотекан, паклитаксел, таксоид, дактиномицин, даунорубицин, 4'-дезоксидоксорубицин, блеомицин, пилкамицин, митомицин, неомицин и гентамицин, этопозид, 4-OH циклофосфамид, координационный комплекс платины, топотекан, терапевтически эффективные аналоги и производные указанных средств, а также их смеси. В соответствии с конкретным аспектом, химиотерапевтическое средство представляет собой темозоломид.
В другом варианте осуществления настоящее изобретение относится к способам лечения последствий рака и/или радиосенсибилизации раковых клеток, с целью повышения чувствительности раковых клеток к лучевой терапии и, следовательно, предотвращения восстановления опухолевых клеток после потенциально летального повреждения ДНК под действием лучевой терапии, включающим введение субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Способ данного варианта осуществления направлен на специфическую и предпочтительную радиосенсибилизацию раковых клеток, в результате чего раковые клетки становятся более чувствительными к лучевой терапии, чем неопухолевые клетки.
Настоящее изобретение также относится к способу лечения рака у субъекта, нуждающегося в этом, который включает введение субъекту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, где раковые клетки имеют дефект репарации расщепленной двухцепочечной ДНК. В одном варианте осуществления дефект репарации расщепленной двухцепочечной ДНК представляет собой дефект гомологичной рекомбинации. В одном варианте осуществления раковые клетки имеют фенотип, выбранный из группы, состоящей из дефекта BRCA-1, дефекта BRCA-2, дефекта BRCA-1 и BRCA-2, и анемии Фанкони.
В другом варианте осуществления настоящее изобретение относится к способам лечения BRCA1/2-ассоциированного рака молочной железы, которые включают введение соединения формулы (I) или его фармацевтически приемлемой соли.
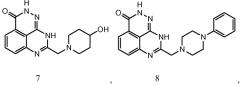
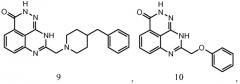
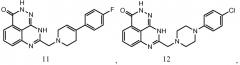
В соответствии с одним вариантом осуществления настоящего изобретения, соединение, предназначенное для использования в способе химиосенсибилизации настоящего изобретения, способе радиосенсибилизации настоящего изобретения или способе лечения рака настоящего изобретения, где раковые клетки имеют дефект репарации расщепленной двухцепочечной ДНК, представляет собой соединение формулы (I) или его фармацевтически приемлемую соль. В другом аспекте соединение выбирают из группы, включающей
и их фармацевтически приемлемые соли.
Настоящее изобретение также относится к способам лечения периферической невропатии, индуцированной химиотерапией. В соответствии с одним аспектом настоящего изобретения, для предотвращения развития симптомов невропатии или уменьшения тяжести таких симптомов, соединения настоящего изобретения вводят до введения по меньшей мере одного химиотерапевтического средства или одновременно с ним. В соответствии с другим аспектом, соединения настоящего изобретения вводят после введения по меньшей мере одного химиотерапевтического средства для лечения симптомов невропатии у пациента или для уменьшения тяжести таких симптомов. В другом аспекте настоящее изобретение относится к способу замедления, отсрочки или прекращения роста раковых клеток у млекопитающего, включающий введение химиотерапевтического средства и дополнительное введение соединения формулы (I) или его фармацевтически приемлемой соли в количестве, достаточном для усиления противораковой активности указанного химиотерапевтического средства.
Специалисты в данной области могут легко определить другие аспекты и преимущества настоящего изобретения из приведенного ниже подробного описания, в котором продемонстрированы и описаны предпочтительные варианты осуществления настоящего изобретения для иллюстрации наилучшего способа осуществления изобретения. При реализации изобретения могут существовать другие и отличные варианты осуществления, и некоторые детали можно модифицировать в разных очевидных аспектах, не отступая от сущности изобретения. Соответственно, описание следует считать иллюстративным, но не ограничивающим.
Краткое описание чертежей
Фиг.1. - Пероральное введение ингибитора PARP-1 соединения 13+TMZ приводит к повышению выживания мышей, несущих модель меланомы B16.
Фиг.2. - Пероральное введение ингибитора PARP-1 соединения 13+TMZ, демонстрирующее повышение выживания моделей внутричерепной глиомы SJGBM.
Фиг.3. - Пероральное введение ингибитора PARP-1 соединения 37+TMZ, демонстрирующее повышение выживания мышей, несущих модель меланомы B16.
Фиг.4. - Пероральное введение ингибитора PARP-1 соединения 37+TMZ, демонстрирующее повышение выживания моделей внутричерепной глиомы SJGBM.
Фиг.5. - Пероральное введение ингибитора PARP-1 соединения 37+облучение, демонстрирующее ингибирование роста опухоли у модели рака головы и шеи.
Фиг.6. - Пероральное введение ингибитора PARP-1 соединения 37, демонстрирующее ингибирование роста мутантных опухолей BRCA1
Настоящее изобретение относится к описанным в данном описании соединениям, их производным и их применению для ингибирования поли(АДФ-рибоза)полимеразы ("PARP"), композициям, содержащим данные соединения, а также способам получения указанных соединений и способам их применения для лечения, профилактики и/или ослабления последствий раковых заболеваний путем усиления цитотоксического действия ионизирующего облучения на опухолевые клетки.
Настоящее изобретение относится к описанным в данном описании соединениям, их производным и их применению для ингибирования поли(АДФ-рибоза)полимеразы ("PARP"), композициям, содержащим данные соединения, а также способам получения указанных соединений и способам их применения для лечения последствий раковых заболеваний путем усиления цитотоксического действия химиотерапевтических средств на опухолевые клетки.
Настоящее изобретение относится к способу химиосенсибилизации при лечении опухолевых и/или раковых клеток, включающему приведение указанных раковых клеток в контакт с соединением формулы (I) и дополнительно приведение указанных раковых клеток в контакт с противораковым средством.
Настоящее изобретение относится к описанным в данном описании соединениям, их производным и их применению для ингибирования поли(АДФ-рибоза)полимеразы ("PARP"), композициям, содержащим данные соединения, а также способам получения указанных соединений и способам их применения для ингибирования роста клеток, имеющих дефекты в пути репарации двухцепочечной ДНК посредством гомологичной рекомбинации (HR).
Соединения и композиции настоящего изобретения можно использовать при лечении рака в присутствии или отсутствии радио- или химиосенсибилизирующих средств. Соединения и композиции предпочтительно используют в отсутствии радио- или химиосенсибилизирующих средств, где рак связан с дефектом в пути репарации двухцепочечной ДНК посредством гомологичной рекомбинации (HR). Такие дефекты включают фенотипы дефектов BRCA-1, дефектов BRCA-2, двойных дефектов BRCA-1/BRCA-2 и анемии Фанкони.
Анемия Фанкони представляет собой генетически гетерогенное заболевание, и пациенты с анемией Фанкони имеют сильно повышенный риск развития ракового заболевания. Одиннадцать белков ассоциированы с анемией Фанкони. FANCA, FANCB, FANCC, FANCE, FANCF, FANCG и FANCM образуют ядерный комплекс. Комплекс взаимодействует с FANCL с включением убихинона FANCD2. Модифицированный FANCD2 необходим для репарации поперечных связей ДНК. FANCd2 накапливается в участках повреждения ДНК и связан с BRCA-1 и BRCA-2.
Примеры раковых заболеваний, которые могут быть связаны с дефектами HR, включают рак молочной железы и рак яичника. Рак молочной железы, который можно лечить с помощью способов настоящего изобретения, включает все типы рака молочной железы, предпочтительно, инвазивный протоковый рак и инвазивный дольковый рак. Рак яичника, который можно лечить с помощью способов настоящего изобретения, включает все типы рака яичника, предпочтительно, эпителиальные опухоли яичника, герминогенные опухоли яичников и стромальные опухоли зародышевых тяжей.
Соединения настоящего изобретения можно синтезировать с использованием исходных веществ и способов, раскрытых в заявке США 10/853714, которая полностью включена в данное описание посредством ссылки.
Как правило, соединения, используемые в композициях настоящего изобретения, такие как соединения формулы (I), ингибируют поли(АДФ-рибоза)полимеразу in vitro с IC50, составляющей примерно 20 мкМ или менее, предпочтительно, менее чем примерно 10 мкМ, более предпочтительно, менее чем примерно 1 мкМ, или, предпочтительно, менее чем примерно 0,1 мкМ, наиболее предпочтительно, менее чем примерно 0,01 мкМ.
Подходящим способом определения IC50 соединения, ингибирующего PARP, является описанный ниже анализ PARP с использованием очищенного рекомбинантного человеческого PARP от Trevigan (Gaithersburg, Md.): ферментный анализ PARP проводят на льду в объеме 100 микролитров, который содержит 100 мМ Tris-HCl (pH 8,0), 1 мМ MgCl2, 28 мМ KCl, 28 мМ NaCl, 3,0 мкг/мл ДНКаза I-активированной ДНК спермы сельди (Sigma, Mo.), 30 микромолярный [3H]никотинамидадениндинуклеотид (62,5 мКи/ммоль), 15 микрограмм/мл фермента PARP и тестируемые соединения в разных концентрациях. Реакцию инициируют путем добавления фермента, затем смесь инкубируют при 25°C. После 2 минут инкубации реакцию останавливают добавлением 500 микролитров охлажденной на льду 30% (масс/об) трихлоруксусной кислоты. Образовавшийся осадок переносят на фильтр из стекловолокна (Packard Unifilter-GF/C) и промывают три раза 70% этанолом. После сушки фильтра определяют радиоактивность путем подсчета сцинтилляций. С помощью описанного анализа ингибирования обнаружено, что соединения настоящего изобретения обладают высокой ферментативной активностью с IC50 в интервале от нескольких наномолей до 20 микромолей.
В данном описании термин "алкил" означает разветвленную или линейную насыщенную углеводородную цепь, содержащую указанное число атомов углерода. Например, если не указано иное, линейный или разветвленный C1-C6алкил представляет собой углеводородную цепь, которая содержит от 1 до 6 атомов углерода, и включает, но без ограничения, такие заместители, как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, н-пентил, н-гексил и т.п. В некоторых вариантах осуществления алкильная цепь представляет собой C1-C6 разветвленную или линейную углеродную цепь. В некоторых вариантах осуществления алкильная цепь представляет собой C2-C5 разветвленную или линейную углеродную цепь. В некоторых вариантах осуществления алкильная цепь представляет собой C1-C4 разветвленную или линейную углеродную цепь. В некоторых вариантах осуществления алкильная цепь представляет собой C2-C4 разветвленную или линейную углеродную цепь. В некоторых вариантах осуществления алкильная цепь представляет собой C3-C5 разветвленную или линейную углеродную цепь. В некоторых вариантах осуществления алкильная цепь представляет собой C1-C2 разветвленную или линейную углеродную цепь. В некоторых вариантах осуществления алкильная цепь представляет собой C2-C3 разветвленную или линейную углеродную цепь.
Термин "алкенил" означает разветвленную или линейную ненасыщенную углеводородную цепь, содержащую указанное число атомов углерода. Например, если не указано иное, линейный или разветвленный C2-C6алкенил представляет собой углеводородную цепь, которая содержит от 2 до 6 атомов углерода и по меньшей мере одну двойную связь, и включает, но без ограничения, такие заместители, как этенил, пропенил, изопропенил, бутенил, изобутенил, трет-бутенил, н-пентенил, н-гексенил и т.п. В некоторых вариантах осуществления алкенильная цепь представляет собой C2-C6 разветвленную или линейную углеродную цепь. В некоторых вариантах осуществления алкенильная цепь представляет собой C2-C5 разветвленную или линейную углеродную цепь. В некоторых вариантах осуществления алкенильная цепь представ