Белково-полипептидный комплекс, обладающий антигипоксическим, тканеспецифическим репаративным действием на центральную и периферическую нервную систему, способ его получения и фармацевтическая композиция на его основе
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии. Описан белково-полипептидный комплекс (БПК), обладающий антигипоксическим, тканеспецифическим репаративным действием на центральную и периферическую нервную систему, получаемый из экстрагированного гомогената нервной ткани эмбрионов копытных сельскохозяйственных животных сроком гестации от середины первой до середины последней трети беременности, способ его получения и фармкомпозиция на его основе. БПК включает тканеспецифические отрицательно заряженные слабокислые, нейтральные белки и полипептиды с молекулярными массами от 0,5 до 200 кДа, причем не менее 70% от общей массы белка имеет молекулярную массу в диапазоне от 20 до 160 кДа. БПК используют в качестве активного действующего компонента в фармацевтических композициях, предназначенных для получения лечебных средств. Изобретения позволяют получать препараты, обладающие высокой биологической активностью и предназначенные для лечения заболеваний центральной и периферической нервной системы, гипоксических состояний, а также используемые в спортивной медицине, медицине катастроф. 3 н. и 2 з.п. ф-лы, 14 ил., 1 табл., 13 пр.
Реферат
Изобретение относится к биологически активной субстанции - белково-полипептидному комплексу (БПК), получаемому из эмбриональной нервной ткани копытных сельскохозяйственных животных, обладающей антигипоксическим, сосудистым и нейропротективным действием, стимулирующим физиологическую и репаративную регенерацию нервной ткани, для применения в производстве лекарственных препаратов при заболеваниях центральной и периферической нервной системы, гипоксических состояниях, в медицине катастроф, спортивной медицине, способу ее получения и фармкомпозиции на его основе.
Принятые сокращения и условные обозначения:
БПК- белково-полипептидный комплекс;
БПНК - белково-полипептидно-нуклеотидный комплекс;
I - ионная сила раствора;
Фармкомпозиция - фармацевтическая композиция.
В настоящее время, на фоне неуклонного роста заболеваний нервной системы сосудистого, травматического, токсического, инфекционного и аутоиммунного генеза, не существует препаратов группы прямых репарантов, специфичных для нервной ткани. Целью данного изобретения явилось создание биологически активной субстанции, обладающей антигипоксическим, тканеспецифическим протективным действием на нервную ткань, путем выделения БПК из нервной ткани эмбрионов копытных сельскохозяйственных животных.
Биологически активная субстанция представляет собой БПК с молекулярной массой входящих в него белково-полипептидных компонентов в пределах от 0,5 до 200 кДа, с содержанием среднемолекулярной фракции в пределах от 20 до 160 кДа не менее 70%, а фармкомпозиция - разбавлением полученного БПК фармацевтически приемлемым буфером с добавлением детергентов, солюбилизаторов, консервантов и равнозначной концентрации нуклеотидных компонентов в виде натриевой соли дезоксирибонуклеиновой кислоты с молекулярной массой входящих в него полинуклеотидов в пределах от 12 до 1000 кДа (12-660 пар оснований), с содержанием среднемолекулярной фракции в пределах от 20 до 500 кДа не менее 80%.
Белково-полипептидный комплекс получен путем ионообменной хроматографии фильтрата надосадочной фракции отцентрифугированного гомогената нервной ткани, в присутствии буферного раствора, детергентов, консервантов и солюбилизаторов из мозга эмбрионов копытных сельскохозяйственных животных сроком гестации от середины первой трети до середины последней трети беременности.
Нуклеотидная фракция БПНК фармкомпозиции получена методом щелочного гидролиза фугата гомогената ткани, оставшегося после получения белково-полипептидной фракции, с последующей очисткой и осаждением целевой фракции этанолом. Полученные фракции объединяются в равноценных концентрационных соотношениях, образуя БПНК с добавлением фармацевтически приемлемого буфера, детергентов, солюбилизаторов и консервантов.
Известен целый ряд биологически активных субстанций и препаратов пептидной, нуклеотидной природы из сырья животного происхождения, обладающих регенеративной и протективной активностью, которые используются для лечения заболеваний нервной системы.
Известен способ получения лечебного средства при заболеваниях, сопровождающихся нарушением функции центральной нервной системы [1], данный способ позволяет получать пептиды и белки с конечной концентрацией до 12 мг/мл и неустановленным разбросом молекулярных масс из эмбрионального мозга животных с помощью длительной (до 30 суток) экстракции и последующим ферментативным протеолизом с удалением образовывающегося осадка на всех этапах выделения. В данном способе полученные белки и полипептиды не охарактеризованы стандартными физико-химическими методами (масса, оптическая плотность, форез и т.д.) белков, а длительная экстракция и ферментативный протеолиз позволяют предполагать низкие цифры молекулярных масс полученных пептидов и достаточно высокий процент примесей в виде липопротеидов и пептидгликанов, что неуклонно ведет к повышению иммуногенности средства.
Известен способ лечения заболеваний центральной нервной системы [2], данный способ предполагает получение экстракта белков и нуклеиновых кислот из ткани мозга эмбрионов человека по стандартной методике с последующей их стерилизацией и лиофилизацией, используя смесь лиофилизата и донорского эмбрионального головного мозга. В данном способе полученные белки и полипептиды не охарактеризованы стандартными физико-химическими методами (масса, оптическая плотность, форез и т.д.), а изначальная лиофилизация ткани изменяет четвертичную и третичную структуру белковых и полипептидных компонентов, что неуклонно ведет к снижению биологической активности и специфичности фармакологического действия полученного экстракта, а также затрудняет его стандартизацию.
Известен способ изготовления биологически активных препаратов из эмбриональных тканей [3], данный способ позволяет получать смесь, не содержащую белков, из низкомолекулярных термостабильных веществ неопределенного состава молекулярной массой менее 10 кДа с содержанием пептидов 1-3 мг/мл и сухим остатком 14-20 мг/мл. Наличие низкомолекулярных термостабильных веществ неопределенного состава не позволяет применение данного препарата парентерально, а присутствие компонентов клеточных стенок и мембран клеточных структур определяет его высокую иммуногенность.
Известна группа изобретений «Лекарственные средства на основе зародыша и способ их получения» [4], данный способ предполагает измельчение и гомогенизацию мягких тканей эмбрионов животных в смеси с физиологическим раствором без четких физико-химических характеристик. Данный способ не позволяет стандартизировать полученную смесь, а отсутствие четких физико-химических характеристик получаемого продукта - применение данного препарата парентерально, из-за присутствия компонентов клеточных стенок и мембран клеточных структур, что определяет его высокую иммуногенность.
Известен способ изготовления биологически активных препаратов на основе эмбриональных тканей [5], который предусматривает гидролиз гомогената от 2 до 42 дней при температуре +4° - +45°С с дальнейшей термообработкой при температуре +60° - +120°С, отделением денатурированных веществ и выделением из гидролизата термостабильного целевого продукта со средней молекулярной массой менее 10 кДа неопределенного состава.
При данном способе изготовления получаемый целевой продукт содержит измененные, денатурированные продукты гидролиза белков и полипептидов с нарушенной четвертичной и третичной структурой, а также продукты распада многих активных молекул, что определяет его невысокую биологическую активность.
Известен способ получения биологически активного препарата из селезенки эмбрионов крупного рогатого скота и фармацевтическая композиция на его основе с иммуномодулирующей, антигипоксической и репаративной активностью [6], данный способ позволяет получить смесь низкомолекулярных пептидов, аминокислот, производных нуклеиновых кислот и других компонентов массой от 5 до 50 кДа из селезенки эмбрионов крупного рогатого скота методом солевой экстракции гомогената 0,9% раствором хлорида натрия с последующей последовательной ультрафильтрацией. В данном способе полученные белки, полипептиды и низкомолекулярные нуклеиновые кислоты не охарактеризованы стандартными физико-химическими методами (оптическая плотность, форез и т.д.), изначальная солевая экстракция физиологическим раствором не позволяет получить большой спектр активных соединений, а достаточно высокий процент примесей в виде липопротеидов и пептидгликанов, что неуклонно ведет к снижению биологической активности и специфичности фармакологического действия полученного препарата, повышению его иммуногенности, а также затрудняет его стандартизацию.
Известен способ получения лекарственного средства из ткани мозга эмбрионов животного и фармацевтическая композиция на его основе [7]. Данный способ позволяет получить смесь пептидов, аминокислот, производных нуклеиновых кислот и других компонентов из мозга эмбрионов животного, выдержанного после предварительного размораживания в течение 24 часов при температуре +10°С, методом двухэтапного экстрагирования гомогената 9% раствором сульфата калия, с последующей стабилизацией метиловым эфиром п-оксибензойной кислоты до концентрации 0,07% и последующей последовательной ультрафильтрацией для получения целевой фракции с молекулярными массами входящих в нее компонентов от 10 до 100 кДа. Длительный временной интервал после размораживания ткани продлевает посмортальный протеолиз, что негативно сказывается на качественном составе экстрагируемых компонентов и неуклонно ведет к потере тканеспецифической биологической активности, а достаточно высокий процент примесей в виде продуктов деградации ткани повышает иммуногенность лекарственного средства и затрудняет его стандартизацию.
Известен способ получения препарата [8], обладающего восстанавливающей активностью при нарушении функции головного мозга, который позволяет выделить из коры головного мозга убойных животных биологически активные полипептиды щелочной природы. Препарат получают путем обработки исходного сырья (ткань, содержащая серое вещество полушарий головного мозга) ацетоном при температуре от -10° до -4°С и соотношении ткани мозга и ацетона 1:5 в течение 18-30 ч, гомогенизации, экстрагирования гомогената 2-4%-ным раствором уксусной кислоты в течение 48-72 ч при рН=3,5-4,5 в присутствии хлористого цинка в концентрации 0,6-1,2 г/л и при соотношении гомогената и раствора уксусной кислоты 1:(8-4), центрифугирования, осаждения биологически активных веществ ацетоном при температуре от -3° до -5°С и соотношении супернатанта и ацетона 1:(7-5) и ионообменной хроматографии полученного осадка на катионите "Биокарб". В результате ионообменной хроматографии получают фракцию, содержащую щелочные полипептиды, которые обладают стимулирующим (или восстанавливающим при снижении активности мозга) действием на клетки коры головного мозга. Описанный способ не позволяет извлечь из коры головного мозга кислые и нейтральные полипептиды и получить биологически активные вещества, обладающие другим действием (например, противосудорожной активностью).
Известен способ получения биологически активных липофильной и гидрофильной фракций плаценты свиной [9, 10], данные способы позволяют получить смесь пептидов, аминокислот, оксикислот методом хлороформно-этанольной и водно-этанольной экстракции с солевым разделением фракций, а также использование хладоновых растворителей для получения липофильной фракции. Данный способ не позволяет получить тканеспецифические для нервной ткани белки и полипептиды, обладая системным действием, а наличие ростовых факторов без факторов дифференцировки и сигнальных тканевых молекул значительно повышает риск неопластических процессов, особенно при отсутствии полинуклиотидов, обладающих выраженным иммуномодулирующим эффектом. Получаемые фракции не имеют четких физико-химических характеристик, а сам способ хлороформно-этанольной и водно-этанольной экстракции и выделения позволяет получить только низкомолекулярные полипептиды и белки с измененной четвертичной и третичной структурой, что неизменно ведет к снижению специфической биологической активности.
Наиболее близким к заявленной группе изобретений по достигаемым результатам и некоторым эффектам биологической активности является известный способ получения биологически активного комплекса, обладающего нейрорегеративным и нейропротективным действием [11]. Данный способ позволяет получить смесь белков и полипептидов из головного мозга эмбрионов сельскохозяйственных животных, взятого на определенной стадии гестации (от начала средней трети до середины последней трети), методом анионообменной хроматографии, используя для нанесения на уравновешенную колонку предварительно отфильтрованный супернатант гомогената ткани с буферным раствором рН 7,2-8,4, целевые фракции получают, разделяя связавшиеся с носителем белки и полипептиды, используя в качестве подвижной фазы 0,05 М ТРИС-глициновый буфер, содержащий 0,1 мМ ЭДТА и 1М NaCl, повышая концентрацию ступенчатым градиентом с шагом 5%. Полученный вышеуказанным способом комплекс подвергают ультрафильтрации на мембране 5 кДа и обессоливают. Характеристику целевой белково-полипептидной фракции проверяют методами ультрафиолетовой спектрометрии, гель-хроматографии, денатурирующего электрофореза в полиакриламидном геле и аминокислотного анализа. Полученный вышеуказанным способом биологически активный комплекс имеет максимум поглощения ультрафиолетового спектра при длине волны 280±5 нм, массу входящих в него белков и полипептидов от 5 до 110 кДа.
Использование при получении данного комплекса на этапе анионообменной хроматографии в составе подвижной фазы 1М NaCl создает слишком высокую ионную силу подвижной фазы, равную 1 моль/л, а включение в состав ЭДТА и ТРИС еще больше ее увеличивает. В связи с этим полученная целевая фракция содержит большое количество кислых высокозаряженных белков и полипептидов, имеющих в клетках мозговой ткани преимущественно мембранную локализацию, в основном выполняющие структурные функции и только в незначительной степени регуляторные, не имеющие не только тканеспецифической, но и выраженной биологической активности. Дальнейшее ступенчатое повышение концентрации соли с шагом 5% еще больше увеличивает присутствие данных белков, увеличивая биологическую инертность смеси, тем самым снижая ее активность и повышая ее аллергенность.
Из уровня техники известны также следующие фармацевтические средства.
Известен иммуномодулятор «Деринат» компании «Техномедсервис» ЗАО ФП (Россия) [12], влияющий на клеточный и гуморальный иммунитет, стимулирующий репаративные процессы и гемопоэз (нормализует количество гранулоцитов, лимфоцитов, тромбоцитов), обладающий противовоспалительным и противоопухолевым действием, нормализующий состояние тканей при дистрофических изменениях сосудистого генеза, оказывающий слабо выраженное антикоагулянтное действие.
Известно средство для лечения геморрагического или ишемического инсультов «Церебролизин» фирмы «Ebewe» (Австрия) [13], который является продуктом обработки мозга интактных свиней.
Известно лечебное средство при заболеваниях, сопровождающихся нарушением функций центральной нервной системы - «Цереброкурин» фирмы ООО «НИР» (Украина) [14], который является продуктом обработки мозга эмбрионов животных.
Известен препарат полипептидной природы, получаемый путем экстракции из коры головного мозга крупного рогатого скота и свиней - «Кортексин» фирмы ООО «Герофарм» (Россия), [15], обладающий ноотропным, церебропротекторным, противосудорожным и антиоксидантным действием.
Известен препарат, повышающий устойчивость ткани головного мозга к интоксикации, гипоксии, гипогликемии, механической травме - «Церебролизат» фирмы «Микроген» НПО ФГУП (Иммунопрепарат) (Россия), [16], обладающий ноотропным действием, представляющий собой гидролизат головного мозга крупного рогатого скота.
Полинуклеотидный состав «Дерината» в виде натриевой соли дезоксирибонуклеиновой кислоты (дезоксирибонуклеат натрия) обозначает системное основное действие препарата как иммуномодулятора, влияющего на клеточный и гуморальный иммунитет. Препарат стимулирует репаративные процессы и гемопоэз (нормализует количество гранулоцитов, лимфоцитов, тромбоцитов), обладает противовоспалительным и противоопухолевым действием, нормализует состояние тканей при дистрофических изменениях сосудистого генеза, оказывает слабо выраженное антикоагулянтное действие. Стимуляция лейкопоэза при лейкопении, вызванной полихимиотерапией или лучевой терапией, наблюдается уже после однократной инъекции. Применение препарата в первые 24 ч после воздействия облучения ускоряет начало и темп восстановления стволовых клеток, а также миелоидного, лимфоидного и тромбоцитарного ростков кроветворения. Препарат активизирует противовирусный, противогрибковый и противомикробный иммунитет, повышает активность фагоцитов в отношении Chlamydiaceae, Staphylococcus aureus, Escherichia coli, Helicobacter pylori. Деринат существенно снижает чувствительность клеток к повреждающему действию цитотоксических препаратов и радиотерапии, что проявляется в снижении кардио- и миелотоксичности у онкологических больных и стабильности терапевтического эффекта при повторных курсах лечения. Препарат обладает неспецифическим репаративным и регенераторным действием. Недостатком известного препарата является низкая специфичность препарата в связи со слабым нейропротективным и регенеративным действием, в том числе и репаративным потенциалом для нервной ткани.
В состав "Церебролизина" входят аминокислоты (~85%), низкомолекулярные пептиды (~15%), микроэлементы, сырьем для получения которых служит мозг свиней. Нейропротективное и трофическое действие препарата осуществляется за счет специфических пептидов и аминокислот, молекулярной массы не выше 10000 Дальтон, из которых доминирующими и определяющими свойства препарата являются аланин, лейцин и лизин. Препарат предназначен для внутримышечного, внутривенного введения и обладает невысокой концентрацией биологически активных компонентов, поэтому вводится в организм больного в значительных дозах длительное время. Недостатком известного препарата является значительная продолжительность курса лечения, низкая активность и специфичность препарата в связи со слабым нейропротективным действием, обладая и крайне низким регенеративным, в том числе и репаративным потенциалом для нервной ткани.
В состав «Цереброкурина» входят водорастворимые пренатальные нейропептиды и продукты расщепления неактивных высокомолекулярных предшественников из гомогенизата мозга эмбрионов животных, который после разбавления физиологическим раствором подвергают взаимодействию с иммобилизованным протеолитическим ферментом, причем режим взаимодействия устанавливают, исходя из контрольной пробы получаемого средства, и полученный раствор выдерживают в течение 30 суток при температуре не выше +10°С. С помощью данной технологии достигается более высокая (по сравнению с Церебролизином) активность получаемого средства и значительно расширяется спектр его действия, за счет более высокой массы содержащихся пептидов и низкомолекулярных белков, оставшихся после протеолиза. Однако, несмотря на длительное формирование раствора до окончания процессов агрегации и протеолиза, данная технология не позволяет получить фракцию необходимой степени очистки для применении препарата внутривенно, что значительно затрудняет его биодоступность. Водная экстракция без буферизации раствора, детергентов, ингибиторов протеолиза и солюбилизантов на начальных этапах получения Цереброкурина, а также неопределенные сроки гестации эмбрионального мозга животных не позволяют обеспечить необходимую степень стандартизации, что допускает значительный разброс по составу полученных эволюционно закрепленных белково-пептидных концентрационных соотношений, снижая его тканеспецифическую нейрорегенеративную активность и стабильность фармакологического действия, ограничиваясь биологическим действием по типу обратной связи за счет сигнальной функции продуктов протеолиза ткани.
В состав «Кортексина» входит комплекс водорастворимых биологически активных щелочных, кислых и нейтральных полипептидов с мол.м. от 0,5 до 15 кДа и изоэлектрической точкой 3,5-9,5, получаемых из измельченной замороженной ткани головного мозга скота, путем экстракции раствором уксусной кислоты, содержащей хлористый цинк, отделения осадка, обработки надосадочной жидкости ацетоном, промывки образовавшегося осадка ацетоном, высушивании с последующей очисткой, стерилизации и лиофилизации целевого продукта. Препарат предназначен для внутримышечного введения и обладает невысокой концентрацией биологически активных низкомолекулярных компонентов, поэтому вводится в организм больного в значительных дозах длительное время. Несмотря на то, что препарат участвует в регуляции соотношений тормозных и возбуждающих аминокислот, концентрации серотонина и дофамина, оказывая ГАМК-позитивное влияние, снижает токсические эффекты нейротропных веществ, улучшает процессы обучения и памяти, ускоряет восстановление функций головного мозга после стрессорных воздействий, Кортексин имеет невысокую активность и специфичность в связи со слабым нейропротективным действием, обладая и низким регенеративным, в том числе незначительным репаративным потенциалом для нервной ткани, что требует значительной продолжительности курсового лечения.
В состав «Церебролизата» также входят водорастворимые полипептиды как результат гидролиза ткани головного мозга крупного рогатого скота, обладающие слабой ферментативной активностью, с молекулярной массой не более 15 кДа. Обозначенная в патенте вариация аминокислотного состава препарата допускает значительный разброс по составу полученных пептидных концентрационных соотношений, определяя низкую тканеспецифическую активность и стабильность фармакологического действия - со слабым нейрометаболическим и невыраженным ноотропным эффектом.
Задачей настоящего изобретения является создание биологически активной субстанции и фармкомпозиции на ее основе, с расширенными свойствам и высокой биологической активностью, обладающей тканеспецифическим репаративно-регенеративным действием на нервную ткань, и разработки способа ее получения, путем выделения биологически активного белково-полипептидного комплекса и полинуклеотидов для создания фармкомозиции из нервной ткани эмбрионов копытных сельскохозяйственных животных, которая решается за счет выбранной совокупности действий и режимов. Особенно важным оказалось определение оптимальных сроков гестации эмбриональной нервной ткани, подбора реагентов, их доз, режимов экстракции, буферизации и регуляции протеолитической активности, для сохранения эффективных концентрационных соотношений белков, полипептидов, закрепленных эволюционно и определяющих биологическую активность комплекса, обеспечивая репаративно-регенеративное тканеспецифическое действие, а также полинуклеотидов для получения фармкомпозиции.
Поставленная задача достигается заявленной группой изобретений при соблюдении всех условий получения БПК и фармкомпозиции.
В заявленную группу изобретений входит белково-полипептидный комплекс, способ его получения из эмбриональной нервной ткани копытных сельскохозяйственных животных на определенных сроках гестации и фармкомпозиция на основе этого белково-полипептидного комплекса.
Таким образом, поставленная задача достигается новым белково-полипептидным комплексом (БПК), обладающим антигипоксическим, тканеспецифическим репаративным действием на центральную и периферическую нервную систему, получаемый из эмбриональной нервной ткани сельскохозяйственных копытных животных сроком гестации от середины первой до середины последней трети беременности, включающий тканеспецифические отрицательно заряженные слабокислые, нейтральные белки и полипептиды, относящиеся к факторам роста, дифференцировки, сигнальным молекулам, определяющим его биологическую и фармакологическую активность, с молекулярными массами от 0,5 до 200 кДа, причем не менее 70% от общей массы белка имеет молекулярную массу в диапазоне от 20 до 160 кДа, имеющих характерный специфический набор полос при денатурирующем гель-электрофорезе («SDS-Page») в 5%-ном полиакриламидном геле по сравнению со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа и максимумом поглощения при длине волны 215±5 нм при снятии ультрафиолетового спектра в области длин волн от 200 до 500 нм.
Поставленная задача достигается также новым способом получения выше охарактеризованного белково-полипептидного комплекса, обладающего антигипоксическим, тканеспецифическим репаративным действием на центральную и периферическую нервную систему, заключающемся в том, что эмбриональную нервную ткань копытных сельскохозяйственных животных сроком гестации от середины первой трети до середины последней трети беременности поэтапно:
- гомогенизируют в буферном растворе, с одновременной экстракцией в присутствии обратимых ингибиторов протеолиза и неионных детергентов при рН не менее 5,2 и не выше 8,5 с последующим центрифугированием при значении g интервале 10000-28000 в течение 90-30 мин;
- полученный супернатант фильтруют;
- фильтрат подвергают анионообменной хроматографии на колонке с анионообменным носителем и разделяя связавшиеся с носителем белки и полипептиды, используя в качестве подвижной фазы буферный раствор, первоначально имеющий ионную силу (I) не выше 0,1 ммоль/л, повышая ее плавно или ступенчато с шагом 0,025 ммоль/л и начиная сбор целевых фракций с ионной силой элюента от 0,125 до 0,15 ммоль/л при рН от 5,2 до 8,5;
- полученные фракции объединяют и подвергают стерилизующей фильтрации.
ЭДТА выполняет одновременно две функции: ингибитора протеолиза и детергента.
С одной стороны, ЭДТА вступает в реакцию, захватывает ионы металлов, тем самым тормозит ферменты, разлагающие белки класса металлопротеинов, выступая в роли ингибиторов протеолиза. Кроме того, в качестве ингибиторов протеолиза можно использовать: гепарин (обратимый ингибитор); апротинин.
Другие виды ингибиторов протеолиза нежелательно использовать, поскольку они применяются в основном для исследований белков, т.к. достаточно токсичны.
С другой стороны, ЭДТА-растворы имеют высокую поверхностную активность, поэтому могут выступать в роли детергента.
Маннит выступает в роли солюбилизатора, препятствуя коагуляции белковых компонентов комплекса.
Общеизвестно, что маннит в пищевой промышленности используется как подсластитель, а также как добавка, препятствующая образованию комков в молочных и других продуктах.
Примером возможных других детергентов и солюбилизаторов являются полисорбаты (твин-80, твин-100).
Кроме того, детергентом является полисорбат-80, солюбилизатором является маннит, кармелоза, а ингибитором протеолиза являются гепарин, гордокс.
Еще одним изобретением заявленной группы является фармацевтическая композиция, обладающая антигипоксическим, иммуномодулирующим, тканеспецифическим репаративным действием на нервную ткань, выполненная в виде раствора, содержащего в качестве активного ингредиента биологически активный белково-полипептидный комплекс по п.1 формулы изобретения в концентрации 0,05-2,0 мг/мл, полученный способом по п.2 формулы изобретения, и полинуклеотидную фракцию в виде натриевой соли дезоксирибонуклеиновой кислоты, проявляющие комплексную с белково-полипептидной фракцией специфическую иммунорегулирующую активность в, по меньшей мере, равноценной концентрации с белково-полипептидным комплексом, и фармацевтически приемлемый разбавитель.
В качестве фармацевтически приемлемого разбавителя фармацевтическая композиция может содержать фармакопейный буферный раствор и, возможно, вспомогательные вещества, включающие высокомолекулярные соединения, стабилизаторы, консерванты и солюбилизаторы.
Фармацевтическая композиция содержит полинуклеотидную фракцию, желательно в виде средне- и низкомолекулярной фракции натриевой соли дезоксирибонуклеиновой кислоты - от 12 до 660 кДа (18-1000 пар оснований), имеющие максимальный УФ-спектр поглощения при длине волны 260±2 нм и минимальный - при 230±2 нм в области длин волн от 190 до 325 нм с отношением D260/280 от 1,6 до 2,0, наличием характерных специфических полос при электрофорезе в 1,8%-ном агарозном геле при окрашивании бромистым этидием, в сравнении со стандартным набором маркеров с диапазоном молекулярных масс от 75 до 7000 пар оснований и синее окрашивание при постановке качественной реакции на рибозу, а также примесью белка, при определении его концентрации по Лоури, не выше 0,18%.
Указанная фармацевтическая композиция предназначена для фармацевтической и косметической промышленности, например для применения парентерально (внутрикожно, подкожно), интраназально или апликационно на слизистые оболочки и кожу.
Ниже приводится краткое описание способа получения комплекса, сам комплекс и фармкомпозиция на его основе.
Итак, белково-полипептидный комплекс получают следующим образом (некоторые операции описаны с указанием детализаций, которые не ограничивают способ):
- нервную ткань эмбрионов копытных сельскохозяйственных животных, сроком гестации от середины первой трети до середины последней трети беременности, размораживают;
- гомогенизируют в буферном растворе, с одновременной экстракцией в присутствии обратимых ингибиторов протеолиза и неионных детергентов при рН не менее 5,2 и не выше 8,5, в соотношениях не менее 1:0,5;
- гомогенат отделяют от балластных веществ фильтрованием через плотную ткань с последующим центрифугированием при значении g интервале 10000-28000 в течение 90-30 мин соответственно, объединяя полученный балластный тканевой материал после фильтрования через плотную ткань и фугат, для получения нуклеотидной фракции фармкомпозиции.
Получение белково-полипептидного комплекса:
- надосадочную жидкость фильтруют через мембранный фильтр с диаметром пор 0,45 мкм;
- фильтрат наносят на уравновешенную хроматографическую колонку с анионообменным носителем, например - Toyopearl DEAE-650M;
- разделение связавшихся с носителем белков производят плавным или ступенчатым градиентом ионной силы раствора, используя в качестве подвижной фазы буферный раствор, имеющий ионную силу не выше 0,1 ммоль/л, повышая ее с шагом 0,025 ммоль/л и начиная сбор целевых фракции с помощью буферного раствора с ионной силой от 0,125 до 0,15 ммоль/л, в интервале рН от 5,2 до 8,5;
- целевые фракции объединяют и подвергают ультрафильтрации на установке при противодавлении не более 8,0 кгс/см2 через материалы с задерживающей способностью выше 200 кДа, разводят буферным раствором, например 0,05М глицин-NaOH рН 7,4, до общей концентрации белка 1,0-2,0 мг/мл;
- полученный раствор подвергают стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,22 мкм и определяют суммарную концентрацию белков.
Все предварительные процессы и процессы получения белково-пептидной фракции желательно производить при температуре от +2° до +8°С.
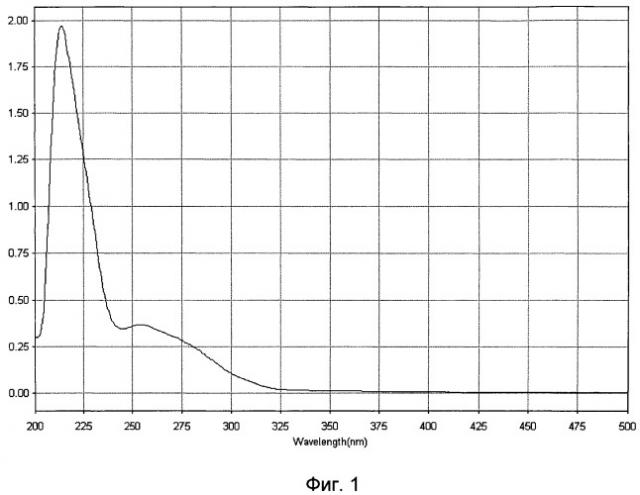
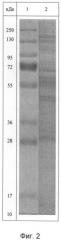
Для идентификации полученного белково-полипептидного комплекса используют методы ультрафиолетовой спектрофотометрии, гель-хроматографии и электрофореза в полиакриламидном геле. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 215±5 нм (фиг.1). Молекулярную массу белков, входящих в препарат, определяют методом денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа (фиг.2). Значение изоэлектрической точки от 4,2 до 8,4. В состав препарата входят белки с молекулярной массой от 0,5 кДа до 200 кДа, из которых не менее 70% имеют молекулярную массу в диапазоне от 20 до 160 кДа.
Получение полинуклеотидной фракции для фармкомпозиции и самой фармкомпозиции:
- объединенный балластный тканевой материал и фугат, оставленный после центрифугирования отфильтрованного гомогената, с помощью миксера ресуспензируют в растворе, содержащем 2,5 мМ ЭДТА и 25 мМ цитрат натрия рН 7,0-8,0, в тех же режимах температур в соотношении не менее 1:1, выдерживая полученную массу в течение 30 минут;
- на этапе гидролиза к полученной массе добавляют 10 М NaOH из расчета конечной молярной концентрации щелочи не более 2 и, после размешивания, инкубируют в течение 16 часов при +48°С;
- охлажденную до +2°С смесь центрифугируют при ~32000 g и +4°С в течение 40 мин;
- перед переливанием супернатанта с поверхности надосадочной жидкости в центрифужных флаконах с помощью полосок фильтровальной бумаги снимают тонкую масляно-жировую пленку желтого цвета;
- в очищенный объединенный супернатант для повторного гидролиза добавляют 1/10 объема 10М NaOH и инкубируют 5 часов при +48°С;
- полученный дигидролизат охлаждают на ледяной бане (мокрый лед, 0°С), а затем при непрерывном перемешивании и под контролем рН-метра добавляют ледяную уксусную кислоту до показателя рН смеси не выше рН 5,4, наблюдая при этом выпадение белого обильного осадка денатурированных белков;
- смесь центрифугируют при ~32000 g и +4°С в течение 1 часа;
- к полученному супернатанту добавили 0,6 объема изопропанола;
- полученную смесь, после инкубации в течение 20 мин при комнатной температуре, центрифугируют при ~32000 g и +20°С в течение 1 часа, формируя осадок ДНК;
- осадок растворяют в 100 мл H2O и добавляют по 1/10 объема 3М ацетата натрия и 3 объема охлажденного до -20°С этанола и хорошо перемешивают;
- полученную суспензию центрифугируют при ~32000 g и +4°С в течение 1 часа;
- полученный осадок растворили в 50 мл H2O на магнитной мешалке;
- в конечном растворе после стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,22 мкм и определяют концентрацию полученной полинуклеотидной фракции.
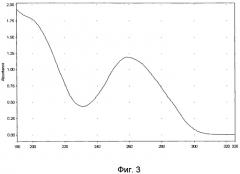
Для идентификации полученной нуклеотидной фракции фармкомпозиции используют методы ультрафиолетовой спектрофотометрии и гель-электрофореза в 1,8% агарозном геле, а также качественные реакции на дезоксирибозу и натрий. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 190 до 325 нм: максимум поглощения отмечается при длине волны 260±2 нм, минимум поглощения - при 230±2 нм (фиг.3). Отношение D260/280 от 1,6 до 2,0. Молекулярную массу нуклеотидов, входящих во фракцию, определяют методом электрофореза в 1,8%-ном агарозном геле, при окрашивании бромистым этидием, в сравнении со стандартным набором маркеров с диапазоном молекулярных масс от 75 до 7000 пар оснований: определяется наличие характерных специфических полос в интервале значений от 12 до 660 кДа (фиг.4). При качественной реакции на рибозу получают синее окрашивание при постановке качественной реакции на рибозу, а также примесью белка при определении его концентрации по Лоури не выше 18%.
Проводят идентификацию полученных белково-пептидного комплекса и нуклеотидной фракции, после чего для получения фармкомпозиции их объединяют как минимум в концентрационно равных соотношениях с расчетом конечной концентрации общего белка и полипептидов в полученном растворе в пределах 0,05-2,0 мг/мл при разбавлении фармацевтически приемлемым буферным раствором, например 50 мМ глицин-фосфатным, содержащим при необходимости вспомогательные вещества, например, с концентрациями 0,5% маннитола, 0,0005% полисорбата-80 и двузамещенного фосфорнокислого натрия до рН не ниже 5,2 и не выше 8,5. Проводят повторную идентификацию смеси и фильтрующую стерилизацию.
Идентификационную характеристику фармкомпозиции (БПНК) проводят методами ультрафиолетовой спектрофотометрии и электрофореза в 1,8% агарозном геле. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 260±2 нм, минимум поглощения - при длине волны 230±2 нм (фиг.5). При электрофорезе в 5%-ном полиакриламидном геле при окрашивании нитратом серебра определяется наличие характерных специфических полос белка и нуклеотидов (фиг.6), а при окрашивании реактивом Кумасси бриллиантовым голубым определяется наличие полос окрашивания, характерных только для белковой фракции (фиг.7).
Таким образом, при выделении БПК важно, чтобы:
- в качестве сырья использовалась эмбриональная нервная ткань копытных сельскохозяйственных животных со сроком гестации от конца первой трети до середины последней трети беременности;
- присутствие в буферном растворе детергентов и солюбилизаторов в достаточных концентрациях;
- на стадиях гомогенизации и анионообменной хроматографии рН буферных сред находился в диапазоне 5,2-8,5;
- при проведении анионообменной хроматографии ионная сила раствора (I) элюента при разделении связавшихся с носителем белков и полипептидов была