Белково-полипептидный комплекс, обладающий тканеспецифическим регенеративно-репаративным и омолаживающим действием на кожную ткань, способ его получения и фармацевтическая композиция на его основе
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии. Описан белково-полипептидный комплекс (БПК), обладающий тканеспецифическим регенеративно-репаративным и омолаживающим действием на кожную ткань, получаемый из экстрагированного гомогената нервной и кожной тканей эмбрионов копытных сельскохозяйственных животных, способ его получения и фармкомпозиция на его основе. БПК включает тканеспецифические отрицательно заряженные слабо кислые, нейтральные белки и полипептиды с молекулярными массами от 0,5 до 200 кДа, причем не менее 70% от общей массы белка имеет молекулярную массу в диапазоне от 20 до 180 кДа. БПК используют в качестве активного действующего компонента в фармацевтических композициях, предназначенных для получения лечебных и косметологических средств. Изобретения позволяют получать препараты, обладающие высокой биологической активностью и предназначенные для лечения аутоиммунных, сосудистых, травматических, токсических заболеваний кожи, а также используемые в эстетической медицине и косметологии. 3 н. и 2 з.п. ф-лы, 14 ил., 11 пр.
Реферат
Изобретение относится к биологической субстанции, получаемой из нервной и кожной тканей эмбрионов копытных сельскохозяйственных животных, предназначенной в качестве биологически активной субстанции, для производства фармацевтических препаратов и косметической продукции, стимулирующей физиологическую и репаративную регенерацию кожи, проявляющуюся уменьшением выраженности признаков ее старения с омолаживающим эффектом и защитой от вредных факторов внешней среды, и способу ее получения.
Принятые сокращения и условные обозначения:
БПК - белково-полипептидный комплекс;
БПНК - белково-полипептидно-нуклеотидный комплекс;
I - ионная сила раствора;
Фармкомпозиция - фармацевтическая композиция.
В настоящее время, на фоне увеличения влияния многочисленных вредных экзогенных и эндогенных факторов (техногенные, экологические и метеорологические катаклизмы, рост количества применяемых синтетических органических соединений, эмоциональный и физический стресс, гормональная дизрегуляция, иммунный сдвиг и т.д.) на барьерную функцию кожи с неуклонным ростом заболеваний кожной ткани аутоиммунного, сосудистого, токсического и травматического генеза, а также ятрогенных осложнений после применения «омолаживающих» препаратов, косметических средств и процедур, очень мало природных активных соединений, поддерживающих и мягко стимулирующих физиологическую регенерацию кожи, не только защищая от вредных воздействий, но и обновляя ее.
Целью данного изобретения явилось создание биологически активной субстанции, обладающей органоспецифическим действием на кожную ткань, стимулирующей ее физиологическую регенерацию, регулирующей клеточные обменные процессы и обладающей омолаживающим эффектом, и фармкомпозиции на его основе в виде белково-полипептидно-полинуклеотидного (БПНК) комплекса.
Биологически активная субстанция представляет собой белково-полипептидный комплекс (БПК) с молекулярной массой входящих в него белково-полипептидных компонентов в пределах от 0,5 до 200 кДа, с содержанием среднемолекулярной фракции в пределах от 20 до 180 кДа не менее 70%, а фармкомпозиция - БПК с фармацевтически приемлемым буферным раствором с добавлением детергентов, солюбилизаторов, консервантов и равнозначной концентрации нуклеотидных компонентов в виде натриевой соли дезоксирибонуклеиновой кислоты с молекулярной массой входящих в него полинуклеотидов в пределах от 12 до 660 кДа (18-1000 пар оснований), с содержанием среднемолекулярной фракции в пределах от 20 до 500 кДа не менее 80%.
БПК получен путем ионообменной хроматографии фильтрата надосадочной фракции отцентрифугированного гомогената ткани, в присутствии буферного раствора, детергентов и солюбилизантов из нервной и кожной тканей эмбрионов копытных сельскохозяйственных животных сроком гестации от середины первой трети до середины последней трети беременности.
Нуклеотидная фракция для фармкомпозиции БПНК получена известным методом щелочного гидролиза фугата гомогената ткани, оставшегося после получения белковой фракции с последующей очисткой и двойным осаждением нуклеотидов сначала изоропанолом, затем этанолом, с центрифугированием и повторным растворением для получения целевой фракции. Полученные фракции объединяются, в необходимых концентрационных соотношениях, образуя фармкомпозицию БПНК с добавлением фармацевтически приемлемого буфера, детергентов, солюбилизаторов и консервантов.
Известен целый ряд препаратов белковой и пептидной природы из сырья животного происхождения, обладающих регенеративно-репаративной активностью, которые используются для лечения заболеваний кожи в эстетической медицине и косметологии.
Известно средство, нормализующее обмен веществ в тканях кожи [1], включающее в себя помимо фракции низкомолекулярных, ассоциированной с белками РНК из ядер и цитоплазмы клеток любых эмбриональных тканей (взяты в качестве примера ткани мозга, печени, тимуса и селезенки поросят в различных соотношениях), пептидную фракцию из гомогената фетальных органов поросят, выделяемую кислым экстрагированием 0,15М HCl с нагреванием на кипящей водяной бане в течение 30 мин, с последующей нейтрализацией щелочью до рН 7,0 и отделением осадка центрифугированием, в результате чего концентрация не охарактеризованных стандартными физико-химическими методами белков достигает 8 мг/мл.
При данном способе изготовления получаемый целевой продукт содержит измененные, денатурированные продукты кислотного и температурного гидролиза белков и полипептидов с нарушенной четвертичной и третичной структурой, а также продукты распада многих активных молекул, что снижает его специфичность и направленность действия и определяет невысокую биологическую активность.
Известен способ получения биологически активного препарата из крови крупного рогатого скота и фармацевтическая композиция на его основе с радиопротекторной, антигипоксической иммуномодулирующей, ранозаживляющей и противогерпетической активностью [2], данный способ позволяет получить депротеинизированный экстракт с помощью последовательной ультрафильтрации с массой компонентов от 10 до 100 кДа. Данный способ позволяет получить депротеинизированный экстракт неустановленного состава, содержащий низкомолекулярные пептиды, аминокислоты, производные нуклеиновых кислот и другие компоненты. Отсутствие белков и полипептидов как класса, представленными в тканях ферментами, факторами роста, дифференцировки и сигнальными молекулами, определяет его невысокую биологическую активность и снижает специфичность действия.
Известен способ получения биологически активных липофильной и гидрофильной фракций плаценты свиной [3], [4]. Способ позволяет получить смесь пептидов, аминокислот, оксикислот методом хлороформно-этанольной и водно-этанольной экстракции с солевым разделением фракций, а также использование хладоновых растворителей для получения липофильной фракции.
Данный способ не позволяет получить тканеспецифические для кожной ткани белки и полипептиды, обладая системным действием, а наличие ростовых факторов без факторов дифференцировки и сигнальных тканевых молекул значительно повышает риск неопластических процессов, особенно при отсутствии полинуклиотидов, обладающих выраженным иммуномодулирующим эффектом. Получаемые фракции не имеют четких физико-химических характеристик, а сам способ хлороформно-этанольной и водно-этанольной экстракции и выделения позволяет получить только низкомолекулярные полипептиды и белки с измененной четвертичной и третичной структурой, что неизменно ведет к снижению специфической биологической активности.
Известен иммуномодулятор «Деринат» компании «Техномедсервис» ЗАО ФП (Россия) [5], влияющий на клеточный и гуморальный иммунитет, стимулирующий репаративные процессы и гемопоэз (нормализует количество гранулоцитов, лимфоцитов, тромбоцитов), обладающий противовоспалительным и противоопухолевым действием, нормализующий состояние тканей при дистрофических изменениях сосудистого генеза, оказывающий слабо выраженное антикоагулянтное действие. Полинуклеотидный состав «Дерината» в виде натриевой соли дезоксирибонуклеиновой кислоты (дезоксирибонуклеат натрия) обозначает системное основное действие препарата, как иммуномодулятора, влияющего на клеточный и гуморальный иммунитет. Препарат стимулирует репаративные процессы и гемопоэз (нормализует количество гранулоцитов, лимфоцитов, тромбоцитов), обладает противовоспалительным и противоопухолевым действием, нормализует состояние тканей при дистрофических изменениях сосудистого генеза, оказывает слабо выраженное антикоагулянтное действие. Стимуляция лейкопоэза при лейкопении, вызванной полихимиотерапией или лучевой терапией, наблюдается уже после однократной инъекции. Применение препарата в первые 24 ч после воздействия облучения ускоряет начало и темп восстановления стволовых клеток, а также миелоидного, лимфоидного и тромбоцитарного ростков кроветворения. Препарат активизирует противовирусный, противогрибковый и противомикробный иммунитет, повышает активность фагоцитов в отношении Chlamydiaceae, Staphylococcus aureus, Escherichia coli, Helicobacter pylori. «Деринат» существенно снижает чувствительность клеток к повреждающему действию цитотоксических препаратов и радиотерапии, что проявляется в снижении кардио- и миелотоксичности у онкологических больных и стабильности терапевтического эффекта при повторных курсах лечения. Препарат обладает неспецифическим репаративным и регенераторным действием. Недостатком известного препарата является низкая специфичность препарата и в связи с этим невысоким регенеративным действием, в том числе и репаративным потенциалом для кожной ткани.
Известно лекарственное средство бионормализующего действия и способ его получения [6], действующим веществом которого является плацентарный экстракт, получаемый методом окислительно-гидролитической модификации раствором хлористой кислоты при соотношении по массе ткань/хлористая кислота 1:(0,1-1,5) и модифицирующими добавками (органические соединения никеля или кобальта), обеспечивающими селективность процесса. Лекарственное средство содержит в своем составе полипептиды в количестве 3,5-7,0 мас.%, аминокислоты в количестве 50-60 мас.%, аминосахариды в количестве 4-5 мас.% и гексуроновые кислоты в количестве 8-9 мас.%, причем указанные продукты находятся в окисленной водорастворимой форме, остальное - полисахариды и неорганические кислоты.
При данном способе получения целевой продукт содержит измененные, денатурированные продукты кислотного гидролиза белков и полипептидов с нарушенной четвертичной и третичной структурой, а также продукты распада многих активных молекул, что снижает его специфичность и направленность действия и определяет невысокую биологическую активность и повышает его иммуногенность.
Известен способ получения биологически активного препарата [7], позволяющий получить экстракт плаценты стельных коров до середины стельности методом гомогенизирования в амниотической жидкости с последующим отделением целевой фракции центрифугированием.
Полученный препарат не содержит тканеспецифических для кожи биологически активных молекул. Полученный данным способом экстракт содержит набор множества биологических веществ, включая гормоны, разнокалиберные белки, жиры, липополисахариды, гликопротеиды и др., что определяет высокую иммуногенность и аллергенность экстракта.
Известен способ получения низкомолекулярной фракции из тканей плаценты свиной [8], позволяющий получать фракции с молекулярными массами 300-350 Да методом криосублимационного фракционирования при температурах в диапазоне (-10°)-(-20°С) и остаточном давлении в камере не выше 0,1 мм рт.ст. в течение 16-20 часов.
Полученная фракция содержит много тканевых составляющих плаценты, что не специфично для кожной ткани, а отсутствие белков, представленными в тканях ферментами, факторами роста, дифференцировки и сигнальными молекулами, определяет ее невысокую биологическую активность.
Известно биологически активное средство, способ его получения и препарат, содержащий указанное средство, и способ использования препарата [9], содержащее в своем составе термостабильные, низкомолекулярные модифицированные компоненты клеточных мембран с антигенной структурой, модифицированной при процессах эмбриогенеза и/или пролиферации, и/или дифференцировки клеток, и/или патологии, предшествовавшей или сопутствовавшей регенерации и/или репарации ткани методом гидролиза отцентрифугированного осадка при гомогенизации модифицированной животной ткани (эмбриональной до середины гестации) с последующей ультрафильтрацией и стерилизацией полученного супернатанта, в качестве препарата используют композицию из препарата, содержащего в своем составе модифицированные компоненты клеточных мембран и наполнитель.
Компоненты клеточных мембран являются сильными иммуногенами, что и определяет биологическую активность данного препарата, не специфически стимулирующего иммунитет. Отсутствие в составе средства биологически активных молекул, представленными в тканях - ферментами, факторами роста, дифференцировки и сигнальными молекулами, определяет невысокую специфическую активность.
Известно средство для биологического омоложения кожи с использованием средства на основе стабилизированной эмульсии перфторуглеродов, позволяющее влиять на обменные процессы в ткани кожи в направлении, противоположном естественным процессам старения [10].
Данное средство позволяет незначительно интенсифицировать синтез структурообразующих компонентов кожной ткани - коллагена, кератина, эластина. Однако для достижения подлинного омолаживающего эффекта необходимо направленное на кожную ткань эпигенетическое воздействие либо на процессы активации теломераз с увеличением интервала Хейфлика, либо на экспрессию факторов, участвующих в перепрограммировании клеток для достижения определенной степени плюрипотентности, что без контроля факторами дифференцировки может привести к развитию неопластических процессов и онкологических заболеваний.
Известен способ биологического омоложения кожи [11], данный способ предлагает внутрикожное и подкожное введение диспергированного биоматериала Аллоплант [12], у которого выявлена способность привлечения и концентрации клеток макрофагального ряда со стимуляцией их созревания, восстанавления кислотно-щелочного баланса кожного покрова за счет нормализации работы потовых и сальных желез со сдвигом обменных процессов в ткани кожи в сторону преобладания процессов, свойственных ткани физиологически более молодого возраста. За счет этого появляется возможность коррекции фиброзных и дегенеративно-дистрофических изменений в тканях (возможность селективного роста тканей на месте имплантированного биоматериала) с усилением обменных процессов, направленных на восстановление фиброархитектоники кожи.
Отсутствие в препарате сбалансированных факторов роста и дифференцировки, специфичных для кожной ткани, не позволяет получить выраженный омолаживающий эффект, а также стимулировать физиологическую и репаративную регенерацию.
Известно косметическое средство для ухода за кожей «Гармония» [13], содержащее экстракт из эмбрионов млекопитающих (человека) и биологически активные добавки природного и химического происхождения (масло герани, масло кориандра, настойку подорожника, экстракт майских листьев березы, экстракт майских листьев черемухи, соки алоэ и чистотела, масло кукурузное, экстракт прополиса, пальмовое масло, облепиховое масло и желток куриного яйца, глицерин, неорганические соли, например, соли Хенкса, двузамещенный фосфат натрия, лимонную кислоту), причем соотношение основы и биологически активных добавок природного и химического происхождения составляет (0,59-5,3):1,0. Экстракт из эмбрионов получают путем гомогенизации и экстракции в солевом растворе, ультрацентрифугированием с последующей фильтрацией надосадочной жидкости.
Получаемый экстракт содержит разномолекулярные фракции не охарактеризованных стандартными физико-химическими методами, водорастворимых денатурированных белков, пептидов, пептидгликанов, липопротеинов, не поддающихся стандартизации, наружное применение которых достаточно иммуногенно с невысоким биологическим эффектом.
Известен способ получения регенерирующего косметического крема для ухода за кожей [14], содержащего наряду с ростовыми факторами, включающими интерлейкин-2, эритропоэтин, эпидермальный фактор роста и лейкоцитарный гормон роста, продукты метаболизма клеток лейкоцитов человека и/или животных при следующем количественном содержании компонентов крема (мас.%): питательная среда с ростовыми факторами и продуктами метаболизма клеток лейкоцитов - 0,7-8,5; биологически активные вещества природного и химического происхождения - 7,0-27,0, полученные из питательной среды, в которой инкубировались клетки человека и/или животных (например, лейкоциты), в присутствии осматотропина. Данная композиция не содержит цитоплазматических, ядерных и мембранных белков и полипептидов, играющих важную сигнальную роль в механизмах регенерации и репарации клеток, концентрация выделенных этими клетками факторов роста и гормонов является не оптимальной, а является продуктом их жизнедеятельности и метаболизма, что значительно снижает биологическую активность композиции, вторично стимулируя физиологическую регенерацию и незначительно репарацию тканей, не имея в составе тканеспецифических факторов для кожи.
Известна композиция по уходу за кожей, содержащая следующие компоненты: ретиноид, выбранный из группы, состоящей из спиртовой формы витамина А, альдегидной формы витамина А, ретинилацетата, ретинилпальмитата и их смесей, масляную фазу, имеющую низкий уровень ненасыщенности, и стабилизирующую систему, выбранную из группы, состоящей по крайней мере из по меньшей мере одного антиоксиданта, растворимого в масле, хилатообразователя, экстракта солодки, гидрохинона, коиэвой кислоты, готулина А, микромерола, глютатиона, L-аскорбил-2 фосфата магния, арбутина, экстракта плаценты и их смесей [15].
Однако известная композиция при длительном применении может вызывать гипертензионнный синдром, не обладает достаточным регенерирующим и омолаживающим эффектом.
Известно косметическое средство для ухода за кожей на основе развивающихся эмбрионов млекопитающих, содержащее основу в виде геля и компоненты на основе экстракта развивающихся эмбрионов (зародышей) млекопитающих, например крупного рогатого скота [16]. Для экстрагирования используют не весь эмбрион животного, а только его зобную железу. Состав содержит (10-30)% экстракта эмбриона животного и (90-70)% основы в виде геля. Препарат наносят на кожу лица и тела для омоложения клеток кожи, защиты от морщин, повышения сопротивляемости кожи и замедления старения тканей.
Однако данное косметическое средство оказывает системную гормональную активность воздействием на весь организм, что имеет противопоказания к применению, а также недостаточную эффективность регенерирующего действия на кожу, не имея в составе тканеспецифических факторов роста и факторов, связанных с предотвращением увядания и старения кожи, сохранением и увеличением ее эластичности и поддержанием хорошего состояния в течение длительного времени.
Наиболее близким к заявленной группе, в том числе и к способу получения белковой фракции, является способ получения биологически активного комплекса, обладающего нейрорегенеративным и нейропротективным действием [17]. Данный способ позволяет получить смесь белков и полипептидов из головного мозга эмбрионов сельскохозяйственных животных, взятого на определенной стадии гестации (от начала средней трети до середины последней трети), методом анионообменной хроматографии, используя для нанесения на уравновешенную колонку предварительно отфильтрованный супернатант гомогената ткани с буферным раствором рН 7,2-8,4, целевые фракции получают, разделяя связавшиеся с носителем белки и полипептиды, используя в качестве подвижной фазы 0,05М ТРИС-глициновый буфер, содержащий 0,1 мМ ЭДТА и 1М NaCl, повышая концентрацию ступенчатым градиентом с шагом 5%. Полученный вышеуказанным способом комплекс подвергают ультрафильтрации на мембране 5 кДа и обессоливают. Характеристику целевой белково-полипептидной фракции проверяют методами ультрафиолетовой спектрометрии, гель-хроматографии, денатурирующего электрофореза в полиакриламидном геле и аминокислотного анализа. Полученный вышеуказанным способом биологически активный комплекс имеет максимум поглощения ультрафиолетового спектра при длине волны 280±5 нм и содержанием входящих в него белков от 5 до 110 кДа не менее 95% от общего содержания белков.
Использование при получении данного комплекса на этапе анионообменной хроматографии в составе подвижной фазы 1М NaCl создает слишком высокую ионную силу подвижной фазы, равную 1 моль/л, а включение в состав элюента - ЭДТА и ТРИС еще больше ее увеличивает. В связи с этим, полученная целевая фракция содержит большое количество кислых высокозаряженных белков и полипептидов, имеющих в клетках мозговой ткани преимущественно мембранную локализацию, выполняющие в основном структурные функции и только в незначительной степени регуляторные, не имеющие, не только тканеспецифической, но и выраженной биологической активности. Дальнейшее ступенчатое повышение концентрации соли с шагом 5% еще больше увеличивает присутствие данных белков, увеличивая биологическую инертность смеси, тем самым снижая ее активность. Использование при получении данного комплекса в качестве сырья эмбриональный головной мозг обуславливает наличие тканеспецифических белков, регулирующих физиологические и репаративные процессы преимущественно нервной ткани, оказывая невыраженное системное действие, поэтому спектр биологической активности в большей степени направлен на коррекцию и лечение нарушенных функций и заболевания нервной системы.
Основной, поставленной перед авторами задачей является получение биологически активного комплекса, стимулирующего физиологическую и репаративную регенерацию кожной ткани для лечения заболеваний и травматических поражений кожи, а также фармкомпозиции для применения в производстве лекарственных препаратов в эстетической медицине и косметологии, влияя на процессы старения и омоложения кожной ткани, отвечающих современным международным требованиям безопасности, предъявляемым к фармацевтическим препаратам и лечебной, лечебно-профилактической и профилактической косметической продукции.
Задачей настоящего изобретения является создание биологически активной субстанции и фармкомпозиции на ее основе, с расширенными свойствами и высокой биологической активностью, обладающей тканеспецифическим репаративно-регенеративным действием на кожную ткань для лечения заболеваний и травматических поражений кожи, применения в производстве лекарственных препаратов в эстетической медицине и косметологии, влияя на процессы старения и омоложения кожной ткани, и разработки способа ее получения, путем выделения биологически активного белково-полипептидного комплекса и полинуклеотидов для создания фармкомозиции из нервной и кожной тканей эмбрионов копытных сельскохозяйственных животных, которая решается за счет выбранной совокупности действий и режимов. Особенно важным оказалось определение оптимальных сроков гестации нервной и кожной тканей, подбора реагентов, их доз, режимов экстракции, буферизации, для сохранения эффективных концентрационных соотношений белков, полипептидов, эволюционно закрепленных в онтогенезе и определяющих биологическую активность комплекса, обеспечивая репаративно-регенеративное тканеспецифическое действие.
Поставленная задача достигается заявленной группой изобретений.
В заявленную группу изобретений входит белково-полипептидный комплекс, способ его получения из эмбриональных нервной и кожной тканей копытных сельскохозяйственных животных на определенных сроках гестации и фармкомпозиция на основе этого белково-полипептидного комплекса.
Таким образом, поставленная задача достигается новым белково-полипептидным комплексом (БПК), обладающим антигипоксическим, тканеспецифическим репаративным действием на центральную и периферическую нервную систему, получаемым из эмбриональной нервной и кожной ткани сельскохозяйственных копытных животных сроком гестации от середины первой до середины последней трети беременности, включающим тканеспецифические отрицательно заряженные слабо кислые, нейтральные белки и полипептиды, относящиеся к факторам роста, дифференцировки, сигнальным молекулам, определяющим его биологическую и фармакологическую активность, с молекулярными массами от 0,5 до 200 кДа, причем не менее 70% от общей массы белка имеет молекулярную массу в диапазоне от 20 до 180 кДа, имеющих характерный специфический набор полос при денатурирующем гель-электрофорезе («SDS-Раде») в 5%-ном полиакриламидном геле по сравнению со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа и максимумом поглощения при длине волны 215±5 нм при снятии ультрафиолетового спектра в области длин волн от 200 до 500 нм.
Поставленная задача достигается также новым способом получения выше охарактеризованного БПК, обладающего антигипоксическим, тканеспецифическим репаративным действием на центральную и периферическую нервную систему, заключающимся в том, что эмбриональная нервная и кожная ткани копытных сельскохозяйственных животных сроком гестации от середины первой трети до середины последней трети беременности поэтапно:
- гомогенизируют в буферном растворе, с одновременной экстракцией в присутствии обратимых ингибиторов протеолиза и неионных детергентов при рН не менее 5,2 и не выше 8,5 с последующим центрифугированием при значении g в интервале 10000-28000 в течение 90-30 мин;
- полученный супернатант фильтруют;
- фильтрат подвергают анионообменной хроматографии с разделением связавшихся белков с использованием элюента, имеющего ионную силу в интервале от 0,14 до 0,21 ммоль/л при рН в интервале от 5,2 до 8,5, начиная сбор целевых фракций подвижной фазой при значении ионной силы 0,175 ммоль/л, увеличивая ее постепенно или ступенчато с шагом 0,035 ммоль/л до значения ионной силы 0,21 ммоль/л, полученные фракции объединяют и подвергают стерилизующей фильтрации.
ЭДТА выполняет одновременно две функции: ингибитора протеолиза и детергента.
С одной стороны, ЭДТА вступает в реакцию, захватывает ионы металлов, тем самым тормозит ферменты, разлагающие белки класса металлопротеинов, выступая в роли ингибиторов протеолиза. Кроме того, в качестве ингибиторов протеолиза можно использовать: гепарин (обратимый ингибитор); апротинин.
Другие виды ингибиторов протеолиза нежелательно использовать, поскольку они применяются в основном для исследований белков, т.к. достаточно токсичны.
С другой стороны, ЭДТА - растворы имеют высокую поверхностную активность, поэтому могут выступать в роли детергента.
Маннит - выступает в роли солюбилизатора, препятствуя коагуляции белковых компонентов комплекса.
Общеизвестно, что маннит в пищевой промышленности используется как подсластитель, а также как добавка, препятствующая образованию комков в молочных и других продуктах.
Примером возможных других детергентов и солюбилизаторов являются полисорбаты (твин-80, твин-100).
Кроме того, детергентом является полисорбат - 80, солюбилизатором является маннит, кармелоза, а ингибитором протеолиза являются гепарин, гордокс.
Еще одним изобретением заявленной группы является фармацевтическая композиция, обладающая тканеспецифическим регенеративно-репаративным действием на кожную ткань, для лекарственных средств, предназначенных для лечения аутоиммунных, сосудистых, травматических, токсических заболеваний кожи, а также в эстетической медицине и косметологии, выполненная в виде раствора и содержащая в качестве активного инградиента белково-полипептидный комплекс по п.2 в концентрации 0,01-2,0 мг/мл, полученный способом по п.1, полинуклеотиды в виде натриевой соли дезоксирибонуклеиновой кислоты, проявляющие комплексную с белково-полипептидным комплексом специфическую иммунорегулирующую активность в, по меньшей мере, равноценной концентрации, и фармацевтически приемлемый разбавитель.
В качестве фармацевтически приемлемого разбавителя фармацевтическая композиция может содержать фармакопейный буферный раствор и, возможно, вспомогательные вещества, включающие высокомолекулярные соединения, стабилизаторы, консерванты и солюбилизаторы.
Фармацевтическая композиция может содержать в качестве полинуклеотидных компонентов полинуклеотиды в виде средне- и низкомолекулярной фракции натриевой соли дезоксирибонуклеиновой кислоты, например, с диапазоном молекулярных масс от 12 до 660 кДа (18-1000 пар оснований), имеющие максимальный УФ-спектр поглощения при длине волны 260±2 нм и минимальный - при 230±2 нм в области длин волн от 190 до 325 нм с отношением D260/280 от 1,6 до 2,0, наличием характерных специфических полос при электрофорезе в 1,8%-ном агарозном геле при окрашивании бромистым этидием, в сравнении со стандартным набором маркеров с диапазоном молекулярных масс от 75 до 7000 пар оснований и синее окрашивание при постановке качественной реакции на рибозу, а также примесью белка, при определении его концентрации по Лоури, не выше 0,4 мг/мл (0,17%).
Указанная фармацевтическая композиция предназначена, в частности, для наружного, парентерального - внутрикожного, подкожного применения, а также апликационно на кожу и слизистые оболочки.
Ниже приводится краткое описание способа получения комплекса, сам комплекс и фармкомпзиция на его основе.
Итак, белково-полипептидный комплекс получают следующим образом (некоторые операции описаны с указанием детализаций, которые не ограничивают способ):
- эмбриональную нервную и кожную ткани копытных сельскохозяйственных животных, сроком гестации от середины первой трети до середины последней трети беременности, размораживают;
- гомогенизируют в буферном растворе, с одновременной экстракцией в присутствии обратимых ингибиторов протеолиза и неионных детергентов при рН не менее 5,2 и не выше 8,5, в соотношениях не менее 1:0,5;
- гомогенат отделяют от балластных веществ фильтрованием через плотную ткань с последующим центрифугированием при значении g в интервале 10000-28000 в течение 90-30 мин, соответственно, объединяя полученный балластный тканевой материал после фильтрования через плотную ткань и фугат, для получения нуклеотидной фракции фармкомпозиции.
Получение белково-полипептидного комплекса:
- надосадочную жидкость фильтруют через мембранный фильтр с диаметром пор 0,45 мкм;
- фильтрат наносят на уравновешенную хроматографическую колонку с анионообменным носителем, например - Toyopearl DEAE-650M;
- разделение связавшихся с носителем белков производят ступенчатым градиентом ионной силы раствора, используя в качестве подвижной фазы буферный раствор, имеющий ионную силу не выше 0,14 ммоль/л, повышая ее с шагом 0,035 ммоль/л, начиная сбор целевых фракций с помощью буферного раствора с ионной силой от 0,175 до 0,21 ммоль/л, в интервале рН от 5,2 до 8,5;
- целевые фракции объединяют и разводят буферным раствором, например 0,05М глицин-NaOH рН 7,4 до общей концентрации белка 1,0-2,0 мг/мл;
- полученный раствор подвергают стерилизующей фильтрации, через мембранный фильтр с диаметром пор не более 0,22 мкм и определяют суммарную концентрацию белков.
Все предварительные процессы и процессы получения белково-пептидной фракции желательно производить при температуре от +2° до +8°С.
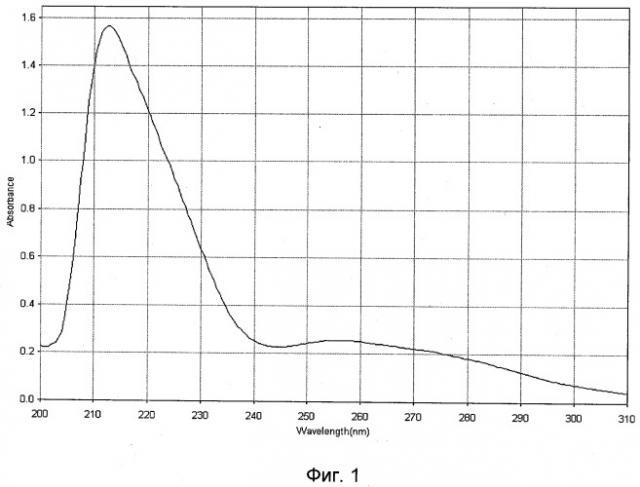
Для идентификации полученного белково-полипептидного комплекса используют методы ультрафиолетовой спектрофотометрии, гель-хроматографии и электрофореза в полиакриламидном геле. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 215±5 нм (фиг.1). Молекулярную массу белков, входящих в препарат, определяют методом денатурирующего гель-электрофореза («SDS-Page») в 5%-ном полиакриламидном геле в сравнении со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 кДа до 250 кДа (фиг.2). Значение изоэлектрической точки от 4,2 до 8,4. В состав препарата входят белки с молекулярной массой от 0,5 кДа до 200 кДа, из которых не менее 70% имеют молекулярную массу в диапазоне от 20 до 180 кДа.
Получение полинуклеотидной фракции для фармкомпозииии и самой фармкомпозиции:
- объединенный балластный тканевой материал и фугат, оставленный после центрифугирования отфильтрованного гомогената, с помощью миксера ресуспензируют в растворе, содержащем 2,5 мМ ЭДТА и 25 мМ цитрата натрия рН 7,0-8,0, в тех же режимах температур в соотношении не менее 1:1, выдерживая полученную массу в течение 30 минут;
- на этапе гидролиза к полученной массе добавляют 10М NaOH из расчета конечной молярной концентрации щелочи не более 2 и, после размешивания, инкубируют в течение 16 часов при +48°С;
- охлажденную до +2°С смесь центрифугируют при ~32000 g и +4°С в течение 40 мин;
- перед переливанием супернатанта с поверхности надосадочной жидкости в центрифужных флаконах с помощью полосок фильтровальной бумаги снимают тонкую масляно-жировую пленку желтого цвета;
- в очищенный объединенный супернатант для повторного гидролиза добавляют 1/10 объема 10М NaOH и инкубируют 5 часов при +48°С;
- полученный дигидролизат охлаждают на ледяной бане (мокрый лед, 0°С), а затем при непрерывном перемешивании и под контролем рН-метра добавляют ледяную уксусную кислоту до показателя рН смеси не выше рН 5,4, наблюдая при этом выпадение белого обильного осадка денатурированных белков;
- смесь центрифугируют при ~32000 g и +4°С в течение 1 часа;
- к полученному супернатанту добавили 0,6 объема изопропанола;
- полученную смесь, после инкубации в течение 20 мин при комнатной температуре, центрифугируют при ~32000 g и +20°С в течение 1 часа, формируя осадок ДНК;
- осадок растворяют в 100 мл Н2О и добавляют по 1/10 объема 3М ацетата натрия и 3 объема охлажденного до -20°С этанола и хорошо перемешивают;
- полученную суспензию центрифугируют при ~32000 g и +4°С в течение 1 часа;
- полученный осадок растворили в 50 мл Н2О на магнитной мешалке;
- в конечном растворе после стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,22 мкм и определяют концентрацию полученной полинуклеотидной фракции.
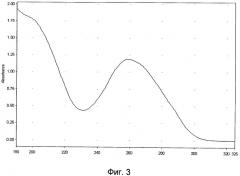
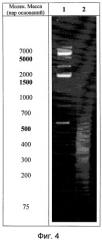
Для идентификации полученной нуклеотидной фракции фармкомпозиции используют методы ультрафиолетовой спектрофотометрии и гель-электрофореза в 1,8% агарозном геле, а также качественные реакции на дезоксирибозу и натрий. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 190 до 325 нм: максимум поглощения отмечается при длине волны 260±2 нм, минимум поглощения - при 230±2 нм (фиг.3). Отношение D260/280 от 1,6 до 2,0. Молекулярную массу нуклеотидов, входящих во фракцию, определяют методом электрофореза в 1,8%-ном агарозном геле, при окрашивании бромистым этидием, в сравнении со стандартным набором маркеров с диапазоном молекулярных масс от 75 до 7000 пар оснований: определяется наличие характерных специфических полос в интервале значений от 12 до 660 кДа (фиг.4). При качественной реакции на рибозу получают синее окрашивание при постановке качественной реакции на рибозу, а также примесью белка при определении его концентрации по Лоури не выше 18%.
Проводят идентификацию полученных белково-пептидного комплекса и нуклеотидной фракции, после чего, для получения фармкомпозиции их объединяют, как минимум в концентрационно равных соотношениях с расчетом конечной концентрации общего белка и полипептидов в полученном растворе в пределах 0,05-2,0 мг/мл при разбавлении фармацевтически приемлемым буферным раствором, например 50 мМ глицин-фосфатным, содержащим при необходимости вспомогательные вещества, например, с концентрациями 0,5% маннитола, 0,0005% полисорбата-80 и двузамещенного фосфорнокислого натрия до рН не ниже 5,2 и не выше 8,5. Проводят повторную идентификацию смеси и фильтрующую стерилизацию.
Идентификационную характеристику фармкомпозиции (БПНК) проводят методами ультрафиолетовой спектрофотометрии и электрофореза в 1,8% агарозном геле. Ультрафиолетовый спектр раствора препарата снимают в области длин волн от 200 до 500 нм: максимум поглощения отмечается при длине волны 260±2 нм, минимум поглощения - при длине волны 230±2 нм (фиг.5). При электрофорезе в 5%-ном полиакриламидном геле при окрашивании нитратом серебра определяется наличие характерных специфических полос белка и нуклеотидов (фиг.6), а при окрашивании реактивом Кумасси бриллиантовым голубым определяется наличие полос окрашивания, характерных только для белковой фракции (фиг.7).
Таким образом, при выделении БПК важно, чтобы:
- в качестве сырья использовались эмбриональные кожная и нервная ткани копытных сельскохозяйственных живот