Способ извлечения никеля (ii) из водных кислых растворов, содержащих другие металлы
Иллюстрации
Показать всеИзобретение относится к извлечению никеля экстракцией из водных кислых растворов в присутствии железа или цветных металлов. В качестве экстрагента используют гидразиды на основе синтетических α-разветвленных третичных карбоновых кислот общей формулы CH3R1R2CC(O)NHNH2, где R1 и R2 - алкильные радикалы, а сумма атомов углерода равна 10-19. При этом при экстракции экстрагент берут в виде 0,2-0,4 моль/л раствора в смеси углеводородного растворителя с 10 об.% 2-этилгексанола. Техническим результатом является высокая степень и селективность извлечения никеля (II) в присутствии железа (III), кобальта (II) или цинка (II). 5 з.п. ф-лы, 2 ил., 9 табл., 10 пр.
Реферат
Изобретение относится к гидрометаллургии цветных металлов и может быть использовано при переработке растворов выщелачивания окисленных никелевых руд, океанических конкреций, никелевого файнштейна и другого сырья при извлечении и отделении никеля от железа, кобальта или цинка.
Необходимость создания настоящего изобретения вызвана сложностью существующих методов извлечения никеля из кислых сульфатных и хлоридных растворов, содержащих примеси железа, кобальта или цинка.
Известен способ разделения никеля и кобальта смесями монокарбоновых кислот и нехелатирующих оксимов [Preston J.S. Solvent Extraction of Nickel and Cobalt by Mixtures of Carboxilic Acids and Nonchelating Oximes. // Hydrometallurgy. №11, 1983, p.p.105-124]. По этому способу извлечение никеля из растворов и отделение его от кобальта осуществляют эквимолярными смесями монокарбоновых кислот (в частности, n-октановой кислотой, n-декановой кислотой, Versatic 6 и 10) и нехелатирующих оксимов (гептанальоксим, октанальоксим и др.). Эффективное извлечение никеля реализуется при pH>4,5. Недостатками способа является высокое значение pH, при котором осуществляется процесс, в результате чего необходимо использовать дорогостоящий нейтрализатор (NaOH, Na2CO3, NH4OH и др.). Кроме того, имеет место низкая устойчивость оксимов к гидролизу, особенно в кислых средах.
По другому способу очистку кобальтовых растворов от никеля из кислых растворов осуществляют экстракцией никеля диалкилдитиофосфорной кислотой (ДТФК) в смесях с азот- и кислородсодержащими электронодонорными соединениями, например, алкиламинами, высшими спиртами, окисями аминов и так далее. Недостатками способа являются медленная экстракция никеля (от 30 мин до 1 ч), а также низкая устойчивость диалкилдитиофосфорной кислоты к реакциям гидролиза и окисления. Так, в присутствии кислорода воздуха ДТФК окисляется до дисульфида [Холькин А.И., Гиндин Л.М., Новоселов Р.И., Флейтлих И.Ю. и др. Очистка кобальтовых растворов от никеля экстракцией диалкилдитиофосфорной кислотой. // Тезисы VI Всесоюзной конференции по химии экстракции, ч.II, Кемерово, 1981. - С.197].
Известен способ извлечения меди(II) и никеля(II) из кислых или щелочных растворов гидразидами карбоновых кислот или их солями, в том числе гидразидами высших изомерных кислот С10-C25 [Авт. свид. СССР №1136485, МКИ С22В 3/00. Способ извлечения цветных металлов из кислых или щелочных растворов экстракцией. Опубл. 15.06.92, БИ №22]. Недостатками применяемых в этом способе гидразидов карбоновых кислот является то, что экстракция никеля(II) осуществляется при pH≥6,6, то есть выше pH гидролиза железа(III).
Ближайшим аналогом, взятым за прототип, является способ экстракции никеля из сернокислых и хлороводородных сред 0,10-0,19 моль/л растворами гидразидов нафтеновых кислот (ГНК) (м.м. 272 и 258) в смеси 2-этилгексанол - керосин и алкилфенол - керосин в присутствии железа(III), кобальта(II), цинка(II) [Радушев А.В., Гусев В.Ю., Богомазова Г.С. Экстракция меди(II) и никеля(II) из кислых растворов гидразидами нафтеновых кислот.// Современные проблемы химии и технологии экстракции. Т.2. / Отв. ред. Холькин А.И. и Юртов Е.В. - М.: 1999. - С.189-194].
Недостатками способа являются:
- плохая совместимость экстрагентов (0,1-0,2 моль/л) с органическими растворителями, что вызывает эмульгирование водной фазы, большой унос (потери) реагента, необходимость использования до 25-40 об.% модификатора;
- низкая устойчивость к гидролизу в кислых средах;
- невысокие коэффициенты разделения пар элементов βNi/Co, βNi/Fe и степень извлечения никеля(II) в области pH 1-2.
Задачей изобретения является разработка способа извлечения никеля из водных кислых растворов с использованием экстрагента, хорошо совместимого с углеводородными растворителями с добавлением модификатора (2-этилгексанола), уменьшение потерь с водной фазой, повышение устойчивости экстрагента к гидролизу и селективности извлечения никеля в присутствии железа(III) или кобальта(II) или цинка(II).
Для решения поставленной задачи предлагается:
1. Способ извлечения никеля(II) из водных кислых растворов, содержащих другие металлы, отличающийся тем, что в качестве экстрагента используют гидразиды на основе синтетических α-разветвленных третичных карбоновых кислот общей формулы (I):
,
где R1 и R2 - алкильные радикалы; сумма атомов углерода в формуле (I) равна 10-19, при этом экстракцию осуществляют раствором 0,2-0,4 моль/л гидразида в углеводородном растворителе с добавлением 10 об.% 2-этилгексанола.
2. Способ по п.1, отличающийся тем, что используют гидразиды формулы (I) с суммой атомов углерода 15-19.
3. Способ по п.1, отличающийся тем, что при извлечении никеля(II) экстракцию осуществляют в водных кислых растворах при pH 0,5-5.
4. Способ по п.1, отличающийся тем, что водный кислый раствор содержит железо(III), а экстракцию осуществляют при pH 0,8-1,5 с разделением никеля(II) и железа(III).
5. Способ по п.1, отличающийся тем, что водный кислый раствор содержит кобальт(II), а экстракцию осуществляют при pH 0,5-4 с разделением никеля(II) и кобальта(II).
6. Способ по п.1, отличающийся тем, что водный кислый раствор содержит цинк(II), а экстракцию осуществляют при pH 0,7-5 с разделением никеля(II) и цинка(II).
Гидразидная функциональная группа (C(O)NHNH2) образует с ионами цветных металлов прочные внутрикомплексные соединения. При достаточно длинном углеводородном радикале в молекуле гидразида эти комплексы растворимы в органических растворителях, что дает возможность использовать гидразиды для экстракционного разделения цветных металлов. Сульфатные или хлороводородные растворы, содержащие катионы никеля(II) и железа(III) или никеля(II) и кобальта(II) или никеля(II) и цинка(II), перемешивают с 0,2-0,4 моль/л растворами соединений общей формулы(I) в керосине с добавлением 10 об.% 2-этилгексанола. При добавлении 2-этилгексанола в количестве менее 10 об.%., расслаивание фаз достигается более чем за 15 мин, добавление же более 10 об.% 2-этилгексанола нецелесообразно, так как увеличиваются потери растворителя с водной фазой. При содержании экстрагента в количестве менее 0,2 моль/л снижается емкость органической фазы до 3 г/л никеля и ниже, а при содержании более 0,4 моль/л экстрагента возрастает вязкость органической фазы.
В кислых растворах гидразиды карбоновых кислот образуют с ионами цветных металлов катионные комплексы [Коган В.А., Зеленцов В.В., Гэрбэлэу Н.В., Луков В.В. Современные представления о строении координационных соединений переходных металлов с органическими производными гидразина. // Журнал неорганической химии. - 1986, - Т.31. - №11. - С.2831-2843]. Поэтому их экстракцию в кислой среде можно представить уравнениями (1) и (2):
здесь индексы "в" и "о" обозначают водную и органическую фазы соответственно, HL - молекула гидразида в нейтральной форме, а n при экстракции обычно равно 3. При концентрации H2SO4=0,5-2 моль/л и до pH 5 или pH 0,5-5 в среде HCl ионы никеля(II), железа(III), кобальта(II), цинка(II) в различной степени переходят в органическую фазу, на чем и основано их разделение.
Описания способа с использованием соединений общей формулы (I) в качестве реагента для извлечения никеля(II) водных кислых растворов и разделения ионов никеля (II)/железа (III), никеля (II)/кобальта (II), никеля (II)/цинка (II) в источниках информации не обнаружено. Достижение заявляемого технического эффекта возможно только при использовании всех существенных признаков предлагаемого решения в совокупности, что обеспечивает соответствие его критерию изобретения «изобретательский уровень».
Возможность осуществления изобретения иллюстрируется примерами, таблицами и фигурами.
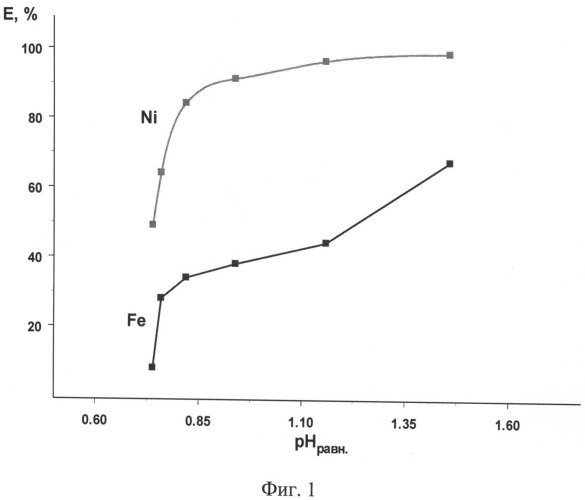
На фигуре 1 представлено влияние кислотности водной фазы на экстракцию Ni(II) и Fe(III). Соотношение Vo:Vв=1:1, τ=5 мин, t=20-22°С, время расслаивания - 15 мин. Экстрагент: 0,4 моль/л раствор гидразидов α-разветвленных третичных карбоновых кислот (ГД), где сумма углеродных атомов равна 10 (ГД -10) и 10 об.% 2-этилгексанола в нонане. Водная фаза: CNi=3,25 г/л; CFe=5,6 г/л; переменное содержание серной кислоты и сульфата натрия.
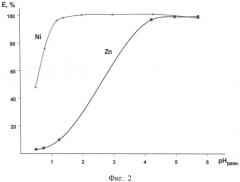
На фигуре 2 представлено влияние кислотности среды на экстракцию Ni(II) и Zn(II). Соотношение Vo:Vв=1:1, τ=5 мин, время расслаивания - 15 мин, t=20-22°С. Экстрагент: 0,4 моль/л раствор ГД-10 в смеси нонан и 10 об.% 2-этилгексанола. Водная фаза: CZn=3,2 г/л; CNi=3,25 г/л; переменное содержание серной кислоты и сульфата натрия.
Пример 1. Распределение гидразидов α-разветвленных третичных карбоновых кислот (ГД), где сумма углеродных атомов равна 15-19 (ГД-15-19) между органической фазой и водными растворами 0,2 М и 2 М H2SO4.
Навеску гидразида с точностью ±0,0002 г растворяли в 10 мл смеси керосин: 2-этилгексанол (9:1) для получения 0,4 моль/л растворов гидразидов. Раствор встряхивали 5 мин с 30 мл 0,2 или 2 моль/л H2SO4. Через 30 мин водный слой сливали, нейтрализовали 2 моль/л NaOH до pH 1-2. Затем добавляли 5 мл 0,5 моль/л CuSO4, 20 мл смеси BuOH:хлороформ (30:70) и встряхивали 5 мин. Органический слой фильтровали через слой ваты для удаления воды. Измеряли оптическую плотность комплекса медь(II) - гидразид. Содержание гидразида определяли фотометрически методом сравнения с приготовленным стандартным образцом раствора комплекса медь(II) - гидразид (λ=660 нм, 1=2 см). По данным анализа рассчитывали унос реагента с водной фазой (уравнение 3) и константы распределения (D) (уравнение 4)
где Ai - оптическая плотность исследуемой пробы;
Aст - оптическая плотность стандартного образца сравнения;
mст - содержание гидразида в пробе сравнения, мг;
mуноса = содержание гидразида, определенное в 30 мл водного слоя, соответствующий уносу из 10 мл органического слоя, мг
где Di - коэффициент распределения гидразида;
Со и Св - начальная концентрация гидразида в органическом и водном слое соответственно, моль/л;
Vв и Vo - объемы водной и органической фаз, мл.
Результаты эксперимента представлены в таблице 1.
Из таблицы видно, что унос у ГД-15-19 меньше, чем у прототипа.
Пример 2. Устойчивость реагентов к гидролизу в кислых средах
Навески гидразидов, содержащие 0,001 моль ГД, термостатировали в течение 1-4 ч при (60±1)°С или кипятили в течение 1 ч в 20 мл 0,2 и 2 моль/л серной кислоты. После охлаждения проб остаточное содержание гидразидов определяли либо потенциометрически (в органической фазе, после экстракции образовавшихся при гидролизе органических кислот 20 мл пентанола, титровали этанольным раствором КОН), либо остаточное содержание гидразидов фотометрически, аналогично примеру 1.
Результаты эксперимента представлены в таблице 2.
Из таблицы 2 следует, что заявляемые реагенты существенно устойчивее к гидролизу по сравнению с прототипом,
Пример 3. Исследование экстракции никеля(II) ГД-15-19 из сернокислых сред.
В делительную воронку помещали 1 мл 0,082 моль/л стандартного раствора сульфата никеля(II), общий объем раствора доводили до 10 мл расчетным количеством раствора H2SO4 и воды, затем добавляли 5 мл 0,2 моль/л реагента в смеси керосин и 10 об.% 2-этилгексанола. Встряхивали воронку 3 мин и выдерживали для расслоения фаз 10 мин. Нижний слой отделяли. Остаточное содержание ионов никеля(II) в водной фазе определяли на атомно-абсорбционном спектрометре. По разности концентраций в водной фазе рассчитывали степень экстракции по уравнению (5)
где Сисх - исходная концентрация металла в водном растворе, мг/л;
Ci - концентрация металла в водном растворе при заданном pH, мг/л.
Коэффициент распределения D рассчитывали по уравнению (6)
где Е - степень экстракции металла, %;
Vв и Vo - объемы водной и органической фаз, мл.
Результаты эксперимента представлены в таблице 3.
Из таблицы 3 видно, что 90-99% извлечение никеля(II) происходит при значении pH выше 1,0.
Пример 4. Исследование экстракции Ni(II) в присутствии Fe(III) ГД-10 из сернокислых сред.
Условия экстракции никеля(II) для ГД-10: соотношение фаз Vo:Vв=1:1, τ=5 мин, t=20-22°С, время расслаивания - 15 мин. Экстрагент: 0,4 моль/л раствор ГД-10 и 10 об.% 2-этилгексанола в нонане. Водная фаза: CNi=3,25 г/л; CFe=5,6 г/л; переменное содержание серной кислоты и сульфата натрия.
Результаты эксперимента представлены на фигуре 1 и в таблице 4.
Пример 5. Исследование экстракции Ni(II) в присутствии Fe(III) ГД-15-19 из сернокислых сред.
Условия проведения эксперимента для ГД-15-19: в делительную воронку вносили по 1 мл растворов сульфатов Ni(II) (0,082 моль/л) и Fe(III) (0,158 моль/л), H2SO4 и Н2О до 10 мл. Добавляли 5 мл 0,2 моль/л раствора гидразида в керосине для ГД-5-19 с добавкой 10 об.% 2-этилгексанола. Время встряхивания - 5 мин. Выдерживали для расслоения фаз 10 мин. Водный слой отделяли и измеряли значение pH. Определяли концентрацию ионов металлов в водной фазе на атомно-абсорбционном спектрометре. Рассчитывали степень экстракции по уравнению (5), а коэффициент распределения D - по уравнению (6).
Результаты эксперимента приведены в таблице 5. Из таблиц 4 и 5 следует, что никель эффективно отделяют от железа при pH 0,8-1,5; βNi/Fe=15-1770.
Для прототипа - 0,19 моль/л раствора ГНК (м.м.=272) в смеси керосин - 2-этилгексанол (3:1) коэффициент разделения βNi/Fe=75 (pH 2, среда H2SO4) при степени извлечения Ni(II) не более 60%.
Пример 6. Исследование совместной экстракции Ni(II) и Fe(III) с ГД-15-19 из хлороводородных сред.
В делительную воронку вносили расчетные количества растворов хлоридов Ni(II), Fe(III), HCl и Н2О до 10 мл. Добавляли 10 мл 0,2 моль/л раствора ГД-15-19 в керосине с добавкой 10 об.% этилгексанола. Время встряхивания - 5 мин. Выдерживали для расслоения фаз 10 мин. Водный слой отделяли и измеряли значение pH. Определяли концентрацию ионов металлов в водной фазе на атомно-абсорбционном спектрометре. Рассчитывали степень экстракции по уравнению (5), а коэффициент распределения D - по уравнению (6).
Результаты эксперимента приведены в таблице 6. Видно, что никель эффективно отделяют от железа при pH 1-2; βNi/Fe=85-2292.
Для прототипа - 0,1 моль/л раствора ГНК (м.м.=258) в смеси керосин - 2-этилгексанол (3:1) коэффициент разделения βNi/Fe=4 (pH 2, среда HCl) при степени извлечения Ni(II) не более 25%.
Пример 7. Исследование совместной экстракции Ni(II) и Со(II) ГД-10 из сернокислых сред.
Условия проведения эксперимента по разделению никеля и кобальта с ГД-10, а также его результаты приведены в таблице 7, из которой видно, что Ni(II) эффективно отделяется от Со(II) при значениях pH 0,7-1,3 с ГД-10.
Пример 8. Исследование совместной экстракции Ni(II) и Со(II) ГД-15-19 из сернокислых сред.
Условия экстракции для ГД-15-19: в делительную воронку вносили расчетные количества растворов сульфатов Ni(II) и Со(II), H2SO4 и Н2О до 10 мл. Добавляли 5 мл 0,2 моль/л раствора ГД-15-19 в керосине с добавкой 10 об.% 2-этилгексанола. Встряхивали 5 мин, выдерживали для расслоения фаз 10 мин. Водный слой отделяли и измеряли значение pH. Определяли концентрацию ионов металлов в водной фазе на атомно-абсорбционном спектрометре. Рассчитывали степень экстракции по уравнению (5), а коэффициент распределения D - по уравнению (6).
Результаты представлены в таблице 8, из которой видно, что Ni(II) хорошо отделяется от Со(II) в области pH 0,5-4, βNi/Co=66-163.
Для прототипа - 0,19 моль/л раствора ГНК (м.м.=272) в смеси керосин - 2-этилгексанол (3:1) коэффициент разделения βNi/Co~3 (pH 3, среда H2SO4).
Пример 9. Исследование совместной экстракции Ni(II) и Zn(II) ГД-10 из сернокислых сред.
Условия проведения эксперимента и результаты представлены в таблице 9 и на фигуре 2.
Из полученных данных следует, что Ni(II) можно эффективно отделить от Zn(II) при pH 0,7-5, βNi/Zn=32-187. Для прототипа - 0,19 моль/л раствора ГНК (м.м.=272) в смеси керосин: 2-этилгексанол (3:1) коэффициент разделения βNi/Zn=4 (рН=4, среда H2SO4).
Предлагаемый способ имеет следующие преимущества по сравнению с прототипом.
1. Хорошая совместимость экстрагента с углеводородными растворителями; высокие константы распределения между органической фазой и кислыми водными растворами, что обеспечивает более быстрое разделение фаз и меньшие значения уноса реагента с рафинатом.
2. Более высокая устойчивость экстрагента к гидролизу в кислых средах по сравнению с прототипом.
3. Более высокие степени извлечения никеля(II) из сульфатных и хлороводородных сред.
4. Возможность выделения никеля(II) в присутствии железа(III) из растворов H2SO4 и HCl при pH 0,8-1,5, то есть до начала гидролиза солей железа(III).
5. Возможность разделения никеля(II) и кобальта(II) при их совместном присутствии из кислых растворов в области pH 0,5-4.
6. Возможность разделения никеля(II) и цинка(II) при их совместном присутствии из кислых растворов с pH 0,7-5.
| Таблица 1 | |||
| Значения констант распределения (D) гидразидов между водной и органической фазами. Соотношение Vo:Vв=1:3; встряхивание 5 мин, расслаивание 30 мин; исходные растворы реагентов 0,4 моль/л в смеси (керосин + 10 об.% 2-этилгексанол). | |||
| Гидразид | Mr | Константы распределения D | |
| 0,2 моль/л H2SO4 | 2 моль/л H2SO4 | ||
| ГД-15-19 | 284 | 1997 | 3330* |
| Прототип ГНК** | 272 | 400 | 313 |
| Примечания: *Перед анализом пробы нейтрализовали NaOH до pH 1-2. | |||
| **0,14 моль/л раствор ГНК с суммой углеродных атомов 14-16 в смеси керосин-алкилфенол (3:2). |
| Таблица 2 | ||||
| Устойчивость реагентов к гидролизу в кислых средах. | ||||
| Реагент | Температура гидролиза, °C | Длительность гидролиза, ч | Степень гидролиза, % | |
| 0,2 моль/л H2SO4 | 2 моль/л H2SO4 | |||
| ГД-10 | 60 | 4 | 0 | <1 |
| Кипячение (~101-104°C) | 1 | 13 | 21 | |
| Прототип ГНК-14-16 | 60 | 1 | 3 | 12 |
| 4 | 18 | 31 |
| Таблица 3 | ||
| Влияние кислотности на экстракцию никеля(II) ГД-15-19 в среде H2SO4. Соотношение Vo:Vв=1:2, τ=5 мин, Т=20-22°C. Экстрагент: 0,2 моль/л раствор ГД-15-19 в смеси керосина и 10% об. 2-этилгексанола. CNi=0,48 г/л. | ||
| Значения pHравн | ENi(II), % | D |
| 2 моль/л H2SO4 | 10 | 0,2 |
| 0,5 моль/л H2SO4 | 45 | 1,6 |
| 0,5 | 78 | 7,1 |
| 1,0 | 89 | 16,2 |
| 1,5 | 95 | 38 |
| 2,4 | 99 | 198 |
| 3,8 | 99 | 198 |
| Таблица 4 | ||||||
| Коэффициенты распределения (D) и разделения (β) Ni(II) и Fe(III) в средах H2SO4/Na2SO4 с ГД-10. | ||||||
| pHравн | Состав водной фазы H2SO4/Na2SO4, моль/л | Fe (в), г/л | Ni (в), г/л | Di | βNi/Fe | |
| Fe(III) | Ni(II) | |||||
| 1,47 | 0,1/0,4 | 1,75 | 0,02 | 2,14 | 164 | 77,6 |
| 1,17 | 0,2/0,3 | 3,25 | 0,13 | 0,77 | 25 | 33,5 |
| 0,93 | 0,3/0,2 | 3,50 | 0,32 | 0,61 | 9,63 | 16,1 |
| 0,82 | 0,4/0,1 | 3,75 | 0,75 | 0,49 | 3,8 | 7,8 |
| 0,76 | 0,5/- | 4,25 | 1,10 | 0,36 | 1,98 | 5,5 |
| 0,74 | 0,75/- | 5,00 | 1,70 | 0,09 | 0,98 | 11 |
| Таблица 5 | |||||
| Коэффициенты распределения (D) и разделения (β) Ni(II) и Fe(III) в средах H2SO4 с ГД-15-19. Соотношение Vo:Vв=1:2, τ=5 мин, t=20-22°C. Экстрагент: 0,2 моль/л раствор в керосине с добавкой 2-этилгексанола (10% об.). CNi=0,48 г/л, CFe=0,88 г/л | |||||
| pH | Е, % | Di | βNi/Fe | ||
| Ni(II) | Fe(III) | Ni(II) | Fe(III) | ||
| 1,5 | 99,99 | 85 | 19998 | 11,3 | 1770 |
| 1,2 | 99 | 52 | 198 | 2,2 | 90 |
| 1,0 | 95 | 47 | 38 | 1,8 | 21,1 |
| 0,75 | 89 | 35 | 16,2 | 1,1 | 14,7 |
| 0,62 | 22 | 8 | 0,56 | 0,17 | 3,3 |
| Таблица 6 | |||||||
| Коэффициенты распределения (D) и разделения (β) Ni(II) и Fe(III) в средах HCl. Соотношение Vo:Vв=1:1, τ=5 мин, время расслаивания=10 мин, t=20-22°C. Экстрагент: 0,2 моль/л раствор ГД-15-19 в керосине с добавкой 10% об. 2-этилгексанола. CNi=0,442 г/л, CFe=0,498 г/л. | |||||||
| pHравн | Fe (в), г/л | Ni (в), г/л | E, % | Di | βNi/Fe | ||
| Fe(III) | Ni(II) | Fe(III) | Ni(II) | ||||
| 2,0 | 0,492 | 0,015 | 1,2 | 96,5 | 0,0412 | 27,5 | 2292 |
| 1,2 | 0,493 | 0,24 | 1,0 | 45,5 | 0,01 | 0,83 | 85 |
| Таблица 7 | ||||||
| Коэффициенты распределения (D) и разделения (β) Ni(II) и Co(II) в средах H2SO4. Экстрагент: 0,4 моль/л ГД-10 в нонане с добавкой 10% об. 2-этилгексанола, Vo:Vв=1:1, τ=5 мин, время расслаивания=15 мин, t=20-22°C. CNi(II)=3,25 г/л, CCo(II)=3,25 г/л. | ||||||
| pH | Состав водной фазы H2SO4/Na2SO4, моль/л | Co(в), г/л | Ni(в), г/л | Di | βNi/Co | |
| Co(II) | Ni(II) | |||||
| - | 1 моль/л H2SO4 | 3,25 | 2,0 | 0 | 0,63 | - |
| 0,7 | 0,5 моль/л H2SO4 | 3,05 | 0,71 | 0,06 | 3,6 | 60 |
| 1,33 | 0,25 моль/л H2SO4/ 0,25 моль/л Na2SO4 | 2,75 | 0,08 | 0,18 | 39,6 | 221 |
| Таблица 8 | |||||
| Коэффициенты распределения (D) и разделения (β) Co(II) и Ni(II) в средах H2SO4. Соотношение Vo:Vв=1:2, τ=5 мин, время расслаивания=10 мин, t=20-22°C. Экстрагент: 0,2 моль/л раствор ГД-15-19 в керосине с добавкой 10% об. 2-этилгексанола. CNi=0, 48 г/л, CCo=0,55 г/л. | |||||
| pH | E, % | Di | βNi/Co | ||
| Ni(II) | Co(II) | Ni(II) | Co(II) | ||
| 2 моль/л H2SO4 | 3 | 0 | 0,06 | - | - |
| 0,5 моль/л H2SO4 | 63 | 0 | 3,4 | - | - |
| 0,5 | 78 | 3 | 7,1 | 0,06 | 118 |
| 1,0 | 89 | 12 | 16,2 | 0,27 | 60 |
| 1,5 | 98 | 22 | 98 | 0,6 | 163 |
| 4,0 | 99 | 60 | 198 | 3 | 66 |
| 7,0 | 99 | 95 | 198 | 38 | 5,2 |
| Таблица 9 | ||||||
| Коэффициенты распределения (D) и разделения (β) Zn(II) и Ni(II) в среде H2SO4/Na2SO4. Соотношение Vo:Vв=1:1, τ=5 мин, время расслаивания=15 мин, t=20-22°C. Экстрагент: 0,2 моль/л раствор ГД-10 в смеси нонан и 10% об. 2-этилгексанола в нонане. Водная фаза: CZn=3,2 г/л CNi=3,25 г/л; переменное содержание серной кислоты и сульфата натрия. | ||||||
| pHравн | Состав водной фазы | Zn(в), г/л | Ni(в) г/л | Di | βNi/Zn | |
| Zn(II) | Ni(II) | |||||
| <0,7 | 1 моль/л H2SO4 | 4,10 | 1,87 | 0,027 | 0,87 | 32 |
| 0,81 | 0,5 моль/л H2SO4 | 3,40 | 0,75 | 0,038 | 3,49 | 92 |
| 1,25 | 0,25 моль/л H2SO4/ 0,25 моль/л Na2SO4 | 3,29 | 0,12 | 0,11 | 27,0 | 246 |
| 4,36 | 0,5 моль/л Na2SO4 | 0,71 | 0,004 | 4,5 | 842 | 187 |
| 5,87 | 0,5 моль/л Na2SO4+ 0,1 моль/л NAOH | 0,02 | 0,001 | 181 | 3250 | 18 |
1. Способ извлечения никеля(II) из водных кислых растворов, содержащих другие металлы, отличающийся тем, что в качестве экстрагента используют гидразиды на основе синтетических α-разветвленных третичных карбоновых кислот общей формулы (I) где R1 и R2 - алкильные радикалы, сумма атомов углерода в формуле (I) равна 10-19, при этом экстракцию ведут раствором 0,2-0,4 моль/л гидразида в углеводородном разбавителе с добавкой 10 об.% 2-этилгексанола.
2. Способ по п.1, отличающийся тем, что используют гидразиды формулы (I) с суммой атомов углерода 15-19.
3. Способ по п.1, отличающийся тем, что при извлечении никеля (II) экстракцию осуществляют в водных кислых растворах при pH 0,5-5.
4. Способ по п.1, отличающийся тем, что водный кислый раствор содержит железо(III), а экстракцию осуществляют при pH 0,8-1,5 с разделением никеля(II) и железа(III).
5. Способ по п.1, отличающийся тем, что водный кислый раствор содержит кобальт(II), а экстракцию осуществляют при pH 0,5-4 с разделением никеля(II) и кобальта(II).
6. Способ по п.1, отличающийся тем, что водный кислый раствор содержит цинк(II), а экстракцию осуществляют при pH 0,7-5 с разделением никеля(II) и цинка(II).