Способ диагностики патологий, связанных с эндокринными заболеваниями
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к лабораторной диагностике, и может быть использовано для диагностики патологий, связанных с заболеваниями коры надпочечников. Способ заключается в определении характеристического профиля исследуемой пробы биологической жидкости человека. Проводят ее концентрирование в режиме off-line. Осуществляют разделение биологически активных веществ с использованием комплексообразующих добавок и определение эталона «нормы». В качестве исследуемых биологически активных веществ берут стероидные гормоны. Разделение гормонов проводят методом обращенно-фазовой высокоэффективной жидкостной хроматографии в режиме градиентного элюирования с использованием детектора на диодной матрице. По стероидным профилям формируют матрицу интенсивностей аналитических сигналов и факторов удерживания каждого стероида. Получают методом главных компонент графические образы каждой пробы, по которым формируют кластеры для «нормы» и для отклонения от нее. После чего проводят корректировку кластеров «нормы» и отклонения методом формального независимого моделирования аналогий классов, которые принимают в качестве эталонов. Проводят диагностирование патологий по попаданию в эталон «нормы» или отклонения графического образа пробы, полученной от пациента. Изобретение обеспечивает достоверность диагностики патологий, связанных с заболеваниями коры надпочечников. 1 з.п. ф-лы, 6 ил. 2 пр.
Реферат
Изобретение относится к области медицины, в частности, к лабораторной диагностике, и может быть использовано для диагностики патологий, связанных с заболеваниями коры надпочечников.
Такие заболевания могут быть связаны с генетически обусловленными аномалиями, воспалительными и опухолевыми процессами в организме, расстройствами системы иммунитета, травмами, нарушениями кровоснабжения, поражениями различных отделов нервной системы, нарушением тканевой чувствительности к гормонам. Нарушение стероидогенеза - диагностический критерий различный эндокринных заболеваний. Колебания концентраций определяемых стероидных гормонов, их соотношения, а также наличие или отсутствие определенных соединений представляют собой, так называемый, профиль, отражающий целый ряд патологических состояний, и позволяют судить о причине нарушений стероидогенеза при различных эндокринных патологиях.
Известен способ одновременного определения клинически важных стероидов в биологической жидкости человека методом капиллярной газовой хроматографии [1]. В известном способе осуществляют предварительный гидролиз коньюгатов стероидов и защиту функциональных групп. Однако известный способ является длительным и затратным, поскольку для его реализации требуются значительные дополнительные временные затраты на выделение конъюгатов стероидов, их гидролиз и функционализацию. Известный способ позволяет диагностировать целый ряд гинекологических и онкологических заболеваний. Однако известный способ недостаточно информативный по отношению к диагностике патологий, связанных с заболеваниями коры надпочечников.
Известен способ определения стероидного профиля мочи [2]. В известном способе проводят ферментативный гидролиз конъюгатов стероидов и двухстадийную процедуру защиты функциональных групп (силилирование и получение метокси-производных). Способ основан на твердофазной экстракции конъюгатов стероидов и их ферментативном гидролизе. Известный способ является дорогостоящим, длительным и недостоверным за счет использования дорогостоящих ферментов, активность которых меняется со временем, и требуется их дополнительное тестирование, а также необходимости проведения дополнительной стадии - получения производных анализируемых гормонов, что значительно усложняет сам процесс и может быть источником дополнительных ошибок.
Известен способ диагностики и мониторинга опухоли коры надпочечников [3]. В известном способе для определения концентрации стероидных гормонов в моче здоровых и больных людей используют газовую и жидкостную хроматография с довольно дорогостоящим детектором - масс-спектрометрическим детектором (МС/МС).
Известен способ диагностирования патологий, наиболее близкий к заявляемому изобретению по достижению технического результата и выбранный в качестве прототипа [4]. Известный способ основан на идентификации исследуемого сложного объекта на основе построения характеристического электрофоретического профиля по биологически активным соединениям в режимах капиллярного зонного или мицеллярного электрофореза с УФ-детектированием.
Недостатком известного устройства являются низкие концентрационная чувствительность и достоверность способа детектирования, а также достаточно большое время, требуемое для диагностирования патологии. В прототипе для повышения чувствительности детектирования аналитов используют различные варианты on-line и off-line концентрирования пробы, что требует дополнительных затрат времени. Кроме того, известный способ может быть применен для экспресс-диагностики различных патологий, связанных с работой сердечно-сосудистой, эндокринной (а именно феохромацитомы) и нервной систем. Однако известный способ недостаточно информативный и эффективный для диагностики эндокринных заболеваний, связанных с патологией коры надпочечников.
Заявляемое изобретение свободно от указанного недостатка.
Техническим результатом предлагаемого способа является повышение чувствительности и достоверности способа диагностики патологий, связанных связанных с заболеваниями коры надпочечников. Способ не требует дополнительного гидролиза, функционализации и on-line концентрирования стероидов, что удешевляет и сокращает время обследования и установления диагноза.
Указанный технический результат достигается тем, что при определении характеристического профиля исследуемой пробы биологической жидкости человека, концентрирования ее в режиме off-line, разделении биологически активных веществ в каждой пробе с использованием комплексообразующих добавок и определении эталона «нормы», в соответствии с заявленным изобретением, в качестве исследуемых биологически активных веществ берут стероидные гормоны, разделение биологически активных веществ проводят методом обращенно-фазовой высокоэффективной жидкостной хроматографии в режиме градиентного элюирования с использованием детектора на диодной матрице, по полученным стероидным профилям формируют матрицу интенсивностей аналитических сигналов и факторов удерживания каждого исследуемого стероида, получают методом главных компонент графические образы каждой исследуемой пробы биологической жидкости человека, по которым формируют кластеры для «нормы» и для отклонения от нее, после чего проводят корректировку кластеров «нормы» и отклонения методом формального независимого моделирования аналогий классов, которые принимают в качестве эталонов «нормы» и отклонения, в сравнении с которыми проводят диагностирование патологий, связанных с эндокринными заболеваниями, по попаданию в эталон «нормы» или отклонения графического образа пробы биологической жидкости, полученной от пациента.
Кроме того, указанный технический результат достигается тем, что в качестве комплексообразующих добавок используют β-циклодекстрин.
Для достижения указанного технического результата получают характеристический профиль стероидных гормонов в биологических объектах методом обращенно-фазовой высокоэффективной жидкостной хроматографии с использованием детектора на диодной матрице. Используется градиентное элюирование и добавка комплексообразователя β-циклодекстрина в состав подвижной фазы, что увеличивает селективность разделения стероидных гормонов.
Стероидные гормоны в биологических объектах содержатся на уровне мкг/л, поэтому для увеличения чувствительности анализа проводится предварительное концентрирование анализируемых соединений. Стадия пробоподготовки предполагает выделение фракции только свободных стероидных гормонов, колебание концентраций которых в максимальной степени отражает состояние пациента.
Проводится хемометрическая обработка полученных характеристических стероидных профилей биологических объектов с использованием метода главных компонент (МГК). Это один из методов анализа многомерных данных (АМД). АМД - это современный подход к моделированию многомерных процессов и явлений, основанный на применении проекционных математических методов, позволяющих выделять в больших массивах данных скрытые переменные и анализировать связи, существующие в изучаемой системе.
На основе полученных хроматографических профилей строится график счетов методом МГК, на котором наносятся графические образы исследуемых проб. В качестве исходных данных для построения матрицы в методе МГК используются полученные качественные и количественные данные, а именно интенсивности аналитических сигналов и факторы удерживания. Вся обработка многомерных данных осуществлялась с помощью программного обеспечения «Unscrambler 9.7». На графике счетов выделяются кластеры исследуемых проб с «нормой» и отклонением от «нормы». Границы кластера определяются путем классификации полученных данных методом формального независимого моделирования аналогий классов, в основе которого лежит предположение о том, что все объекты одного класса имеют сходные свойства, но обладают индивидуальными особенностями.
Определение «нормы» и отклонения от «нормы» проводят построением матрицы данных по полученным стероидным профилям анализируемой пробы пациента, каждый элемент которой представляется графически, и после математической обработки методом МГК проводится отнесение образца к какому-либо кластеру (норме или патологии), занимающему определенную область на графике. Для проверки правильности отнесения каждого образца к тому или иному кластеру проводят классификацию методом формального независимого моделирования аналогий классов.
В этом заключается совокупность существенных признаков, обеспечивающая достижение технического результата.
Заявленный способ базируется на многолетних фундаментальных исследованиях, проводимых на лабораторных базах Санкт-Петербургского государственного университета и Санкт-Петербургской Медицинской Академии Последипломного образования.
Заявляемый способ диагностики патологий, связанных с заболеваниями коры надпочечников, осуществлен методом обращено-фазовой высокоэффективной жидкостной хроматографии с детектором на диодной матрице (190-400 нм) с использованием градиентного режима элюирования. Состав подвижной фазы ацетонирил/вода.
Заявленный способ поясняется фигурами 1-3, а также 4-6, поясняющими конкретные примеры его реализации.
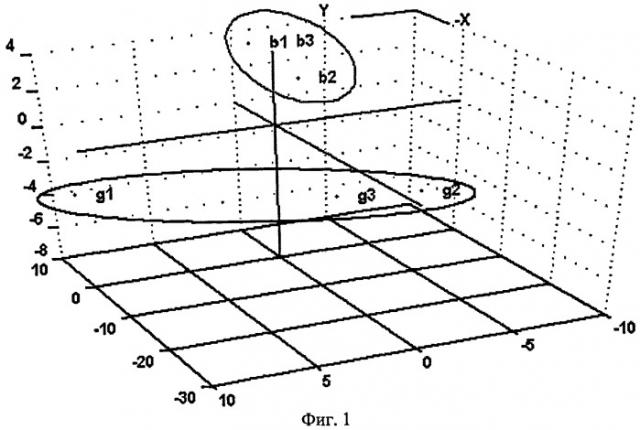
На Фиг.1 представлен график счетов МГК для первых трех главных компонент (ГК1-ГК2-ГК3), иллюстрирующий взаимное расположение кластеров образцов с болезнью Иценко-Кушинга (БИК) и гормонально неактивной гиперплазией коры надпочечников (ГНГКН). Имеются два неперекрывающихся кластера.
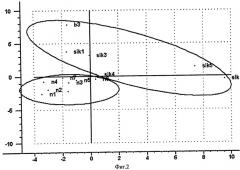
На Фиг.2 представлен график счетов в координатах двух главных компонент (ГК1-ГК2) стероидных профилей исследуемых проб с синдромом/болезнью Иценко-Кушинга и проб с «нормой».
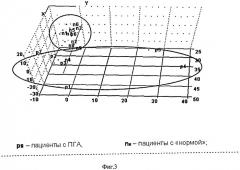
На Фиг.3 представлен график счетов в координатах двух главных компонент ГК1-ГК2 при обработке стероидных профилей больных с первичным гиперальдостеронизмом (ПГА) и образцов с «нормой».
Предлагаемый способ диагностики был многократно апробирован в реальном времени на базе Санкт-Петербургской государственной Медицинской Академии последипломного образования. Ниже приведены примеры конкретной реализации заявленного способа.
ПРИМЕР 1
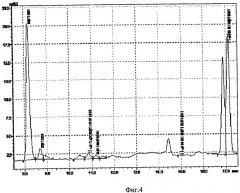
На Фиг.4 представлен хроматографический характеристический профиль сыворотки крови пациента с подозрением на первичный гиперальдостеронизм, полученный методом обращенно-фазовой жидкостной хроматографии. На хроматограммах, полученных для больных с первичным гиперальдостеронизмом, в некоторых случаях регистрируется неизвестный пик в районе 11-дегидрокортикостерона (соединение А, время удерживания ~10,8 мин), а также характерный дублет пиков высокой интенсивности (11-дезоксикортизол и неизвестный компонент).
Пробоподготовку проводят следующим образом. Берут исследуемую пробу биологической жидкости человека (1 мл сыворотки крови, мочи) и проводят предварительную пробоподготовку биологических объектов с использованием твердофазной экстракции стероидных гормонов на сорбционном материале с высокой удельной поверхностью и объемной емкостью - на сверхсшитом полистироле марки Purosep 270 - из сыворотки крови и мочи. Сорбционный патрон (медицинский шприц объемом 5 см3), заполненный сорбентом (Purosep 270), промывают 6 мл этанола. Затем 1 мл пробы пропускают через сорбционный патрон, промывают сорбент 2 мл 0,1 М раствора гидроксида натрия, 2 мл 40%-ного раствора этанола и затем 2 мл 20%-ного водного раствора ацетонитрила для удаления белков, липидов и других мешающих соединений и сорбировавшиеся стероиды элюируют 5 мл смеси растворителей метанол - дихлорметан (1:2, объемн.). Для концентрирования аналитов элюат выпаривают досуха и перерастворяют в 60 мкл 10% водного раствора ацетонитрила для проведения анализа методом ОФ-ВЭЖХ.
Анализ пробы после пробоподготовки проводят методом обращенно-фазовой высокоэффективной жидкостной хроматографии с детектором на диодной матрице (190-400 нм) с использованием градиентного режима элюирования с использованием жидкостного хроматографа («Shimadzu»); детектор на диодной матрице, 254 нм; подвижная фаза: ацетонитрил/вода, градиентный режим, колонка: Luna, 5 мкм, скорость потока: 300 мкл/мин. Состав подвижной фазы - ацетонитрил/вода.
Для проведения количественного определения компонентов пробы строится градуировочная зависимость площади пика от концентрации аналита по каждому компоненту пробы. Погрешность определения составляет 3-5%.
На Фиг.5 показан график счетов в координатах двух главных компонент ГК1-ГК2 при обработке стероидных профилей больных с первичным гиперальдостеронизмом (ПГА) и образцов с «нормой» и нанесенный графический образ исследуемого пациента.
Неизвестный образец попадает в кластер отклонения от «нормы» и однозначно классифицируется как относящийся к патологии после проверки методом формального независимого моделирования аналогий классов. Важно и то обстоятельство, что предполагаемая патология также была подтверждена традиционно использующимися в медицине методами диагностики.
ПРИМЕР 2
На Фиг.6 показан график Кумана, иллюстрирующий расстояние от образца пациента, поступившего с подозрением на синдром Иценко-Кушинга, до двух моделей («норма» и СИК). Неизвестный образец однозначно классифицируется как не относящийся к «норме», но в кластер изучаемой нами патологии СИК он не попадает с учетом границ класса. Предполагаемая патология также не была подтверждена традиционно использующимися в медицине методами диагностики.
Технико-экономическая эффективность заявленного способа состоит в повышении достоверности и точности диагностики эндокринных патологий, а также удешевлении и ускорении ее проведения (по сравнению с известными аналогами), что позволяет своевременно обнаружить у пациентов эндокринные заболевания, связанные, в частности, с синдромом и болезнью Иценко-Кушинга и первичным гиперальдостеронизмом.
Источники информации
1. Е.Е.Антипов, Е.М.Антипов, Е.Н.Орлов, Е.Е.Антипов, Е.М.Антипов. Способ одновременного определения клинически важных стероидов в биологической жидкости человека. // Патент РФ №2380704 С2 (RU).
2. C.H.L.Shakelton «Profiling steroid hormones and urinary steroids» // J. of Chromatography biochemical applications. Vol.379. June 20.1986.
3. Assay for detection of adrenal tumor. Патент WO 2010/092363 A1.
4. A.A.Сидорова, О.В.Ганжа. «Способ идентификации объекта путем построения его характеристического электрофоретического профиля». Патент РФ №2327978 С2 (RU) (прототип).
1. Способ диагностики патологий, связанных с заболеваниями коры надпочечников, заключающийся в определении характеристического профиля исследуемой пробы биологической жидкости человека, концентрирования ее в режиме off-line, разделении биологически активных веществ в каждой пробе с использованием комплексообразующих добавок и определении эталона «нормы», отличающийся тем, что в качестве исследуемых биологически активных веществ берут стероидные гормоны, разделение биологически активных веществ проводят методом обращенно-фазовой высокоэффективной жидкостной хроматографии в режиме градиентного элюирования с использованием детектора на диодной матрице, по полученным стероидным профилям формируют матрицу интенсивностей аналитических сигналов и факторов удерживания каждого исследуемого стероида, получают методом главных компонент графические образы каждой исследуемой пробы биологической жидкости человека, по которым формируют кластеры для «нормы» и для отклонения от нее, после чего проводят корректировку кластеров «нормы» и отклонения методом формального независимого моделирования аналогий классов, которые принимают в качестве эталонов «нормы» и отклонения, в сравнении с которыми проводят диагностирование патологий, связанных с эндокринными заболеваниями, по попаданию в эталон «нормы» или отклонения графического образа пробы биологической жидкости, полученной от пациента.
2. Способ по п.1, отличающийся тем, что в качестве комплексообразующих добавок используют β-циклодекстрин.