Офтальмологический препарат в виде глазных капель, содержащий дисульфирам и таурин
Иллюстрации
Показать всеИзобретение относится к области офтальмологи. Офтальмологический препарат в виде глазных капель содержит 0,2-0,5 масс.% дисульфирама, растворенного в фармацевтически приемлемом носителе на водной основе, 0,5-2,0 масс.% гидроксипропилциклодекстрина, 2,0-5,0 масс.% таурина; агент, обеспечивающий требуемую осмоляльность, содержащий хлорид натрия, моногидрофосфат и дигидрофосфат натрия, и метилпарабен (нипагин) в качестве консерванта. Изобретение обеспечивает эффективное лечение патологических состояний глаз, таких как катаракта, глаукома, офтальмогипертензии и травматические повреждения роговицы, расширяет арсенал существующих средств глазных капель. 5 з.п. ф-лы, 5 табл., 2 ил., 5 пр.
Реферат
Изобретение относится к фармакологии и офтальмологии и может найти применение при создании препарата для лечения патологических состояний глаз, выбранных из катаракты, глаукомы, офтальмогипертензии и травматического повреждения роговицы, у пациентов различного возраста.
Сведения об известном уровне техники
В наиболее широком смысле термином «катаракта» определяют любое изменение оптической однородности или снижение прозрачности хрусталика глаза. В этиологию катаракты вовлечено множество факторов, таких как наследственность, старение организма, диабет, табакокурение, питание, кумулятивный эффект рентгеновского и УФ-излучений, и нарушения эндокринного и/или ферментного равновесий в организме.
Наиболее значимыми среди химических соединений, вызывающих катаракту, являются кислородные радикальные частицы, например, образующиеся под действием УФ-излучения, присутствующего в спектре солнечного света. Такие частицы нарушают гомеостаз хрусталика за счет повышения уровня ионов Са2+ в хрусталике, что, в частности, активирует кальцийзависимые протеазы, например, кальпаин. Это приводит к разрушению белков хрусталика, таких как кристаллины, и, в конечном итоге, к его помутнению.
Предложенный механизм не является единственным, однако позволяет выбирать мишени для лекарств и разрабатывать стратегии лечения. В частности, одним из известных и весьма безопасных антиоксидантов, связывающих гидроксильные, перекисные, пероксинитрильные радикалы, является дисульфирам - димер диэтилдитиокарбамата, который сам также способен устранять действие гидроксильных радикалов и ингибировать пероксидацию липидов. Однако низкая растворимость дисульфирама в воде, его неустойчивость в нейтральных водных средах и неспособность проникать через роговицу являются существенными препятствиями к его применению в офтальмологии.
В заявке ЕР 2238978 (опубл. 13.10.2010) раскрыта фармацевтическая композиция, содержащая комплекс включения дисульфирама и циклодекстрина, необязательно содержащая незакомплексованный дисульфирам и один или более фармацевтически приемлемых носителей. В примерах осуществления изобретения раскрыты жидкая парентеральная, таблетированная пероральная и пеллетированная подкожная формы препарата для лечения зависимости от алкоголя и кокаина, содержащие 15-80 масс.% комплекса дисульфирама.
В статье Nagai N. et al. «Delay in ICR/f Rat Lens Opacification by the Instillation of Eye Drops Containing Disulfiram and Hydroxypropyl-β-cyclodextrin Inclusion Complex» (Biol. Pharm. Bull. Vol.30(8) (2007). P.1529-1534, опубл. 05.06.2007) на модели крыс ICR/f (линия с катарактой, наследуемой по рецессивному типу) показано следующее. К 77 дню жизни животных в группах, получавших глазные капли, содержащие дисульфирам, помутнение хрусталика было на 35-45% менее выражено, чем у животных контрольной группы, получавших изотонический солевой раствор, у которых уже к 75 дню жизни сформировалась четко наблюдаемая катаракта. Животным опытных групп начиная с 30 дня жизни дважды в сутки вводили в левый глаз 50 мкл капель, содержащих 0,25-0,50% дисульфирама, 3,0-5,0% 2-гидроксипропил-β-циклодекстрина и 0,1% гидроксипропилметилцеллюлозы.
В статье Nagai N., Ito Y., Takeuchi N. «Effect of Disulfiram Eye Drops on Lipid Peroxide Formation via Excessive Nitric Oxide in Lenses of Hereditary Cataract ICR/f Rats» (Biol. Pharm. Bull. Vol.31 (5) (2008). P.981-985, опубл. 13.02.2008) показано, что введение капель, содержащих 0,25-0,50% дисульфирама, 3,0-5,0% 2-гидроксипропил-β-циклодекстрина и 0,1% гидроксипропил-метилцеллюлозы к 77 дню жизни животных в 1,5-2 раза увеличивает пиксельный показатель прозрачности хрусталика и в той же пропорции снижает содержание ионов Са2+ в хрусталике. При этом в хрусталике в 1,5 раза уменьшается концентрация NO и в 2 раза снижается содержание липидных пероксидов.
Авторы рассматривают результаты, раскрытые в обеих статьях, как основание для дальнейших исследований подобных препаратов дисульфирама в качестве потенциальных лекарств против катаракты, обусловленной старением.
В статье Nagai N., Ito Y., Takeuchi N. «Pharmacokinetic and Pharmacodynamic Evaluation of the Anti-cataract Effect of Eye Drops Containing Disulfiram and Low-Substituted Methylcellulose Using ICR/f Rat Lens as a Hereditary Cataract Model» (Biol. Pharm. Bull. Vol.35 (2) (2012). P. 239-245, опубл. 24.11.2011) на модели крыс ICR/f показано, что введение глазных капель, содержащих 0,5% дисульфирама, 5% 2-гидрокси-пропил-β-циклодекстрина, 0,1% гидроксипропил-метилцеллюлозы и 2,0% метилцеллюлозы позволяет в интервале времени с 77 по 84 день жизни самцов модельных животных поддерживать пиксельный показатель прозрачности хрусталика, превышающий в 2-3 раза показатель в контрольной группе. Также было установлено, что препарат, содержащий метилцеллюлозу в клинической концентрации (2,0%), более эффективен, чем аналогичный препарат, описанный в предыдущих статьях. Авторы связывают этот факт с гелеобразованием при повышении температуры до температуры глаза (около 35°С), что увеличивает время удерживания глазных капель на поверхности роговицы.
Из уровня техники известны различные офтальмологические препараты, содержащие таурин. В заявке ЕР 0778021 (опубл. 11.06.1997) раскрыты глазные капли для ускорения регенерации роговицы после повреждения, содержащие 0,5-3,0% таурина, хлорид натрия, хлорид калия и бикарбонат натрия, имеющие рН от 5,5 до 8,0 и осмотическое давление от 250 до 450 мОсм.
В патенте RU 2127099 (опубл. 10.03.1999) раскрыты глазные капли, содержащие (в масс.%):
| натрия сукцинат шестиводный | 1,91 |
| натрия цитрат 5,5-водный | 0,40 |
| сорбит | 0,80 |
| натрия хлорид | 0,31 |
| L-глутаминовая кислота | 0,015 |
| рибофлавин мононуклеотидфосфат | 0,02 |
| бензалкония хлорид | 0,014 |
| глюкоза | 0,30 |
| таурин | 4 г |
| вода дистиллированная для инъекций | остальное. |
Применение капель позволяет улучшить энергетический метаболизм в клетках переднего, заднего эпителия роговицы и кератобластах при любых процессах, нарушающих этот обмен.
В патенте RU 2404768 (опубл. 10.03.1999) раскрыты глазные капли для профилактики и лечения катаракты, содержащие, г:
| таурин | 1,5-1,9 |
| карнозин | 1,5-1,9 |
| глутатион | не менее 0,01 |
| декстран низкомолекулярный | |
| микродиспергированный | 10,5-15,0 |
| бензалкония хлорид | 0,005-0,02 |
| вода очищенная | до 100 мл |
Недостатком известных препаратов, содержащих таурин, является присутствие солей бензалкония, которые могут вызывать аллергические реакции. Поэтому существует потребность в новых эффективных и безопасных средствах для лечения катаракты.
На рынке офтальмологических препаратов РФ присутствуют глазные капли «Таулонг» (ЗАО «Институт фармацевтических технологий»), содержащие 3 масс.% таурина, а также, г:
| никотинамид (ниацин, витамин РР) | 4 |
| декстран | 30 |
| метилпарагидроксибензоат (метилпарабен, нипагин) | 1 |
| натрия хлорид | 4,5 |
| калия монофосфат | 10 |
| натрия двухосновного фосфат | 8,5 |
| вода для инъекций | до 1000 мл |
В настоящее время единые представления о причинах возникновения и механизмах развития глаукомы отсутствуют. Более того, иногда возникают сложности при попытке определить понятие «глаукома». Специалисты насчитывают порядка 60 заболеваний глаза, имеющих следующие общие особенности: постоянное или периодическое превышение индивидуально толерантного уровня ВГД, глаукомную оптическую нейропатию, приводящую в своей конечной стадии к атрофии зрительного нерва, и характерные для глаукомы нарушения зрительных функций.
В контексте изобретения термин «глаукома» обозначает хроническую болезнь глаз, характеризующуюся постоянным или периодическим повышением внутриглазного давления (ВГД) с развитием трофических расстройств в путях оттока внутриглазной жидкости, в сетчатке и в зрительном нерве, что вызывает развитие краевой экскавации диска зрительного нерва и появление типичных дефектов в поле зрения.
В статье Ito Y., Nagai N., Shimomura Y. «Reduction in Intraocular Pressure by the Instillation of Eye Drops Containing Disulfiram Included with 2-Hydroxypropyl-β-cyclodextrin in Rabbit» (Biol. Pharm. Bull. Vol.33 (9) (2010). P.1574-1578, опубл. 08.06.2010) на модели глазной гипертензии у кроликов, вызванной быстрой инфузией 5% раствора глюкзы, показано, что введение глазных капель, содержащих 0,1-0,5% дисульфирама, 1,1-5,0% 2-гидроксипропил-β-циклодекстрина и 0,1% гидроксипропил-метилцеллюлозы в промежутке времени от 5 до 30 минут после индуцирования глазной гипертензии, позволяет на 10-30% снизить ВГД. Авторы статьи считают, что полученные результаты дают основания считать исследованные препараты основой для разработки антиглаукомных средств.
В статье Ермаковой В.Н. «Эффективность сочетания тауфона с антиадренергическими препаратами при первичной открытоугольной глаукоме» (Росс. офт. журн. №2 (2008). С.12-17) показано, что сочетанное применение тауфона с тимололом, проксодололом, проксофелином и проксокарпином в течение длительного времени (до 1 года) позволяет лишь незначительно снизить ВГД, но в достаточной мере улучшает отток водянистой влаги.
Офтальмогипертензия не является заболеванием как таковым, но представляет собой патологическое состояние повышенного внутриглазного давление, которое в норме находится в пределах 10-21 мм Нg. Стойкая или часто возникающая офтальмогипертензия может стать не только причиной развития глаукомы, но также привести к другим повреждениям глаза, ведущим к потере зрения, например к окклюзии ретинальной вены и неглаукоматозному разрушению слоя волокон зрительного нерва [Minckler D.S. «Histology of optic nerve damage in ocular hypertension and early glaucoma». Surv. Ophthalmol. Vol.33 (April 1989). P.401-411].
В статье Бунина А.Я., Ярцева Е.И., Колесникова Ю.А., Ермаковой В.Н., Яковлева А.А., Берниковой Т.А., Комлева Н.А. «Влияние таурина на внутриглазное давление и гемато-офтальмический барьер (экспериментальное исследование [Вопр. офт. №1 (1978). С.22-24] на модели простагландиновой гипертензии у кроликов показано, что инстилляция 4% раствора таурина задерживает во времени повышение ВГД и статистически достоверно снижает на 2-5 мм Hg ВГД опытного глаза в течение всего эксперимента. Сходные результаты были получены и на модели солевой гипертензии глаз у макак резус. Таким образом, таурин оказывает гипотензивное действие на офтальмотонус, что может быть обусловлено угнетением секреции водянистой влаги.
Тем не менее, существует потребность в офтальмологических препаратах, обладающих большей фармакологической активностью.
Краткое описание чертежей
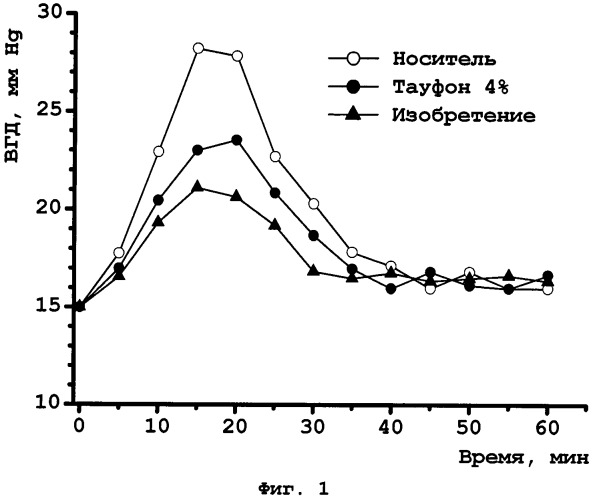
На Фиг.1 представлена зависимость внутриглазного давления (ВГД) от времени для модели острой глаукомы у кроликов.
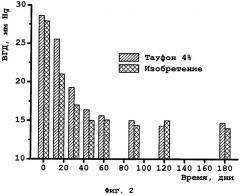
На Фиг.2 представлена зависимость внутриглазного давления (ВГД) от времени для модели хронической глаукомы у кроликов.
Описание изобретения
Авторы настоящего изобретения провели обширные исследования и установили, что существует возможность создания устойчивой жидкой фармацевтической композиции, содержащей 0,2-0,5 масс.% дисульфирама. Таким образом, настоящее изобретение, направленное на расширение арсенала лекарственных средств, предоставляет офтальмологический препарат в виде глазных капель, содержащий дисульфирам и таурин, предназначенный для лечения патологических состояний глаз, выбранных из катаракты, глаукомы, офтальмогипертензии и травматического повреждения роговицы, отличающийся тем, что содержит 0,2-0,5 масс.% дисульфирама, растворенного в фармацевтически приемлемом носителе на водной основе за счет образования комплекса включения с гидроксипропилциклодекстрином, присутствующим в количестве 0,5-2,0 масс.%, 2,0-5,0 масс.% таурина, агент, обеспечивающий требуемую осмоляльность, содержащий хлорид натрия, моногидрофосфат и фосфатный буфер, и метилпарабен (нипагин) в качестве консерванта.
Термин «лечение» в контексте изобретения следует понимать в широком смысле, в котором он означает улучшение течения заболевания, замедление прогрессирования заболевания, частичное или полное восстановление функций глаз или устранение патологического состояния, а также отдаление нежелательных последствий, вызванных патологическим состоянием.
Способ расчета состава агента, обеспечивающего требуемую осмоляльность, в зависимости от заданных значений осмотического давления и pH фармацевтической композиции находится в компетенции среднего специалиста в данной области. Содержание консерванта (метилпарабена) не должно превышать величины, установленной действующими нормативами для средств местного применения.
Достижение технического результата изобретения, заключающегося в улучшении течения катаракты или глаукомы, а также в долговременном снижении внутриглазного давления, продемонстрировано на соответствующих адекватных моделях in vivo.
При сравнительном исследовании действия известного препарата «Тауфон, глазные капли 4%» и препарата в соответствии с изобретением на модели травматической катаракты у кроликов авторы показали, что наилучшие результаты, характеризующиеся минимальными площадью и интенсивностью помутнения поврежденного участка хрусталика, отмечены у кроликов, получавших предлагаемый препарат (табл.2).
При сравнительном исследовании действия известного препарата «Тауфон, глазные капли 4%» и препарата в соответствии с изобретением на модели острой глаукомы у кроликов авторы показали, что наилучшие результаты, характеризующиеся более заметным снижением ВГД, отмечены у кроликов, получавших предлагаемый препарат (фиг.1).
При сравнительном исследовании действия известного препарата «Тауфон, глазные капли 4%» и препарата в соответствии с изобретением на модели хронической глаукомы у кроликов авторы показали, что наилучшие результаты, характеризующиеся значимо большим снижением ВГД, отмечены у кроликов, получавших предлагаемый препарат (фиг.2).
В процессе проведения всех исследований не было обнаружено каких-либо побочных эффектов, а также признаков непереносимости и аллергизирующего действия предложенного препарата.
Таким образом, авторы доказательно подтверждают достижение заявленного технического результата настоящего изобретения.
Осуществление изобретения
Далее изобретение будет проиллюстрировано примерами его осуществления.
Пример 1. Общая методика приготовления глазных капель
Отдельно готовят раствор агента, обеспечивающего требуемую осмоляльность. Для этого в стерильной дистиллированной воде, взятой в объеме 10% от объема готового препарата, растворяют при перемешивании дигидрофосфат натрия и хлорид натрия.
В стерильной дистиллированной воде, взятой в объеме 70% от объема готового препарата, при перемешивании растворяют метилпарабен (нипагин), добавляют дисульфирам, а затем - гидроксипропилциклодекстрин (ГПЦД). Смесь перемешивают в отсутствие света до получения раствора (приблизительно 20 часов), после чего добавляют таурин и приготовленный раствор агента, обеспечивающего требуемую осмоляльность. Проводят стерилизующую фильтрацию через фильтр с размером пор 0,2 мкм, асептически фасуют во флаконы по 10 мл, которые затем укупоривают и снабжают этикетками.
Массовое содержание (в г/100 г раствора и в масс.%) твердых субстанций в препаратах, приготовленных в соответствии с примером 1, представлены в таблице 1.
| Таблица 1 | ||||
| Компонент | Препарат 1 | Препарат 2 | ||
| Масса, г | Масс.% | Масса, г | Масс.% | |
| Дисульфирам | 0,2 | 0,2 | 0,5 | 0,5 |
| ГПЦД | 0,5 | 0,5 | 2,0 | 2,0 |
| Таурин | 2,0 | 2,0 | 5,0 | 5,0 |
| Дигидрофосфат натрия | 0,26 | 0,26 | 0,25 | 0,25 |
| Гидрофосфат натрия | 0,1 | 0,1 | 0,1 | 0,1 |
| Хлорид натрия | 0,8 | 0,8 | 0,85 | 0,85 |
| Метилпарабен | 1,0 | 1,0 | 1,0 | 1,0 |
Пример 2. Исследование лечебного действия на модели травматической катаракты у кроликов
Исследование проводят на 24 кроликах породы «Шиншилла» средней массой 3,5 кг возрастом 3,5-4 месяца с моделью травматической катаракты.
Моделирование травматической катаракты осуществляют на правом глазу всех животных следующим образом. После медикаментозного миоза, вызываемого двукратными инстилляциями в конъюнктивальную полость 1%-ного раствора пилокарпина гидрохлорида с интервалом в 15 минут, производят лазерную коагуляцию пигментной каймы зрачка с локализацией коагулятов 1,5-2,0 мм кнаружи от оптического центра хрусталика в меридиане 8-10 ч. На радужку каждого глаза наносят 15-40 коагулятов. Параметры лазерного излучения: энергия импульса 1,6-2,2 Вт, длительность импульса 0,6 сек. Доставку лазерного излучения осуществляли через налобный бинокулярный офтальмоскоп.
В соответствии с задачами исследования все животных разделяют на 3 группы (таблица 2).
| Таблица 2 | ||
| Группа | Препарат и режим дозирования | Число животных (глаз) |
| 1 | Препарат 2 соответствии с изобретением; 1 мг/кг массы кролика 1 раз в сутки субконъюнктивально в течение 10 дней. | 6 (6) |
| 2 | «Тауфон, глазные капли 4%»; 1 мг/кг массы кролика 1 раз в сутки субконъюнктивально в течение 10 дней. | 6 (6) |
| 3 | Вода для инъекций по 0,3 мл кролику 1 раз в сутки субконъюнктивально в течение 10 дней. | 6 (6) |
В первую неделю биомикроскопию хрусталика и исследование его прозрачности проводят ежедневно, а в дальнейшем - еженедельно в проходящем свете с помощью щелевой лампы ЩЛ-2Б и налобного бинокулярного микроскопа (НБО-2) с использованием офтальмоскопических линз различной оптической силы.
Кроме того, у всех кроликов непосредственно после моделирования катаракты, а также через 1 и 2 месяца терапии сравниваемыми препаратами осуществляют фоторегистрацию характера помутнения хрусталика с помощью аппарата «Retcam-2» (производство Massive Research, США). Результаты динамического наблюдения за кроликами заносят в специальную регистрационную карту.
Через 30 минут после лазерного воздействия пигментная кайма зрачка в местах нанесения лазерных коагулятов приобретает молочно-белый цвет. На второй день эксперимента зрачок приобретает прежний размер и обнажает отдел хрусталика, подвергнутый воздействию лазерного излучения. Он представляет собой участок интенсивного помутнения капсулы и передних кортикальных слоев хрусталика подковообразной формы (проекция пигментной каймы суженного зрачка в момент лазерного воздействия). При этом тонкий участок помутнения, повторяющий контур края зрачка, окружен ореолом субкапсулярных вакуолей и участков развивающегося помутнения, не распространяющихся более чем на 1,5 мм от основного «контурного» помутнения.
Начиная с третьего-четвертого дня помутнение рассматриваемых участков хрусталика достигает максимальной интенсивности, глубины и площади и стабилизируется. Тенденция к обратному (крайне незначительному) развитию травматическая катаракта приобретает начиная с 30-го дня эксперимента. Однако даже через 60 суток лечения изучаемыми препаратами ни в одном случае не отмечено полного регресса помутнения хрусталика.
Площадь помутнения хрусталика определяют с помощью микрометрической сетки, накладываемой на полноразмерное изображение хрусталика, выполненное с помощью аппарата «Retcam-2», по формуле:
S=N+n/2,
где S - площадь помутнения, мм2; N - число миллиметровых квадратиков, полностью «занятых» помутнением; n - число миллиметровых квадратиков, частично «занятых» помутнением.
Выраженность помутнения хрусталика оценивают по четырехбалльной шкале: «0» - полная прозрачность хрусталика; «1» - нежное облачковидное помутнение; «2» - выраженное помутнение, за которым, однако, угадывается ослабленный рефлекс с глазного дна; «3» - интенсивное плотное помутнение хрусталика при отсутствии в его проекции рефлекса с глазного дна. В связи с тем что помутнения хрусталика неоднородны, вычисляют усредненный коэффициент помутнения умножением выраженности помутнения в каждом его участке на его площадь с последующим суммированием и делением на общую площадь помутнения.
Результаты динамического наблюдения за кроликами в группах, указанных в таблице 1, представлены в таблице 3.
| Таблица 3 | |||||
| n | Этап наблюдения | ||||
| Груп-па | 30 сутки | 60 сутки | |||
| Площадь, мм2 | Выраженность | Площадь, мм2 | Выраженность | ||
| 1 | 6 | 5,3±0,5 | 2,5±0,3 | 4,5±0,5 | 2,0±0,2 |
| 2 | 6 | 5,8±0,5 | 2,7±0,2 | 5,0±0,5 | 2,1±0,2 |
| 3 | 6 | 6,1±0,6 | 2,8±0,2 | 5,8±0,5 | 2,6±0,2 |
При исследовании эффективности проводимой животным терапии установлено, что оба изучаемых препарата оказывают существенное положительное влияние на клиническое течение экспериментальной травматической катаракты. Так, через 1 месяц проводимого лечения у всех животных, получавших сравниваемые препараты, отмечена устойчивая тенденция к уменьшению площади и интенсивности помутнения хрусталика. При этом рассматриваемые изменения касаются, прежде всего, зоны вакуолизации и «вторичного» помутнения передних субкапсулярных и передних кортикальных слоев хрусталика.
Препарат в соответствии с изобретением по результатам обследования на 30-е сутки эксперимента оказался незначительно, но статистически значимо более эффективен, чем препарат «Тауфон, глазные капли 4%». В контрольной группе 3 площадь, глубина и интенсивность помутнения оставались более стабильными, чем у животных, получавших терапию.
По результатам дальнейшего наблюдения за кроликами, проведенного в период с 30 по 60-й день эксперимента, установлена более заметная тенденция к обратному развитию патологических изменений в хрусталиках (площади, глубины и выраженности помутнения), в особенности - в группе 1, получавшей терапию препаратом в соответствии с изобретением.
Пример 3. Исследование лечебного действия на модели острой глаукомы у кроликов
Исследования проводят на кроликах породы «Шиншилла» массой от 1,5 до 2,1 кг. Внутриглазное давление (ВГД) измеряют бесконтактным автоматическим тонометром TonoVet (Jorgen Kruuse, Дания) и для дальнейших исследований отбирают животных с базальным ВГД 12-16 мм Hg, формируя из них 3 группы по 4 особи обоего пола в каждой.
Кроликам в правый (контрольный) глаз вводят фармацевтический носитель, в левый (опытный) глаз - раствор исследуемого препарата 2. Через 15 минут после инстилляции лекарства в заднюю ушную вену кроликам вводят 5% раствор декстрозы (15 мл/кг). Измеряют ВГД каждые 5 минут до достижения значения, близкого к нормальному. Результаты измерений, усредненные по группам, показаны на фиг.1.
Пример 4. Исследование лечебного действия на модели хронической глаукомы у кроликов
Исследования проводят на кроликах породы «Шиншилла» массой от 1,5 до 2,1 кг. Животным внутривенно вводят диазепам (1 мг/кг) и кетамин (25 мг/кг). В заднюю камеру через канюлю вводят свежеприготовленный раствор α-хемотрипсина (50 Ед в 0,1 мл стерильного физраствора). Внутриглазное давление (ВГД) измеряют бесконтактным автоматическим тонометром TonoVet (Jorgen Kruuse, Дания) и для дальнейших исследований отбирают животных с устойчивой офтальмогипертензией, формируя из них 3 группы по 4 особи обоего пола в каждой.
Кроликам в правый (контрольный) глаз вводят фармацевтический носитель и измеряют ВГД в исходной временной точке. В левый (опытный) глаз - раствор исследуемого препарата 1. Измерения ВГД производят в начальный момент времени, и далее - в 15, 30, 45, 60, 120 и 180 дни эксперимента. Результаты измерений, усредненные по группам, показаны на фиг.2.
Пример 5. Исследование репаративного действия на модели обширного эпителиального дефекта роговицы у кроликов
Экспериментальные исследования проводят на 16 самцах кроликов породы «Белый великан» (32 глаза) массой 2,8-3,0 кг, содержащихся в стандартных условиях вивария. В качестве экспериментальной модели используют модель обширного эпителиального дефекта роговицы, который наносят на оба глаза каждого животного следующим образом. После эпибульбарной анестезии иннокаином в центре роговицы трепаном для послойной пересадки роговой оболочки глаза формируют раневое повреждение диаметром 5 мм и глубиной 0,5 мм, для чего ограничительный штифт на трепане устанавливают в соответствующее положение. Область повреждения окрашивают 1% раствором натриевой соли флуоресцеина. Удаление несквозного диска, включающего эпителий, боуменову мембрану и поверхностный слой стромы, в пределах флуоресцеиновой метки производят специальным изогнутым шпателем. Затем дефект повторно окрашивают тем же раствором и промывают стерильным физиологическим раствором. Все манипуляции проводят под стандартной тотальной внутривенной анестезией.
После проведения стандартной операции животных разделяют на две группы по восемь особей в каждой группе. В послеоперационном периоде животным первой группы в один глаз ежедневно по 2-3 капли 2 раза в день инстилируют препарат в соответствии с изобретением, животным второй группы - препарат сравнения «Тауфон, глазные капли 4%». Второй глаз служит контролем. В контрольные глаза инстилируют стерильный физиологический раствор.
Эффективность ранозаживления оценивают по результатам клинического исследования глаза и времени завершения эпителизации области операционной травмы с применением следующих методов исследования:
1) осмотра в фокальном и боковом освещении,
2) биомикроскопиии переднего отрезка глаза с помощью ручной щелевой лампы Heine HSL 150 с оценкой состояния конъюнктивы, ее инъецированности сосудами, наличия кровоизлияний и отеков. Также оценивают состояние роговицы на предмет площади, характера и глубины поражения, наличия и характера (диффузный, локальный) отеков, степени инфильтрации роговицы, наличия поверхностной и глубокой васкуляризации роговицы, а также определяют характер и тип сформировавшихся рубцов.
3) флуоресцинового теста окрашивания роговицы, который выполняют стерильными одноразовыми полосками флуоресцина (производство Haag-Streit AG) для оценки динамики эпителизации роговицы и определения время эпителизации.
Все данные исследований заносят в специальные формы отчетов и снабжают фотоснимками.
На финальном этапе проводят морфологические исследования энуклеированных глаз кроликов, умерщвленных методом воздушной эмболии, на 25 сутки после начала эксперимента. После энуклеации, глаза предназначенные для исследования, фиксируют в 10% растворе формалина и передают в сертифицированную ветеринарную патолого-анатомическую лабораторию.
В результате исследований методами 1)-3) для препарата в соответствии с изобретением и известного препарата «Тауфон, глазные капли 4%» получена обобщенная оценка, приведенная в таблице 4. Для получения указанной оценки исходили из всех показателей состояния роговицы, учитывая опытные и контрольные глаза с одинаковой эпителизацией.
| Таблица 4 | |||
| Лучшая эпителизация глаз: | |||
| опытных (глаза/%) | контрольных (глаза/%) | ||
| Группа 1 (препарат 2) | 24.06 | 5/62,5% | 0/0,0% |
| 29.06 | 5/62,5% | 1/12,5% | |
| 06. 07 | 6/75,0% | 1/12,5% | |
| Группа 2 (Тауфон, 4%) | 24.06 | 1/12,5% | 0/0,0% |
| 29.06 | 3/37,5% | 2/25,0% | |
| 06.07 | 4/50,0% | 2/25,0% |
Результаты морфологического исследования опытных глаз с контрольными по следующим гистологическим критериям оценки ранозаживления:
1) степень и наличие отека роговицы,
2) наличие васкуляризации роговицы,
3) наличие фиброза или патологической грануляции роговицы,
4) степень воспаления,
5) степень изъязвления роговицы,
6) эпителиальная гиперплазия роговицы
по степеням от нормы (0), до тяжелой степени (4) обобщенно представлены в таблице 5.
| Таблица 5 | |||
| Применение препарата: | |||
| Эффективно (животных/%) | Неэффективно (животных/%) | Равнозначно (животных/%) | |
| Группа 1 (препарат 2) | 5/62,5% | 3/37,5% | 0/0,0% |
| Группа 2 (Тауфон, 4%) | 4/50,0% | 3/37,5% | 1/12,5% |
Полученные в примерах данные показывают достижение заявленных технических результатов при реализации настоящего изобретения в соответствии с вариантами препарата, содержащими различные количества активных ингредиентов - комплекса, образованного дисульфирамом и циклодекстрином, и таурина.
1. Офтальмологический препарат в виде глазных капель, содержащий дисульфирам и таурин, предназначенный для лечения патологических состояний глаз, выбранных из катаракты, глаукомы, офтальмогипертензии и травматического повреждения роговицы, отличающийся тем, что он содержит 0,2-0,5 мас.% дисульфирама, растворенного в фармацевтически приемлемом носителе на водной основе за счет образования комплекса включения с гидроксипропилциклодекстрином, присутствующим в количестве 0,5-2,0 мас.%, 2,0-5,0 мас.% таурина, агент, обеспечивающий требуемую осмоляльность, где указанный агент содержит хлорид натрия, моногидрофосфат и дигидрофосфат натрия и метилпарабен (нипагин) в качестве консерванта.
2. Офтальмологический препарат по п.1, отличающийся тем, что он содержит 0,2 мас.% дисульфирама, растворенного в фармацевтически приемлемом носителе на водной основе за счет образования комплекса включения с гидроксипропилциклодекстрином, присутствующим в количестве 0,5 мас.%, и 2,0 мас.% таурина.
3. Офтальмологический препарат по п.1, отличающийся тем, что он содержит 0,5 мас.% дисульфирама, растворенного в фармацевтически приемлемом носителе на водной основе за счет образования комплекса включения с гидроксипропилциклодекстрином, присутствующим в количестве 2,0 мас.%, и 5,0 мас.% таурина.
4. Офтальмологический препарат по п.3, отличающийся тем, что он предназначен для лечения катаракты.
5. Офтальмологический препарат по п.1-3, отличающийся тем, что он предназначен для лечения глаукомы и/или офтальмогипертензии.
6. Офтальмологический препарат по п.3, отличающийся тем, что он предназначен для лечения травматического повреждения роговицы.