Ингибирующее дипептидилпептидазу iv средство и фармацевтическая композиция на его основе
Иллюстрации
Показать всеПредложены: средство, применяемое для лечения или профилактики заболеваний, в которые вовлечен фермент дипептидилпептидаза-IV (ДПП-IV), представляющее собой Лимиглидол (он же дигидрохлорид 9-диэтилами-ноэтил-2,3-дигидроимидазо[1,2-а] бензимидазола, он же диабенол), фармацевтическая композиция на его основе того же назначения, применение Лимиглидола для изготовления фармацевтической композиции того же назначения и применение Лимиглидола для нормализации уровня инкретинов в крови (например, GLP-1, GIP, которые разрушаются под действием ДПП-IV). Показана высокая селективность Лимиглидола в отношении ДПП IV. Изобретение обеспечивает возможность применения Лимиглидола для предотвращения, замедления прогрессирования и/или лечения состояний, в патогенез которых вовлечен фермент ДПП-IV, включая бесплодие, синдром поликистоза яичников, нарушения роста, слабость, артрит, отторжение аллотрансплантата, аутоиммунные заболевания (склеродермия и рассеянный склероз), различные иммуномодуляторные заболевания (красная волчанка или псориаз), СПИД, кишечные заболевания (некротический энтерит, заболевание с включениями микроворсин или заболевание брюшной полости), синдром воспаления кишечника, атрофию и так далее. 4 н. и 6 з.п. ф-лы, 1 фиг., 2 табл., 1 пр.
Реферат
Изобретение относится к области медицины, конкретно к средству, применяемому для предотвращения, замедления прогрессирования и/или лечения состояний, опосредованных ферментом дипептидилпептидазой IV, т.е. заболеваний, расстройств или состояний, которые можно лечить или предупреждать путем ингибирования этого фермента.
Дипептидилпептидаза IV (согласно номенклатуре ферментов IUBMB ЕС.3.4.14.5, далее - ДПП-4) представляет собой мембраносвязанную сериновую пептидазу, которая локализуется в ряде тканей (кишечник, печень, легкие, почки), а также на T-лимфоцитах крови, где фермент известен как CD-26. В литературе этот фермент имеет широкое множество названий, включая DPP4, DP4, DAP-IV, FAPS, белок 2, образующий комплекс с аденозиндезаминазой, белок, связывающий аденозиндезаминазу (ADAbp), дипептидиламинопептидаза IV; Xaa-Pro-дипептидиламинопептидаза; Gly-Pro-нафтиламидаза; постпролиндипептидиламинопептидаза IV; лимфоцитарный антиген CD26; гликопротеин GP110; глицилпролинаминопептидаза; глицилпролинаминопептидаза; Х-пролилдипептидиламинопептидаза; pep X; лейкоцитарный антиген CD26; глицилпролилдипептидиламинопептидаза; дипептидилпептидгидролаза; глицилпролиламинопептидаза; дипептидиламинопептидаза IV; аминоацилпролилдипептидиламинопептидаза; инициирующая T-клетки молекула Tp103; X-PDAP.
ДПП-4 является неклассической сериновой аминодипептидазой, которая отщепляет дипептиды Хаа-Pro с аминоконца (N-конца) полипептидов и белков. Также известно, что зависимое от ДПП-4 медленное высвобождение дипептидов типа X-Gly или X-Ser происходит в случае некоторых встречающихся в природе пептидов.
ДПП-4 конститутивно экспрессируется на эпителиальных и эндотелиальных клетках множества разных тканей (кишечник, печень, легкое, почка и плацента), а также выявляется в жидкостях организма. ДПП-4 также экспрессируется на циркулирующих T-лимфоцитах, и было показано, что ДПП-4 тождественна антигену клеточной поверхности CD-26.
Известно, что ДПП-4 in vivo легко инактивирует глюкагон, подобный пептиду-1 (GLP-1) и полипептиду, угнетающему секрецию желудка (GIP) и проявляет протеолитическую активность против ряда иммунорегуляторных, эндокринных и неврологических пептидов (GHRH, NPY, GLP-2, VIP).
GLP-1 и GIP являются инкретинами и вырабатываются после потребления пищи. 29-аминокислотным пептид GLP-1 (7-36) получается в результате посттрансляционного процессинга проглюкагона в тонком кишечнике. GLP-1 (7-36) оказывает множество воздействий in vivo, включая ингибирование секреции глюкагона, стимуляцию секреции инсулина, усиление чувства насыщения и замедление опорожнения желудка. Однако GLP-1 (7-36) очень быстро распадается in vivo и, как было показано, имеет короткое время полужизни in vivo (t1/2) - 1,5 минуты, поэтому в клинической практике его невозможно использовать в качестве лекарственного препарата.
Изучение генетически выведенных мышей нокаутированных по ДПП-4 и in vivo/in vitro испытания с применением селективных ингибиторов ДПП-4 показали, что ДПП-4 является первичным ферментом GLP-1 (7-36) in vivo. В связи с этим было предложено ингибирование фермента ДПП-4, разрушающего инкретины в организме. Основная функция фермента заключается в быстрой инактивации олигопептидов в разных тканях и органах путем отщепления двух аминокислот от концевой части. GLP-1 расщепляется с помощью ДПП-4 до GLP-1 (9-36), который ведет себя как физиологический антагонист GLP-1 (7-36). Изучено, что фермент ДПП-4 быстро инактивирует ГПП-1 и ГИП сразу после их секреции в организме. При ингибировании ДПП-4 уровень и активность инкретинов повышается и их действие продлевается. Поэтому ингибирование ДПП-4 in vivo увеличивает уровни эндогенного GLP-1 (7-36) и уменьшает образование его антагониста GLP-1 (9-36). В результате этого нормализуется дисбаланс соотношения глюкагон/инсулин. Как следствие, ингибиторы ДПП-4 могут применяться в качестве лекарственных средств для предотвращения, замедления прогрессирования и/или лечения состояний, опосредованных ДПП-4. В результате исследований выявлен ряд соединений, ингибирующих ДПП-4, которые начали применяться в медицинской практике. Однако все еще существует высокая потребность в новых ингибиторах ДПП-4.
Задача настоящего соединения заключается в разработке средства с ингибирующим ДПП-4 действием и создание на его основе фармацевтической композиции для предотвращения, замедления прогрессирования и/или лечения состояний, в патогенез которых вовлечен фермент ДПП-4.
Для решения поставленной задачи предлагается средство, обладающее ингибирующим ДПП-4 действием, которое представляет собой Лимиглидол.
В другом аспекте изобретения предлагается фармацевтическая композиция, обладающая ингибирующим ДПП-4 действием, которая содержит Лимиглидол в терапевтически эффективном количестве и фармацевтически приемлемые вспомогательные вещества. Предпочтительно фармацевтическая композиция предназначена для нормализации уровня инкретинов в крови и/или нормализации функции эндотелиальных клеток.
Еще в одном варианте изобретения предлагается применение Лимиглидола для лечения и/или профилактики заболеваний, которые можно лечить или предупреждать путем ингибирования фермента дипептидилпептидаза IV, предпочтительно для нормализации уровня инкретинов в крови и/или нормализации функции эндотелиальных клеток.
Также согласно изобретения предлагается применение Лимиглидола для изготовления фармацевтической композиции, обладающей ингибирующим ДПП-4 действием. В предпочтительном варианте предлагается применение Лимиглидола для изготовления фармацевтической композиции для нормализации уровня инкретинов в крови и/или нормализации функции эндотелиальных клеток, более предпочтительно для изготовления композиции в виде твердой лекарственной формы.
В основе изобретения лежит неожиданно обнаруженное авторами новое свойство известного соединения Лимиглидола в отношении ключевого фермента метаболизма ДПП-4. В результате проведенных исследований Лимиглидол был выявлен как средство для ингибирования фермента ДПП-4.
Лимиглидол (или дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-a] бензимидазола) был известен как соединение, обладающее антиагрегационным, снижающим вязкость крови, а также снижающим инсулино-резистентность действием (патенты РФ 2061481, 2386634). Сведения о наличии у него других видов активности, в частности ингибирование дипептидилпептидазы, в литературе отсутствуют.
Активность Лимиглидола согласно настоящему изобретению в качестве ингибитора ДПП-4 может быть продемонстрирована при помощи методов, известных в данной области техники. Константы ингибирования определяют следующим образом. Применяют непрерывный флуоресцентный анализ с субстратом Gly-Pro-AMC, который расщепляется при помощи ДПП-4 для освобождения флуоресцирующей АМС уходящей группы. Кинетические параметры, которые описывают такую реакцию, являются следующими: Km=50 мкМ; k cat=75 s-1; kcat / Km=1,5×106 М-1s-1. Обычно реакция содержит приблизительно 50 пМ фермента, 50 мкМ Gly-Pro-AMC, и буфер (100 мМ HEPES, рН 7,5, 0,1 мг/мл BSA, 0,1 мМ ДТТ и 1 мМ ЭДТА) в общем реакционном объеме 100 мкл. Флуоресценцию АМС постоянно регистрируют при помощи микропланшетного флуорометра в 96-луночном планшете при длине волны возбуждения 380 нм и длине волны излучения 460 нм. В этих условиях, около 0,8 мкМ АМС образуется за 30 минут при 37°C. Фермент, использованный в этих исследованиях был очищен до гомогенного состояния из плазмы крови человека методами преципитации сульфатом пммонияы, гидрофобной хроматографии на фенил-сефарозе, гель-фильтрации на сефадексе G-100 и аффинной хроматографии на конканавалин A-сефарозе. Пелеченный препарат ДПП-4 был гомогенен, представлял собой гомодимер с массой мономера 110 кД.
Для измерения констант диссоциации соединений растворы ингибитора в ДМСО добавляли в реакционные смеси, содержащие фермент и субстрат (конечная концентрация ДМСО составила 1%). Все эксперименты проводили при температуре 37°C, используя стандартные реакционные условия. Для определения IC50 установили скорости реакции при помощи нелинейной регрессии по уравнению Ченга-Пруссофа для конкурентного ингибирования. Ошибки при воспроизведении констант диссоциации обычно не превышали двух.
Лимиглидол проявляет высокую селективность в отношении ингибитора ДПП-4, что подтверждается экспериментальными данными, приведенными ниже. Дипептидилпептидаза-IV (все работы по получению ферментных препаратов проводили при 4°C).
Плазму крови разводили в 5 раз 0.02 М трис-HCl буфером с рН 7.5, содержащим 0.1 мМ дитиотреитола и 1.0 мМ ЭДТА. К разбавленной плазме при перемешивании добавляли кристаллический (NH4)2SO4 до 70% насыщения (560 г/л). Преципитат собирали центрифугированием, осадок растворяли в 0.05 М Na-фосфатном буфере с рН 7.0, содержащем 1.5 М (NH4)2SO4, и наносили на колонку (2.6×15 см) фенил-сефарозы (Amersham-Pharmacia). Белки элюировали понижающимся градиентом (NH4)2SO4 в фосфатном буфере. Фракции, содержащие активность ДПП-4, собирали, концентрировали добавлением (NH4)2SO4, а полученный осадок растворяли в 0.02 М трис-HCl буфере с рН 7.5, содержащем 0.1 мМ дитиотреитола и 1.0 мМ ЭДТА и наносили на колонку (2.6×90 см) с сефадексом G-100 (Amersham-Pharmacia). Белки элюировали тем же буфером со скоростью 30 мл/час. Активные фракции собирали, концентрировали ультрафильтрацией на мембране UM-30 (Amicon) и хроматографировали на колонке конканавалин-A-сефарозы (Amersham-Pharmacia). Окончательную очистку проводили ионообменной хроматографией на колонке MonoQ (Amersham-Pharmacia). Полученный препарат ДПП-4 представлял собой димер с молекулярной массой при гель-хроматографии на ультрагеле АсА-34 220 Kd. Фермент был гомогенен при электрофорезе в геле полиакриламида в присутствии додецилсульфата Na и имел значение молекулярной массы для мономера около 110 Kd.
Очищенную ДПП-4 концентрировали методом ультрафильтрации и хранили при
-80°C.
Дипептидилпептидаза-II.
Фермент очищали из плаценты крупного рогатого скота. Разделение активностей ДПП-2 и ДПП-4 в процессе выделения контролировали по гидролизу субстрата Lys-Ala-AMC при рН 5.5 (специфично для ДПП-2) в отличие от гидролиза Gly-Pro-АМС, расщепляемого с оптимумом рН при 7.5.
Для выделения ДПП-2 использовали модифицированную по сравнению с описанной для плаценты человека процедуру. Частичную очистку ДПП-2 из гомогената проводили фракционированием сульфатом аммония, хроматографией на DEAE-целлюлозе (Wathman) и фенил-сефарозе (Amesham-Pharmacia). Полученный препарат фермента хранили при -80°C.
Кроме того, в качестве ферментного препарата использовали плазму крови человека.
Пролилэндопептидаза.
Очистку пролилэндопептидазы из эритроцитов крови человека проводили методом ионообменной хроматографии на DEAE-сефадексе А-50 (Amersham-Phamacia), гель-хроматографии на сефадексе G-75 (Amersham-Phamacia) и высокоэффективной хроматографии на колоне MonoQ (Amersham-Phamacia) в системе FPLC. Полученный препарат ПЭП представлял собой мономер и был гомогенен при элетрофорезе в геле полиакриламида в присутствии додецилсульфата Na и имел значение молекулярной массы 75 Kd.
Очищенную ПЭП концентрировали методом ультрафильтрации и хранили при
-80°C.
Определение активности протеиназ
За единицу активности фермента принимали его количество, расщепляющее 1 мкмоль субстрата за 1 мин.
Определение дипептидилпептидазы-IV (КФ 3.4.14.5, CD26).
Активность ДПП-4 определяли по гидролизу субстрата Gly-Pro-7-амино-4-метилкумарина (Bachem) флуорометрически.
Протокол измерения:
Последовательно смешивали 20 мкл раствора фермента (от 0.5 до 5 мкг фермента) с 760 мкл 0.02М Трис-HCl буфера рН 8.0 и 20 мкл раствора Gly-Pro-AMC (1 мг/мл в DMSO), энергично перемешивали и инкубировали при 37°C в течение 20 мин. Реакцию останавливали 200 мкл 20% уксусной кислоты. Флуоресценцию 4-метил-кумарил-7-амида измеряли при длине волны возбуждения 380 нм и флуоресценции 460 нм.
Удельную активность определяли по формуле:
A=[(E-C)/(S-B)]*t-1*v-1,
где E - флуоресценция пробы (380/460 нм); C - флуоресценция смеси, содержащей по 20 мкл субстрата и фермента, 760 мкл буфера (рН 6.0), и 200 мкл 20% уксусной кислоты; B - флуоресценция смеси, содержащей 20 мкл субстрата, 780 мкл буфера и 200 мкл уксусной кислоты; S - флуоресценция смеси, содержащей 20 мкл субстрата, 780 мкл и 200 мкл уксусной кислоты и 1 мкл раствора 7-амино-4-метилкумарина (1 нмоль).
Определение дипептидилпептидазы-II (КФ 3.4.14.2, ДПП-2)
Активность ДПП-2 определяли по гидролизу субстрата Lys-Ala-7-амино-4-метилкумарина (Bachem) флуорометрически при рН 5.5 (для гидролиза субстрата Gly-Pro-AMC оптимум наблюдали при рН 8).
Протокол измерения:
Последовательно смешивали 20 мкл раствора фермента (от 0.5 до 5 мкг фермента) с 760 мкл 0.1М Na-фщсфатного буфера рН 5.5 и 20 мкл раствора Lys-Ala-AMC (1 мг/мл в DMSO), энергично перемешивали и инкубировали при 37°С в течение 20 мин. Реакцию останавливали 200 мкл 20% уксусной кислоты. Флуоресценцию 4-метил-кумарил-7-амида измеряли при длине волны возбуждения 380 нм и флуоресценции 460 нм.
Удельную активность определяли по формуле:
A=[(E-C)/(S-B)]*t-1*v-1,
где E - флуоресценция пробы (380/460 нм); C - флуоресценция смеси, содержащей по 20 мкл субстрата и фермента, 760 мкл буфера (рН 5.5), и 200 мкл 20% уксусной кислоты; B - флуоресценция смеси, содержащей 20 мкл субстрата, 780 мкл буфера и 200 мкл уксусной кислоты; S - флуоресценция смеси, содержащей 20 мкл субстрата, 780 мкл и 200 мкл уксусной кислоты и 1 мкл раствора 7-амино-4-метилкумарина (1 нмоль).
Определение дипептидилпептидазы-I (КФ 3.4.14.1; катепсин C, ДПП-1)
В эксперименте использовали коммерческий препарат катепсина C из селезенки быка (С-8511, Sigma-Aldrich) с удельной активностью ≥5 ед./мг белка.
Активность ДПП-1 измеряли двумя способами - спектрофотометрически с субстратом His-Ser-p-нитроанилидом (His-Ser-pNA, Bachem, Heidelberg, Germany) и флуорометрически с субстратом Gly-Arg-7-амино-4-метилкумарином (Gly-Arg-АМС, Bachem).
Спектрофотометрический метод определения активность ДПП-1.
От 0.25 до 10 мкг ферментного препарата ДПП-1 инкубировали в течение 5 мин при 37°C в 500 мкл активационного буфера (100 mM Na2HPO4 с рН 6.0, содержащего 20 mM NaCl, 1 mM EDTA и 4 mM цистеина), добавляли 400 мкл субстратного буфера (100 mM Na-фосфатный буфер с рН 6, содержащий 20 mM NaCl, 1 mM EDTA, 125 mM His-Ser-pNA и 1% DMSO). Освобождение p-нитроанилина регистрировали в течение 10 мин на спектрофотометре DU-50 (Beckman, USA) при 410 нм. Количество р-нитроанилина определяли на основании коэффициента молярной экстинкции 8800 M-1л-1см-1.
Флуорометрический метод определения активность ДПП-1.
В качестве субстрата в этом определении использовали Gly-Arg-7-амино-4-метилкумарином (Gly-Arg-AMC, Bachem). Освобождение 4-метил-кумарил-7-амина регистрировали на спектрофлуорометре LS-5-B (Perkin-Elmer).
Протокол измерения:
Последовательно смешивали 20 мкл раствора фермента (от 0.5 до 5 мкг фермента) с 760 мкл 0.1М Na-фосфатного буфера рН 6.0 и 20 мкл раствора Gly-Arg-AMC (1 мг/мл в DMSO), энергично перемешивали и инкубировали при 37°C в течение 20 мин. Реакцию останавливали 200 мкл 20% уксусной кислоты. Флуоресценцию 4-метил-кумарил-7-амида измеряли при длине волны возбуждения 380 нм и флуоресценции 460 нм.
Удельную активность определяли по формуле:
A=[(E-C)/(S-B)]*t-1*v-1,
где E - флуоресценция пробы (380/460 нм); C - флуоресценция смеси, содержащей по 20 мкл субстрата и фермента, 760 мкл буфера (рН 6.0), и 200 мкл 20% уксусной кислоты; B - флуоресценция смеси, содержащей 20 мкл субстрата, 780 мкл буфера и 200 мкл уксусной кислоты; S - флуоресценция смеси, содержащей 20 мкл субстрата, 780 мкл и 200 мкл уксусной кислоты и 1 мкл раствора 7-амино-4-метилкумарина (1 нмоль).
Дипептидилпептидаза 8/9 (ДПП-8/9)
Для определения активности дипептидилпептидазы 8/9 использовали так называемый «желатиназный» метод, что отличает ее от других дипептидилпептидаз, которые желатину не гидролизуют. Ферментный препарат получали из лейкоцитов периферической крови человека различными хроматографическими процедурами.
Пролилэндопептидаза (КФ 3.4.21.26, ПЭП)
Активность ПЭП определяли аналогично определению ДПП-4 с использованием флуорогенного субстрата Z-Ala-Pro-AMC, где Z=бензилоксикарбонил).
В эксперименте использовали очищенный из эритроцитов человека фермент.
Пролидаза (КФЗ.4.13.9).
В эксперименте использовали очищенную из почек свиньи пролидазу (Sigma-Aldrich, Р6675). Фермент избирательно гидролизует дипептиды типа Хаа-Pro (частично Xaa-Hyp) и не гидролизует дипептид Pro-Pro.
Принцип определения фермента основан на мониторинге катализируемого ферментом расщепления субстрата Gly-L-Pro при 40°C и рН 8.0 в кювете спектрофотометра при длине волны 242 нм в 1-см кварцевой кювете.
За 1 единицу активности принимали количество фермента, гидролизующее 1 мкмоль Gly-Pro за 1 мин.
В определении использованы следующие реактивы фирмы Sigma-Aldrich:
A. 50 мМ трис-HCl буфер, рН 8.0 (готовится 100 мл из Trizma base (Т-1503), доводится 1н. HCl до рН 8.0 при 40°C);
Б. 30 мМ раствор глутатиона (GSH) (готовится непосредственно перед использованием 5 мл на деионизованной воде из восстановленного глутатиона (G-4251));
B. 20 мМ раствор MnCl2 (готовится 10 мл раствора на деионизованной воде (MnCl2·4H2O, М-3634));
Г. 25 мМ Gly-L-Pro (готовится 30 мл на растворе A, используя Gly-L-Pro (G-3002). Значение рН доводят до 8.0 при 40°C, используя при необходимости 1н HCl или NaOH);
Д. Раствор пролидазы (готовится непосредственно перед использованием раствор с содержанием фермента около 5 мг/мл в холодном растворе А).
Протокол измерения:
Готовят активированный фермент, смешивая (в мл) следующие растворы точно в перечисленном порядке:
| Раствор А (буфер) | 2.40 |
| Раствор В (MnCl2) | 0.40 |
| Раствор Б (GSH) | 0.10 |
| Раствор Д (пролидаза) | 0.20 |
Перемешивают и инкубируют при 40°C в течение 20, 25 и 30 мин. Сразу после окончания активации помещают в кварцевую кювету спектрофотометра DU-50 (Beckman-Coulter):
| Опыт | Контроль | |
| Раствор Г (Gly-Pro, мл) | 2.70 | 2.70 |
| Раствор В (MnCl2, мл) | 0.20 | 0.20 |
Перемешивают и нагревают до 40°C. Регистрируют оптическую плотность при 242 нм до стабильного значения. Затем добавляют, мл:
| Активационная смесь с ферментом | 0.50 |
| Активационная смесь без фермента | 0.50 |
Быстро перемешивают и регистрируют снижение оптической плотности около 5 мин.
Вычисления:
Е д . ф е р м . / м л = ( Δ A 242 н м / м и н О п ы т − ( Δ А 242 н м / м и н К о н т р о л ь ) ( 3.1 ) ( 3.4 ) ( 0.0254 ) ( 0.5 ) ( 0.2 )
| 3.1= | объем (в мл) активационной смеси |
| 3.4= | объем (в мл) реакционной смеси |
| 0.0254= | миллимолярный коэффициент экстинкции для Gly-Pro при 242 нм |
| 0.5= | объем (в мл) использованного в определении фермента |
| 0.2= | объем (в мл) использованного при активации фермента |
Определение степени ингибирования (IC50) пептидаз лимиглидолом и препаратами сравнения (ситаглиптином и вилдаглиптином).
В эксперименте использовали препараты ингибиторов в концентрации 0.1, 1, 10 и 100 мкМ. Для каждой концентрации измерения проводили в присутствии различных концентраций Gly-Pro-АМС (0.006, 0.024, 0.10, 0.39, 1.56, 1.25, 6.25, 25 и 100 nM. Было проведено три отдельных эксперимента в трех параллельных измерениях.
Параметры ингибирования определяли в программе Prism-4 (GraphPad Software Inc., San Diego, CA, USA).
Протокол измерения:
К 20 мл раствора фермента (около 5 мг/мл белка) или неочищенной плазмы крови добавляли 740 мкл 0.02 М Трис-HCl с рН 8.0, 20 мкл раствора лимиглидола, ситаглиптина или вилдаглиптина и преинкубировали при 37°C в течение 30 мин. Затем к смеси добавляли 20 мкл раствора субстрата в DMSO и продолжали инубировать в тех же условиях в течение 20 мин. Реакцию останавливали добавлением 200 мкл 20% раствора уксусной кислоты. Флуоресценцию освободившегося в процессе ферментативной реакции 4-метил-кумарил-7-амида измеряли при длине волны возбуждения 380 нм и флуоресценции 460 нм. Графическое представление полученных результатов.
Для статистического анализа и графического представления полученных результатов использовали пакет программ Prizm 4 (GraphPad Software, Inc.). Результаты по изучению влияния на активность ДПП-4 в образцах плазмы крови всеми изученными соединениями представлены в табл.1.
| Таблица 1 | ||||
| Влияние препаратов на активность дипептидилпептидазы IV в плазме крови больных диабетом (n=7) и здоровых добровольцев (n=6) | ||||
| Препарат | Остаточная активность дипептидилпептидазы IV (%) | |||
| Концентрация соединения нмоль | ||||
| 0 | 1 | 10 | 100 | |
| Плазма 1 | 100.0±8.2 | - | - | |
| Плазма 1+Лимиглидол | 100.0±8.2 | 72.5±6.9 | 27.8±3.4 | 4.9±0.5 |
| Плазма 1+Ситаглиптин | 100.0±8.2 | 43.8±5.7 | 12.3±3.5 | 1.5±0.4 |
| Плазма 1+Вилдаглиптин | 100.0±8.2 | 29.5±4.8 | 8.4±1.6 | 0.6±0.2 |
| Плазма 2 | 100.0±5.9 | - | - | - |
| Плазма 2+Лимиглидол | 100.0±5.9 | 81.4±9.5 | 35.9±5.7 | 5.7±2.3 |
| Плазма 2+Ситаглиптин | 100.0±5.9 | 34.6±6.8 | 23.8±6.7 | 3.1±1.8 |
| Плазма 2+Вилдаглиптин | 100.0±5.9 | 35.8±7.2 | 19.5±7.2 | 2.1±1.2 |
Как видно из таблицы, активность ДПП-4 в плазме крови угнеталась всеми изученными препаратами в диапазоне концентраций от 1 до 100 нмоль.
Предварительно можно сказать, что наибольшая ингибиторная активность наблюдается у препарата сравнения Вилдаглиптин. Лимиглидол и используемый нами в качестве другого препарата сравнения Ситаглиптин уступают ему незначительно. Для сравнения ингибиторных свойств Лимиглидола с препаратами Ситаглиптином и Вилдаглиптином было проведено исследование кинетики ингибирования очищенного из плазмы крови человека фермента.
Изучение кинетики ингибирования очищенной дипептидилпептидазы IV Лимиглидолом, Ситаглиптином и Вилдаглиптином.
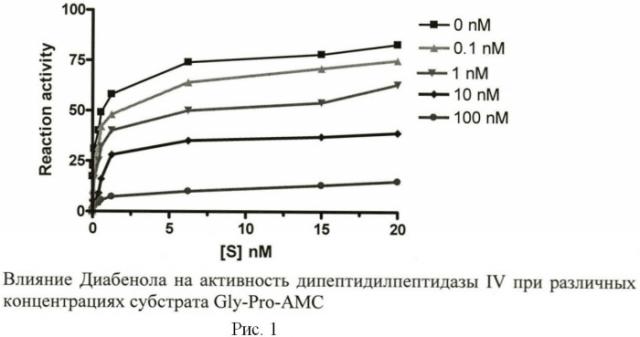
Ингибирование Лимиглидолом активности очищенной. ДПП-4 представлены на рисунке 1 (влияние Диабенола на активность дипептидилпептидазы IV при различных концентрациях субстрата Gly-Pro-AMC).
Как видно из рисунка 1, ДПП-4 ингибируется препаратом Лимиглидол достаточно эффективно.
В следующем эксперименте было проведено сравнительное изучение ингибиторной активности препаратов Лимиглидол, Ситаглиптин и Вилдаглиптин.
Полученные нами в одном эксперименте значения IC50 для препаратов сравнения Ситаглиптин и Вилдаглиптин данные соответствуют данным литературы. Значения IC50 для них, рассчитанные из уравнения Ченга-Пруссофа, находились в диапазоне 5.1±2.3 нмоль/л (Вилдаглиптин), 24.7±9.4 нмоль/л (Ситаглиптин), и 150.5±17.9 нмоль/л для Лимиглидола.
Взаимодействие Лимиглидола и препаратов сравнения с другими родственными ДПП-4 ферментами изучали на очищенных коммерческих препаратах пролидазы и катепсина С (ДПП-1).
Пролилэндопептидаза, ДПП-2 и ДПП-4 были выделены и очищены в лаборатории психофармакологии НИИ фармакологии им. В.В.Закусова РАМН.
Влияние Лимиглидола, Ситаглиптина и Вилдаглиптина на активность родственных ДПП-4 ферментов.
Было также изучено влияние Лимиглидола и препаратов сравнения на активность ДПП-1, ДПП-2, пролидазы, пролилэндопептидазы.
Результаты этого исследования представлены в табл.2.
| Таблица 2 | |||||
| Влияние Лимиглидола, Ситаглиптина и Вилдаглиптина на активность дипептидилпептидаз 1, 2, 8/9, пролилэндопептидазы и пролидазы | |||||
| Препарат | IC50 (мкмоль/л) | ||||
| ДПП 8/9 | ДПП-2 | ДПП-1 | ПЭП | Пролидаза | |
| Лимиглидол | 23±6 | 2400±320 | 3200±290 | 6500±870 | >800000 |
| Ситаглиптин | 9±2 | 3200±160 | 9150±490 | 1800±230 | >1000000 |
| Вилдаглиптин | 6±2 | 1205±230 | 21000±1500 | 1500±270 | >1000000 |
Как видно из табл.2 все исследованные препараты практически не проявляли избирательности по отношению к ферментам, близким по специфичности ДПП-4. Полученные в эксперименте результаты показали, что препарат Лимиглидол обладает высокой ингибирующей активность по отношению к очищенной из плазмы крови человека дипептидилпептидазе IV. Препараты сравнения - Ситаглиптин и Вилдаглиптин также показали в данном исследовании высокую ингибиторную активность.
Лимиглидол и препараты сравнения не проявили в достаточной степени ингибирующих свойств по отношению к другим протеиназам - дипептидилпептидазам 1, 2, 8/9, пролилэндопептидазе и пролидазе. Таким образом, препарат Лимиглидол обладает высокой селективностью по отношению к дипептидилпептидазе IV.
Выявленная у Лимиглидола ингибирующая ДПП-4 активность при высокой селективности в отношении последней обусловили возможность следующих эффектов при применении Лимиглидола. Снижение активности ДПП-4 и родственных ей ферментов приводит к стабилизации поступившего извне инкретина, т.е применением Лимиглидола можно контролировать расщепление инкретина в крови, чем достигается нормализация уровня инкретинов. Из этого следует возможность применения Лимиглидола для предотвращения, замедления прогрессирования и/или лечения состояний/заболеваний, опосредованных ферментом дипептидилпептидазой IV, предпочтительно для нормализации уровня инкретинов в крови и/или нормализации функции эндотелиальных клеток.
Таким образом, в соответствии с изобретением предлагается применение Лимиглидола для предотвращения, замедления прогрессирования и/или лечения следующих состояний или заболеваний, в патогенез которых вовлечен фермент ДПП-4: бесплодие, синдром поликистоза яичников, нарушения роста, слабость, артрит, отторжение аллотрансплантата при трансплантации, аутоиммунные заболевания (такие как склеродермия и рассеянный склероз), различные иммуномодуляторные заболевания (такие как красная волчанка или псориаз), СПИД, кишечные заболевания (такие как некротический энтерит, заболевание с включениями микроворсин или заболевание брюшной полости), синдром воспаления кишечника, атрофию или поражение слизистой оболочки кишечника, вызванные химиотерапией, нервную анорексию, остеопороз, сахарный диабет, синдром X, дисметаболический синдром, осложнения при диабете, глюкозурия, гиперлипидемия, метаболические ацидозы, гиперинсулинемию, ожирение, атеросклероз и родственные заболевания, а также воспалительные заболевания кишечника (такие как болезнь Крона и язвенный колит), при этом больному, нуждающемуся в лечении, назначают прием терапевтически эффективного количества ингибитора ДПП-4.
Подвижность сперматозоидов/контрацепция мужчины: фармацевтические композиции, включающие ингибиторы ДПП-4, можно применять для изменения подвижности сперматозоидов и для контрацепции мужчины, так как в семенной жидкости важные для подвижности сперматозоида простатосомы, органеллы, производимые простатой, обладают сверхвысокими уровнями активности ДПП-4 (Eur. J. Clin. Chem. Clin. Biochem 30, 333-338 (1992)).
Дефицит гормона роста: фармацевтические композиции можно применять для лечения дефицита гормона роста, исходя из гипотезы, что рилизинг-фактор гормона роста (GRF), пептид, стимулирующий высвобождение гормона роста из передней доли гипофиза, расщепляется ферментом ДПП-4 in vivo (WO 00/56297). Следующие данные свидетельствуют, что GRF является эндогенным субстратом: (1) GRF эффективно расщепляется in vitro с образованием неактивного продукта GRF [3-44] (ВВА 1122, 147-153 (1992)); (2) GRF быстро разлагается в плазме до GRF [3-44]; указанные явления можно предотвращать воздействием ингибитора ДПП-4 дипротина A; и (3) GRF [3-44] обнаруживают в плазме трансгенных свиней с человеческим GRF (J. Clin. Invest. 83, 1533-1540 (1989)). Следовательно, ингибиторы ДПП-4 можно применять для того же спектра симптомов, которые обсуждаются для стимуляторов секреции гормона роста.
Повреждение кишечника: потенциальное применение фармацевтических композиций, содержащих ингибиторы ДПП-4, для лечения повреждения кишечника подсказано результатами исследований, указывающих, что глюкагоноподобный пептид-2 (GLP-2), вероятный эндогенный субстрат для ДПП-4, может вызывать трофическое воздействие на кишечный эпителий (Regulatory Peptides 90, 27-32 (2000)). Введение GLP-2 приводит к увеличению массы тонкой кишки у грызунов и смягчает повреждение кишечника в моделях колита и энтерита у грызунов.
Иммунодепрессия: ингибирование ДПП-4 посредством фармацевтических композиций, содержащих ингибиторы ДПП-4, можно применять для модуляции иммунной реакции, основываясь на исследованиях причастности фермента ДПП-4 к активации T-клеток и к процессингу хемокинов, и на эффективности ингибиторов ДПП-4 в моделях заболевания in vivo.
ВИЧ-инфекция: фармацевтические композиции, включающие ингибиторы ДПП-4, можно применять для лечения или предотвращения ВИЧ-инфекции или СПИДа, потому что ряд хемокинов, которые ингибируют проникновение ВИЧ-клеток, являются потенциальными субстратами для ДПП-4 (Immunology Today 20, 367-375 (1999)). В случае альфа-SDF-l расщепление уменьшает противовирусную активность (PNAS 95, 6331-6 (1998)). Таким образом, при ингибировании ДПП-4 можно ожидать стабилизации альфа-SDF-l для уменьшения инвазивной способности ВИЧ.
Ожирение: фармацевтические композиции, содержащие ингибитор ДПП-4, можно применять для лечения ожирения. Такое лечение основано на наблюдаемом ингибирующем влиянии GLP-1 и GLP-2 на всасывание пищи и опорожнение желудка. Экзогенное введение GLP-1 существенно уменьшает всасывание пищи и замедляет опорожнение желудка у человека (AmJ. Physiol. 277, R910-R916, 1999). ICV-введение GLP-1 крысам и мышам также значительно влияет на всасывание пищи (Nature Medicine 2, 1254-1258 (1996)). У мышей GLP-1R* такого ингибирования всасывания съеденной пищи не наблюдается, что указывает на то, что данные эффекты опосредованы рецепторами GLP-1 мозга. По аналогии с GLP-1 вероятно, что GLP-2 также регулируется ДПП-4. ICV-введение GLP-2 также ингибирует всасывание пищи, аналогично эффектам, наблюдаемым для GLP-1 (Nature Medicine 6, 802-807, 2000).
Гемопоэз: фармацевтические композиции, включающие ингибиторы ДПП-4, можно применять для лечения или предотвращения гемопоэза, потому что ДПП-4 может быть вовлечен в гемопоэз. Ингибитор ДПП-4, Val-Boro-Pro, стимулировал гемопоэз в модели нейтропении мышей, индуцированной циклофосфамидом (WO 99/56753).
Нейронные расстройства: фармацевтические композиции, включающие ингибиторы ДПП-4, можно применять для лечения или предотвращения различных нейронных или психиатрических расстройств, потому что ряд пептидов, вовлеченных в различные нейронные процессы, расщепляется ДПП-4 in vitro. Следовательно, ингибитор ДПП-4 может обладать терапевтическим преимуществом при лечении нейронных расстройств.
Инвазия (прорастание) опухоли и метастазов: фармацевтические композиции, включающие ингибиторы ДПП-4, можно применять для лечения или предотвращения инвазии опухоли и метастазов, потому что во время трансформации нормальных клеток в злокачественный фенотип наблюдается увеличение или уменьшение экспрессии некоторых эктопептидаз, включая ДПП-4 (J. Exp. Med. 190, 301-305 (1999)). Повышение и понижение уровня таких протеинов, по-видимому, является специфичным в отношении различных типов тканей и клеток. Например, наблюдается повышенная экспрессия CD26/ДПП-4 при Т-клеточной лимфоме, T-клеточном остром лимфобластном лейкозе, при карциномах щитовидной железы клеточного происхождения, базально-клеточных карциномах и карциномах молочной железы. Таким образом, фармацевтические композиции, содержащие ингибиторы ДПП-4 можно применять в лечении таких карцином.
Доброкачественная гипертрофия предстательной железы (ВРН): фармацевтические композиции, включающие ингибиторы ДПП-4, можно применять для лечения доброкачественной гипертрофии предстательной железы, так как у пациентов с BPH отмечается повышенная активность ДПП-4 в ткани простаты (Eur. J. Clin. Chem. Clin. Biochem 30, 333-338 (1992)).
Гингивит: фармацевтические композиции, включающие ингибиторы ДПП-4, можно применять для лечения гингивита, так как в некоторых исследованиях, устанавливающих связь с тяжестью периодонтального заболевания, обнаружена активность ДПП-4 в десневой жидкости, находящейся в десневой борозде (Arch. Oral Biol. 37, 167-173 (1992)).
Остеопороз: фармацевтические композиции, включающие ингибиторы ДПП-4, можно применять для лечения или профилактики остеопороза, так как в остеобластах присутствуют GIP-рецепторы.
Принимая во внимание эффекты инкретинов на секрецию глюкагона, применение Лимиглидола является целесообразным для пациентов, для которых будет полезным нормализация уровня глюкагона и его соотношения с инсулином, и достигаемый за счет этого улучшенный контроль за уровнем глюкозы в крови, например больных с диабетом или преддиабетом, для которых показаны ингибиторы ДПП-4, предпочтительно для пациентов с сахарным диабетом 2 типа с нормальной или избыточной массой тела, диабетом с эндокринопатией, с медленно прогрессирующим сахарным диабетом 1 типа у взрослых на ранних стадиях и в сочетании с инсулином, диабетом в молодом возрасте (MODY диабет), а также больных сахарным диабетом с сопутствующими осложнениями, такими как ретинопатия, невропатия, нефропатия.
Согласно изобретения предлагается также фармацевтическая композиция, обладающая ингибирующим ДПП-4 действием, которая содержит Лимиглидол в терапевтически эффективном количестве и фармацевтически приемлемые вспомогательные вещества.
Заявляемая композиция предназначена для млекопитающего, предпочтительно человека, мужчины или женщины, нуждающегося в ингибировании активности фермента дипептидилпептидазы-IV. Предпочтительно фармацевтическая композиция предназначена для нормализации уровня инкретинов в крови. В другом предпочтительном варианте фармацевтическая композиция предназначена для нормализации функции эндотелиальных клеток.
Более конкретно заявляемая композиция предназначена для лечения таких заболеваний или состояний, как бесплодие, синдром поликистоза яичников, нарушения роста, слабость, артрит, отторжение аллотрансплантата при трансплантации, аутоиммунные заболевания (такие как склеродермия и рассеянный склероз), различные иммуномодуляторные заболевания (такие как красная волчанка или псориаз), СПИД, кишечные заболевания (такие как некротический энтерит, заболевание с включениями микроворсин или заболевание брюшной полости), синдром воспаления кишечника, атрофию или поражение слизистой оболочки кишечника, вызванные химиотерапией, нервную анорексию, остеопороз, синдром X, дисметаболический синдром, осложнения при диабете, гиперинсулинемия, глюкозурия, гиперлипидемия, метаболические ацидозы, ожирение, атеросклероз и родственные заболевания, а также воспалительные заболевания кишечника (такие как болезнь Крона и язвенный колит), а также таких больных сахарным диабетом, для лечения которых эффективно применение ингибиторов ДПП-4, и больных сахарным диабетом с сопутствующими осложнениями, такими как ретинопатия, невропатия, нефропатия.
Предлагаемое лекарственное средство выполняют в виде различных лекарственных форм, предпочтительно твердых лекарственных форм - таблеток, таблеток с замедленным/пролонгированным высвобождением, капсул, гранул, порошков. В качестве вспомогательных веществ могут быть использованы вещества, обычно применяемые в фармацевтической промышленности для производства твердых лекарственных форм, например, крахмал, сахарид, целлюлоза и ее производные, желатин, поливинилпирролидон, полиэтиленоксид, фосфат кальция, лубрикант, смачивающий агент, как натрийлаурилсульфат, сложные эфиры полиоксиэтиленсорбитана и жирных кислот (твины), сложные эфиры сорбитана и жирных кислот (спаны), предпочтительно крахмал, в том числе модифицированный, лактоза, микрокристаллическая целлюлоза, натрийкроскарбоксиметилцеллюлоза, поливинилпирролидон, вспомогательные вещества - ингибиторы высвобождения, лубрикант. Примерами последнего являются стеариновая кислота и/или ее соли - стеарат кальция, стеарат магния, стеарат цинка, тальк, коллоидная двуокись кремния, аэросил, полиэтиленгликоль, гидрогенизованное растительное масло, жидкий парафин. Новая композиция может также содержать ароматизаторы,