Рекомбинантная трехвалентная вакцина от гриппа человека
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и генной инженерии. Предложена рекомбинантная трехвалентная вакцина от гриппа человека, содержащая три типа нереплицирующихся наночастиц на основе генома аденовируса человека 5-го серотипа, каждый из которых несет разные гены гемагглютинина вируса гриппа, причем вакцина содержит дополнительно иммуностимулятор и буфер. Изобретение может быть использовано в медицине в целях вакцинации от вируса гриппа. 5 з.п. ф-лы, 9 ил., 2 табл., 8 пр.
Реферат
Изобретение относится к области медицины, в частности к вакцинопрофилактике инфекционных заболеваний респираторного тракта человека, в том числе гриппа.
Грипп - высококонтагиозное вирусное заболевание людей, птиц и млекопитающих животных. В мире каждый год регистрируются сезонные подъемы заболеваемости гриппом (эпидемии), вызванные вирусами типа А или В, приводящие к увеличению смертности и значительному экономическому ущербу. Как правило, наиболее тяжелые заболевания вызывают вирусы гриппа А. Среди многих подтипов вирусов гриппа А в настоящее время среди людей циркулируют подтипы гриппа A(H1N1) и A(H3N2). Эти вирусы широко распространены в природе и могут поражать людей, многие виды млекопитающих (лошадей, свиней, тюленей и т.д.) и птиц, они могут представлять угрозу пандемии с большим количеством человеческих жертв (Gorman O.T. et al., Evolutionary processes in influenza viruses: divergence, rapid evolution, and stasis, Curr. Top. Microbiol. Immunol., 1992, №176, с.75-97 - Эволюционный процесс у вируса гриппа: дивергенция, быстрая эволюция и застой), (Грипп, Информационный бюллетень, 2009, №211, доступен: http://www.who.int/mediacentre/factsheets/fs211/ru/index.html).
Защита человека от постоянных атак вирусов гриппа осложняется трудностью прогнозирования появления новых пандемических и эпидемических штаммов, а также низкой перекрестной реактивностью вакцин, большинство из которых обеспечивают хорошую защиту только от того штамма вируса гриппа из которого они были произведены.
Для решения проблемы защиты от вируса гриппа птиц максимального числа людей в случае пандемии, вызванной этим вирусом, ВОЗ предлагает вести работы по трем направлениям: увеличение применения вакцин против сезонных эпидемий гриппа, увеличение производственных возможностей для наработки большого количества вакцин в случае пандемии и проведение исследований по получению новых эффективных вакцин, в том числе получение новых типов вакцин, таких как рекомбинантные субъединичные вакцины, ДНК-вакцины и вакцины на основе вирусных векторов и вирусоподобных частиц (Abdulhaqq S.A., Weiner D.B. DNA Vaccines: developing new strategies to enhance immune responses, 2008, №42, с.219-232 - Вакцины: разработка новых стратегий для усиления иммунного ответа).
Одним из наиболее эффективных на сегодняшний день подходов для решения вышеописанных задач является использование генетических вакцин, базирующихся на аденовирусных векторах (Zaia J.A., The status of gene vectors for the treatment of diabetes, Cell Biochem. Biophys, 2007, №48 (2-3), с.183-90 - Статус генетических векторов для лечения сахарного диабета). При введении в организм таких вакцин происходит попадание генетического материала в клетки организма и экспрессия в них генов целевых белков патогена. В результате антигены соответствующих патогенов распознаются иммунной системой, что приводит к индукции как гуморального, так и клеточного иммунного ответа (Карпов А.П. и др. Конструирование рекомбинантных аденовирусов птиц CELO, экспрессирующих гены гликопротеинов gB, gE, gI вируса болезни Марека, Биотехнология, 2007, №5, с.38-44), (Knoblich H.V. et al., Antibody titers to infectious bursal disease virus in broiler chicks after vaccination at one day of age with infectious bursal disease virus and Marek's disease virus, Avian Dis., 2000, №44 (4), с.874-84 - Титры антител к вирусу Бурсальной болезни у цыплят-бройлеров после вакцинации в однодневном возрасте вирусами Бурсальной болезни и вирусом болезни Марека).
На сегодняшний момент наиболее хорошо изученным и часто используемым для генетической вакцинации является рекомбинантный аденовирус человека пятого серотипа. Вакцины на основе рекомбинантного аденовируса человека пятого серотипа имеют ряд преимуществ перед другими генетическими вакцинами. Во-первых, рекомбинантные аденовирусы являются репликативно-дефектными и не способны вызывать заболевания. Безопасность аденовирусов человека пятого серотипа с делегированными Е1 и Е3 областями генома подтверждается целым рядом проведенных клинических испытаний различных вакцинных и терапевтических препаратов на их основе (Hoelscher M.A. et al., Development of adenoviral-vector-based pandemic influenza vaccine against antigenically distinct human H5N1 strains in mice, Lancet, 2006, №367 (9509), с.475-81 - Разработка аденовекторных пандемических вакцин от гриппа против антигенно различных человеческих штаммов H5N1 на мышах), (Van Kampen K.R. et al., Safety and immunogenicity of adenovirus-vectored nasal and epicutaneous influenza vaccines in humans, Vaccine, 2005, №23(8), с.1029-36 - Безопасность и иммуногенность аденовекторных назальных и накожных противогриппозных вакцин у человека). Во-вторых, рекомбинантные аденовирусы позволяют проводить интраназальную иммунизацию и, как следствие, индуцируют образование мукозального иммунного ответа. В-третьих, на сегодняшний момент разработаны быстрые и гибкие технологии получения рекомбинантных аденовирусов, позволяющие реализовать масштабное производство различных кандидатных вакцин на основе аденовирусных векторов на одной технологической линии, без ее переоборудования и изменения регламента. Вышеперечисленные свойства делают рекомбинантные аденовирусы хорошей технологической платформой для создания широкого спектра вакцин против различных субтипов вируса гриппа.
Рекомбинантные аденовирусы обладают следующими характеристиками (Harrop R. et al., Recombinant viral vectors: cancer vaccines, Adv. Drug Deliv. Rev., 2006, №58(8), с.931-47 - Рекомбинантные вирусные векторы: вакцины против рака):
- способны трансдуцировать как делящиеся, так и постмитотические клетки (Tang D.C. et al., Overexpression of adenovirus-encoded transgenes from the cytomegalovirus immediate early promoter in irradiated tumor cells, Hum. Gene Ther., 1997, №8(17), с.2117-24 - Гиперэкспрессии трансгенов, кодированных в аденовирусе под действием раннего промотора цитомегаловируса у облученных опухолевых клеток), (Tang D.C. et al., Butyrate-inducible and tumor-restricted gene expression by adenovirus vectors, Cancer Gene Ther., 1994, №1(1), c.15-20 - Бутират-индуцибельная и уничтожающая опухоль экспрессия гена аденовирусными векторами);
- ДНК аденовируса остается в экстрахромосомной форме;
- они могут быть получены в титре более 1010 ЕД/мл, что может позволить использовать их в качестве живых рекомбинантных вакцин для ветеринарии и медицины;
- способны к размножению только в специальных линиях клеток in vitro;
- обеспечивают высокий уровень экспрессии целевого гена в клетке-мишени;
- выводятся из организма в течение 4-5 недель;
- иммунизация рекомбинантными аденовирусами обеспечивает индукцию как клеточного, так и гуморального иммунного ответа (Schagena F.H.E. et al., Immune responses against adenoviral vectors and their transgene products: a review of strategies for evasion, Critical Reviews in Oncology/Hematology, 2004, №50(1), с.51-70 - Иммунный ответ против аденовирусных векторов и их трансгенных продуктов: обзор стратегий устранения);
- процесс получения нового рекомбинантного аденовируса занимает несколько недель, что может позволить быстро реагировать на меняющуюся эпидемиологическую обстановку в максимально сжатые сроки.
Интраназальная иммунизация рекомбинантным аденовирусом человека 5-ого серотипа не приводит к каким-либо нежелательным эффектам (Van Kampen K.R. et al., Safety and immunogenicity of adenovirus-vectored nasal and epicutaneous influenza vaccines in humans, Vaccine, 2005, №23(8), с.1029-36 - Безопасность и иммуногенность аденовекторных назальных и накожных противогриппозных вакцин у человека).
Применение генетических вакцин на основе аденовируса человека 5-ого серотипа может быть ограничено наличием предсуществующего иммунного ответа у людей, уже встречавшихся ранее с этим вирусом (Bangari D.S. et al., Comparative transduction efficiencies of human and nonhuman adenoviral vectors in human, murine, bovine, and porcine cells in culture, Biochem. Biophys. Res. Commun., 2005, №327, с 960-966 - Сравнительная эффективность трансдукции человеческими и нечеловеческими аденовирусными векторами человеческих, мышиных, бовинных и свиных культур клеток).
Однако в отличие от парентерального введения, при интраназальной иммунизации вакцины на основе аденовируса человека 5-ого серотипа могут избегать воздействия предсуществующего иммунного ответа (Van Kampen K.R. et al., Safety and immunogenicity of adenovirus-vectored nasal and epicutaneous influenza vaccines in humans, Vaccine, 2005, №23(8), с.1029-36 - Безопасность и иммуногенность аденовекторных назальных и накожных противогриппозных вакцин у человека). Высокая иммуногенность рекомбинантного аденовируса человека 5-ого серотипа при интраназальном введении приводит к эффективной доставке трансгена через мукозальный барьер. Показано, что даже однократное введение вакцин на основе аденовируса человека 5-ого серотипа приводит к пролонгированной ex vivo экспрессии трансгена, несмотря на предсуществующий иммунный ответ как у лабораторных животных (Wadsworth S.C. et al., Adenovirus vector-infected cells can escape adenovirus antigen-specific cytotoxic T-lymphocyte killing in vivo, J. Virol., 1997, №71(7), с.5189-5196 - Клетки, инфицированные аденовирусным вектором, могут избежать уничтожения аденовирусными антигенно-специфичными цитотоксическими Т-лимфоцитами in vivo). Аналогично и у приматов (Zabner J. et al. Safety and efficacy of repetitive adenovirus-mediated transfer of CFTR cDNA to airway epithelia of primates and cotton rats, Nat. Genet, 1994, №6(1), с.75-83 - Безопасность и эффективность повторяющегося обеспеченного аденовекторами переноса CFTR кДНК на дыхательный эпителий приматов и хлопковых крыс).
Современный уровень формулирования вакцин подразумевает не только индукцию протективного специфического иммунитета, но и индукцию врожденного иммунитета для более широкого спектра противоинфекционной защиты. Одними из ключевых рецепторов врожденной иммунной системы млекопитающих являются Toll-подобные рецепторы (TLR). Рецепторы данного семейства способны распознавать специфические высококонсервативные молекулярные участки (паттерны) в структуре патогенов, инициируя развитие реакций как врожденного, так и приобретенного иммунного ответа, проводя в конечном итоге к элиминации возбудителя из организма. При этом каждый отдельный тип TLR способен связывать широкий спектр молекул микробного происхождения, различных по химическим свойствам и структуре. Таким образом, сегодня полученные данные позволяют повышать иммуногенность вакцинного антигена при совместном применении с веществами, способными взаимодействовать с паттерн-распознающими рецепторами, активация которых приводит к дополнительной стимуляции иммунных реакций. Перспективность описанного подхода подтверждается многочисленными клиническими испытаниями различных лигандов паттернраспознающих рецепторов в качестве молекулярных адъювантов для вакцин (O'Hagan D.T., MF59 is a safe and potent vaccine adjuvant that enhances protection against influenza virus infection MF59, Expert Rev. Vaccines, 2007, №6(5), 699-710 -безопасный и эффективный вакцинный адъювант, который усиливает защиту против инфицирования вирусом гриппа), (Di Paolo D. et al., One-year vaccination against hepatitis В virus with a MPL-vaccine in liver transplant patients for HBV-reIated cirrhosis, Transplint, 2010, №23(11), с.1105-1112 - Вакцинация продолжительностью один год против вируса гепатита В MPL-вакциной у пациентов с трансплантацией печени вследствие цирроза, вызванного вирусом гепатита В).
При разработке противогриппозных вакцин следует учитывать рекомендации ВОЗ, которые говорят о преимуществе использования сезонных трехвалентных вакцин, включающих H1N1 (Пандемический грипп H1N1, 2009, Краткое сообщение №23, 10 августа 2010 г., Женева, доступен: http://www.who.int/csr/disease/swineflu/notes/briefing_20100810/ru/in dex.html).
Итак, для эффективной защиты против респираторных инфекций необходимо создание высокоиммуногенных интраназальных вакцин, вводимых однократно, которые способны одновременно защищать от различных штаммов вируса гриппа и других инфекционных возбудителей респираторных болезней человека.
Известна вакцина против пандемических штаммов вирусов гриппа на основе рекомбинантного аденовирусного вектора, содержащая нуклеотидную последовательность, которая кодирует как минимум один антиген штамма вируса птичьего гриппа (Заявка на выдачу патента США №2008/0187557).
Существенным недостатком данной вакцины является наличие антигенов только птичьего гриппа (штамма H5N1, штамма H7N7 или штамма H9N2), что существенно сужает спектр ее специфичности и не позволяет использовать для профилактики сезонного гриппа человека, вызванного различными субтипами H1, а также других респираторных инфекционных болезней человека. Данная вакцина выбрана авторами в качестве аналога.
Известна также фармацевтическая композиция, содержащая как минимум 4 вектора, при этом каждый вектор способен экспрессировать гемагглютинины или их иммуногенные части различных штаммов вируса гриппа. Данная вакцина способна вызвать иммунный ответ у человека к целевым штаммам вируса гриппа (Заявка на выдачу патента США №2010/00987221).
Вектором в данном техническом решении могут быть плазмиды и различные вирусные векторы, при этом в состав композиции могут вводиться адъюванты. Данное решение принято авторами за прототип.
Недостаткам данной композиции является необходимость проведения бустерной (повторной) вакцинации для получения протективного иммунитета к штаммам вируса гриппа из-за влияния антигенной конкуренции большого количества антигенов в составе вакцины на иммуногенность каждого из них. Кроме того, вакцина не способна активировать врожденный иммунитет и поэтому не индуцируют более широкую иммунную защиту от других видов микроорганизмов.
Задачей, решаемой данным изобретением, является создание трехвалентной вакцины, которая обеспечит при однократном интраназальном введении протективный иммунный ответ у человека в течение 6 месяцев и более ко всем входящим в состав вакцины штаммам вируса гриппа, снижение стоимости производства и затрат препаратов, медицинского инструментария и рабочего времени медицинского персонала при обеспечении возможности быстрого создания вакцины из сезонных эпидемически значимых штаммов, снижение реактогенности вакцины, обеспечение широкого профилактического антимикробного спектра действия вакцины, направленной против возбудителей инфекционных заболеваний респираторного тракта.
Поставленная задача решается за счет того, что рекомбинантная трехвалентная вакцина от гриппа человека содержит рекомбинантный аденовирусный вектор, с нуклеотидной последовательностью, которая кодирует гемагглютинин вируса гриппа, при этом в качестве рекомбинантного аденовирусного вектора используют нереплицирующиеся наночастицы на основе генома аденовируса человека 5-ого серотипа, способные экспрессировать гемагглютинины вируса гриппа, при этом она содержит композицию из трех типов нереплицирующихся наночастиц в эффективном количестве, каждая из которых несет отличные от других гены гемагглютинина вируса гриппа, вакцина также содержит дополнительно пептидогликан и буфер. Генами гемагглютинина вируса гриппа являются: Н1, Н3, НВ, любые рекомендованные на момент производства вакцины Всемирной Организацией Здравоохранения.
Буфер добавляют в композицию до достижения общего объема 0,5 мл, а эффективная доза нереплицирующихся наночастиц со вставкой гемагглютинина Н1, нереплицирующихся наночастиц со вставкой гемагглютинина Н3 и нереплицирующихся наночастиц со вставкой гемагглютинина НВ и пептидогликана содержится в 0,5 мл вакцины.
Рекомбинантная трехвалентная вакцина содержит в объеме 0,5 мл: нереплицирующиеся наночастицы со вставкой гемагглютинина Н1 вируса гриппа A/California/07/09 (H1N1) - не более 107 ЕД активности; нереплицирующиеся наночастицы со вставкой гемагглютинина Н3 вируса гриппа A/Perth/16/2009 (H3N2) - не более 107 ЕД активности; нереплицирующиеся наночастицы со вставкой гемагглютинина НВ вируса гриппа B/Brisbane/60/2008 - не более 107 ЕД активности;
- пептидогликан - 1-20 мкг
- буфер - остальное.
В рекомбинантной трехвалентной вакцине в качестве пептидогликана используют кислый пептидогликан с молекулярной массой от 1200 до 40000 кДа.
Введение рекомбинантной трехвалентной вакцины осуществляют интраназально.
Реализация изобретения
Для решения поставленной задачи были использованы рекомендации ВОЗ, которая рекомендовала вести работы по трем направлениям: увеличение применения вакцин против сезонных эпидемий гриппа, обеспечение возможностей для наработки большого количества вакцин в случае пандемии и проведение исследований по получению новых эффективных вакцин, в том числе получение новых типов вакцин, таких как рекомбинантные вакцины, на основе вирусных векторов и вирусоподобных частиц (Abdulhaqq S. A., DNA Vaccines: developing new strategies to enhance immune responses, 2008, №42, с.219-232 - Вакцины: разработка новых стратегий для усиления иммунного ответа).
Защита человека от постоянных атак вирусов гриппа осложняется трудностью прогнозирования появления новых пандемических и эпидемических штаммов, а также низкой перекрестной реактивностью вакцин, большинство из которых обеспечивают хорошую защиту только от того штамма вируса гриппа, из которого они были произведены, поэтому следующей задачей при разработке вакцины была поставлена задача создания трехвалентной вакцины, которая обеспечит протективный иммунный ответ у человека ко всем входящим в состав вакцины штаммам вируса гриппа, при этом обеспечивается снижение стоимости производства и затрат препаратов, медицинского инструментария и рабочего времени медицинского персонала.
Основная же задача состояла в том, чтобы обеспечить возможность быстрого создания вакцины из сезонных эпидемически значимых штаммов, при этом должна снижаться реактогенность вакцины, и обеспечиваться широкий профилактический антимикробный спектр действия вакцины, направленной против возбудителей инфекционных заболеваний респираторного тракта. При этом созданная вакцина должна вводиться однократно интраназально.
Учитывая перечисленные задачи была создана безопасная экономически выгодная высокоиммуногенная интраназальная рекомбинантная трехвалентная вакцина, содержащая нереплицирующиеся наночастицы на основе генома аденовируса 5-го серотипа, продуцирующая непосредственно на слизистой носовой полости 3 типа эпидемически значимых гемагглютининов вируса гриппа и обладающая способностью вызывать образование протективного иммунитета у человека при однократном введении ко всем входящим в состав штаммам вируса гриппа, а также обеспечивающая стимулирование врожденного иммунитета ко многим микроорганизмам, при этом вакцина пригодна для профилактики инфекционных заболеваний респираторного тракта человека, в частности гриппа.
Геном гемагглютинина Н1 может быть любой гемагглютинин субтипа Н1, в частности, рекомендуемый на момент производства вакцины ВОЗ в зависимости от эпидемической ситуации в мире (http://www.who.int/ru/), например Н1 калифорнийский.
Геном гемагглютинина Н3 может быть любой гемагглютинин субтипа Н3, в частности, рекомендуемый на момент производства вакцины ВОЗ в зависимости от эпидемической ситуации в мире (http://www.who.int/ru/), например Н1 пертский.
Геном гемагглютинина НВ может быть любой гемагглютинин субтипа НВ, в частности, рекомендуемый на момент производства вакцины ВОЗ в зависимости от эпидемической ситуации в мире (http://www.who.int/ru/), например НВ брисбанский.
Использование в фармацевтической и клинической практике заявляемой вакцины позволяет достичь нескольких технических, лечебных и экономических результатов:
- заявляемая вакцина безопасна для человека и вызывает протективный иммунитет к специфическим штаммам вируса гриппа;
- вакцина удобна для применения, так как вводится интраназально однократно для создания напряженного иммунитета на протяжении 6 месяцев и более;
- вакцина пригодна для профилактики гриппа человека, а также инфекционных заболеваний респираторного тракта различной этиологии;
- применение вакцины экономически оправдано, поскольку однократное введение обеспечивает профилактику инфекционных респираторных заболеваний человека, в том числе создает протективный иммунитет к специфическим штаммам вируса гриппа на протяжении всего предэпидемического и эпидемического периодов заболеваемости.
Указанные единые технические, лечебные и экономические результаты при осуществлении изобретения по объекту «вакцина» достигаются за счет того, что заявляемая вакцина осуществляется при помощи нереплицирующихся наночастиц на основе генома аденовируса человека 5-го серотипа, несущих вставку гена гемагглютинина вируса гриппа. Особенность заявляемой вакцины заключается в том, что содержание нереплицирующихся наночастиц, экспрессирующих различные гемагглютинины вируса гриппа (по 107 ЕД активности каждого из 3-х входящих в состав вакцины типов), позволяет вызывать образование специфического протективного иммунитета к каждому из них при однократном интраназальном введении, а также обеспечивает активацию врожденного иммунитета к широкому спектру микроорганизмов, вызывающих заболевания респираторного тракта. Вакцина профилактирует инфекционные респираторные заболевания человека, в частности грипп.
Приведенные далее примеры раскрывают:
- Конструирование нереплицирующейся наночастицы на основе генома аденовируса человека 5-ого серотипа со вставкой гена гемагглютинина вируса гриппа человека.
- Получение вакцины.
- Определение оптимальной дозы нереплицирующихся наночастиц.
- Определение оптимальной дозы иммуностимулятора.
- Определение оптимального объема вакцины.
- Определение иммуногенных и протективных свойств трехвалентной вакцины с иммуностимулятором.
Определение широких антимикробных свойств иммуностимулятора, входящего в состав вакцины.
Клиническая апробация рекомбинантной трехвалентной вакцины проводилась на 2-х группах добровольцев.
Приведенные в описании таблицы и рисунки подтверждают выполнение поставленной задачи.
Пример 1
Конструирование нереплицирующейся наночастицы на основе генома аденовируса человека 5-ого серотипа со вставкой гена гемагглютинина вируса гриппа человека.
Конструирование нереплицирующейся наночастицы на основе генома аденовируса человека 5-ого серотипа (размером 70-80 нм) со вставкой гена гемагглютинина (из перечня: Н1, Н3, НВ) вируса гриппа человека осуществляли методом гомологичной рекомбинации в клеточной культуре. За основу брали общеизвестную известную рекомбинантную плазмиду, например pJM17 (McGrory W.J. et al., A simple technique for the rescue of early regioni mutations into infectious human adenovirus type 5, Virology, V.163, №2, 1988 - Простая техника для удаления раннего региона 1 в инфекционном аденовирусе человека 5 типа). Клонирование проводили с использованием общеизвестных лабораторных методик (например, Sambrook J. et al., Molecular cloning: а laboratory manual, 3rd ed., Russell, 2001, том 1, 2, 3 - Молекулярное клонирование - лабораторное руководство). Искусственно синтезированный кДНК гена гемагглютинина вируса гриппа (из перечня: Н1, Н3, НВ) лигировали в общеизвестную шаттл-плазмиду, например pACCMV.pLpA (Roth M.G., Methods in cell biology, №43, с.175 - Методы в клеточной биологии), (Go' mez-Foix A. et al., Adenovirus-mediated transfer of the muscle glycogen phosphorylase gene into hepatocytes confers altered regulation of glycogen metabolism, J. Biol. Chem., 1992, №267 (35), 15, с.25129-25134 - Обеспечиваемый аденовирусом перенос гена фосфорилазы мышечного гликогена в гепатоциты меняет регуляцию метаболизма гликогена). Далее, для взаимной трансформации полученной плазмиды pACCMV - Н и плазмиды pJM17 ими трансфецировали клетки 293 (например, №300192, CLS, Germany) с помощью стандартного метода кальциево-фосфатной преципитации (Graham F.L. A new technique for the assay of infectivity of human adenovirus 5 DNA, Virology, 1973, №52 (2), с.456-67 - Новая техника метода заражения ДНК аденовируса человека 5-ого серотипа). Получили нереплицирующиеся наночастицы на основе аденовируса человека 5-ого серотипа с делециями в области Е1 и ЕЗ генома аденовируса. В области Е1 нереплицирующиеся наночастицы содержали экспрессирующую кассету с CMV-промотором, геном гемагглютинина вируса гриппа (из перечня: Н1, Н3, НВ) и сигналом полиаденилирования. То есть в результате получили 3 типа нереплицирующихся наночастиц. Тип Н1 выбрают в зависимости от сезонной эпидемиологической ситуации, в период проведения конструирования за Н1 был взят Н1 калифорнийский. Типы Н3 и НВ также выбрают в зависимости от сезонной эпидемиологической ситуации, в период проведения конструирования за Н3 был взят Н3 пертский, за НВ был взят НВ брисбанский.
Бляшки нереплицирующихся наночастиц образовывались на культуре клеток через несколько дней после трансфекции, их отбирали пастеровской пипеткой, полученный материал размножали на клетках линии 293 до получения 108 ЕД активности на мл суспензии.
Пример 2
Получение вакцины.
Исходя из рекомендованных в примерах 3, 4, 5 доз, содержание в вакцине каждого из трех типов нереплицирующихся наночастиц со вставкой гена гемагглютинина вируса гриппа (Н1, Н3, НВ), созданных на основе генома аденовируса человека 5-го серотипа, должно составлять не более 107 ЕД активности, а иммуностимулятора от 1 до 20 мкг в 0,5 мл вакцины. Получение данной вакцины проходит в несколько этапов.
Для этого полученную в предыдущем примере клеточную суспензию, содержащую нереплицирующиеся наночастицы в титре 108 ЕД на мл, использовали для дальнейшего наращивания титров нереплицирующихся наночастиц и приготовления готовой вакцины с заданным содержанием нереплицирующихся наночастиц каждого из 3-х типов не более 107 ЕД активности, а также от 1 до 20 мкг иммуностимулятора в 0,5 мл вакцины.
Таким образом, для наработки необходимых титров нереплицирующихся наночастиц волновой биореактор с 4500 мл суспензии пермиссивной клеточной культуры 293 засевали клеточной суспензией объемом 500 мл, содержащей нереплицирующиеся наночастицы с титром 108 ЕД активности на мл.
Культивировали для наращивания нереплицирующихся наночастиц внутри клеток и достижения их активности 2×108 ЕД/мл, ориентировочно в течение 48 часов. По достижению необходимого содержания клеточную массу подавали на очистку, которая состояла из нескольких стадий:
1) Проводили осаждение клеточной массы центрифугированием. Поступающая на очистку суспензия имела не менее 3,3×1011 частиц на 5 л. Центрифугирование проводили при режиме 6000 g в течение 15 мин, при этом жидкий надосадок сливали, а оставшуюся твердую часть, содержащую клетки и нереплицирующиеся наночастицы, подавали на дальнейшие стадии очистки.
2) Извлечение нереплицирующихся наночастиц из клеточной культуры проводили путем разрушения клеток четырехкратным перемораживанием-оттаиванием. Готовили буферный раствор с рН 8,0: 5 mМ ТрисНСl, 0,075 MNaCl, 1 mM MgCl2, 5% сахароза, 1% полисорбат 80. Полученный в предыдущую стадию осадок ресуспендировали в 70 мл буфера (коэффициент содержания × 71). Объем раствора составлял 80 мл.
Замораживание проводили в течение 2 часов в жидком азоте, размораживали на водяной бане (при +37°С), не допуская перегрева.
3) Для облегчения дальнейшего удаления геномной клеточной ДНК проводили дополнительную обработку нуклеазой. Для этого добавляли бензоназу до концентрации в растворе 150 U/мл и ставили на мягкое перемешивание с помощью магнитной мешалки на 3 часа при комнатной температуре (21-23°С).
4) Отделение нереплицирующихся наночастиц от разрушенных клеток осуществляли центрифугированием при 9000g 10 мин. Отбирали супернатант, содержащий нереплицирующиеся наночастицы.
5) Дальнейшую очистку проводили ультрафильтрацией. Для этого полученный супернатант разводили буфером (50 mM TrisHCl рН 7,5, 1М NaCl, 2 mM MgCl2, 5% сахароза, рН 7,5) до объема не менее 200 мл перемешиваем с помощью магнитной мешалки. В процессе фильтрации объем циркулирующего раствора (ретентата) постоянно доводили до исходного (200 мл).
6) Далее очистку производили путем анион-обменной хроматографии.
Ретентат наносили на колонку (AxiChrom 70/300 объемом 400 мл), содержащую анионнообменный сорбент Q Sepharose virus licenced. Нереплицирующиеся наночастицы сорбируются на колонке, в то время как примеси не сорбируются, а вымываются буфером А. После удаления примесей нереплицирующиеся наночастицы десорбировали промывкой буфером Б. Условия хроматографирования: поток 193 мл/мин, буфер A (40mM TrisHCl, 0,27 М NaCl, 2mM MgCl2, 5% Сахароза, 0,1% Полисорбат 80, рН 7,5), проводимость ×~28-30 mS/cm; буфер Б (40 mM TrisHCl, 0,5M NaCl, 2mM MgCl2, 5% сахароза, 0,1% полисорбат 80, рН 7,5), проводимость ~50 mS/cm. Элюат в объеме 200 мл отправляли на следующую стадию.
7) Эксклюзионная хроматогафия.
Полученный в предыдущей стадии элюат наносили на колонку (AxiChrom 100/300 объемом 800 мл), содержащую сорбент Q Sepharose 4 FastFlow. Высокомолекулярные вещества, не входящие в поры сорбента, элюировали первым пиком (к ним относятся нереплицирующиеся наночастицы), примеси элюировали после выхода пика нереплицирующихся наночастиц. Условия хроматографирования: поток 130 мл/мин, буфер (10 mM TrisHCl, 75 мМ NaCl, 1 mM MgCl2, 5% сахароза, 0,05% полисорбат 80, рН 8,0).
К полученномуй элюату (80 мл) добавляли этанол до концентрации 0,5% и этилендиаминтетрауксусную кислоту (ЭДТА) до концентрации 100 мкМ, отправляли на следующую стадию.
8) Нормальная фильтрация.
Для стерилизации полученного препарата проводили фильтрование через систему фильтров с размером пор 22 мкМ. Конечный объем препарата на данной стадии составлял 80 мл и содержал нереплицирующиеся наночастицы со вставкой гена гемагглютинина вируса гриппа одного типа в титре 3,3×1011 ЕД/мл. Его разбавляли формулирующим буфером (например, 10 mM TrisHCl, 75mM NaCl, 1mM MgCl2, 5% сахароза, 0,05% полисорбат 80, 0,5% Этанол, 100 мкм ЭДТА, рН 8,0) до получения заданной активности 107 ЕД на 0,1 мл, что позволяло длительно хранить препарат при температуре от +4 до +6°С без потери активности.
Для формулирования готовой вакцины к от 1 до 20 мкг иммуностимулятора (патент РФ 2195308), содержащемся в 0,1 мл дистиллированной воды, добавляли полученные в предыдущую стадию препараты 3-х типов нереплицирующихся наночастиц со вставкой гена гемагглютинина (из перечня: Н1, Н3, НВ) вируса гриппа с активностью не более 107 ЕД, по 0,1 мл каждого препарата (т.е. всего добавляли 0,3 мл) и доводили формулирующим буфером до объема 0,5 мл. Далее стерилизовали нормальной фильтрацией. Таким образом, поставленная задача по приготовлению вакцины выполнена.
Пример 3
Определение оптимальной дозы нереплицирующихся наночастиц.
Определение дозы нереплицирующихся наночастиц проводили с помощью оценки иммуногенной и протективной активности нереплицирующихся наночастиц, экспрессирующих гены 3-х типов гемагглютинина вируса гриппа.
В качестве экспериментальных животных использовали мышей Balb/c весом 7-9 грамм. Для иммунизации лабораторных мышей животные были разбиты на группы не менее 10 особей, иммунизацию проводили под легким эфирным наркозом. В качестве контрольных использовалась группа мышей, получавших 0,9% раствор NaCl. Заражение животных вирусами гриппа птиц или отбор крови для анализа сывороток проводился через три недели после иммунизации.
Для определения вышеописанной оптимальной дозы нереплицирующихся наночастиц на основе генома аденовируса человека 5, экспрессирующих ген гемагглютинина вируса гриппа A/California/07/09 (H1N1), мыши были однократно интраназально иммунизированы нереплицирующимися наночастицами в дозе 105 и 107 ЕД на животное. Объем вводимых растворов составил 50 мкл. Через три недели после иммунизации у животных брали кровь для определения в сыворотке крови уровня антител к вирусу гриппа A/California/07/09 (H1N1) и проводили заражение животных летальной дозой вируса гриппа H1N1, адаптированного для мышей.
Уровень специфических антител к вирусу гриппа H1N1 определяли с помощью стандартных реакций вирус-нейтрализации (РВН) и реакции торможения гемагглютинации (РТГА).
Оценку уровня вирус-нейтрализующих антител к вирусу гриппа H1N1 в сыворотках крови иммунизированных мышей проводили по стандартной методике. Согласно результатам реакции вирус-нейтрализации у группы животных, иммунизированных нереплицирующимися наночастицами в дозе 105 ЕД на животное, наблюдалось повышение титров до 1/10, что означает иммуногенность данной дозы. У животных, получавших нереплицирующиеся наночастицы в дозе 107 ЕД, наблюдалось повышение уровня антител в пределах значений титров 1/10-1/20, что означает иммуногенность данной дозы.
Уровень специфических антител к гемагглютинину вируса гриппа H1N1 в сыворотке крови животных, иммунизированных вакциной, определяли с помощью стандартной методики РТГА (реакции торможения гемагглютинации).
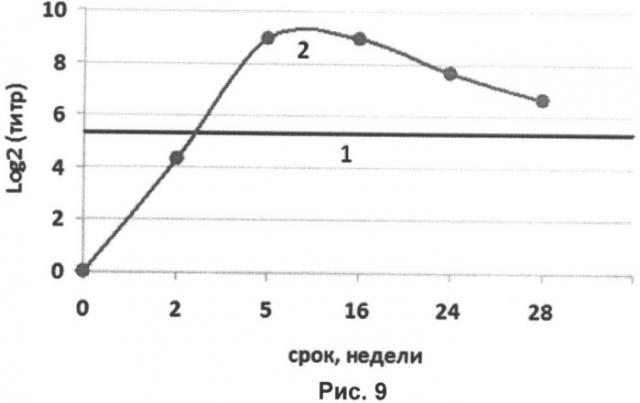
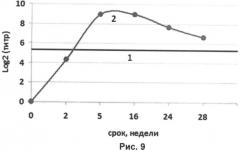
На рисунке 1 представлены результаты РТГА:
1 - уровень специфических антител к гемагглютинину вируса гриппа H1N1 в сыворотках крови мышей, интраназально иммунизированных нереплицирующимися наночастицами со вставкой гена гемагглютинина в дозе 105 ЕД на животное;
2 - уровень специфических антител к гемагглютинину вируса гриппа H1N1 в сыворотках крови мышей, интраназально иммунизированных нереплицирующимися наночастицами со вставкой гена гемагглютинина в дозе 107 ЕД на животное;
3 - контрольное вещество (0,9% раствор NaCl).
Таким образом, титр антител к гемагглютинину вируса гриппа птиц в сыворотках крови мышей, получавших нереплицирующиеся наночастицы в дозе 105 ЕД/мышь, составил 4,2 log2 (средний геометрический титр, СГТ 1/20). Титр антител к гемагглютинину вируса гриппа птиц в сыворотках крови мышей, получавших нереплицирующиеся наночастицы в дозе 107 ЕД/мышь, составил 5,8 log2 (средний геометрический титр, СГТ 1/64). При вакцинации контрольным веществом титр составил 2,7 log2, т.е. СГТ менее 1/10, что означает отсутствие иммуногенности.
Титр 107 ЕД/мышь является немного более иммуногенным по сравнению с титром 105 ЕД/мышь и в РВН, и в РТГА.
Для изучения протективных (защитных) свойств вакцинации мышей нереплицирующимися наночастицами в двух разных дозах иммунизированных животных заражали летальной дозой вируса гриппа H1N1. Заражение проводили через 21 день после иммунизации интраназально, под легким эфирным наркозом. Животных наблюдали в течение 14 дней после заражения.
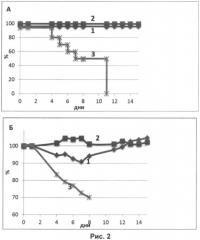
На рисунке 2 представлены кривые выживаемости мышей (А) и изменения их веса (Б) после заражения летальной дозой вируса гриппа H1N1:
Кривая 1 (♦) - иммунизация мышей в дозе 105 ЕД на животное;
Кривая 2 (■) - иммунизация мышей в дозе 107 ЕД на животное;
Кривая 3 (Ж) - контрольное вещество (0,9% раствор NaCl).
Таким образом, результаты, представленные на рисунке, показывают, что мыши, интраназально иммунизированные нереплицирующимися наночастицами в дозе 105 ЕД, так же как и 107 ЕД на животное, в 100% случаев защищены от гибели и проявления признаков заболевания (резкого падения веса).
Дозы нереплицирующихся наночастиц со вставкой гемагглютинина Н1 вируса гриппа A/California/07/09 (H1N1), со вставкой гемагглютинина Н3 вируса гриппа A/Perth/16/2009 (H3N2); со вставкой гемагглютинина НВ вируса гриппа B/Brisbane/60/2008, рекомендованных ВОЗ на 2011-2012 гг., в результате исследований были определены как не более 107Д активности каждой из перечисленных.
Пример 4
Определение оптимальной дозы иммуностимулятора, в качестве которого был выбран пептидогликан.
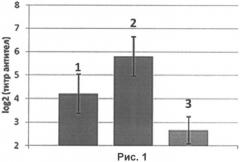
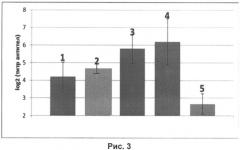
Для повышения иммуногенности выбранной в предыдущем примере дозы нереплицирующихся наночастиц, несущих ген гемагглютинина вируса гриппа и расширения противоинфекционного спектра действия вакцины, выбрали кислый пептидогликан с молекулярной массой от 1200 до 40000 кДа (патент РФ 2195308). Определение оптимальной дозы иммуностимулятора проводили при иммунизации лабораторных мышей Balb/c, весом 7-9 г. однократно, интраназально нереплицирующимися наночастицами в дозе 107 ЕД на животное. При этом были использованы три дозы иммуностимулятора - 1, 10 и 20 мкг на мышь. Общий объем смеси нереплицирующихся наночастиц и иммуностимулятора, вводимой животным, составил 50 мкл. Через три недели после иммунизации у животных отбирали кровь и оценивали уровень антител к вирусу гриппа A/California/07/09 (H1N1) с помощью стандартных методик РТГА (реакции торможения гемагглютинации) и РВН (реакции вирус-нейтрализации). Результаты представлены на рисунках 3 и 4.
На рисунке 3 представлены уровни специфических антител к гемагглютинину вируса гриппа H1N1, определенный в РТГА в сыворотках крови мышей, интраназально иммунизированных нереплицирующимися наночастицами в дозе 107 ЕД на животное в смеси с иммуностимулятором в дозах:
1 - без иммуностимулятора;
2-1 мкг на животное;
3-10 мкг на животное;
4 - 20 мкг на животное;
5 - контрольное вещество (0,9% раствор NaCl).
На рисунке 3 видно значительное повышение иммуногенности нереплицирующихся наночастиц в смеси с иммуностимулятором во всех предложенных дозах - 1, 10 и 20 мкг на животное по сравнению с наночастицами, введенными без иммуностимулятора, а также контрольным веществом.
На рисунке 4 представлен уровень специфических антител к гемагглютинину вируса гриппа H1N1, определенный в РВН в сыворотках крови мышей, интраназально иммунизированных нереплицирующимися наночастицами в дозе 107 ЕД на