Способ получения фотокаталитически активного диоксида титана
Иллюстрации
Показать всеИзобретение может быть использовано в производстве пигментов, керамики, адсорбентов, косметики, антибактериальных препаратов, катализаторов. Способ получения фотокаталитически активного диоксида титана из четыреххлористого титана включает осаждение диоксида титана одновременным сливанием в воду раствора соли титана и водного раствора аммиака при постоянных pH и температуре и интенсивном перемешивании, промывку, сушку и термообработку образовавшегося осадка. Осаждение ведут из раствора сульфата титанила при pH=3-6 и температуре 50-80°C. При этом раствор сульфата титанила готовят растворением четыреххлористого титана при комнатной температуре в слабоконцентрированной серной кислоте 4,5-22% при массовом соотношении SO4/Ti=0,5-3 с последующим разбавлением дистиллированной водой до концентрации 150-250 г/л TiO2. Изобретение позволяет повысить фотокаталитическую активность диоксида титана, получаемого из четыреххлористого титана. 1 табл., 8 пр.
Реферат
Изобретение относится к способу получения нанодисперсного диоксида титана, используемого в качестве фотокатализатора.
Нанодисперсный диоксид титана в последнее время находит все более широкое применение в различных областях современной науки и техники, в том числе в фотокатализе, электрохимии, оптике, микроэлектронике, в производстве пигментов, керамики, адсорбентов, косметики, антибактериальных препаратов, газовых датчиков, в синтезе мезопористых пленочных покрытий, катализаторов и носителей катализаторов для процессов экологической очистки, в нанобиотехнологии, фундаментальной медицине и др.
В качестве фотокатализатора применяется нанодисперсный диоксид титана анатазной модификации, который под воздействием ультрафиолетового излучения может эффективно обезвреживать многие вредные химические вещества в воздухе и воде, такие как органические спирты, альдегиды, кислоты, ароматические и хлорорганические соединения, красители и др. Фотокаталитическая активность диоксида титана в значительной степени зависит от природы исходного сырья и способа его приготовления. Для получения диоксида титана в качестве наиболее доступных источников исходного сырья, производимых в мире в достаточно больших объемах, могут быть использованы растворы сульфата титанила, применяемые в производстве пигментного диоксида титана, и четыреххлористый титан, применяемый в производстве губчатого титана [1]. Из анализа патентной и научно-технической информации следует, что диоксид титана, содержащий сульфат-ионы, часто обладает более высокой фотокаталитической активностью по сравнению с катализаторами, не содержащими сульфат-ионов [2-6].
Известные методы приготовления сульфатированного диоксида титана можно разделить на две группы: сульфатирование TiO2 пропиткой сульфатом аммония или серной кислотой [5, 6] и гидротермальный синтез TiO2 непосредственно из растворов сульфата титанила [2-4]. При синтезе по второму способу получают нанодисперсные частицы анатаза с сильно разупорядоченной кристаллической структурой, в которой стабилизируются сульфат-ионы [7-8].
В России в настоящее время в достаточно больших объемах производится лишь четыреххлористый титан, который может стать перспективным материалом в качестве исходного соединения титана в получении фотокаталитически активного диоксида титана.
Известны способы получения фотокаталитически активного диоксида титана по сернокислотной технологии [2-4] путем термического гидролиза растворов сульфата титанила в присутствии избытка серной кислоты при температуре 100-250°C в течение нескольких часов. Полученный в результате термического гидролиза гидрогель гидратированного диоксида титана (метатитановая кислота) промывают водой, сушат и прокаливают на воздухе при температуре не выше 500°C. Готовый катализатор имеет кристаллическую структуру анатаза. В зависимости от условий проведения процесса термического гидролиза и температуры термообработки получают диоксид титана с удельной поверхностью от 50 до 330 м2/г. К недостаткам данного способа следует отнести большое количество образующейся гидролизной серной кислоты, представляющей собой отходы производства, а также отсутствие в России производства сульфата титанила.
Известен способ получения фотокаталитически активного диоксида титана методом высокотемпературного газо-фазного окисления паров четыреххлористого титана. Получаемый TiO2 представляет собой смесь анатаза и рутила, содержание которого может достигать до 60%. Диоксид титана, полученный данным способом, содержит примеси хлора до 0,6 мас.% и характеризуется удельной поверхностью около 50 м2/г. По данной технологии фирма "Degussa" производит фотокаталитически активный диоксид титана марки Р-25, широко используемый в Европе [1, 9]. Недостатком данного метода получения TiO2 является сложность технологического процесса с применением специального дорогостоящего оборудования и более низкая активность получаемого фотокатализатора по сравнению с катализаторами, полученными по сернокислотной технологии.
Известен способ получения фотокаталитически активного диоксида титана, путем модифицирования его добавками ионов фтора [10], состоящий в приготовлении водного раствора фторида аммония к которому при комнатной температуре прибавляют спиртовый раствор металлорганического соединения титана. Полученную при этом суспензию гидроксида титана подвергают длительному старению для завершения процесса гидролиза, после чего воду и спирт удаляют выпариванием, а осадок гидроксида диоксида титана высушивают при температуре 100°C и прокаливают при температуре 400-500°C. При данном способе получения образуется диоксид титана, представляющий собой смесь анатаза и брукита, его удельная поверхность при температуре прокаливания 400°C составляет 140 м2/г, а после прокаливания при 500°C - около 80 м2/г. К недостаткам данного метода приготовления можно отнести использование дорогих металлорганических соединения титана и фтора, а также невысокую фотокаталитическую активность получаемого диоксида титана.
Известен способ получения фотокаталитически активного диоксида титана термическим гидролизом или осаждением металлорганических соединений титана с последующей сушкой и термообработкой [11, 12]. Недостатком метода получения из металлорганических соединений титана является высокая цена исходных соединений титана и часто более низкая активность.
Известен способ получения диоксида титана из четыреххлористого титана, включающий реакцию TiCl4 с 60-80% раствором серной кислоты с образованием промежуточного продукта - сульфата титанила, который затем нагревают в автоклаве в течение 6-7 часов при дополнительном добавлении 35-50% серной кислоты. В результате получают кристаллический дигидрат сульфата титанила TiOSO4·2H2O, который отфильтровывают, а затем снова растворяют в воде, и раствор подвергают термическому гидролизу при температуре 130-150°C. В процессе термического гидролиза получают гидратированный диоксид титана, который отделяют от раствора, сушат и подвергают термической обработке. По фазовому составу получаемый диоксид титана представляет собой смесь рутила и анатаза. Недостатками данного способа являются многостадийность, низкая производительность и низкий выход готового продукта [13]. Увеличение выхода готового продукта может достигаться уменьшением концентрации серной кислоты до 20-55% на первой стадии процесса образования промежуточного продукта сульфата титанила [14]. К недостаткам относится отсутствие данных о фотокаталитической активности полученного данными методами диоксида титана.
Наиболее близким способом получения фотокаталитически активного диоксида титана из четыреххлористого титана является осаждение из солянокислого раствора TiCl4 водным раствором аммиака при постоянном значении pH=7, с последующей фильтрацией осадка, сушкой и термообработкой [15]. Способ состоит в том, что раствор четыреххлористого титана в соляной кислоте, разбавленной водой (1:1), и водный раствор аммиака одновременно приливают в реактор, частично наполненный дистиллированной водой, при поддержании постоянного значения pH=7, и температуры 70-80°C. Процесс проводят при интенсивном перемешивании образующейся суспензии гидрогеля диоксида титана. После завершения процесса осаждения полученный осадок отфильтровывают, промывают дистиллированной водой, сушат и прокаливают на воздухе при температуре 450-500°C.
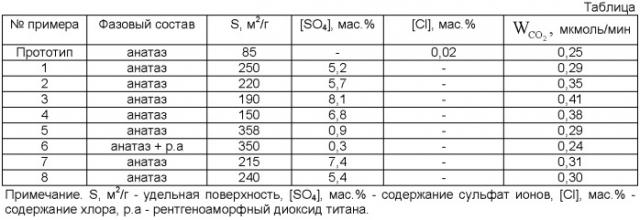
Основным недостатком данного способа приготовления диоксида титана является его сравнительно низкая фотокаталитическая активность (таблица).
Изобретение решает задачу по разработке способа получения фотокаталитически активного диоксида титана с использованием четыреххлористого титана, обеспечивающего улучшения качества катализатора путем дополнительной стабилизации сульфат-ионов в структуре TiO2.
Задача получения диоксида титана с высокой фотокаталитической активностью с использованием четыреххлористого титана решается способом приготовления, состоящим в том, что растворение четыреххлористого титана проводят при комнатной температуре в слабоконцентрированных растворах серной кислоты (4,5-22%) при соотношении SO4/Ti (мас.) = 0,5-3, после чего раствор разбавляют дистиллированной водой до концентрации 150-250 г/л TiO2 и получают раствор сульфата титанила. Затем из полученного раствора проводят осаждение диоксида титана 25% водным раствором аммиака. Процесс осаждения проводят одновременным приливанием полученного раствора сульфата титанила и раствора аммиака в реактор, частично наполненный дистиллированной водой, при поддержании постоянного значения pH=3-6 и температуры 50-80°C. Процесс ведут при интенсивном перемешивании образующейся суспензии гидрогеля диоксида титана механической мешалкой. После завершения процесса осаждения осадок отфильтровывают на нутч-фильтре и промывают дистиллированной водой, затем сушат на воздухе до воздушно-сухого состояния и в сушильном шкафу при 100-110°C и, если необходимо, прокаливают в муфельной печи при температуре не выше 350°C.
Указанные интервалы соотношения SO4/Ti (мас.)=0,5-3 определяются тем, что увеличение соотношения SO4/Ti (мас.)>3 приводит к образованию побочного продукта сульфатдихлорида титана TiCl2SO4, который оседает на мешалке и стенках реактора, что снижает выход основного продукта. При уменьшении соотношения SO4/Ti (мас.)<0,5 образуется побочный продукт титан оксихлорид гидроксид. Интервалы значений pH=3-6 и температуры 50-80°C являются наилучшим для получения катализаторов с оптимальными свойствами, такими как фазовый состав, удельная поверхность, содержание сульфат-ионов.
Отличительным признаком предлагаемого способа получения фотокаталитически активного диоксида титана является концентрация серной кислоты 4,5-22%, используемой для растворения четыреххлористого титана, интервал соотношений SO4/Ti (мас.)=0,5-3, концентрация раствора сульфата титанила 150-250 г/л TiO2, интервал значений pH=3-6, при котором проводят процесс осаждения.
Технический результат - повышение фотокаталитической активности диоксида титана, получаемого из четыреххлористого титана.
Сущность изобретения иллюстрируется следующими примерами и таблицей.
Пример 1.
К 30 мл дистиллированной воды добавляют 5 мл концентрированной серной кислоты, получают 8,7% серную кислоту. В полученный раствор при комнатной температуре при перемешивании постепенно добавляют 20 мл четыреххлористого титана до соотношения SO4/Ti (мас.)=1. Получают раствор сульфата титанила. К полученному раствору сульфата титанила добавляют 20 мл дистиллированной воды до достижения концентрации 220 г/л TiO2. Затем из этого раствора проводят осаждение диоксида титана путем одновременного сливания раствора сульфата титанила и 25% водного раствора аммиака в реактор, в который налито 200 мл дистиллированной воды, нагретой до 80°C, при поддержании постоянного значения pH=4 и температуры 80°C, процесс ведут при интенсивном перемешивании механической мешалкой суспензии гидрогеля диоксида титана, образующегося в процессе осаждения. После завершения процесса осаждения осадок отфильтровывают на нутч-фильтре и промывают дистиллированной водой, сушат на воздухе, затем в сушильном шкафу при 100°C.
Пример 2.
Аналогичен примеру 1 с тем исключением, что к 30 мл дистиллированной воды добавляют 10 мл концентрированной серной кислоты и получают 16% серную кислоту и в полученный раствор при комнатной температуре при перемешивании постепенно добавляют 20 мл четыреххлористого титана до соотношения SO4/Ti (мас.)=2.
Пример 3.
Аналогичен примеру 1, отличие состоит в том, что осаждение диоксида титана проводят при pH=3.
Пример 4.
Аналогичен примеру 1, отличие состоит в том, что осаждение диоксида титана проводят при pH=3, катализатор прокаливают при температуре 350°C.
Пример 5.
Аналогичен примеру 1, отличие состоит в том, что осаждение гидроксида титана проводят при pH=6 и температуре 50°C.
Пример 6.
Аналогичен примеру 2, отличие состоит в том, что осаждение проводят при pH=7 и температуре 50°C.
Пример 7.
Аналогичен примеру 1, отличие состоит в том, что растворение четыреххлористого титана проводят в 22% серной кислоте при соотношении SO4/Ti (мас.)=3, а осаждение ведут при pH=5.
Пример 8.
Аналогичен примеру 1, отличие состоит в том, что растворение четыреххлористого титана проводят в 4,5% серной кислоте при соотношении SO4/Ti (мас.)=0,5.
У катализаторов, полученных по примерам 1-8, измеряют фотокаталитическую активность, определяют фазовый состав, величину удельной поверхности, содержание примесей серы и хлора.
Измерение фотокаталитической активности проводят в реакции фотокаталитического окисления ацетона в CO2 в воздухе при следующем составе реакционной смеси: концентрация паров ацетона - 500 млн. д., относительная влажность - 30%, температура - 40°C. Объемная скорость реакционной смеси (U) составляет 0,03 л/мин. Испытания проводят в стальном реакторе с циркулированием реакционной смеси на образце катализатора, нанесенном на стеклянную подложку размером 2.4×2.9 см2. Освещение проводили УФ светом лампы Philips, 365 нм, 9 Вт. Измерение концентраций ацетона и CO2 проводили методом ИК-спектроскопии на спектрометре Nicolet 380. Фотокаталитическую активность катализаторов оценивали по скорости образования C O 2 ( W C O 2 , м к м о л ь / л ) по формуле: W C O 2 = Δ C C O 2 ⋅ U , где Δ C C O 2 - разность концентраций CO2 в конечной реакционной смеси (КРС) и исходной реакционной смеси (ИРС), мкмоль/л; U - объемная скорость, л/мин.
Определение рентгенофазового состава катализаторов проводят на дифрактометре URD-63 (Германия) с монохроматизированным Cukα-излучением методом сканирования по точкам (шаг 0.05°, время накопления 10 сек в точке) в интервале 2θ 10-60°.
Величину удельной поверхности S (м2/г) измеряют по традиционной методике термодесорбции аргона по четырем точкам сорбционного равновесия на приборе СОР-БИ-М фирмы "МЕТА" (Россия).
Содержание примесей серы и хлора определяют на рентгеноспектральном флуоресцентном анализаторе ARL - Advant'x с Rh анодом. Результаты анализа по содержанию S (мас.%) пересчитывали на SO4 (мас.%).
В таблице приведены результаты испытаний фотокаталитических свойств, химический и фазовый состав, величина удельной поверхности предлагаемых катализаторов.
Из приведенных примеров и таблицы видно, что предлагаемый способ позволяет получать нанодисперсный диоксид титана из четыреххлористого титана с более высокой фотокаталитической активностью по сравнению с прототипом. Увеличение фотокаталитической активности достигается путем получения диоксида титана со структурой анатаза, в которой стабилизируются сульфат-ионы в количестве 0,9-8,1 мас.%. Это достигается проведением процесса осаждения из раствора сульфата титанила, полученного растворением четыреххлонистого титана в растворе серной кислоты заданной концентрации, при температуре 50-80°C в области значений pH=3-6. Увеличение pH при проведении процесса осаждения до 7 приводит к появлению рентгеноаморфной фазы диоксида титана и уменьшению содержания фазы TiO2 со структурой анатаза с одновременным снижением содержания сульфат-ионов в образце до 0,3 вес.%, что в свою очередь приводит к снижению фотокаталитической активности.
Предлагаемый способ получения фотокаталитически активного сульфатированного диоксида титана отличается от других известных в литературе способов простотой исполнения, поскольку позволяет получать исходный раствор сульфата титанила в низкоконцентрированных растворах серной кислоты, что позволяет снизить количество вредных стоков, а также исключить стадию термического гидролиза раствора сульфата титанила, которая осуществляется при длительным автоклавировании при повышенных температурах.
Источники информации
1. Тарасов А.В. Металлургия титана. Москва: ИКЦ, Академкнига, 2003. 325 с.
2. US 6726891, 27.04.2004.
3. RU 2408427, B01J 37/08, C01G 23/053, 10.01.2011.
4. RU 2408428, B01J 37/34, C01G 23/053, B01D 53/86, 10.01.2011.
5. D.V.Kozlov, A.V.Vorontsov и др. // Journal of Catalysis. 2008. V.258. P.87.
6. Ma Z., Yue Y., Deng X., Gao Z. // J. Molec. Catal. A. 2002. V.178. P.97.
7. Зенковец Г.А., Цыбуля С.В., Бургина Е.Б., Крюкова Г.Н. Кинетика и катализ. // 1999. Т.40. №4. С.623.
8. Жеребцов Д.А., Сюткин С.А., Первушин В.Ю., Кузнецов Г.Ф., Клещев Д.Г., Герман В.А., Викторов В.В., Колмогорцев A.M., Сериков А.С. // Журнал неорганической химии. 2010. Т.55. №8. С.1271.
9. Hadjiivanov K.I., Klissurdki D.G. // Chem. Sos. Rev. // 1996.V.25. P.61.
10. Yu J.C., Yu J., Ho W., Jiang Z., Zhang L. // Chem. Mater. 2002. V.14. P.3808.
11. WO 2010091478, 19.08.2010.
12. US 6576589, 10.06.2003.
13. ЕПВ 424058, 24.04.1991.
14. RU 2102324, C01G 23/053, 20.01.1998.
15. Тарасова Д.В., Максимов Н.Г., Цикоза Л.Т., Зенковец Г.А., Оленькова И.П. // Изв. Сиб. Отд. АН СССР. 1981. №7. С.81.
Способ получения фотокаталитически активного диоксида титана из четыреххлористого титана, включающий осаждение диоксида титана одновременным сливанием в воду раствора соли титана и водного раствора аммиака при постоянных pH и температуре и интенсивном перемешивании, промывку, сушку и термообработку образовавшегося осадка, отличающийся тем, что осаждение ведут из раствора сульфата титанила при pH 3-6 и температуре 50-80°C, при этом раствор сульфата титанила готовят растворением четыреххлористого титана при комнатной температуре в слабоконцентрированной серной кислоте 4,5-22% при массовом соотношении SO4/Ti=0,5-3 с последующим разбавлением дистиллированной водой до концентрации 150-250 г/л TiO2.