Производные 2-амино-2-фенилалканола, их получение и фармацевтические композиции, содержащие их
Иллюстрации
Показать всеИзобретение относится к новым производным 2-амино-2-фенил-алканола, обладающим анальгетической активностью. В формуле (I):
R1 представляет собой атом водорода, алкильный радикал, содержащий от 1 до 4 атомов углерода в линейной или разветвленной цепи, алкильный радикал, содержащий от 2 до 4 С в линейной или разветвленной цепи, замещенный гидрокси, алкокси, алкилтио, ацилокси, амино, алкиламино, диалкиламино, алкилкарбамоилокси, алкоксикарбониламино, уреидо или алкилуреидо, R2 представляет собой -CO-R радикал, -CO-Y-R4 радикал, или R2 представляет собой алкильный радикал, содержащий от 2 до 4 С, замещенный гидрокси, алкокси, алкилтио, ацилокси, амино, алкиламино, диалкиламино, алкильные остатки которого могут образовывать с атомом азота, к которому они присоединены, гетероцикл, имеющий 5 или 6 членов, необязательно несущий еще один гетероатом, выбранный из кислорода или азота, или замещенный алкилкарбамоилокси, алкоксикарбониламино, уреидо или алкилуреидо, при это следует понимать, что выше упомянутый замещенный алкильный радикал представляет собой линейную или разветвленную цепь и содержит, по меньшей мере, 2 атома углерода между атомом азота, несущим R2 и заместитель; R3 представляет собой алкильный радикал, содержащий от 1 до 4 атомов углерода в линейной или разветвленной цепи. Значения радикалов R, R4, R5, Y приведены в формуле изобретения. Изобретение также относится к получению указанных соединений и к фармацевтической композиции, содержащей их. 3 н. и 3 з.п. ф-лы, 17 пр.
Реферат
Настоящее изобретение относится к различным образом замещенным производным 2-амино-2-фенил-алканола, которые, в частности, применимы главным образом из-за их анальгезирующего действия. Настоящее изобретение также относится к получению данных производных, а также фармацевтических композиций, содержащих их.
(S) 2-метиламино-2-фенил-н-бутил-3,4,5-триметоксибензоат и его применение в лечении хронической боли было описано в международной заявке WO 99/01417.
Применение тримебутина, 2-диметиламино-2-фенилбутил-3,4,5-триметокси-бензоата водородистого малеата, или его стереоизомеров в лечении воспалительных нарушений и боли было описано в европейской заявке EP 1110549.
Сложные эфиры аминоспиртов с приведенной ниже структурой описаны в Патентной заявке Соединенного Королевства GB 1434826:
в которой с R1 по R3 могут представлять собой, в частности, атом водорода, R4 может представлять собой алкильный радикал, R7 может представлять собой арил, необязательно замещенный от 1 до 3 алкоксильными радикалами, и R5 и R6 представляют собой атом водорода, алкильный или аралкильный радикал или образуют гетероцикл вместе с атомом азота, к которому они присоединены. Данные продукты применимы в качестве спазмолитиков. Заявка Соединенного Королевства также описывает карбаматы, в которых R7 имеет структуру -NH-R"7. Образованные таким образом арилкарбаматы имеют анальгетическую и противовоспалительную активность. Однако подобные модификации амина были весьма ограниченными и не способны были приводить к эффективным анальгетикам.
В настоящее время обнаружено, что производные сложного эфира 2-амино-2-фенил-алканола общей формулы:
где
R1 представляет собой атом водорода, алкильный радикал, содержащий от 1 до 4 атомов углерода в линейной или разветвленной цепи, алкильный радикал, содержащий от 2 до 4 C в линейной или разветвленной цепи, замещенный гидрокси, алкокси, алкилтио, ацилокси, амино, алкиламино, диалкиламино, алкилкарбамоилокси, алкоксикарбониламино, уреидо или алкилуреидо,
R2 представляет собой -CO-R радикал, в котором R представляет собой атом водорода, алкильный радикал, арил, гетероциклил, бензил или гетероциклилметильный радикал, -CO-Y-R4 радикал, в котором Y представляет собой гетероатом, выбранный из -O-, -S-, -NH-, -Nalk-, где alk представляет собой линейный или разветвленный алкильный радикал, содержащий от 1 до 4 C, а R4 выбирают из алкильного, арильного, аралкильного или гетероциклилалкильного радикалов, которые могут быть замещены одним или более атомами галогена, или гидроксильного, алкильного радикалов, содержащих от 1 до 4 C в линейной или разветвленной цепи, алкокси, алкилтио, ациламиноалкилтио, алкоксикарбонила или ациламино, алкильные остатки которых содержат от 1 до 4 C в линейной или разветвленной цепи, или оксо, или может быть замещен R5COO- радикалом, в котором R5 представляет собой алкильный радикал, необязательно замещенный бензилоксикарбониламино, ациламино или аминокислотным остатком, или представляет собой гетероциклильный радикал, или
R2 представляет собой алкильный радикал, содержащий от 2 до 4 C, замещенный гидрокси, алкокси, алкилтио, ацилокси, амино, алкиламино, диалкиламино, алкильные остатки которого могут образовывать с атомом азота, к которому они присоединены, гетероцикл, имеющий 5 или 6 членов, необязательно несущий еще один гетероатом, выбранный из кислорода или азота, или замещенный алкилкарбамоилокси, алкоксикарбониламино, уреидо или алкилуреидо, при это следует понимать, что выше упомянутый замещенный алкильный радикал представляет собой линейную или разветвленную цепь и содержит, по меньшей мере, 2 атома углерода между атомом азота, несущим R2 и заместителем;
R3 представляет собой алкильный радикал, содержащий от 1 до 4 атомов углерода в линейной или разветвленной цепи, в их R или S формах или их смеси, а также их фармацевтически приемлемые соли, если таковые существуют, имеют особенно ценную активность в качестве анальгетиков, в частности, в лечении хронической боли.
Следует понимать, что, если не упомянуто специально, то алкильные или ацильные радикалы или остатки являются линейными или разветвленными и содержат от 1 до 7 атомов углерода, в частности, ацильные радикалы могут быть ацетильными радикалами. Арильные или аралкильные радикалы могут быть моно или бициклическими радикалами, содержащими от 6 до 10 членов, например, фенил, нафтил, бензил, фенетил или нафтилалкил.
Следует понимать, что гетероциклильные радикалы могут быть моно или бициклическими радикалами, ароматическими или неароматическими, содержащими от 5 до 10 членов, и, содержащими от 1 до 4 гетероатомов, выбранных из кислорода, азота или серы. В частности они могут быть выбраны из тиенильного, фурильного, пирролильного, пирролидинильного, пиперидильного, пиридильного, пиразинильного, пиримидинильного, пиридазинильного, пиперазинильного, диоксолильного, имидазолильного, имидазолинильного, пиразолильного, тетразолильного, пиранильного, тетрагидропиранильного, тетрагидрофуранильного, оксазолильного, тиазолильного, тиазинильного, морфолинильного, тиоморфолинильного, индолильного, индолизинильного, хинолильного, нафтиридинильного радикалов.
Следует понимать, что аминокислоты, упомянутые выше, могут быть, в частности, выбраны из глицина, аланина, лейцина, изолейцина, пролина, валина, фенилаланина в L или D формах, и что данные группы защищаются перед реакциями синтеза, в виде амидов или карбаматов; защита и освобождение защищенных радикалов осуществляется в соответствии со способами, описанными T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 4th Edition ISBN 978-0-471-69754-1, December 2006.
Атомы галогена выбирают из хлора, фтора, брома и иода.
В соответствии с предпочтительным вариантом осуществления данного изобретения, алкильный или ацильный радикалы являются линейными или разветвленными и содержат от 1 до 4 атомов углерода.
В соответствии с данным изобретением производные сложного эфира 2-амино-2-фенил-алканола общей формулы (I) получают посредством действия производного общей формулы:
в которой Z представляет собой атом галогена, гидроксильный радикал или остаток реакционно-способного сложного эфира, на производное 2-амино-2-фенилалканола общей формулы:
в которой R1 и R3 определены выше, а R'2 представляет собой атом водорода или определено выше как R2, после чего следует, по необходимости, если один из R'2 или R1 представляет собой атом водорода, замещение аминогруппы полученного производного сложного эфира 2-амино-2-фенил-алканола общей формулы:
в которой R1, R'2 и R3 определены выше;
либо, если R'2 представляет собой H, и если необходимо получить производные, в которых R2 представляет собой -CO-R, посредством действия реакционно-способного производного кислоты общей формулы
в которой R определено выше;
либо, если R'2 представляет собой H, и необходимо получить производные, в которых R2 представляет собой -CO-Y-R4, при этом Y представляет собой O, S, NH или Nalk,
- либо посредством действия фосгена, после чего следует реакция со спиртом, тиолом или амином общей формулы:
в которой R4 представляет собой необязательно замещенный алкильный радикал и, в котором, при необходимости, функциональные группы, которые могут замещаться в ходе реакции, предварительно защищаются, или арил, аралкил или гетероциклилалкильный радикал, а Y представляет собой атом кислорода или серы, или NH или Nalk радикал
- либо посредством действия галоида общей формулы:
в которой R4 определен выше, представляет собой предпочтительно разветвленный арил или алкил, Y представляет собой атом кислорода или серы, а Hal представляет собой атом галогена, предпочтительно хлор,
- либо, если необходимо получить радикал R4, несущий заместитель -C(alk)-O-CO-R5, в котором alk определен в п.2, а R5 определен в п.1, посредством действия хлоралкилхлорформиата, после чего следует реакция полученного продукта с солью щелочного металла соответствующей кислоты R5COOH, например, натриевой солью, калиевой солью или цезиевой солью соответствующей кислоты: R5COOCs, или в качестве альтернативы серебряной солью или солью четвертичного аммония (например, трет-бутиламмониевой солью) выше упомянутой кислоты;
либо, если R'2 представляет собой H, и если необходимо получить производные, в которых R2 представляет собой замещенный алкил, или было получено производное общей формулы (IV), в котором R1 представляет собой атом водорода, а R'2 определено как R2, и если необходимо получить продукт общей формулы (I), в котором R1 представляет собой необязательно замещенный алкил, посредством ацилирования галогенангидридом или реакционно- способным сложным эфиром со структурой:
или
в которой R1 или R2 определены выше, а Z представляет собой атом галогена или остаток реакционно-способного эфира, после чего следует восстановление образовавшегося амида до амина;
либо также, если было получено производное общей формулы (IV), в которой R1 представляет собой атом водорода, а R'2 определено как R2, и если необходимо получить продукт общей формулы (I), в которой R1 представляет собой алкил, посредством действия галогенированного производного формулы
в которой R1 представляет собой алкильный радикал, а X представляет собой атом галогена или сульфоновый радикал, в присутствии основания.
Продукт общей формулы (II) может представлять собой реакционно-способное производное 3,4,5-триметоксибензойной кислоты, такое как галогенангидрид или реакционно-способный эфир.
Реакция производного 2-амино-2-фенилалканола общей формулы (III) осуществляется предпочтительно с применением производного, в котором R'2 представляет собой атом водорода. Если продукт общей формулы (II) представляет собой реакционно-способное производное 3,4,5-триметоксибензойной кислоты, такое как галогенангидрид или реакционно-способный сложный эфир, то реакция производного общей формулы (II) с производным 2-амино-2-фенил алканола общей формулы (III) осуществляется преимущественно в присутствии азотсодержащего основания, такого как, например, триэтиламин, диметиламинопиридин, диизопропилэтиламин в случае галогенангидрида формулы (II), и данная реакция обычно осуществляется в органическом растворителе, таком как хлорированный растворитель (дихлорметан, дихлорэтан, хлороформ, например), при температуре, лежащей в диапазоне от 0 до 70°C, предпочтительно в атмосфере азота. А в случае реакционно-способного сложного эфира формулы (II), в присутствии метилата натрия в органическом растворителе, таком как толуол, в присутствии спирта, такого как метанол или этанол, при температуре, лежащей в диапазоне от 25 до 150°C. Если Z представляет собой атом галогена, то он предпочтительно выбирается из хлора или брома. Если продукт общей формулы (II) представляет собой 3,4,5-триметоксибензойную кислоту, то реакция обычно осуществляется в присутствии карбодиимида, в галогенированном растворителе (дихлорметан, дихлорэтан, хлороформ, например), при температуре, лежащей в диапазоне от 0 до 70°C.
Следует понимать, что, если необходимо получить производное общей формулы (IV) в R или S форме, то реакции подвергают производное 2-амино-2-фенилалканола общей формулы (III) в R или S форме. Также следует понимать, что производные общей формулы (IV) в R или S форме приводят к производным общей формулы (I) в R или S форме.
Замещение аминогруппы производного общей формулы (IV) посредством действия реакционно-способного производного кислоты общей формулы (V) предпочтительно осуществляется с применением галогенангидрида или сложного эфира, в частности, реакционно-способного сложного эфира, предпочтительно в присутствии конденсационного агента, такого как третичный амин (триэтиламин, диизопропилэтиламин, диметиламинопиридин, в частности). Данную реакцию обычно осуществляют в органическом растворителе, таком как хлорированный растворитель (дихлорметан, дихлорэтан, хлороформ, например), при температуре, лежащей в диапазоне от 0 до 70°C. Если необходимо получить производное, в котором R2 представляет собой формил, то реакция предпочтительно проводится посредством действия сложного эфира, разбавленного при помощи растворителя.
Реакция спирта или тиола общей формулы (VI) осуществляется после действия фосгена на аминогруппу производного общей формулы (IV), (в виде раствора в ароматическом растворителе, таком как, например, толуол), в органическом растворителе, таком как галогенированный растворитель (например, хлорированный растворитель, такой как дихлорметан, дихлорэтан или хлороформ) в присутствии четвертичного амина (триэтиламин, диизопропилэтиламин, диметиламинопиридин, в частности) при температуре, лежащей в диапазоне от 0 до 25°C. Реакция спирта или тиола общей формулы (VI) осуществляется посредством добавления производного общей формулы (VI) в присутствии третичного амина, как упомянуто выше, при температуре, лежащей в диапазоне от 0 до 70°C, в галогенированном растворителе (дихлорметан, дихлорэтан, хлороформ, например). Предпочтительно в атмосфере азота. Следует понимать, что если существует опасность того, что заместители будут замещаться в ходе реакции, то последние защищаются предварительно. Защита и освобождение защищенных радикалов осуществляется в соответствии со способами, описанными T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 4th Edition ISBN 978-0-471-69754-1, December 2006.
Реакция производного общей формулы (VII) с аминогруппой производного общей формулы (IV) осуществляется в присутствии конденсационного агента, такого как третичный амин (триэтиламин, диизопропилэтиламин, диметиламинопиридин, в частности). Данную реакцию обычно осуществляют в органическом растворителе, таком как хлорированный растворитель (дихлорметан, дихлорэтан, хлороформ, например), или тетрагидрофуран, при температуре, лежащей в диапазоне от 0 до 70°C. Предпочтительно данная реакция проводится в атмосфере азота.
Если необходимо получить соединение, в котором радикал R4 имеет заместитель -C(alk)-O-CO-R5, то реакцию проводят посредством действия хлоралкилхлорформиата на соединение общей формулы (IV), и данную реакцию проводят в органическом растворителе, таком как хлорированный растворитель (дихлорметан, дихлорэтан, например), или, таком как простой эфир (тетрагидрофуран, например), при температуре от -10 до 50°C. После этого следует реакция полученного соединения со щелочной солью соответствующей кислоты R5COOH, например, натриевой солью, калиевой солью или цезиевой солью, серебряной солью или солью четвертичного аммония, в органическом растворителе, таком как, например, амид, такой как диметилформамид, хлорированный растворитель (дихлорметан, например), сложный эфир (этилацетат, например), ароматический углеводород (толуол, например), нитрил (ацетонитрил, например), кетон (ацетон, метилэтилэтилкетон, например), необязательно в присутствии иодида натрия, при температуре от 0 до 60°C.
Если необходимо получить соединение общей формулы (I), в котором R2 представляет собой замещенный алкил или в котором R1 представляет собой необязательно замещенный алкил, то реакцию алкилирования аминогруппы производного общей формулы (IV) проводят в галогенированном растворителе (дихлорметан, дихлорэтан, например) или в простом эфире (тетрагидрофуран), при температуре, лежащей в диапазоне от 0 до 70°C. При необходимости, реакционно-способный сложный эфир можно получить при помощи гидроксибензотриазола. Восстановление проводят в присутствии борана в тетрагидрофуране, при температуре, лежащей в диапазоне от 0 до 70°C.
Реакцию продукта формулы (IX) осуществляют с применением галогенированного производного, в котором галоген выбирают из хлора, брома или иода, или с применением сульфонового производного, такого как тозилат, мезилат или трифлат, в присутствии основания, такого как щелочной карбонат (NaHCO3 или KHCO3, например).
Производные 3,4,5-триметоксибензойной кислоты общей формулы (II) можно получить в соответствии с обычными способами превращения карбоновых кислот в их реакционно-способные производные, которые не изменяют остальную часть молекулы.
Производные общей формулы (III) можно получить в соответствии со способом, описанным в патентных заявках FR 2765218 или EP 510168 или по аналогии со способом, описанным в данных заявках.
Галогенированные производные общей формулы (VII) можно получить посредством действия фосгена на соответствующий спирт или тиол общей формулы (VI). Данную реакцию осуществляют при условиях аналогичных условиям, описанным ранее для действия фосгена на аминогруппу производного общей формулы (IV).
Следует понимать, что, если необходимо получить продукт общей формулы (I) в S или R форме, то реакции подвергают производное 2-амино-2-фенилалканола общей формулы (III) в S или R форме.
Производные 2-амино-2-фенил алканола общей формулы (III) в S или R форме можно получить в соответствии со способом, описанным в европейском патенте EP 510168, или посредством разделения в соответствии со стандартными способами разделения энантиомеров, которые не воздействуют на остальную часть молекулы.
Фармацевтически приемлемые соли могут быть дополнительными солями с кислотами, если таковые существуют. В частности, соли с минеральными кислотами, такими как, например, гидрохлориды, гидробромиды, сульфаты, фосфаты или соли присоединения органических кислот, такие как, например, ацетаты, малеаты, фумараты, тартраты, цитраты.
Производные общей формулы (I) могут быть очищены в соответствии с обычными способами, в частности, посредством хроматографии или посредством кристаллизации.
Производные общей формулы (I) особенно применимы благодаря их эффективной анальгетической активности, в частности, при хронической боли.
Их активность была продемонстрирована in vitro при исследовании ингибирования натриевых каналов по способу из G. B. Brown, 3H-batrachotoxinin-A benzoate binding to voltage-sensitive sodium channels: inhibition by the channel blockers tetrodotoxin and saxitoxin, J. Neurosci., 6, 2064 (1986). В данном исследовании in vitro, продукты в соответствии с данным изобретением показали ингибирующие активности от 25 до 90% при концентрациях 3,2 (M).
Более того, их активность in vivo была продемонстрирована на крысах в исследовании боли с короткой и длинной фазой, вызванной формалином, с применением способа взятого из Wheeler-Aceto et al., psychopharmacology, 104, 35-44 (1991). В данном способе продукт Примера 4 проявил активность и при короткой фазе, и при длинной в дозе 39,3 мг/кг при подкожном пути введения. Активность in vivo также была продемонстрирована в исследовании абдоминальной боли, посредством ирритации и растяжения толстой кишки у крыс в соответствии со способом аналогичным способу, описанному в Langlois et al., Euro. J. Pharmacol., 324, 211-217 (1997). В данном исследовании продукт Примера 4 проявил активность у крыс при дозах от 13,1 мг/кг до 26,2 мг/кг при подкожном пути введения.
Более того, было показано, после в.в. инъекции крысам, что периоды полувыведения некоторых продуктов в соответствии с настоящим изобретением являются особенно длительными.
Наконец, продукты в соответствии с данным изобретением не проявляют токсичности. Фактически, у мыши при внутрибрюшинном пути введения в дозах 26,2 мг/кг при 7 введениях, повторяющихся в течение 2 дней, и у крысы при пероральном пути введения в дозах 39,3 мг/кг, не наблюдалось ни смертности, ни признаков аномального поведения.
Особенно применимы продукты общей формулы (I), здесь и далее называемой (Ia), в которой R1 и R3 определены выше, а R2 в -NR1R2 представляет собой -CO-O-R4 радикал, в котором R4 имеет структуру:
при этом alk представляет собой алкильный радикал, содержащий от 1 до 6 атомов углерода в линейной или разветвленной цепи, а R5 определен в общей формуле (I), или здесь и далее называемой (Ia'), в которой R3 определен выше, и в -NR1R2 R1 представляет собой атом водорода, а R2 представляет собой -CO-R радикал, который определен выше.
А из продуктов общей формулы (Ia) и (Ia') более предпочтительными являются продукты общей формулы (Ia), в которой R1 представляет собой атом водорода, алкильный радикал, содержащий от 1 до 4 атомов углерода (в частности, метил) или 2-метоксиэтильный радикал.
Также предпочтительными являются продукты общей формулы (I), здесь и далее называемой (Ib), в которой R1 и R3 определены выше, а R2 в -NR1R2 представляет собой замещенный алкильный радикал, как определено выше для R2 в общей формуле (I).
Перечисленные ниже примеры иллюстрируют настоящее изобретение.
В примерах, которые следуют ниже, применяемые аббревиатуры имеют следующие значения:
ДМФА - диметилформамид
ДМСО - диметилсульфоксид
ТГФ - тетрагидрофуран
DIPEA - N,N-диизопропилэтиламин
ТСХ - тонкослойная хроматография.
Пример 1. Синтез ORC012
0,300 г (0,8 ммоль, 1 экв.) (S) 2-метиламино-2-фенил-н-бутил-3,4,5-триметоксибензоата и 0,442 г (2,4 ммоль, 3 экв.) гидрохлорид никотиноилхлорида помещают в атмосферу азота, затем суспендируют в 3 мл безводного 1,2-дихлорэтана. Затем добавляют 0,4 мл (2,4 ммоль, 3 экв.) N,N-диизопропилэтиламина. Перемешивание поддерживают в течение 20 часов при температуре окружающей среды.
Полученную реакционную смесь обрабатывают 6 мл насыщенного раствора NaHCO3, затем экстрагируют 12 мл дихлорметана. Органическую фазу снова промывают 6 мл насыщенного раствора NaHCO3, затем сушат над Na2SO4, фильтруют и выпаривают досуха. Полученный остаток очищают посредством флэш-хроматографии на силикагеле (градиент этилацетат/циклогексан от 3:7 до 6:4, по объему), для того чтобы получить 0,189 г (46%) ожидаемого продукта (S) 2-(метил-3-пиридилкарбониламино)-2-фенил-н-бутил-3,4,5-триметоксибензоата в виде белой пены.
1H-ЯМР (CDCl3, 400 МГц):
δ м.д.=0,93 (т, J=7,6 Гц, 3H, CH3); 2,27 (м, 1H, диастереотопный CH2); 2,52 (м, 1H, диастереотопный CH2); 2,91 (с, 3H, NCH3); 3,77 (с, 6H, 2×OCH3); 3,82 (с, 3H, OCH3); 5,03 (д, J=11,5 Гц, 1H, OCH2); 5,24 (д, J=11,5 Гц, 1H, OCH2); 7,10-7,40 (м, 8H, ArH); 7,73 (д, J=7,8 Гц, 1H, ArH); 8,57 (д, J=4,9 Гц, 1H, ArH); 8,66 (м, 1H, ArH). LC-MS (ES): m/z=479 (M+H)+. Rf (SiO2, дихлорметан/метанол 98:2): 0,36.
(S) 2-метиламино-2-фенил-н-бутил-3,4,5-триметоксибензоат можно получить в соответствии со способом, описанным в заявках FR 2765218 и EP 0510168.
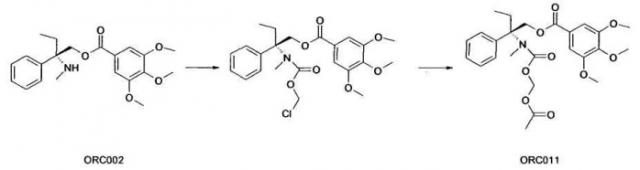
Пример 2. Синтез ORC011:
Стадия 1:
1,17 г (2,83 ммоль; 1 экв.) (S) 2-метиламино-2-фенил-н-бутил-3,4,5-триметоксибензоата помещают в атмосферу азота, затем растворяют в 1 мл 1,2-дихлорэтана. Затем медленно по каплям добавляют 0,77 мл (8,50 ммоль; 3 экв.) хлорметилхлороформиата. Полученную реакционную смесь перемешивают в течение 6 часов при температуре окружающей среды, затем обрабатывают 10 мл насыщенного раствора NaHCO3, затем экстрагируют 20 мл дихлорметана. Органическую фазу снова промывают 10 мл насыщенного раствора NaHCO3, сушат над Na2SO4, фильтруют, затем выпаривают досуха.
Полученный остаток очищают посредством флэш-хроматографии на силикагеле (этилацетат/циклогексан 2:8, по объему), для того чтобы получить 0,830 г (63%) ожидаемого продукта (S) 2-(хлорметоксикарбонилметиламино)-2-фенил-н-бутил-3,4,5-триметоксибензоата в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,92 (т, J=7,2 Гц, 3H, CH3); 2,24 (м, 1H, диастереотопный CH2); 2,45 (м, 1H, диастереотопный CH2); 3,03 (с(шир), 3H, NCH3); 3,89 (с, 6H, 2×OCH3); 3,91 (с, 3H, OCH3); 4,99 (с(шир), 2H, OCH2); 5,71 (с(шир), 2H, ClCH2); 7,19-7,37 (м, 7H, ArH). MS (Cl, NH3): m/z (%)=483 [(M+NH4)+, 65], 465 [(M+•), 10], 343 [(MH-C3O2NClH5)+, 100]. Rf (SiO2, этилацетат/циклогексан, 3:7): 0,41
Стадия 2:
0,289 г (0,62 ммоль; 1 экв.) (S) 2-(хлорметоксикарбонилметил амино)-2-фенил-н-бутил-3,4,5-триметоксибензоата помещают в раствор в 10,2 мл N,N-диметилформамида, затем помещают при 0°C. Затем медленно добавляют беловатую суспензию 0,125 г (0,62 ммоль; 1 экв.) ацетата цезия в 4,1 мл N,N-диметилформамида. Перемешивание поддерживают в течение 17 часов при температуре окружающей среды.
Затем добавляют дополнительно 0,038 г (0,18 ммоль; 0,3 экв.) ацетата цезия, и продолжают перемешивание в течение 7 часов при температуре окружающей среды.
Затем полученную реакционную смесь разбавляют в 20 мл этилацетата. Органическую фазу промывают 2×12 мл NaHCO3 (10%), 2×12 мл водой и 12 мл насыщенного раствора NaCl, сушат над Na2SO4, фильтруют и выпаривают досуха.
Полученный остаток очищают посредством флэш-хроматографии на силикагеле (градиент этилацетат/циклогексан от 1:9 до 3:7, по объему), для того чтобы получить 0,065 г (20%) ожидаемого продукта (S) 2-(ацетоксиметоксикарбонилметиламино)-2-фенил-н-бутил-3,4,5-триметоксибензоата в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,80 (т, J=6,5 Гц, 3H, CH3); 1,92 (с, 3H, CH3CO); 2,13 (с(шир), 1H, диастереотопный CH2); 2,35 (м, 1H, диастереотопный CH2); 2,93 (с(шир), 3H, NCH3); 3,80 (с, 6H, 2×OCH3); 3,82 (с, 3H, OCH3); 4,82 (д, J=10,6 Гц, 1H, диастереотопный CH2); 4,96 (м, 1H, диастереотопный OCH2); 5,57 (с(шир), 2H, OCH2O); 7,10-7,27 (м, 7H, ArH). MS (CI, NH3): m/z (%)=479 [(M+NH4-C2H5)+, 100], 285 [15], 230 [15].
Rf (SiO2, этилацетат/циклогексан 3:7): 0,21.
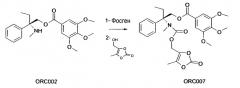
Пример 3. Синтез ORC007:
0,40 г (1,07 ммоль; 1 экв.) (S) 2-метиламино-2-фенил-н-бутил-3,4,5-триметоксибензоата помещают в атмосферу азота, затем помещают в раствор в 53 мл дихлорметана. Затем добавляют 1,3 мл (2,53 ммоль; 2,36 экв.) раствора при 20% фосгена в толуоле, затем добавляют 0,16 мл (1,18 ммоль; 1,1 экв.) триэтиламина. Перемешивание поддерживают в течение 22 часов при температуре окружающей среды. Затем добавляют 0,69 г (5,35 ммоль; 5 экв.) 4-(гидроксиметил)-5-метил-1,3-диоксол-2-она. По прошествии еще 24 часов при температуре окружающей среды полученную реакционную смесь промывают 2×40 мл водой и 1×40 мл 1M HCl. Полученную органическую фазу сушат над Na2S04, фильтруют, затем выпаривают досуха.
Полученный остаток очищают посредством 2 флэш-хроматографии на силикагеле (градиент дихлорметан, затем этилацетат/циклогексан от 1:9 до 3:7, по объему), для того чтобы получить 0,085 г (15%) ожидаемого продукта (S) 2-(5-метил-1,3-диоксол-2-он-4-илметиламино)-2-фенил-н-бутил-3,4,5-триметоксибензоата в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 МГц):
δ м.д.=0,78 (т, J=7,2 Гц, 3H, CH3); 1,94 (с, 3H, CH3); 2,02 (м, 1H, диастереотопный CH2); 2,32 (м, 1H, диастереотопный CH2); 3,02 (с(шир), 3H, NCH3); 3,80 (с, 6H, 2×OCH3); 3,82 (с, 3H, OCH3); 4,64 (с(шир), 2H, OCH2Csp2); 4,80 (м, 1H, диастереотопный OCH2); 4,93 (м, 1H, диастереотопный OCH2); 7,10-7,27 (м, 7H, ArH).
MS (CI, NH3): m/z (%)=547 [(M+NH4)+, 5], 479 [80], 260 [100].
Rf (SiO2, дихлорметан/метанол, 98:2): 0,16.
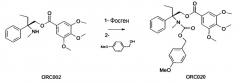
Пример 4. Синтез ORC020
Стадия 1:
(S) 2-метиламино-2-фенил-н-бутил-3,4,5-триметоксибензоат (1,49 г; 4,0 ммоль; 1 экв.) помещают в раствор в 40 мл дихлорметана в 100 мл трехгорлой колбе в токе азота. Раствор охлаждают до 0°C. Затем добавляют раствор фосгена в толуоле при 20% (4,95 мл; 9,4 ммоль; 2,4 экв.) и N,N-диизопропилэтиламин (730 мкл; 4,4 ммоль; 1,1 экв.) при температуре, не превышая 5°C. Ледяную баню удаляют, и полученную смесь перемешивают в течение 20 часов. Получают (S) 2-(хлорформилметиламино)-2-фенил-н-бутил-3,4,5-триметоксибензоат.
Стадия 2:
2,53 мл 4-метоксибензилового спирта (20 ммоль; 10 экв.) помещают в раствор в 10 мл дихлорметана, затем добавляют по каплям половину объема полученной реакционной смеси (871,8 мг; 2 ммоль; 1 экв.) (S) 2-(хлорформилметиламино)-2-фенил-н-бутил-3,4,5-триметоксибензоата (стадия 1), т.е. 20 мл полученного раствора. После 1 часа при температуре окружающей среды добавляют N,N-диизопропилэтиламин (1,30 мл; 8 ммоль; 4 экв.), затем перемешивание поддерживают в течение 20 часов. Полученную реакционную смесь приливают в 20 мл насыщенного раствора NH4Cl (pH=7-8). После декантирования водную фазу экстрагируют 2×20 мл дихлорметана. Органические фазы объединяют и промывают 2×20 мл насыщенного раствора NH4Cl (pH=7, затем pH=6), и 20 мл полунасыщенного раствора NaCl, затем сушат Na2SO4. Неочищенный продукт очищают на силикагеле (35 частей, элюент этилацетат/циклогексан 7/3), для того чтобы получить прозрачное масло (S) 2-(4-метоксибензилоксикарбонилметиламино)-2-фенил-н-бутил-3,4,5-триметоксибензоата (15%; 170 мг). Полученное масло растворяют в 1 мл эфира и 1 мл пентана, для того чтобы получить эмульсию, которая будет устойчивой. Колбу охлаждают в течение 2 часов при 4°C, затем удаляют супернатант растворителя при помощи пастеровской пипетки. Твердое вещество сушат при помощи лопастного насоса, для того чтобы получить белую пену.
Rf (SiO2, этилацетат/циклогексан 7:3): 0,42
1H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,86 (т, J=7,3 Гц, 3H); 2,16 (кв.д, J=7,3 Гц и 14,8 Гц, 1H, CH2); 2,38 (кв.д, J=7,3 Гц и 14,8 Гц, 1H, CH2); 3,09 (шир.с, 3H); 3,80 (c, 3H); 3,87 (c, 6H); 3,91 (c, 3H); 4,93 (мл, 4H); 6,79 (м, 2H); 7,05 (мл, 1H); 7,18 (м, 2H); 7,30 (м, 6H).
MS (CI, NH3): m/z=555 [(M+NH4)+], 537, 494, 463, 268.
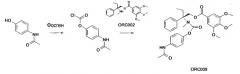
Пример 5. Синтез ORC009:
0,081 г (0,54 ммоль; 1 экв.) 4-ацетамидофенола в атмосфере азота помещают в суспензию в 3,6 мл безводного этилацетата и помещают в условия при температуре 0°C. Затем добавляют 0,43 мл (0,82 ммоль; 1,54 экв.) 20% раствора фосгена в толуоле. Затем добавляют (также при 0°C) 0,075 мл (0,54 ммоль; 1 экв.) триэтиламина. Затем смесь помещают в условия при температуре окружающей среды. Через 1 час добавляют 0,40 г (1,07 ммоль; 2 экв.) (S) 2-метиламино-2-фенил-н-бутил-3,4,5-триметоксибензоата. Перемешивание продолжают в течение 18 часов при температуре окружающей среды.
Полученную реакционную смесь разбавляют в 5 мл этилацетата, затем промывают 8 мл воды и 8 мл 1M HCl. Органическую фазу сушат над Na2SO4, фильтруют, затем выпаривают досуха.
Полученный остаток очищают посредством флэш-хроматографии на силикагеле (градиент от дихлорметана до дихлорметан/метанол 9:1, по объему). Полученный продукт измельчают в порошок дважды в 1,5 мл пентан/эфир 1:1, для того чтобы получить 0,092 г (31%) белого твердого вещества (S) 2-(4-ацетиламинофенилоксикарбонил метиламино)-2-фенил-н-бутил-3,4,5-триметоксибензоата.
1H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,86 (т, J=6,8 Гц, 3H, CH3); 2,02 (c, 3H, CH3CO); 2,18 (м, 1H, диастереотопный CH2); 2,43 (м, 1H, диастереотопный CH2); 3,06 (с(b), 3H, NCH3); 3,79 (c, 6H, 2×OCH3); 3,83 (c, 3H, OCH3); 4,87 (д, J=11,1Гц, 1H, диастереотопный CH2); 5,03 (м, 1H, диастереотопный CH2); 6,70 (с(b), 1H, NH); 7,14-7,37 (м, 11H, ArH).
MS (CI, NH3): m/z (%)=568 [(M+NH4)+, 90], 374 [(MH-C9O3NH8)+, 10], 343 [(MH-C10О3N2H11)+, 40].
Rf (SiO2, дихлорметан/метанол 98:2): 0,28
Пример 6. Синтез ORC021
400 мкл (2,4 ммоль; 3 экв.) DIPEA добавляют по каплям при температуре окружающей среды в атмосфере азота к раствору 300 мг (0,8 ммоль; 1 экв.) (S) 2-метиламино-2-фенил-н-бутил-3,4,5-триметоксибензоата в 3 мл дихлорметана, затем добавляют по каплям 337 мкл (2,4 ммоль; 3 экв.) 4-хлорфенилхлорформиата. Полученную смесь перемешивают при температуре окружающей среды в течение 70 часов. Полученную реакционную смесь приливают в 30 мл насыщенного раствора NaHCO3 (pH=7), затем экстрагируют 30 мл дихлорметана, затем 10 мл дихлорметана. Органическую фазу промывают 20 мл насыщенного раствора NaCl (pH=7-8), затем сушат над Na2SO4 и выпаривают досуха, для того чтобы получить масло. Последнее очищают на колонке с силикагелем (50 частей; элюент этилацетат/циклогексан 2/8). Полученное масло охлаждают до -50°C в атмосфере азота, для того чтобы осадить продукт, добавляют 2×2 мл пентана. Затем полученный продукт сушат под вакуумом в течение 1 часа, для того чтобы получить белый порошок, содержащий 4% растворителя, который не возможно выпарить до конца. Полученный порошок растворяют в 1 мл CH2Cl2, затем выпаривают досуха, для того чтобы получить белую пену (S) 2-(4-хлорфеноксикарбонилметиламино)-2-фенил-н-бутил-3,4,5-триметоксибензоата (360 мг, 85%) после вакуумирования в течение 20 часов.
Rf (SiO2, этилацетат/циклогексан 4:6): 0,66
1H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,94 (т, J=7,4 Гц, 3H); 2,27 (м, 1H, CH2); 2,51 (кв.д, J=7,4 Гц и 14,6 Гц, 1H, CH2); 3,20 (шир.с, 3H); 3,88 (c, 6H); 3,92 (c, 3H); 5,00 (дд, J=10,4 Гц и J=61,1 Гц, 2H, CH2); 6,80 (шир.с, 2H); 7,23 (шир.м, 3H); 7,29 (м, 2H); 7,38 (м, 4H).
MS (CI, NH3): m/z=545 [(M+NH4)+], 343, 195.
Пример 7. Синтез ORC018:
N,N-диизопропилэтиламин (0,4 мл; 2,4 ммоль; 3 экв.) добавляют по каплям при температуре окружающей среды в атмосфере азота к раствору (S) 2-метиламино-2-фенил-н-бутил-3,4,5-триметоксибензоата (300 мг; 0,8 ммоль; 1 экв.) в дихлорэтане, затем по каплям добавляют этилхлортиоформиат (260 мкл; 2,4 ммоль; 3 экв.). Перемешивание поддерживают при температуре окружающей среды в течение 70 часов. Полученную реакционную смесь приливают в 30 мл насыщенного раствора NaHCO3 (pH=7), затем экстрагируют 30 мл дихлорметана и 10 мл дихлорметана. Органическую фазу промывают 20 мл насыщенного раствора NaCl (pH=7-8), затем сушат над Na2SO4 и выпаривают досуха. Полученное масло растворяют в 3 мл эфира, затем при мягком нагревании добавляют 3 мл пентана. Полученный мутный раствор держат холодным в течение 20 часов, затем удаляют супернатант при помощи пипетки. Данную операцию проводят дважды 5 мл эфир/пентан. Затем полученные кристаллы сушат в колбе, для того чтобы получить белый порошок (S) 2-(этилтиокарбонилметиламино)-2-фенил-н-бутил-3,4,5-триметоксибензоата (251 мг, 68%).
Rf (SiO2, этилацетат/циклогексан 1:3): 0,50.
1H-ЯМР (CDCl3, 400МГц): δ м.д.=0,93 (т, J=7,4 Гц, 3H); 1,24 (т, J=7,3 Гц, 3H); 2,22 (кв.д, J=7,4 Гц и 14,3 Гц, 1H, CH2); 2,41 (кв.д, J=7,4 Гц и 14,3 Гц, 1H, CH2); 2,83 (кв., J=7,3 Гц, 2H); 3,02 (c, 3H); 3,88 (c, 6H); 3,90 (c, 3H); 4,99 (д, J=11,3 Гц, 1H, CH2); 5,11 (д, J=11,3 Гц, 1H, CH2); 7,16 (шир.с, 2H); 7,26 (м, 1H); 7,34 (м, 4H).
MS (CI, NH3): m/z=479 [(M+NH4)+], 462 [(M+H)+], 343, 250.
Пример 8. Синтез ORC033
Никотиновую кислоту (0,081 г, 0,00064 моль) растворяют в ДМФА (1 мл) в атмосфере азота. Добавляют фторид цезия (0,098 г, 0,00064 моль), и полученный раствор перемешивают при температуре окружающей среды в течение 15 минут. Полученный раствор охлаждают до 0°C и добавляют по каплям (S) 2-(хлорметоксикарбонилметиламино)-2-фенил-н-бутил-3,4,5-триметоксибензоат (100,0 мг, 0,0002146 моль), предварительно растворенный в ДМФА (1 мл). Полученную смесь нагревают при 70°C в течение 17 часов.
После охлаждения добавляют этилацетат (5 мл), и органическую фазу промывают насыщенным раствором NaHCO3, затем насыщенным раствором хлорида натрия. Органическую фазу сушат над Na2SO4, фильтруют и выпаривают, для того чтобы получить 120 мг желтого масла. Полученный продукт очищают [(SiO2; циклогексан/AcOEt (3/7)], для того чтобы получить 86 мг (S)-2-(никотинилокси-метоксикарбонилметиламино)-2-фенил-н-бутил-3,4,5-триметокси-бензоата в виде аморфного белого твердого вещества.
ТСХ: SiO2, циклогексан/AcOEt (3/7) Rf 0,37
ЯМР 1H (CDCl3): δ 0,86 (3H, т, J=7,55 Гц, CH3-CH2), 2,10-2,22 (1H, м, CH-CH3), 2,40-2,48 (1H, м, CH-CH3), 3,09 (3H, шир.с, NCH3), 3,85-3,88 (9H, д, J=9,79 Гц, 3 OCH3), 4,88-4,95 (2H, шир.д, J=9,61 Гц, CH2-O), 5,91 (2H, шир.с, CH2), 7,14 (2H, с, Harom), 7,25-7,39 (8H, м, Harom), 8,20 (1H, шир.с, Hpyr), 8,77-8,80 (1H, дд, J1=1,69 Гц, J2=4,89 Гц, Hpyr), 9,15 (1H, шир.с, Hpyr).
MS (ES+): [M+H]+, m/z: 552
Пример 9. Синтез ORC035
N-карбобензилоксиглицин (0,20 г, 0,00096 моль) растворяют в ДМФА (2 мл) в атмосфере азота. Добавляют фторид натрия (0,15 г, 0,00096 моль) и полученную смесь перемешивают в течение 15 минут при температуре окружающей среды.
Полученную смесь охлаждают до 0°C и добавляют по каплям (S) 2-(хлорметоксикарбонилметила