Пептид cdca1 и включающее его фармацевтическое средство
Иллюстрации
Показать всеНастоящее изобретение относится к области биохимии и иммунологии и может быть использовано в фармакологии для получения лекарственных средств с противораковым действием. Описан пептид, представляющий собой фрагмент (351-359) полипептида 1, связанного с циклом деления клетки (CDCA1), и обладающий способностью индуцировать цитотоксические (киллерные) Т-клетки, а также его аналоги, включающие замену второй от N-конца аминокислоты метионином и/или С-концевой аминокислоты валином или лейцином и сохраняющие индуцирующее действие в отношении киллерных Т-клеток. Предлагается использовать пептиды по изобретению как непосредственно, так и в составе иммуногенных композиций (вакцин), для профилактики и/или лечения раковых заболеваний, связанных с экспрессией HLA-A2 и CDCA1. 18 н. и 3 з.п. ф-лы, 1 табл., 4 ил., 2 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым пептидам, которые эффективны в качестве вакцин против типов рака, в высокой степени экспрессирующих пептид 1, связанный с циклом деления клетки (CDCA1), таких как рак легких и холангиоцеллюлярная карцинома, и к фармацевтическим средствам, которые включают эти пептиды, для лечения и профилактики опухолей.
Известный уровень техники
В последние годы количество больных раком легких продолжает расти по всему миру и в настоящее время в мире приблизительно один миллион человек умирает от рака легких ежегодно. Также и в Японии смертность от рака легких увеличивается и по оценке достигнет 123000 в 2015 г. Рак легких более характерен для мужчин и отношение мужчин к женщинам составляет три к одному. Рак легких в 1993 г. опередил рак желудка, являясь лидирующей причиной смерти от рака у мужчин. Более того, с ростом количества курящих женщин число больных женского пола, как ожидается, возрастет. Рак легких является лидирующей причиной смерти от рака с 2000 г. и при старении общества количество больных, как предполагается, будет дополнительно расти в будущем. Курение рассматривается как главная причина развития рака легких, а другие причины представляют собой вдыхание асбеста, загрязнение воздуха и тому подобное. Раннее выявление и срочное лечение важны для лечения рака легких. Однако недавно отмечалось, что простой рентген грудной клетки и тестирование мокроты, выполняемые при медицинском обследовании, не эффективны для раннего выявления рака легких, и они не ведут к снижению смертности от рака. Так как количество смертей от рака легких, как предполагается, будет продолжать расти в будущем, неотложной задачей является разработка новых терапевтических стратегий.
В Японии количество смертей от рака желчевыводящих путей возрастает и в 2005 г. 16586 человек умерли от рака желчевыводящих путей. В большинстве случаев рака желчевыводящих путей никаких субъективных симптомов на ранних стадиях не выявляется. По сравнению с типами рака, которые возникают в полости пищеварительного тракта, такими как рак желудка и рак ободочной кишки, рак желчевыводящих путей трудно выявить и диагностировать на ранних стадиях. Следовательно, во многих случаях рак уже прогрессировал и является неоперабельным при выявлении. В дополнение к хирургическому вмешательству при раке желчевыводящих путей проводят лучевую терапию и химиотерапию, но они не являются терапевтически эффективными и необходимо создание нового терапевтического метода.
С другой стороны, последние разработки в молекулярной биологии и иммунологии опухолей показали, что цитотоксические Т-клетки (киллеры) и хелперные Т-клетки узнают пептиды, образованные при деградации белков, которые специфически и в высокой степени экспрессируются в раковых клетках и которые презентируются на поверхности раковых клеток или антигенпрезентирующих клеток с помощью молекул HLA, и вызывают иммунологическую реакцию с разрушением раковых клеток. Более того, многие опухолевые белки-антигены и производные от них пептиды, которые стимулируют такую иммунологическую реакцию для борьбы с раком, идентифицированы, и антигенспецифическая терапия опухолей применяется клинически.
Молекула класса I HLA экспрессируется на поверхности всех имеющих ядро клеток организма. Она связывается с пептидом, появляющимся в результате внутриклеточной деградации белков, продуцируемых в цитоплазме или ядре, и экспрессирует пептид на клеточной поверхности. На поверхности нормальной клетки с молекулами класса I HLA связаны пептиды, происходящие от нормальных аутологичных белков, и они не узнаются и не разрушаются Т-клетками иммунной системы. С другой стороны, в процессе превращения в рак раковые клетки иногда экспрессируют большое количество белков, которые почти не экспрессируются или незначительно экспрессируются в нормальных клетках. Когда молекулы класса I HLA связываются с пептидами, возникшими в результате внутриклеточной деградации белков, специфически и в высокой степени экспрессирующихся в раковых клетках, и затем экспонируют пептиды на поверхности раковых клеток, цитотоксические Т-клетки (киллеры) узнают и разрушают только раковые клетки. С помощью введения таких специфичных для рака антигенов или пептидов индивидууму раковые клетки могут быть разрушены, и рост раковой опухоли может быть подавлен без вреда для нормальных клеток. Это называется иммунотерапией рака с использованием канцероспецифичных антигенов. Молекулы класса II HLA экспрессируются главным образом на поверхности антигенпрезентирующих клеток. Молекулы связываются с пептидами, происходящими от канцероспецифичных антигенов, которые возникают в результате внутриклеточной деградации канцероспецифических антигенов, включенных в антигенпрезентирующие клетки после поступления из внеклеточного окружения, и затем экспонируют пептиды на поверхности клеток. Хелперные Т-клетки, которые их узнают, активируются и индуцируют или усиливают иммунную реакцию против опухолей с помощью продукции различных цитокинов, которые активируют другие иммунокомпетентные клетки.
Соответственно, если разрабатывается иммунотерапия, которая направлена на антигены, специфически и в высокой степени экспрессирующиеся при типах рака, такая терапия может эффективно уничтожать только типы рака, не вызывая какого-либо вредного эффекта в нормальных аутологичных органах. Предполагается также, что терапия может быть полезна для любых больных с терминальной стадией рака, к которым не могут быть применены другие способы лечения. Кроме того, с помощью введения канцероспецифического антигена и пептида в виде вакцины заранее индивидуумам с высоким риском развития рака развитие рака может быть предотвращено.
Хотя существуют различные терапевтические методы лечения рака легких, рак легких имеет плохой прогноз по сравнению с другими типами рака и он является одним из неподатливых типов рака. Причина заключается, например, в быстрой прогрессии и во многих случаях рак находится в прогрессирующей форме к моменту обнаружения. Более того, так как хирургическое вмешательство является высоко инвазивным, количество больных, которым показано хирургическое вмешательство, является ограниченным и полное лечение с помощью лучевой терапии или химиотерапии затруднено. Если разрабатывается иммунотерапия, направленная на антигены, которые в высокой степени и специфически экспрессируются в клетках рака легких, то только рак может быть эффективно уничтожен с помощью такого терапевтического метода без какого-либо повреждения нормальных аутологичных органов. Более того, такой терапевтический метод, как ожидается, применим для любого больного с терминальной стадией рака и для больных, для которых не применимы другие методы лечения из-за крайне плохой функции легких. Кроме того, так как риск развития рака легких высок среди курильщиков, иммунотерапия может быть применима для профилактики рака легких у группы с высоким риском развития рака легких.
С помощью широкого геномного анализа экспрессии генов с использованием микроматриц кДНК авторы настоящего изобретения проанализировали экспрессионный профиль 27648 генов человека в 37 клинических случаях немелкоклеточного рака легких и в эмбриональных органах, и в различных нормальных органах взрослого человека. В результате авторы обнаружили, что CDCA1 (пептид 1, связанный с циклом деления клетки, также известный как гомологи человека Nuf2 (hNuf2)) (GenBank No. поступления NM_145697) в высокой степени экспрессируется во многих случаях рака легких, в то время как он едва экспрессируется в эмбриональной печени или нормальных органах взрослого человека, за исключением семенников, недоступных для иммунной системы. Более того, CDCA1 в высокой степени экспрессируется во всех случаях холангиоцеллюлярной карциномы, раке мочевого пузыря и почечно-клеточной карциноме. Высокая экспрессия CDCA1 обнаружена также в раковых тканях в 40% или более случаев рака простаты, хронического миелогенного лейкоза, злокачественной лимфомы, рака шейки матки, остеосаркомы, рака молочной железы, саркомы мягких тканей и рака ободочной кишки. Этот факт предполагает, что CDCA1 может служить в качестве канцероспецифического антигена при многих карциномах.
HLA-A2 часто наблюдается в популяциях людей независимо от расы и имеется у приблизительно 30% японцев. Следовательно, если можно было бы идентифицировать пептид-антиген рака, который презентируется цитотоксическим Т-клеткам (киллерам) с помощью HLA-A2, он мог бы широко применяться не только у японцев, но и у белой расы и других. Соответственно, важной задачей является идентификация пептидов-антигенов рака, которые презентируются Т-клеткам-киллерам с помощью HLA-A2. Было бы крайне удачно, если бы такие пептиды-антигены рака применялись для иммунотерапии рака легких, который характеризуется высокой заболеваемостью и смертностью по всему миру.
Документы предшествующего уровня техники, относящиеся к настоящему изобретению, представлены ниже.
[Непатентный документ 1] DeLuca J.G., Moree, B., Hickey, J.M., Kilmartin, J.V., and Salmon, E.D., hNuf2 inhibition blocks stable kinetochore-microtubule attachment and induces mitotic cell death in HeLa cells J. Cell Biol. 159: 549-555, 2002.
[Непатентный документ 2] DeLuca, J.G., Dong, Y., Hergert, P, Strauss, J., Hickey, J.M., Salmon, E.D., McEwen, B.F., Hec1 and Nuf2 Are Core Components of the Kinetochore Outer Plate Essential for Organizing Microtubule Attachment Sites., Mol. Biol. Cell 16: 519-531, 2005.
[Непатентный документ 3] Hayama, S., Daigo, Y., Kato, T., Ishikawa, N., Yamabuki, T., Miyamoto, M., Ito, T., Tsuchiya, E., Kondo, S., and Nakamura, Y., Activation of CDCA1-KNTC2, Members of Centromere Protein Complex, Involved in Pulmonary Carcinogenesis., Cancer Res. 66: 10339-10348, 2006.
[Непатентный документ 4] Liu, S.T., Rattner, J.B., Jablonski, S.A., and Yen, T.J., Mapping the assembly pathways that specify formation of the trilaminar kinetochore plates in human cells., J. Cell Biol. 175: 41-53, 2006.
[Непатентный документ 5] DeLuca, J.G., Howell, B.J., Canman, J.C., Hickey, J.M., Fang, G., and Salmon, E.D., et al. Nuf2 and Hec1 Are Required for Retention of the Checkpoint Proteins Mad1 and Mad2 to Kinetochores., Current Biology 13: 2103-2109, 2003.
[Непатентный документ 6] Liu, D., Ding, D., Du, J., Cai, Xin., Huang, Y., Ward, T., Shaw, A., Yang, Y., Hu, R., Jin, C., and Yao, X., Human NUF2 Interacts with Centromere-associated Protein E and Is Essential for a Stable Spindle Microtubule-Kinetochore Attachment. J.Biol.Chem.282: 21415-21424, 2007.
Раскрытие изобретения
[Задачи, решаемые изобретением]
Целью, достигаемой настоящем изобретением, является разработка средств для осуществления иммунотерапии, которая подавляет рост рака посредством стимуляции иммунитета раковых больных против рака, как терапевтического метода для метастазирующего или трудноизлечимого типов рака, которые трудно лечить путем хирургического вмешательства, химиотерапии и лучевой терапии, для лечения рака легких, рака желчевыводящих путей и т.д. Авторы настоящего изобретения идентифицировали пептиды, которые происходят от белков, специфически и в высокой степени экспрессируемых при раке, и которые презентируются Т-клеткам-киллерам с помощью HLA-A2, тем самым обеспечивая возможность применения иммунотерапии у 30% японцев, больных различными типами рака, которые в высокой степени экспрессируют CDCA1.
[Способы осуществления]
Авторы настоящего изобретения при анализе тканей рака легких с использованием микроматриц кДНК идентифицировали ген CDCA1 (GenBank No. поступления NM_145697), который в высокой степени экспрессируется в раке легких. В нормальных тканях экспрессия CDCA1 обнаружена только в семенниках, недоступных для иммунной системы. Для проверки того, будет или нет противоопухолевый иммунитет индуцироваться Т-клетками-киллерами, специфичными по отношению к CDCA1, использовали HLA-A2 трансгенных мышей, экспрессирующих HLA-A2, который имеется у приблизительно 30% японцев. Конкретно в настоящем изобретении авторы проверили, будут индуцироваться или нет ограниченные HLA-A2 Т-клетки-киллеры, специфичные по отношению к пептиду, когда HLA-A2 трансгенных мышей иммунизируют дендритными клетками, происходящими из костного мозга мыши, пульсированными пептидами CDCA1 человека, обладающими мотивом связывания HLA-A2. Будут Т-клетки-киллеры, специфичные по отношению к пептиду CDCA1, индуцироваться в клетках селезенки иммунизированных мышей или нет, проверяли с использованием теста ELISPOT с определением интерферона-γ (IFN-γ), продуцируемого Т-клетками-киллерами, активированными распознаваемыми пептидами, презентируемыми с помощью HLA-A2. В результате идентифицировано два типа новых пептидов CDCA1, которые могут быть применены для иммунотерапии, направленной на HLA-A2-позитивный рак у больных. Более того, было подтверждено, что CTL, происходящие от больных раком и от здоровых доноров, активированные этими пептидами, проявляют цитолитическую активность против клеток, экспрессирующих CDCA1. Это значит, что пептиды, как ожидалось, узнаются ограниченными HLA-A2 Т-клетками-киллерами человека и применимы для иммунотерапии рака у больных с HLA-A2 позитивным раком.
Более конкретно, в настоящем изобретении предлагается следующее:
[1] пептид (A) или (B) ниже:
(A) пептид, содержащий аминокислотную последовательность SEQ ID NO: 1 или 2;
(B) пептид, который содержит аминокислотную последовательность SEQ ID NO: 1 или 2, где одна, две или несколько аминокислот заменены, удалены, вставлены и/или добавлены и где пептид проявляет активность, индуцирующую цитотоксические (киллерные) Т-клетки;
[2] пептид по [1], где вторая аминокислота с N-конца представляет собой лейцин или метионин;
[3] пептид по [1], где C-концевая аминокислота представляет собой валин или лейцин;
[4] средство для индукции иммунитета против рака, которое содержит один или более пептидов по [1] в качестве активного ингредиента;
[5] средство для лечения и/или профилактики рака, которое содержит один или более пептидов по [1] в качестве активного ингредиента;
[6] средство для индукции антигенпрезентирующей клетки, которое проявляет активность, индуцирующую цитотоксические (киллерные) Т-клетки, где указанное средство включает один или более пептидов по [1] в качестве активного ингредиента;
[7] средство для индукции антигенпрезентирующей клетки, которое проявляет активность, индуцирующую цитотоксические (киллерные) Т-клетки, где указанное средство включает в качестве активного ингредиента один или более полинуклеотидов, кодирующих пептиды по [1];
[8] средство для индукции цитотоксической (киллерной) Т-клетки, где указанное средство включает один или более пептидов по [1] в качестве активного ингредиента;
[9] антитело против пептида по [1];
[10] хелперная Т-клетка, цитотоксическая (киллерная) Т-клетка или включающая их популяция иммуноцитов, которые индуцируются с использованием пептида по [1];
[11] антигенпрезентирующая клетка, которая презентирует комплекс, включающий пептид по [1] и антиген HLA;
[12] антигенпрезентирующая клетка по [11], которая индуцируется средством по [6] или [7];
[13] экзосома, которая презентирует комплекс, включающий пептид по [1] и антиген HLA;
[14] экзосома по [13], где антиген HLA представляет собой HLA-A2 (HLA-A2*0201);
[15] способ индукции антигенпрезентирующей клетки, которая проявляет активность, индуцирующую цитотоксические (киллерные) Т-клетки, который включает стадию контактирования антигенпрезентирующей клетки с пептидом по [1];
[16] способ индукции антигенпрезентирующей клетки, которая проявляет активность, индуцирующую цитотоксические (киллерные) Т-клетки, который включает стадию введения полинуклеотида, кодирующего пептид по [1], в антигенпрезентирующую клетку;
[17] способ индукции цитотоксической (киллерной) Т-клетки, который включает стадию контактирования Т-клетки с пептидом по [1];
[18] способ индукции иммунитета против рака, который включает стадию введения пептида по [1] индивидууму;
[19] способ лечения и/или профилактики рака, который включает стадию введения пептида по [1] индивидууму;
[20] применение пептида по [1] для получения средства для индукции иммунитета против рака;
[21] применение пептида по [1] для получения средства для лечения и/или профилактики рака;
[22] пептид по [1] для индукции иммунитета против рака;
[23] пептид по [1] для лечения и/или профилактики рака.
Краткое описание фигур
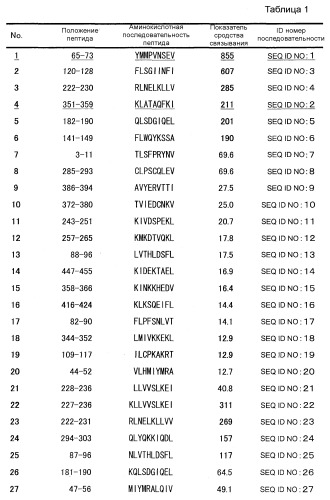
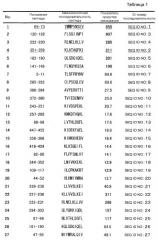
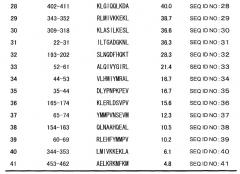
На фиг. 1A представлен протокол идентификации пептидов CDCA1, узнаваемых ограниченными HLA-A2 киллерными Т-клетками. День, когда клетки селезенки отбирали у иммунизированных мышей, обозначен как «день 0». На фиг. 1B представлены результаты теста ELISPOT. Тест ELISPOT использовали для проверки того, будут или нет киллерные Т-клетки, полученные от иммунизированных мышей, специфически отвечать на пульсированные пептидом CDCA1 клетки и продуцировать IFN-γ. В результате киллерные Т-клетки, индуцированные пептидом CDCA1-1 или CDCA1-4, специфически узнавали клетки T2A2, пульсированные пептидом CDCA1, и продуцировали IFN-γ. Однако никакого специфичного для CDCA1 иммунного ответа киллерных Т-клеток не наблюдалось у киллерных Т-клеток, индуцируемых другими пептидами. Следовательно, установлено, что пептиды CDCA1-1 и CDCA1-4 являются эпитопными пептидами, способными индуцировать специфичные для CDCA1 ограниченные HLA-A2 Т-клетки-киллеры. Номера пептидов CDCA1, представленных на фигуре 1B, соответствуют номерам пептидов, представленным в графе «ПОЛОЖЕНИЕ ПЕПТИДА» таблицы 1, но не номерам последовательностей ID, описанным в настоящем документе.
На фиг. 2 представлен результат теста ELISPOT по определению IFN-γ, продуцируемому Т-клетками-киллерами, активированными в результате специфического узнавания пептидов CDCA1. На фиг. 2A представлен результат индукции Т-клеток-киллеров путем стимуляции пульсированных пептидом CDCA165-73 (No. 1) (SEQ ID NO:1) дендритных клеток, происходящих из костного мозга HLA-A2 трансгенных мышей. Когда в качестве стимулированных клеток использовали пульсированные пептидом CDCA1 клетки T2A2, количество в пятне и суммарная область пятна были значительно больше, чем таковые когда в качестве стимулированных клеток использовали HLA-A2 позитивные пульсированные не CDCA1 клетки T2A2. Таким образом, установлено, что пептид CDCA1-1 представляет собой эпитопный пептид, способный индуцировать ограниченные HLA-A2 Т-клетки-киллеры. На фиг. 2B представлен результат индукции Т-клеток-киллеров путем стимуляции пульсированных пептидом CDCA1351-359 (No. 4) (SEQ ID NО:2) дендритных клеток, происходящих из костного мозга HLA-A2 трансгенных мышей. Когда в качестве стимулированных клеток использовали пульсированные пептидом CDCA1 клетки T2A2, количество в пятне и суммарная область пятна были значительно больше, чем таковые, когда в качестве стимулированных клеток использовали HLA-A2 позитивные пульсированные не CDCA1 клетки T2A2. Таким образом, установлено, что пептид CDCA1351-359 (No. 4) представляет собой эпитопный пептид, способный индуцировать ограниченные HLA-A2 Т-клетки-киллеры.
На фиг. 3 представлен специфический иммунный ответ CDCA1 индуцированных CTL от здорового донора. На фиг. 3A представлен протокол индукции специфических для CDCA1 CTL из PBMC. PBMC получали от здорового донора и CD8+ Т-клетки и CD14+ клетки отделяли с использованием микрошариков. Затем продуцировали взаимодействующие с пептидом CD8+ CTL, и DC получали из CD14-позитивных клеток путем культивирования в течение пяти дней в присутствии GM-CSF и ИЛ-4. DC культивировали в присутствии β2 микроглобина при 37°С в течение четырех часов и пульсировали HLA-A2 связывающими пептидами. Пульсированные пептидом DC затем облучали и смешивали с аутологичными CD8-позитивными Т-клетками в отношении 1:20. Клетки культивировали в содержащей AIM-V 2% аутосыворотке, снабженной ИЛ-7. Через три дня в культуральную среду добавляли ИЛ-2. На 12 и 19 дни Т-клетки повторно стимулировали пульсированными пептидом аутологичными DC. DC получали по использованию. Тест ELISPOT на IFN-γ и тест высвобождения Cr выполняли через пять и шесть дней после третьей пептидной стимуляции. На фиг. 3B и C представлены результаты теста ELISPOT, выполненного после совместного культивирования клеток-мишеней с CTL, от донора, индуцированных с использованием пептида CDCA165-73 (No. 1) и пептида CDCA1351-359 (No. 4), соответственно. Продукция IFN-γ против пульсированных пептидом T2 клеток была существенно выше, чем против пульсированных не пептидом T2 клеток. На фиг.3D представлена индуцированная цитотоксичность CTL от PBMC донора 1, больного раком и здорового донора 1 против пульсированных пептидом CDCA1 клеток Т2. На фиг. 3E представлен дозозависимый ответ CTL, происходящих от здорового донора 1, индуцированный пептидом CDCA1351-359. CTL продуцировали большое количество IFN-γ в ответ на T2 клетки, пульсированные пептидом в концентрации 0,2 мкг/мл или боле при отношении E/T равном 5.
На фиг. 4 представлена индуцированная цитотоксическая активность CTL от здорового донора против CDCA1-позитивных раковых клеток. На фиг. 4A представлена экспрессия в клетках COLO201, когда экспрессионный вектор гена CDCA1 введен в клетки. Лентивирус, в котором индуцируется экспрессия CDCA1-HA под контролем промотора EF-1α и промотора CMV, использовали для инфицирования линии раковых клеток (COLO201), которые экспрессируют HLA-A2, но не CDCA1, три раза. Лизат клеток подвергали анализу вестерн-блоттингом с использованием антитела против HA (в середине) или антитела против CDCA1 (вверху). На фиг. 4B, C и D представлена продукция IFN-γ против COLO201/CDCA1. Продукция IFN-γ была значительно выше в трансформированной линии раковых клеток COLO201, чем в нетрансформированной COLO201. Более того, продукция IFN-γ против PANC1, эндогенно экспрессирующих как CDCA1, так и HLA-A2, была существенно выше, чем продукция против A549, не экспрессирующих ни CDCA1, ни HLA-A2. На фиг. 4E и F представлены результаты теста высвобождения 51Cr, когда индуцированные CTL донора и клетки-мишени культивировали совместно. Цитотоксичность была обнаружена для PANC1 (CDCA1+, HLA-A2+), но не для A549 (CDCA1+, HLA-A2-) и COLO201 (CDCA1-, HLA-A2+). На фиг. 4G представлена корреляция между реагирующими на пептид CDCA1 CTL и позитивными по тетрамеру HLA-A2-CDCA1 CTL среди CD8-позитивных клеток. На левой диаграмме представлен тест ELISPOT с использованием пульсированных пептидом клеток T2 в качестве клеток-мишеней и отношение E/T составляло 5. На правой диаграмме представлен результат анализа FACS. Клетки, проанализированные на левой диаграмме, представляют собой происходящие от здорового донора 1 CTL из PBMC три раза подвергавшихся стимуляции пульсированными пептидом DC. Клетки, проанализированные на правой диаграмме, представляют собой наивные CD8-позитивные клетки, выделенные из PBMC здорового донора 1.
Способ осуществления изобретения
Если не указано иначе, все технические и научные термины, используемые в настоящем документе, имеют такое же значение, что и обычно понимаемое специалистом в той области техники, к которой принадлежит настоящее изобретение.
Пептиды по настоящему изобретению представляют собой эпитопы, ограниченные HLA-A2, который является аллелем HLA, часто обнаруживаемым в популяциях японцев и людей белой расы. Конкретно, используя связывающее сродство к HLA-A2 в качестве показателя, отбирали кандидатные пептиды, связывающие HLA-A2, происходящие от CDCA1. У отобранных пептидов оценивали, будут или нет индуцироваться Т-клетки-киллеры в организме HLA-A2-трансгенных мышей под действием дендритных клеток, происходящих из клеток костного мозга HLA-A2-трансгенной мыши (BM-DC), пульсированных отобранными пептидами. Цитотоксические (киллерные) Т-клетки индуцировали in vivo у HLA-A2-трансгенных мышей под действием CDCA1-1 (YMMPVNSEV (SEQ ID NO:1)) и CDCA1-4 (KLATAQFKI (SEQ ID NO:2)). Т-клетки-киллеры, индуцированные этими пептидами, проявляли реакцию иммунного ответа на T2A2 клетки, пульсированные этими пептидами. Однако эти Т-клетки-киллеры не демонстрировали реакцию иммунного ответа на T2A2 клетки, не пульсированные пептидом. Более того, CTL, происходящие от больного раком и происходящие от здорового донора, которые были индуцированы с использованием CDCA1-1 и CDCA1-4, проявляли цитолитическую активность против клеточных линий, экспрессирующих CDCA1. Эти результаты демонстрируют, что пептиды, происходящие от CDCA1, пригодны в качестве пептидов, индуцирующих иммунную реакцию против CDCA1-презентирующих клеток, и что пептиды, происходящие от CDCA1, представляют собой ограниченные HLA-A2 эпитопные пептиды. Показано, что CDCA1 в высокой степени экспрессируется в канцерогенных тканях в большинстве случаев рака легких, холангиоцеллюлярной карциномы, рака мочевого пузыря, почечно-клеточной карциномы, рака простаты, хронического миелогенного лейкоза, злокачественной лимфомы, рака шейки матки, остеосаркомы, рака молочной железы, саркомы мягких тканей и рака ободочной кишки. На основе этих фактов CDCA1 рассматривается как пригодный в качестве иммунотерапевтической мишени для различных типов рака.
(1) Пептиды по настоящему изобретению и средства для индукции иммунитета против рака, которые содержат пептиды
Пептид по настоящему изобретению является любым из от (A) до (D) ниже.
(A) Пептид, содержащий аминокислотную последовательность SEQ ID NO: 1 или 2.
(B) Пептид, который содержит аминокислотную последовательность SEQ ID NO: 1 или 2, где одна, две или несколько аминокислот заменены, удалены, вставлены и/или добавлены и где пептид проявляет активность, индуцирующую цитотоксические (киллерные) Т-клетки.
(C) Пептид по (B), где вторая аминокислота с N-конца представляет собой лейцин или метионин.
(D) Пептид по (B), где C-концевая аминокислота представляет собой валин или лейцин.
В настоящем документе «пептид, который проявляет активность, индуцирующую Т-клетки-киллеры», означает «пептид, обладающий индуцирующей Т-клетки активностью, который стимулирует Т-клетки-киллеры (цитотоксические Т-клетки/CTL)».
Пептид по настоящему изобретению является эпитопным пептидом, содержащим менее приблизительно 40 аминокислот, предпочтительно менее приблизительно 20 аминокислот, более предпочтительно менее приблизительно 15 аминокислот, и включающим аминокислотную последовательность SEQ ID NO: 1 или 2 и проявляющим активность в виде индукции Т-клеток-киллеров. Более того, пептиды по настоящему изобретению (эпитопные пептиды) могут включать пептид, включающий аминокислотную последовательность SEQ ID NO: 1 или 2, где одна, две или несколько аминокислот заменены, удалены, вставлены и/или добавлены до тех пор, пока сохраняется способность индуцировать Т-клетки-киллеры. Количество замененных, удаленных, вставленных и/или добавленных остатков обычно составляет пять аминокислот или менее, предпочтительно четыре аминокислоты или менее, более предпочтительно три аминокислоты или менее, даже более предпочтительно одну аминокислоту или две аминокислоты.
Варианты пептидов (т.е. пептиды, включающие аминокислотные последовательности, полученные в результате модификации исходных аминокислотных последовательностей путем замены, делеции, вставки и/или добавления одного, двух или нескольких аминокислотных остатков), как известно, сохраняют исходную биологическую активность (Mark DF et al., (1984) Proc Natl Acad Sci USA 81:5662-6; Zoller MJ and Smith M, (1982) Nucleic Acids Res 10:6487-500; Dalbadie-McFarland G et al. (1982) Proc Natl Acad Sci USA 79:6409-13). Аминокислотная модификация предпочтительно сохраняет свойства исходных аминокислотных боковых цепей. Примеры свойств аминокислотных боковых цепей включают: гидрофобную аминокислоту (A, I, L, M, F, P, W, Y, V); гидрофильную аминокислоту (R, D, N, C, E, Q, G, H, K, S, T); и боковые цепи, обладающие следующими функциональными группами или свойствами в целом: алифатические боковые цепи (G, A, V, L, I, P); боковые цепи, содержащие гидроксильные группы (S, T, Y); боковые цепи, содержащие атом серы (C, M); боковые цепи, содержащие карбоновые кислоты и амиды (D, N, E, Q); боковые цепи, содержащие основания (R, K, H); и боковые цепи, содержащие ароматические кольца (H, F, Y, W). Буквы в скобках представляют собой однобуквенные коды аминокислот.
В предпочтительном варианте осуществления пептиды по настоящему изобретению (иммуногенные пептиды) представляют собой нонапептиды (9-членные) или декапептиды (10-членные).
Для получения пептидов с высоким связывающим сродством и активностью, индуцирующей Т-клетки-киллеры, аминокислотная последовательность пептида - части природного CDCA1 может быть модифицирована путем замены, делеции, вставки и/или добавления одной, двух или нескольких аминокислот. В настоящем документе термин «несколько» относится к пяти или менее, предпочтительно к трем или менее, более предпочтительно к двум или менее. Более того, так как известна упорядоченность пептидных последовательностей, которые обладают высоким сродством к антигенам HLA, (Kubo RT, et al., (1994) J. Immunol., 152, 3913-24; Rammensee HG, et al., (1995) Immunogenetics. 41:178-228; Kondo A, et al. (1995) J. Immunol. 155:4307-12), пептиды по настоящему изобретению (эпитопные пептиды) могут быть модифицированы на основе упорядоченности для того, чтобы повысить их сродство к антигенам HLA. Например, пептиды с высоким связывающим сродством к HLA-A2 могут быть получены путем замены второй аминокислоты с N-конца на лейцин или метионин. Сходно, пептиды с высоким связывающим сродством к HLA-A2 могут быть также получены путем замены C-концевой аминокислоты на валин или лейцин.
Когда последовательность эпитопного пептида идентична части аминокислотной последовательности эндогенного или экзогенного белка, обладающего отличной функцией, могут вызываться побочные эффекты, такие как аутоиммунные нарушения или аллергические симптомы против конкретного вещества. Для того, чтобы избежать таких побочных эффектов модифицированный эпитопный пептид не должен быть идентичным аминокислотным последовательностям известных белков. Для этой цели необходимо осуществить поиск гомологии с использованием доступных баз данных для подтверждения того, что не существует эндогенного или экзогенного белка с отличной функцией, который имеет 100% гомологию с модифицированным эпитопным пептидом. С помощью этой процедуры можно избежать рисков, обусловленных указанной выше модификацией аминокислотной последовательности для повышения связывающего сродства к антигенам HLA и/или повышения активности, индуцирующей Т-клетки-киллеры.
Хотя указанные выше пептиды, обладающие высоким связывающим сродством к антигенам HLA, как предполагается, являются высокоэффективными в качестве вакцин против рака, кандидатные пептиды, отобранные с использованием в качестве показателя высокое связывающее сродство, необходимо проверить, обладают ли они действительно активностью, индуцирующей Т-клетки-киллеры. Активность, индуцирующая Т-клетки-киллеры, может быть подтверждена с помощью: индукции антигенпрезентирующих клеток, обладающих антигеном MHC человека (например, В-лимфоцитов, макрофагов и дендритных клеток), более конкретно индукции дендритных клеток, происходящих от мононуклеарных лейкоцитов периферической крови человека; стимуляции их интересующим пептидом; затем смешивания их с CD8-позитивными клетками; и измерения цитотоксической активности в отношении клеток-мишеней. В качестве реакционной системы могут быть использованы трансгенные животные, которые экспрессируют антиген HLA человека (как описано, например, в BenMohamed L, et al. (2000) Hum. Immunol. 61(8):764-79, относящихся к этому статьях, книгах и адресах связи). Например, для измерения цитотоксической активности клетки-мишени метят радиоактивным изотопом 51Cr или тому подобным. Цитотоксическая активность на клетках-мишенях может быть проверена с помощью измерения IFN-γ, продуцируемого и секретируемого Т-клетками-киллерами в присутствии антигенпрезентирующих клеток, обладающих иммобилизованным пептидом; и визуализации зоны продукции IFN-γ в культуральной среде с использованием моноклонального антитела против IFN-γ.
Как показано в примерах, данные по тестированию активности пептидов, индуцирующей Т-клетки-киллеры, продемонстрировали, что пептиды, обладающие высоким связывающим сродством к антигену HLA не обязательно обладают высокой активностью, индуцирующей Т-клетки-киллеры. Однако пептиды, содержащие аминокислотные последовательности CDCA1-1 (YMMPVNSEV (SEQ ID NO:1)) и CDCA1-4 (KLATAQFKI (SEQ ID NO:2)) проявили особенно высокую активность, индуцирующую Т-клетки-киллеры.
Как описано выше, в настоящем изобретении предлагаются пептиды, проявляющие активность, индуцирующую Т-клетки-киллеры, более конкретно, пептиды, включающие аминокислотную последовательность SEQ ID NO: 1 или 2 и их варианты (т.е. аминокислотные последовательности, в которых одна, две или несколько аминокислот заменены, удалены, вставлены и/или добавлены). Предпочтительно, аминокислотные последовательности пептидов, включающие девять аминокислот SEQ ID NO: 1 или 2, или их варианты не идентичны последовательностям других эндогенных белков. Особенно пептиды с высоким связывающим сродством к HLA-A2 могут быть получены путем замены второй аминокислоты с N-конца на лейцин или метионин и/или путем замены C-концевой аминокислоты на валин или лейцин.
Пептиды по настоящему изобретению могут включать модификации, такие как гликозилирование, окисление боковой цепи и фосфорилирование, до тех пор, пока пептиды не потеряют свою активность, индуцирующую Т-клетки-киллеры. Другие модификации включают, например, D-аминокислоты и другие аминокислотные аналоги, которые могут быть использованы для повышения периода полужизни пептидов в сыворотке.
Методы получения и продукции пептидов по настоящему изобретению особенно не ограничены. Пригодны химически синтезированные пептиды или рекомбинантные пептиды, продуцируемые с помощью методов рекомбинации генов.
Химически синтезированные пептиды по настоящему изобретению могут быть синтезированы в соответствии с методами химического синтеза, такими как метод Fmoc (флуоренилметилоксикарбонильный метод) и метод t-Boc (трет-бутилоксикарбонильный метод). Пептиды по настоящему изобретению могут быть также синтезированы с использованием различных имеющихся в продаже пептидных синтезаторов.
Пептиды по настоящему изобретению могут быть получены в виде рекомбинантных белков с помощью получения ДНК, обладающих нуклеотидными последовательностями, кодирующими пептиды или их варианты или гомологи, и введения их в подходящую экспрессионную систему.
Используемые экспрессионные векторы могут быть предпочтительно любыми векторами, которые могут автономно дуплицироваться в клетках-хозяевах или могут быть включены в хромосому клеток-хозяев и содержат промотор в положении, подходящем для разрешения экспрессии гена, кодирующего пептид. Трансформированные клетки, обладающие геном, кодирующим пептид по настоящему изобретению, могут быть получены путем введения указанного выше экспрессионного вектора хозяину. Хозяин может представлять собой любое из бактерий, дрожжей, животных клеток и клеток насекомых, и экспрессионный вектор может быть введен хозяину с использованием известных способов в зависимости от хозяина.
В настоящем изобретении рекомбинантные пептиды могут быть выделены путем культивирования трансформированных клеток, полученных, как описано выше, продукции и накопления пептидов в культуре и получения пептидов по настоящему изобретению из культуры.
Когда трансформированной клеткой является прокариот, такой как E. coli, или эукариот, такой как дрожжи, культуральная среда для этих микроорганизмов может быть либо природной, либо синтетической средой, до тех пор, пока она содержит источник углерода, источник азота, неорганические соединения и тому подобное, что может быть использовано микроорганизмами и позволяет эффективно культивировать трансформированную клетку. Условия культивирования могут быть условиями, традиционно используемыми для культивирования микроорганизмов. После культивирования пептиды по настоящему изобретению могут быть выделены из культуры трансформированных клеток и очищены с использованием общепринятых методов выделения и очистки пептидов.
Пептиды, включающие аминокислотную последовательность, в которой одна, две или несколько аминокислот заменены, удалены, вставлены или добавлены в аминокислотную последовательность SEQ ID NO: 1 или 2 могут быть подходящим образом продуцированы или получены специалистом в данной области техники на основе информации о последовательности нуклеотидов в ДНК, кодирующей аминокислотную последовательность SEQ ID NO: 1 или 2. Конкретно, ген, который кодирует пептид, включающий аминокислотную последовательность, в которой одна, две или несколько аминокислот заменены, удалены, вставлены и/или добавлены в аминокислотную последовательность SEQ ID NO: 1 или 2, и проявляющий активность, индуцирующую Т-клетки-киллеры, может быть получен с помощью любых методов, известных специалистам в данной области техники, таких как химический синтез, методы генной инженерии и мутагенез. Например, пр