Стабильная рекомбинантная аденозиндеаминаза
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Описаны выделенная рекомбинантная аденозиндеаминаза, включающая полипептид SEQ ID NO: 1 или вариантный полипептид SEQ ID NO: 1 выделенной рекомбинантной аденозиндеаминазы, где вариантный полипептид SEQ ID NO: 1 включает одну или более аминокислотных замен, выбранных из группы, состоящей из: Gln вместо Lys198; Ala вместо Thr245; и Arg вместо Gly351, и кодирующая ее ДНК. Представлен конъюгат полиалкиленоксида с указанной аденозиндеаминазой для лечения аденозиндеаминаза-опосредованных заболеваний, где аденозиндеаминаза включает от 11 до 17 цепей полиалкиленоксида с молекулярной массой 5 кДа на белок АДА. Предложены способы очистки рекомбинантной аденозиндеаминазы, включающие очистку белка с помощью ионообменной хроматографии или очистку белка с помощью хроматографии гидрофобного взаимодействия. Кроме того, представлены препараты рекомбинантной аденозиндеаминазы, полученные указанными способами. Изобретение позволяет получить рекомбинантную аденозиндеаминазу, обладающую повышенной стабильностью. 8 н. и 6 з.п. ф-лы, 1 табл., 10 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННУЮ ЗАЯВКУ
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 60/913,009, поданной 20 апреля 2007 года, содержание которой включено в настоящий документ путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение обеспечивает рекомбинантную аденозиндеаминазу, мутированную с целью повышения стабильности.
УРОВЕНЬ ТЕХНИКИ
Аденозиндеаминазу (АДА) использовали при лечении заболевания, обусловленного ферментной недостаточностью, называемого тяжелым комбинированным иммунодефицитом (ТКИД) или "бабл-бой" (мальчик в пузыре), в течение некоторого времени. Более 15 лет компания Энзон Фармасьютикалз делала терапевтическую АДА доступной для пациентов в форме ПЭГилированной АДА, полученной с использованием бычьего фермента АДА.
Недавно были предприняты попытки заменить бычий фермент рекомбинантным ферментом (в дальнейшем "рАДА"). В качестве замены очищенной природной бычьей АДА рассматривали как рекомбинантный человеческий ("рчАДА"), так и рекомбинантный бычий ("рбАДА") ферменты. Ферменты рбАДА и рчАДА несколько менее устойчивы по сравнению с нативным очищенным бычьим ферментом, который применяется в настоящее время. И рчАДА, и рбАДА, как полагают, разлагаются по механизму, согласуемому с разложением цистеина: добавление кислорода; формирование дитиолов; ускорение разложения при повышении pH; осаждение, особенно при повышенном pH и концентрации образцов. В восстановленном состоянии цистеин содержит реакционно-способную SH- группу (сульфгидрильную), и в такой форме ответственен за разложение.
Экспериментальные данные позволили предположить, что единственный, внешний цистеин может являться ответственным за разложение, наблюдаемое и для рбАДА, и для рчАДА. Структура бычьей АДА (то есть, нативной бычьей АДА, очищенной из бычьего источника) в значительной мере схожа со структурой рчАДА: и бычья АДА, и рчАДА имеют одинаковое количество цистеинов в одних и тех же положениях первичной последовательности. Получаемая в настоящее время рекомбинантная человеческая и рекомбинантная бычья АДА содержат продукты разложения/примеси (дитиолы), которые согласуются с реакционной способностью цистеина. Нативная бычья АДА отличается по структуре от рекомбинантной бычьей АДА тем, что в нативной бычьей АДА с каждым молем АДА связан один моль цистеина. Кроме того, нативная бычья АДА устойчива при высоком pH, что позволяет предположить, что цистеин, связанный с АДА, функционирует как блокирующая группа.
Одним из способов стабилизации рекомбинантной человеческой и/или рекомбинантной бычьей АДА является кэпирование активного остатка Cys (Cys 74 в зрелом рбАДА и зрелом рчАДА) любым из окисленного глутатиона, иодоацетамида, йодуксусной кислоты, цистина, других дитиолов и их смесей. Данный способ описан в заявке на патент США 11/738,012 (настоящего заявителя), озаглавленной "Стабилизированные белки" (Stabilized Proteins), содержание которой путем отсылки включено в настоящий документ в полном объеме.
Несмотря на вышеизложенное, устранение потребности в дополнительной стадии кэпирования посредством изменения структуры белка с целью обеспечения собственной стабильности непосредственно при экспрессии является предпочтительным. В патенте США 5346823 описана стабилизация прокариотических протеаз, таких как субтилизин, а также нейтральной протеазы, путем замены дестабилизирующих остатков Cys на Ser и другие аминокислотные остатки, посредством мутации. Однако мутационный анализ активных сайтов в АДА показал, что замена остатка Cys (Cys 262) приводила к значительному снижению активности фермента, Bhaumik et al 1993, The J. of Biol. Chem., 268 (8):5464-5470. Таким образом, до настоящего изобретения стабилизация аденозиндезаминаз путем замены активного и внешнего остатка Cys другим аминокислотным остатком с сохранением оптимальной полезной активности фермента не была известна.
Таким образом, выгодно обеспечить устойчивые рбАДА и рчАДА, то есть, без значительного разложения во время хранения и обработки, при уровнях pH, используемых при оптимальном ПЭГилировании фермента.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, изобретение обеспечивает рекомбинантную АДА, в которой любой окисляемый остаток цистеина заменен неокисляемым аминокислотным остатком по сравнению с формой дикого типа фермента АДА. Мутеин АДА включает неокисляемый аминокислотный остаток, который является одной из природных L-аминокислот, например, аланином, аспарагиновой кислотой, глутаминовой кислотой, фенилаланином, глицином, гистидином, изолейцином, лизином, лейцином, метионином, аспарагином, пролином, глутамином, аргинином, серином, треонином, валином, триптофаном, тирозином и/или известными в уровне техники вариантами и производными природных L-аминокислот, например, 2-аминоадипиновой кислотой, 3-аминоадипиновой кислотой, бета-аланином, бета-аминопропионовой кислотой, 2-аминомасляной кислотой, 4-аминомасляной кислотой, пиперидиновой кислотой, 6-аминокапроновой кислотой, 2-аминогептановой кислотой, 2-аминоизомасляной кислотой, 3-аминоизомасляной кислотой, 2-аминопимелиновой кислотой, 2,4-диаминомасляной кислотой, десмозином, 2,2'-диаминопимелиновой кислотой, 2,3-диаминопропионовой кислотой, н-этилглицином, н-этиласпарагином, гидроксилизином, алло-гидроксилизином, 3-гидроксипролином, 4-гидроксипролином, изодесмозином, алло-изолейцином, н-метилглицином, саркозином, н-метилизолейцином, 6-н-метиллизином, н-метилвалин, норвалин, норлейцин, орнитин и т.п. Необязательно, метионин или триптофан исключаются, поскольку они являются потенциально окисляемыми.
Более предпочтительно, неокисляемым аминокислотным остатком является один из серина, аланина, аспарагина, глутамина, глицина, изолейцина, лейцина, фенилаланина, треонина, тирозина и валина. Серин является наиболее предпочтительным. В некоторых предпочтительных вариантах осуществления окисляемый цистеин расположен приблизительно в 74 положении зрелого белка АДА. Рекомбинантным АДА предпочтительно является рекомбинантная бычья АДА или рекомбинантная АДА человека, то есть, например, транслированная с молекулы ДНК, соответствующей SEQ ID NO: 2 или SEQ ID NO: 4, и которая предпочтительно включает SEQ ID NO: 1 или SEQ ID NO: 3. Когда рекомбинантной АДА является рекомбинантная бычья АДА, соответствующая SEQ ID NO: 1, АДА необязательно экспрессируется с полиморфизмом, выбранным из одного или более Gln вместо Lys198; Ala вместо Thr245; и Arg вместо Gly351.
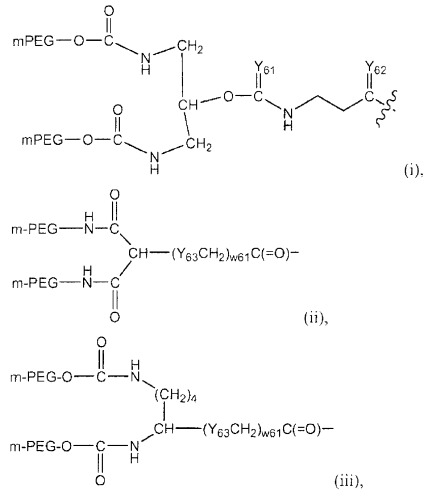
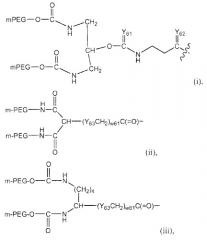
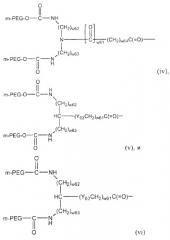
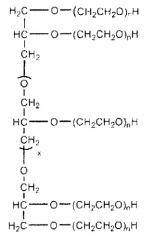
Изобретение также обеспечивает конъюгат полиалкиленоксид-АДА, где полиалкиленоксид предпочтительно является полиэтиленгликолем. Необязательно полиэтиленгликоль конъюгирован с рекомбинантной аденозиндеаминазой посредством химического линкера, выбранного из группы, состоящей из сукцинимидилкарбоната, тиазолидинтиона, уретана, сукцинимидилсукцината и линкеров на основе амидов. Предпочтительным является сукцинимидилкарбонат. Полиэтиленгликоль предпочтительно ковалентно присоединен к эпсилон-аминогруппе Lys рекомбинантной аденозиндеаминазы.
Конъюгат полиэтиленгликоль-АДА включает, по меньшей мере, 1 (то есть, один или более) полиэтиленгликолевых цепей, присоединенных к эпсилон-аминогруппам, предпочтительно, по меньшей мере, 5 (то есть, пять или более) полиэтиленгликолевых цепей, присоединенных к эпсилон-аминогруппам, или, более предпочтительно, от приблизительно 11 до приблизительно 18 полиэтиленгликолевых цепей, присоединенных к эпсилон-аминогруппам остатков Lys рекомбинантной АДА.
Полиэтиленгликоль конъюгатов изобретения имеет молекулярную массу приблизительно от 2000 до приблизительно 100000 кДа, или, более предпочтительно, приблизительно от 4000 до приблизительно 45000 кДа.
Изобретение дополнительно обеспечивает способ очистки рекомбинантных аденозиндеаминаз изобретения. Например, рекомбинантную аденозиндеаминазу предпочтительно очищают с помощью ионообменной хроматографии (например, Capto Q, DEAE и SP хроматографии), а рекомбинантную аденозиндеаминазу SEQ ID NO: 1 предпочтительно очищают с помощью хроматографии гидрофобного взаимодействия.
Кроме того, настоящее изобретение дополнительно обеспечивает способ лечения АДА-опосредованного заболевания у млекопитающих, включающий введение эффективного количества рекомбинантной АДА согласно настоящему изобретению. АДА-опосредованное заболевание включает, например, ТКИД, рак и т.п.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает стабильные рекомбинантные ферменты - аденозиндеаминазы. Аденозиндеаминазы изобретения получают посредством замены остатка цистеина, который подвергается процессам окисления, когда фермент находится в растворе, приемлемым альтернативным аминокислотным остатком, который сохраняет активность, заряд и третичную структуру фермента при одновременном устранении источника деструктивной нестабильности.
A. Определения
В целях обеспечения ясности при описании изобретения ниже приведены определения нескольких терминов.
Термин "рекомбинантный" относится к белку, полученному с помощью клеток, которые в нативном состоянии не содержат эндогенной копии ДНК, способной экспрессировать указанный белок. Клетки продуцируют рекомбинантный белок, поскольку они были генетически изменены посредством введения соответствующей выделенной последовательности нуклеиновой кислоты. Термин также включает ссылку на клетку, или нуклеиновую кислоту, или вектор, которые были модифицированы посредством введения гетерологичной (экзогенной или чужеродной) нуклеиновой кислоты или посредством изменения нативной нуклеиновой кислоты с получением формы, которая не является нативной для данной клетки, или указанная клетка получена из клетки, модифицированной таким способом. Таким образом, например, рекомбинантные клетки экспрессируют гены, которые не присутствуют в нативной (нерекомбинантной) форме клетки, экспрессируют мутантные гены, которые присутствуют в нативной форме, или экспрессируют нативные гены, которые каким-либо иным образом неправильно экспрессируются, экспрессируются недостаточно или не экспрессируются вообще.
Используемая в настоящем описании "нуклеиновая кислота" или "последовательность нуклеиновых кислот" включают ссылку на дезоксирибонуклеотидный или рибонуклеотидный полимер или в одно- или двунитевой форме и, если нет иного ограничения, охватывают известные аналоги природных нуклеотидов, которые гибридизуются с нуклеиновыми кислотами аналогично природным нуклеотидам. Если не указано иное, конкретная последовательность нуклеиновых кислот включает соответствующую комплементарную последовательность.
Термин "кодирующий" применительно к указанной нуклеиновой кислоте включает ссылку на нуклеиновые кислоты, которые включают информацию для трансляции в специфический белок. Информация определяется посредством кодонов.
"Клетка-хозяин" является клеткой, которая может поддерживать репликацию или экспрессию экспрессионного вектора. Клетки-хозяева могут являться прокариотическими клетками, такими как клетки E. coli, или эукариотическими, такими как клетки дрожжей, насекомых, амфибиий или млекопитающих.
Используемые в настоящем описании "полипептид", "пептид" и "белок" используются попеременно и включают ссылку на полимер, состоящий из аминокислотных остатков.
Термин "остаток" или "аминокислотный остаток", или "аминокислота" включает ссылку на аминокислоту, которая входит в состав белка, полипептида или пептида (совокупно "пептид").
Аминокислота может являться природной аминокислотой и, если нет иного ограничения, может охватывать известные аналоги природных аминокислот, которые могут функционировать аналогично природным аминокислотам.
"Трансфекция" относится к поглощению вектора экспрессии клеткой-хозяином, независимо от того, экспрессируются ли какие-то кодирующие последовательности фактически, или нет. Многочисленные способы трансфекции известны среднему специалисту в данной области. Например, трансфекцию проводят в присутствии вектора экспрессии и высоких концентраций CaPO4, с помощью электропорации, при использовании фага или вирусного вектора экспрессии для встраивания в клетку-хозяина, посредством механического встраивания нуклеиновой кислоты, и даже путем культивирования клетки-хозяина в присутствии неупакованных фрагментов нуклеиновой кислоты. Трансфекцию обычно считают успешной, когда в клетке-хозяине наблюдается какая-либо индикация работы целевого вектора.
"Трансформация" описывает введение нуклеиновой кислоты в организм таким образом, чтобы нуклеиновая кислота была способна к репликации либо в качестве внехромосомного элемента, либо путем интегрирования в хозяйскую хромосому. В зависимости от используемой клетки-хозяина трансформацию проводят, применяя известные из уровня техники способы, соответствующие конкретным клеткам-хозяевам. Кальциевую обработку, в которой применяется хлорид кальция, как описано Cohen, S. N. Proc. Natl. Acad. Sci. (USA), 69:2110 (1972) и Mandel et al, J. Mol. Biol. 53:154 (1970), обычно используют для прокариотических или других клеток, которые имеют клеточные стенки (например, многие бактериальные и/или растительные клетки). Для клеток млекопитающих, не имеющих подобных клеточных стенок, предпочтителен способ преципитации фосфатом кальция Graham, F. and van der Eb, A., Virology, 52: 456-457 (1978). Общие аспекты трансформации системы хозяйских клеток млекопитающих были описаны в патенте США 4,399,216, опубликованном 16 августа 1983 года. Трансформацию дрожжей обычно выполняют согласно методу Van Solingen, P., et a!., J. Bad., 130: 946 (1977) и Hsiao, C. L., et al., Proc. Natl. Acad. Sci, (USA) 76: 3829 (1979). Однако также могут использоваться любые другие известные из уровня техники способы введения нуклеиновой кислоты, например, ДНК, в клетки, такие как, например, микроинъекция, липофекция или слияние протопластов.
Используемый в настоящем описании термин "комплементарный" применительно к нуклеиновой кислоте относится к парной противоположной цепи, синтезируемой (с использованием принципа коплементарности Уотсона-Крика) при репликации первой молекулы нуклеиновой кислоты с использованием указанной молекулы в качестве матрицы для формирования новой, второй цепи нуклеиновых кислот. В одном аспекте изобретения две молекулы нуклеиновой кислоты считаются комплементарными друг другу, когда они гибридизуются или связываются при жестких условиях.
Понятие "функционально связанный" относится к такому смежному расположению элементов, например, регуляторной области и открытой рамки считывания, при котором может осуществляться нормальное функционирование элементов. Таким образом, открытая рамка считывания, которая "функционально связана" с регуляторными последовательностями, относится к конфигурации, в которой кодирующая последовательность может экспрессироваться под контролем указанных последовательностей.
"Регуляторные последовательности" относятся к последовательностям нуклеиновых кислот, необходимым для экспрессии функционально связанной кодирующей последовательности в специфическом организме-хозяине. Регуляторные последовательности, подходящие для прокариотов, например, включают промотор, необязательно последовательность оператора, сайт связывания рибосомы и, возможно, другие пока еще плохо изученные последовательности. Эукариотические клетки, как известно, используют, например, такие регуляторные последовательности как промоторы, сигналы полиаденилирования и энхансеры, а также многие другие.
"Система экспрессии" или "экспрессионный вектор" относятся к последовательностям нуклеиновых кислот, содержащим целевую кодирующую последовательность и регуляторные последовательности в функциональной связи, посредством которых организмы-хозяева, трансформированные указанными последовательностями, способны продуцировать кодируемые белки. Для осуществления трансформации система экспрессии может быть включена в вектор, впрочем, затем соответствующая молекула нуклеиновой кислоты может быть также интегрирована в хромосому организма-хозяина.
Используемые в настоящем описании "клетка", "клеточная линия" "культура клеток" используются попеременно, при этом все подобные обозначения включают потомство. Таким образом, "трансформанты" или "трансформированные клетки" включают первичную целевую клетку и культуры, полученные из нее без учета количества пассажей. Также следует понимать, что все потомство может не являться строго идентичным по геномному содержанию, что обусловлено намеренными или случайными мутациями. Также включено мутантное потомство, обладающее такими же функциональными свойствами, которые выявлены у первоначально трансформированной клетки. В случаях, когда необходимы иные определения, это будет понятно из контекста.
В рамках настоящего изобретения термин "остаток", как следует понимать, означает ту часть соединения, к которому он относится, например, ПЭГ, АДА, аминокислоту и т.д., которая остается после того, как она подверглась реакции замещения другим соединением.
В рамках настоящего изобретения термин "полимерный остаток" например, "остаток ПЭГ", как следует понимать, означает ту часть полимера или ПЭГ, которая остается после того, как она подверглась реакции с другими соединениями, группами и т.д.
В рамках настоящего изобретения термин "алкил", используемый в настоящем описании, относится к насыщенному алифатическому углеводороду, включая линейные, разветвленные и циклические алкильные группы. Термин "алкил" также включает алкил-тио-алкильные, алкоксиалкильные, циклоалкилалкильные, гетероциклоалкильные и C1-6-алкилкарбонилалкильные группы. Предпочтительно, алкильная группа включает 1-12 атомов углерода. Более предпочтительно, алкильная группа является низшим алкилом, включающим приблизительно от 1-7 атомов углерода, наиболее предпочтительно приблизительно 1-4 атомов углерода. Алкильная группа может быть замещена или незамещена. Когда алкильная группа замещена, замещенная группа (группы) предпочтительно включает гало, окси, азидо, нитро, циано, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-гидрокарбонил, арил и амино.
В рамках настоящего изобретения термин "замещенный", используемый в настоящем описании, относится к добавлению или замене одного или нескольких атомов, содержащихся в пределах функциональной группы или соединения, одной из групп, выбранных из гало, окси, азидо, нитро, циано, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-карбонил, арил и амино.
Термин "алкенил", используемый в настоящем описании, относится к группам, содержащим, по меньшей мере, одну углерод-углеродную двойную связь, включая линейные, разветвленные и циклические группы. Предпочтительно, алкенильная группа включает приблизительно 2-12 атомов углерода. Более предпочтительно, алкенильная группа является низшим алкенилом, включающим приблизительно от 2-7 атомов углерода, наиболее предпочтительно приблизительно 2-4 атома углерода. Алкенильная группа может быть замещена или незамещена. Когда алкенильная группа замещена, замещенная группа (группы) предпочтительно включает гало, окси, азидо, циано, нитро, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-алкилкарбонилалкил, арил и амино.
Термин "алкинил", используемый в настоящем описании, относится к группам, содержащим, по меньшей мере, одну углерод-углеродную тройную связь, включая линейные, разветвленные и циклические группы. Предпочтительно алкинильная группа включает приблизительно 2-12 атомов углерода. Более предпочтительно алкинильная группа является низшим алкинилом, включающим приблизительно от 2-7 атомов углерода, наиболее предпочтительно приблизительно 2-4 атома углерода. Алкинильная группа может быть замещена или незамещена. Когда алкинильная группа замещена, замещенная группа (группы) предпочтительно включает гало, окси, азидо, нитро, циано, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-гидрокарбонил, арил и амино. Примеры "алкинила" включают пропаргил, пропин и 3-гексин.
В рамках настоящего изобретения термин "арил" относится к ароматической углеводородной кольцевой системе, содержащей, по меньшей мере, одно ароматическое кольцо. Ароматическое кольцо необязательно может быть сконденсировано или иным образом присоединено к другим ароматическим углеводородным кольцам или неароматическим углеводородным кольцам. Примеры арильных групп включают, например, фенил, нафтил, 1,2,3,4-тетрагидронафталин и бифенил. Предпочтительные примеры арильных групп включают фенил и нафтил.
В рамках настоящего изобретения термин "циклоалкил" относится к циклическому C3-8-углеводороду. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил. циклогептил и циклооктил.
В рамках настоящего изобретения термин "циклоалкенил" относится к циклическому C3-8-углеводороду, содержащему, по меньшей мере, одну углерод-углеродную двойную связь. Примеры циклоалкенила включают циклопентенил, циклопентадиенил, циклогексенил, 1,3-циклогексадиенил, циклогептенил, циклогептатриенил и циклооктенил.
В рамках настоящего изобретения термин "циклоалкилалкил" относится к алкильной группе, замещенной C3-8-циклоалкильной группой. Примеры циклоалкилалкильной группы включают циклопропилметил и циклопентилэтил.
В рамках настоящего изобретения термин "алкокси" относится к алкильной группе с указанным количеством атомов углерода, присоединенной к основной части молекулы через кислородный мостик. Примеры алкоксигрупп включают, например, метокси, этокси, пропокси и изопропокси.
В рамках настоящего изобретения "алкиларильная" группа относится к арильной группе, замещенной алкильной группой.
В рамках настоящего изобретения "аралкильная" группа относится к алкильной группе, замещенной арильной группой.
В рамках настоящего изобретения термин "алкоксиалкил" относится к алкильной группе, замещенной алкоксигруппой.
В рамках настоящего изобретения термин "алкил-тио-алкил" относится к алкил-S-алкил-тиоэфирной группе, например метилтио метильной или метилтиоэтильной.
В рамках настоящего изобретения термин "амино" относится к азотсодержащей группе, которая, как известно из уровня техники, получена из аммиака путем замещения одного или нескольких водородных радикалов органическими радикалами. Например, термины "ациламино" и "алкиламино" относятся к определенным органическим радикалам, N-замещенным арильной и алкильной замещающими группами, соответственно.
В рамках настоящего изобретения термин "алкилкарбонил" относится к карбонильной группе, замещенной алкильной группой.
В рамках настоящего изобретения термины "галоген" или "гало" относятся к фтору, хлору, брому и иоду.
В рамках настоящего изобретения термин "гетероциклоалкил" относится к неароматической кольцевой системе, содержащей, по меньшей мере, один гетероатом, выбранный из азота, кислорода и серы. Гетероциклоалкильное кольцо необязательно может быть сконденсировано или иным образом присоединено к другим гетероциклоалкильным кольцам и/или неароматическим углеводородным кольцам. Предпочтительные гетероциклоалкильные группы включают от 3 до 7 членов. Примеры гетероциклоалкильных групп включают, например, пиперазин, морфолин, пиперидин, тетрагидрофуран, пирролидин и пиразол. Предпочтительные гетероциклоалкильные группы включают пиперидинил, пиперазинил, морфолинил и пирролидинил.
В рамках настоящего изобретения термин "гетероарил" относится к ароматической кольцевой системе, содержащей, по меньшей мере, один гетероатом, выбранный из азота, кислорода и серы. Гетероарильное кольцо может быть сконденсировано или иным образом присоединено к одному или нескольким гетероарильным кольцам, ароматическим или неароматическим углеводородным кольцам, или гетероциклоалкильным кольцам. Примеры гетероарильных групп включают, например, пиридин, фуран, тиофен, 5,6,7,8-тетрагидроизохинолин и пиримидин. Предпочтительные примеры гетероарильных групп включают тиенил, бензотиенил, пиридил, хинолил, пиразинил, пиримидил, имидазолил, бензимидазолил, фуранил, бензофуранил, тиазолил, бензотиазолил, изоксазолил, оксадиазолил, изотиазолил, бензизотиазолил, триазолил, тетразолил, пирролил, индолил, пиразолил и бензопиразолил.
В рамках настоящего изобретения термин "гетероатом" относится к азоту, кислороду и сере.
В некоторых вариантах осуществления замещенные алкилы включают карбоксиалкилы, аминоалкилы, диалкиламино, гидроксиалкилы и меркаптоалкилы; замещенные алкенилы включают карбоксиалкенилы, аминоалкенилы, диалкениламино, гидроксиалкенилы и меркаптоалкенилы; замещенные алкинилы включают карбоксиалкинилы, аминоалкинилы, диалкиниламино, гидроксиалкинилы и меркаптоалкинилы; замещенные циклоалкилы включают такие группы, как 4-хлорциклогексил; арилы включают такие группы, как нафтил; замещенные арилы включают такие группы, как 3-бромфенил; аралкилы включают такие группы, как толил; гетероалкилы включают такие группы, как этилтиофен; замещенные гетероалкилы включают такие группы, как 3-метокси-тиофен; алкокси включает такие группы, как метокси; и фенокси включает такие группы, как 3-нитрофенокси. «Гало», как следует понимать, включает фтор, хлор, йод и бром.
В рамках настоящего изобретения "положительное целое число", как следует понимать, включает целое число, большее или равное 1 и, как будет понятно средним специалистам в данной области, находится в пределах области рациональности.
В рамках настоящего изобретения термин "связанный", как следует понимать, включает ковалентное (предпочтительно) или нековалентное присоединение одной группы к другой, то есть, в результате химической реакции.
Понятия "эффективные количества" и "достаточные количества" в рамках настоящего изобретения должны означать количество, которое обеспечивает достижение требуемого эффекта или терапевтического эффекта, причем эффект как таковой понятен средним специалистам в данной области.
В рамках настоящего изобретения термин "аденозин", как следует понимать, включает нуклеозиды аденозин и дезоксиаденозин. Аденозин также включает аденозин и дезоксиаденозин, присутствующие в форме АМФ, АДФ, ATP, дАМФ, дАДФ или дАТФ.
В рамках настоящего изобретения "аденозин-опосредованное заболевание" или "аденозиндеаминаза-реактивное заболевание", как следует понимать, широко включает любые заболевания, патологические состояния или нарушения, при которых успешно применяют введение АДА или ее активной фракции, и т.д., независимо от пути введения.
В рамках настоящего изобретения "лечение аденозин-опосредованного заболевания" или "лечение аденозиндеаминаза-реактивного заболевания", такого как ТКИД, как следует понимать, означает устранение, минимизацию или уменьшение проявления симптомов или состояний, по сравнению с наблюдаемыми в отсутствие лечения с применением АДА. Степень реконвалесценции можно подтвердить, например, по снижению уровня аденозина.
В широком смысле, лечение аденозин-опосредованного заболевания следует считать успешным, когда получен требуемый клинический ответ. В альтернативе, успешность лечения можно подтвердить, получив, по меньшей мере, 20%-е или предпочтительно 30%-е, более предпочтительно 40%-е или выше (то есть, 50%-е или 80%-е) снижение уровня аденозина, включая другие клинические показатели, рассматриваемые специалистом в данной области, по сравнению с наблюдаемым в отсутствие лечения с применением АДА.
Кроме того, применение терминов в форме единственного числа для удобства описания никоим образом не следует считать ограничивающим в какой-либо мере. Таким образом, например, ссылка на композицию, включающую фермент, относится к одной или более молекулам данного фермента. Нужно также понимать, что настоящее изобретение не ограничено конкретными конфигурациями, стадиями способов и материалами, описанными в настоящей заявке, поскольку такие конфигурации, стадии способов и материалы могут несколько изменяться.
Нужно также понимать, что терминология, используемая в настоящей заявке, используется лишь с целью описания конкретных вариантов осуществления и не должна являться ограничивающей, поскольку объем настоящего изобретения будет определяться прилагаемой формулой и ее эквивалентами.
B. Ферменты АДА, полученные генно-инженерными методами
Первоначальные попытки получить рекомбинантный фермент АДА, включая ферменты, экспрессируемые с человеческих или бычьих генов, выявили неустойчивость при хранении, не наблюдаемую ранее для природной АДА, получаемой из кишечного тракта крупного рогатого скота. Проведенные исследования продуктов деградации рчАДА и рбАДА подтвердили, что оба фермента АДА разлагаются по механизму, согласуемому с разложением цистеина. Например, добавление кислорода к рчАДА приводит к формированию более гидрофильных соединений, чем рчАДА, имеющих массу на 16 и 32 Да выше, чем у рчАДА. Кроме того, это приводит к формированию дитиолов (на что указывает реверсия формирования продуктов деградации в результате добавления дитиотреитола [ДТТ]); увеличение интенсивности разложения при повышении pH; осаждение, в особенности при повышении pH и при высокой концентрации образцов, что позволяет предположить возможность формирования межмолекулярных дисульфидных связей, приводящего к образованию нерастворимых агрегатов.
Авторы настоящего изобретения определили, что единственный, внешний цистеин ответственен за разложение, наблюдаемое для рчАДА. Бычья (неразлагаемая) АДА обладает структурой, схожей со структурой рчАДА: и бычья АДА, и рчАДА содержат одинаковое количество цистеинов в одних и тех же положениях первичной последовательности. При этом рбАДА также содержит продукты деградации/примеси (дитиолы), которые согласуются с реакционной способностью цистеина. Нативная бычья АДА отличается по структуре от рбАДА тем, что в ней один моль цистеина связан с каждым молем АДА, причем нативная бычья АДА стабильна при высоком pH, что позволяет предположить то, что цистеин, связанный с АДА, функционирует как блокирующая группа. Цистеин, связанный с нативной бычьей АДА, может быть удален путем обработки восстановителем, таким как монотиогликоль или ДТТ. Не желая связывать это с какой-либо теорией или гипотезой, можно предположить, что цистеиновая группа сопряжена с АДА через дисульфидную связь следующим образом:
АДА-S-S-цистеин,
где один цистеин в первичной последовательности АДА связан с молекулой цистеина. Цистеины, присутствующие в таких дисульфидных связях, устойчивы к процессам окислительной деструкции, упомянутым в первом разделе. Остатки цистеина расположены в положениях 74, 152, 153, 168 и 261 человеческой и бычьей зрелой АДА. Изучение трехмерной структуры бычьей АДА, полученной с помощью рентгеноструктурного анализа (Kinoshita et al., 2005, Biochemistry, 44:10562-10569) показало, что цистеины в положениях 74, 152, 153, 168 и 261 не могут участвовать в образовании внутримолекулярных дисульфидных связей. Структурные геометрические ограничения, как известно, вообще предотвращают образование дисульфидных связей вицинальными остатками цистеина, такими как те, которые находятся в положениях 152 и 153 АДА. Таким образом, все остатки цистеина потенциально находятся в восстановленном состоянии и, следовательно, являются потенциальными кандидатными сайтами для реакций окислительной деструкции. Однако вышеуказанный визуальный анализ трехмерной структуры бычьей АДА показал, что цистеин 74 совершенно точно подвергается воздействию растворителя в большей степени, чем другие четыре цистеина и, кроме того, что другие четыре цистеина, по-видимому, углублены внутрь структуры фермента в такой степени, что существенное взаимодействие с сольватированными реагентами, вероятно, предотвращается (если белок не денатурирован). Существование единственного реакционно-способного остатка цистеина могло бы объяснить монодериватизацию нативной бычьей аденозиндеаминазы, что, по-видимому, происходит в результате посттрансляционной модификации.
Факты, изложенные выше, указывают, что реакционно-способный цистеин в положении 74 может являться ответственным за разложение, наблюдаемое для рчАДА и рбАДА, и что кэпирование реакционно-способной -S-H группы цистеина защищает рчАДА или рбАДА от очевидных процессов окислительной деструкции, наблюдаемых для указанных рекомбинантных ферментов. С целью подтверждения этого проводили следующий эксперимент. Рекомбинантный чАДА в концентрации приблизительно 0,6 мг/мл обрабатывали 125 мМ иодоацетамида (IAA) в натрий-фосфатном буфере с pH 7,4 в течение 16 часов при 37°C. В течение нескольких минут после начала реакции анализ пробы с помощью ОФ-ВЭЖХ с УФ- и масс-спектрометрическим детектированием показал, что приблизительно 70,9% рчАДА подверглось монодериватизации IAA, а 17,2% подверглось дериватизации по двум сайтам. После инкубирования в течение 2 и 16 часов хроматографический профиль не был значительно изменен, что указывает на то, что производное являлось устойчивым к окислительной деструкции, типичной для рчАДА. Затем приготовили подобный образец рчАДА, но без IAA, который анализировали аналогичным образом. После инкубирования в течение 16 часов при 37°C и pH 7,4 белок рчАДА деградировал на 30% (степень разложения образца по сравнению с исходной деградацией). Результаты соответствуют единственному, преобладающему внешнему цистеину, который может быть защищен путем кэпирования иодоацетамидом. Данные эксперименты описаны более подробно в патенте США (настоящего заявителя) 11/738,012, озаглавленном "Стабилизированные белки", включенном в настоящее описание путем отсылки, как указано выше.
Хотя кэпирование эффективно предотвращает окислительную деструкцию реакционно-активного цистеина в АДА, применение подобного блокированного фермента требует дополнительной технологической стадии. Таким образом, было исследовано прямое устранение нестабильного остатка Cys из кодирующего гена путем замены другой аминокислотой. Подходящей для замены аминокислотой является такая аминокислота, которая не подвергается такому же типу окисления, не нарушает формирование третичной структуры свернутого белка АДА, а в обычном варианте осуществления изобретения подобрана так, чтобы не подвергаться случайному связыванию с активированным полиалкиленоксидом в процессе формирования конъюгата. Подходящей для замены окисляемого цистеина согласно изобретению является любая из известных в уровне техники природных аминокислот и/или неприродных аминокислот, и/или их производных, которые соответствуют указанному критерию. Примерный список таких аминокислот включает природные L-аминокислоты, такие как: аланин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, метионин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан и тирозин. Триптофан и метионин могут окисляться относительно легко и в некоторых необязательных вариантах осуществления являются менее предпочтительными.
Способы получения рекомбинантных белков с применением сайт-специфического включения неприродных аминокислот в клетки-хозяева описаны в литературе, например, Liu et al., 2007, Nat. Methods 4(3):239-44, Xie et al., 2006 Nat. Rev. Mol. Cell. Biol. 7(10):775-82, Ryu et al., 2006, Nat. Methods 3(4):263-65, Deiters et al, 2004, Bioorg. Med. Chem Lett. 14(23):5743-5, Bogosian et al., 1989, J. Biol. Chem. 264(1):531-9, Tang et al., 2002, Biochemistry 41(34):10635-45, Budisa et al., 1995. Eur. J. Biochem. 230(2): 788-96, а также Randhawa et al., 1994, Biochemistry, 33(14):4352-62. Таким образом, заменяющая аминокислота может также включать модифицированную или менее типичную аминокислоту, такую как: 2-аминоадипиновую кислоту, 3