Способ качественной оценки биокоррозионных поражений тонкостенных герметичных оболочек из алюминиево-магниевых сплавов при эксплуатации космических аппаратов и суспензия споровых материалов для его реализации
Иллюстрации
Показать всеГруппа изобретений относится к микробиологии. Предложены способ качественной оценки биокоррозионных поражений тонкостенных герметичных оболочек из алюминиево-магниевых сплавов при эксплуатации космических аппаратов и суспензия споровых материалов грибов для осуществления указанного способа. Изготавливают испытательные и контрольные образцы из алюминиево-магниевых сплавов. Подготовленные образцы высушивают, стерилизуют. Культуры грибов - штаммов микроорганизмов Paecilomyces variotii Bainier BKM F-4039D, Ulocladium botrytis Preuss BKM F-4032D, Penicillium chrysogenum Thom BKM F-4034D, Aspergillus sydowii (Bainier et Sartory) Thom et Church BKM F-4037D, Cladosporium sphaerospermum Penz. BKM F-4041D засевают для выращивания спор в пробирки со скошенной агаризованной средой Чапека-Докса. Термостатируют пробирки при температуре (29±2)°С в течение 14-28 суток до появления зрелого спороношения. Готовят суспензии споровых материалов отдельных культур указанных грибов, которые затем смешивают в равных соотношениях, причем концентрация спор каждого вида гриба в суспензии должна быть в пределах 1-2 млн/см3. Полученную суспензию наносят на простерилизованные испытательные образцы. Затем их высушивают и помещают по одному образцу в чашки Петри на поверхность агаризованной среды Чапека-Докса. Контрольные образцы, не обработанные споровым материалом, также располагают на поверхности агаризованной среды Чапека-Докса в чашках Петри. Чашки Петри с испытательными и контрольными образцами помещают в разные эксикаторы, на дно которых наливают воду для поддержания влажности более 90%. Эксикаторы закрывают и выдерживают в термостате при температуре (29±2)°С. Проводят экспозицию испытательных и контрольных образцов в течение 40, 120 и 180 суток. Затем образцы извлекают из чашек Петри, удаляют продукты коррозии и мицелий с поверхности образцов, промывая их в проточной воде. Выдерживают образцы в 70%-ном этиловом спирте в течение 30 минут, после этого промывают детергентом и высушивают. Затем с помощью сканирующего электронного микроскопа проводят качественную оценку биокоррозионных поражений. По изменению внешнего вида поверхности образцов оценивают начальные этапы биокоррозии и ее тип, распределение коррозионного поражения на поверхности образцов, а также определяют зависимость биокоррозионного процесса от времени. Изобретения позволяют осуществлять качественную оценку начальных этапов биокоррозионных поражений тонкостенных герметичных оболочек из алюминиево-магниевых сплавов толщиной не более 2 мм. 2 н.п. ф-лы, 9 табл.
Реферат
Изобретение относится к технической микробиологии и биокоррозионным испытаниям, а именно к способам определения подверженности алюминиево-магниевых сплавов, применяемых в авиа-космической технике, к воздействиям технофильных штаммов микроорганизмов, выделенных в реальных эксплуатационных условиях с элементов конструкций Российского сегмента (PC) Международной космической станции (МКС) и депонированных во Всероссийскую коллекцию микроорганизмов (ВКМ).
Космическая станция - зона повышенного риска с экстремальными условиями для работы оборудования. Постоянный контроль всех параметров внутренней среды, в том числе и микрофлоры станции, обеспечивает повышение надежности и безопасности ее работы.
Все материалы в процессе эксплуатации неизбежно подвергаются различным воздействиям окружающей среды, которые вызывают коррозионные процессы на их поверхности. Они могут быть вызваны как воздействием химических веществ (химическая коррозия), так и действием различных микроорганизмов (биологическая коррозия). Реальные коррозионные процессы, как правило, происходят под действием обоих факторов.
Действие микроорганизмов представляет собой один из факторов, способствующих возникновению и развитию процессов коррозии металлов (Албитская О.Н., Шапошникова Н.А. «Влияние плесеней на коррозию металлов» // Микробиология. 1960. Т. 29. С.725-730; Коваль Э.З., Касьян Д.М., Дахановский В.И. «Исследования грибной коррозии» // Биологические повреждения строительных и промышленных материалов. Киев: Наукова думка, 1978, с.59-60; Лугаускас А.Ю., Микульскене А.И., Шляужене Д.Ю. Каталог микромицетов-биодеструкторов полимерных материалов. Отв. ред. М.В.Горленко, М.: Наука, 1987, 340 с.).
В основе действия микроорганизмов на металлы лежит электрохимический механизм. Микроорганизмы могут вызывать или изменять коррозию тремя основными способами:
1. Непосредственно воздействуя на кинетику электродных реакций.
2. Образованием метаболитов, обладающих коррозионными свойствами (неорганические и органические кислоты и т.п.).
3. Изменениями на поверхности раздела металл-электролит, которые могут привести к коррозии (например, образование участков с повышенным образованием оксидов) (Costello J.A., 1969. The corrosion of metals by micro-organisms. Int. Biodent. Bull., 5, 101).
Плесневые грибы развиваются на поверхностях, контактирующих с металлами (ткань, лакокрасочное покрытие, топливо и т.д.), откуда споры гриба распространяются и при конденсации влаги начинают развиваться, образуя органические кислоты.
Коррозии способствует конденсация паров воды мицелием гриба, накопление им в процессе роста органических кислот. Кроме этого, под мицелием грибов создаются условия, благоприятные для развития других микроорганизмов.
Алюминиевые сплавы широко используются в аэрокосмической индустрии, судостроении. При длительном использовании устойчивость и надежность деталей и узлов агрегатов в значительной мере зависит от процессов коррозии, в том числе и от коррозии, вызванной микроорганизмами, - биокоррозии. В основе действия микроорганизмов на металлы лежит элекрохимический механизм. Микроорганизмы могут способствовать возникновению коррозионных повреждений и усиливать их, непосредственно воздействуя на кинетику электродных реакций.
Известен способ определения показателей биокоррозионного повреждения сталей, оксидных алюминиевых и магниевых сплавов (патент RU №1766073, 1995 г., МПК6: C12Q 1/02, C12Q 1/18), характеризующийся тем, что подготовленные образцы металлов высушивают в сушильном шкафу при температуре 80°С в течение 15 минут, взвешивают, заворачивают в крафт-бумагу, стерилизуют в сушильном шкафу в течение 2 часов при температуре 165°С, затем выдерживают образцы на поверхности газона тест-культуры, выращенной на питательной среде сусло-агар в чашке Петри. На поверхность питательной среды сусло-агар в чашке Петри помещают одну бактериологическую петлю спор гриба Aspergillus flavus Link BKMF-3190 Д и растирают равномерно шпателем по всей поверхности питательной среды, чашки Петри заворачивают в бумагу и термостатируют при температуре 30°С. После термостатирования, когда на поверхности среды образуется сплошной рост гриба, на его поверхности стерильным пинцетом располагают простерилизованные образцы разных металлов. Количество испытанных образцов каждого металла должно быть не менее 5 шт. Контролем служат те же образцы металлов, но размещенные на поверхности стерильной питательной среды в чашках Петри, не засеянной тест-культурой. Подготовленные к испытаниям чашки Петри с металлическими образцами помещают в эксикатор, на дно которого наливают стерильную дистиллированную воду, за счет чего в эксикаторе поддерживают влажность 96-98%. Эксикаторы располагают в термостатной комнате при температуре (30±2)°С. Продолжительность экспозиции опытных и контрольных образцов 9 месяцев. После окончания испытаний чашки Петри с металлическими образцами подвергают стерилизации в автоклаве ВК-75 при давлении 2 атм и температуре 120°С 2 ч. После стерилизации металлические образцы очищают от мицелия, питательной среды и продуктов коррозии с помощью скальпеля. Продукты коррозии алюминиевых сплавов удаляют в растворе состава: хрома (VI) окись 20 г/дм3; кислота ортофосфорная (пл. 1,59) 50 см3/дм3; температура 80-95°С.
При удалении продуктов коррозии образцы пинцетом в вертикальном положении опускают в раствор и выдерживают 1 мин. Затем образцы вынимают из раствора, промывают сначала в воде, затем в ацетоне, просушивают и взвешивают.
Потерю массы образцов определяют по формуле
K ∑ 1 5 Δ m ∑ 1 5 m o • 100 %
где Δm - потеря массы испытуемого образца;
Δm, mo, m, где mo - масса образца до испытаний, г;
m - масса образца после испытаний и удаления продуктов коррозии, г.
Недостатком способа-прототипа является невозможность оценить начальные этапы биокоррозионного повреждения из-за низкой чувствительности предложенного метода. Поэтому стандартно используемое для оценки степени коррозии взвешивание образцов, как в прототипе, не дает четких результатов на начальных этапах процесса биокоррозии, когда потери веса незначительны. Кроме того, при взвешивании нельзя судить о характере повреждений, вызываемых используемыми микроорганизмами.
Известен шгамм Penicillium chrysogenum BKMF-3068D, используемый в качестве тест-культуры для испытаний алюминиевых сплавов на грибостойкость (авторское свидетельство SU №1606530, 15.11.1990, МПК5: C12N 1/14, C12Q 1/02).
Известен штамм гриба Aspergillus flavus Link как тест-культура для определения грибостойскости сталей, оксидных алюминиевых и магниевых сплавов (патент RU №1766073, 1995 г., МПК6: C12Q 1/02, C12Q 1/18), взятый за прототип.
Недостатками этих штаммов является их низкая активность по отношению к алюминиево-магниевым сплавам, используемым в гермозамкнутых объемах, особенностью которых является присутствие в них вредных микропримесей (ВМП), которые являются специфической питательной средой, формирующей биологическую агрессивность (органические соединения с высокой биокоррозионной активностью) в отношении различных материалов и в том числе алюминиево-магниевых сплавов.
Использование грибов из коллекции ВКМ в соответствии с ГОСТом 9.048-89, как правило, не дает ожидаемых результатов, так как культуры грибов при хранении и многочисленных пересевах теряют активность. Использование метода частоты встречаемости видов для оценки биоповреждения материалов более показательно, чем традиционный метод оценки в баллах. Грибы, рекомендуемые ГОСТом 9.048-89 для испытания на грибостойкость, не соответствуют фактической пораженности материалов. Поэтому целесообразнее пользоваться тем набором грибов, которые имеют достаточно большую частоту встречаемости непосредственно на используемом материале (Журнал «Микология и фитопатология», том 31, выпуск 2, г.Санкт-Петербург, 1997 г., с.85).
Таким образом, известные коллекционные штаммы микроорганизмов не могут быть использованы для качественной оценки биокоррозионных поражений тонкостенных герметичных оболочек из алюминиево-магниевых сплавов.
Задачей изобретения является качественная оценка начальных этапов биокоррозионных поражений тонкостенных герметичных оболочек из алюминиево-магниевых сплавов толщиной не более 2 мм с различным видом обработки поверхности (механически обработанной, химически полированной, анодированной), смоделированных в зависимости от эксплуатационных условий (от места нахождения материала в эксплуатационном гермообъеме), и выделение консорциума штаммов микроорганизмов, естественно сформированного в зависимости от конкретного местоположения элементов конструкции в условиях гермозамкнутого объема.
Техническим результатом изобретения является:
- обнаружение инициации процесса биокоррозии, определение биокоррозионных эффектов (оценка внешнего вида пораженной поверхности - определение типа коррозии, распределения коррозионного поражения и характеристика его формы, отличия от химической коррозии; зависимость биокоррозионного процесса от времени);
- возможность увеличения надежности и ресурса эксплуатации конструкционных материалов в присутствии технофильных микроорганизмов в эксплуатационных условиях гермозамкнутого объема.
Заявленная суспензия споровых материалов, включающая смесь споровых материалов отдельных культур грибов Paecilomyces variotii Bainier ВКМ F-4039D, Ulocladium botrytis Preuss BKM F-4032D, Penicillium chrysogenum Thom BKM F-4034D, Aspergillus sydowii (Bainier et Sartory) Thom et Church BKM F-4037D, Cladosporium sphaerospermum Penz. BKM F-4041D, является перспективным тестом при проверке авиационно-конструкторских материалов на биокоррозионную стойкость.
Технический результат достигается тем, что способ качественной оценки биокоррозионных поражений тонкостенных герметичных оболочек из алюминиево-магниевых сплавов при эксплуатации космических аппаратов характеризуется тем, что изготавливают испытательные и контрольные образцы из алюминиево-магниевых сплавов, подготовленные образцы высушивают, стерилизуют, для выращивания спор культуры грибов засевают в пробирки со скошенной агаризованной средой Чапека-Докса, термостатируют пробирки при температуре (29±2)°С в течение 14-28 суток до появления зрелого спороношения, готовят суспензию спорового материала, которую наносят на простерилизованные испытательные образцы, затем их высушивают и помещают по одному образцу в чашки Петри на поверхность агаризованной среды Чапека-Докса, контрольные образцы, не обработанные споровым материалом, также располагают на поверхности агаризованной среды Чапека-Докса в чашках Петри, чашки Петри с испытательными и контрольными образцами помещают в разные эксикаторы, на дно которых наливают воду для поддержания влажности более 90%, эксикаторы закрывают и выдерживают в термостате при температуре (29±2)°С, проводят экспозицию испытательных и контрольных образцов, затем образцы извлекают из чашек Петри, удаляют продукты коррозии и мицелий с поверхности образцов, промывая их в проточной воде, определяют показатели биокоррозионных поражений, на среде Чапека-Докса готовят суспензии споровых материалов отдельных культур грибов - штаммов микроорганизмов Paecilomyces variotii Bainier BKM F-4039D, Ulocladium botrytis Preuss BKM F-4032D, Penicillium chrysogenum Thom BKM F-4034D, Aspergillus sydowii (Bainier et Sartory) Thom et Church BKM F-4037D, Cladosporium sphaerospermum Penz. BKM F-4041D, которые затем смешивают в равных соотношениях, причем концентрация спор каждого вида гриба в суспензии должна быть в пределах 1-2 млн/см3, полученную суспензию с помощью распылителя наносят на испытательные образцы алюминиево-магниевых сплавов с различным видом обработки поверхности - механически обработанной, химически полированной, анодированной, после промывания образцов в проточной воде их выдерживают в 70%-ном этиловом спирте в течение 30 минут, после этого промывают детергентом и высушивают, затем с помощью сканирующего электронного микроскопа проводят качественную оценку биокоррозионных поражений: по изменению внешнего вида поверхности образцов оценивают начальные этапы биокоррозии и ее тип, распределение коррозионного поражения на поверхности образцов, а также определяют зависимость биокоррозионного процесса от времени, при этом экспозицию испытательных и контрольных образцов проводят в течение 40, 120 и 180 суток.
Технический результат достигается с помощью суспензии споровых материалов, включающей смесь споровых материалов отдельных культур грибов Paecilomyces variotii Bainier BKM F-4039D, Ulocladium botrytis Preuss BKM F-4032D, Penicillium chrysogenum Thom BKM F-4034D, Aspergillus sydowii (Bainier et Sartory) Thom et Church BKM F-4037D, Cladosporium sphaerospermum Penz. BKM F-4041D в равных соотношениях, для оценки биокоррозионных поражений тонкостенных герметичных оболочек из алюминиево-магниевых сплавов при эксплуатации космических аппаратов.
Штамм микроорганизма Paecilomyces variotii Bainier BKM F-4039D.
Свойство микроорганизма. Способность вызывать повреждения конструкционных материалов, используемых в авиа-космической технике (алюминиево-магниевые сплавы, полимерные материалы), происхождение - из гермозамкнутого объема космического аппарата.
Родословная штамма (место выделения, источник выделения и другая информация о движении штамма). Штамм выделен из пыли, собранной воздушным фильтром на Российском Сегменте Международной Космической Станции (PC MKC) в период работы станции МКС-9, 24 октября 2004 г.
Способ получения штамма. Посев проводили на твердую питательную среду методом отпечатка фрагмента фильтра.
Метод идентификации, определитель, по которому проводилась идентификация. Идентификация по морфологическим признакам. Определитель: Samson R.A.: Paecilomyces and some allied Hyphomycetes. // Studies in Mycology. 1974. No. 6. 119 pp.
Культурально-морфологические и микроскопические особенности штамма. Колонии на среде сусло-агар (malt-agar) растут очень быстро и достигают диаметра 8 см за 7 дней при температуре 25°С. Бархатисто паутинистые плоские, иногда пушистые и тогда довольно высокие войлочные, сильно порошащие. Состоят из плотного слоя конидиеносных структур. Мицелий бесцветный. Спороношение от темно-охряного до оливково-бежево-коричневатого цвета. Экссудат отсутствует или незаметен. Реверс колонии желтоватый до желто-коричневого и практически черного, при обильном образовании хламидоспор. Конидиеносцы гладкие, слегка шероховатые или с инкрустацией, несут довольно плотную кисточку, состоящую из неупорядоченных веточек, несущих метула с 2-7 фиалидами. В основном 35-90×3.5-7.0 µm, но иногда до 150 µm в длину. Фиалиды в пучках или одиночные, вариабельные по форме и размеру, 12-20(35)×2.5-5.0 µm, имеют цилиндрическое брюшко и длинную тонкую шейку. Конидии полушаровидные, булавовидные, эллиптические, гладкостенные, 3.2-15.0×2.0-5.0 µm. Хламидоспоры обычно присутствуют одиночные или в коротких цепочках, округлые, толстостенные, темноокрашенные, гладкие или слегка шероховатые 4.0-8.0 (10) µm в диаметре.
Описание условий, необходимых для культивирования штамма (состав среды, температура, срок выращивания и т.д.). Условия культивирования штамма особенностей не имеют и стандартные для большинства мицелиальных грибов.
Среды:
- среда Чапека с 3%-ным содержанием сахарозы (сахароза - 30 г; NaNO3 - 2 г; KH2PO4 - 1 г; KCl - 0,5 г; MgSO4 7Н2О - 0,5 г; FeSO4 7H2O - 0,001 г; агар - 20 г; водопроводная вода - 1 литр);
- сусло-агар (16 - баллинговое неохмеленное пивное сусло - 150 мл; агар - 20 г; водопроводная вода - 800 мл); температура 22-25°С; срок выращивания 7-10 дней.
Оптимум рН среды культивирования: 6-6,5.
Описание режима хранения штамма (среды, условия, предельный срок и т.д). Для хранения подходят все методы. Штамм сохранялся методом периодических пересевов на среде сусло-агар.
Данный вид мицелиального гриба не числится в качестве патогенного в "Положении о порядке учета, хранения, обращения, отпуска и пересылки культур бактерий, вирусов, риккетсий, грибов, простейших, микоплазм, бактериальных токсинов, ядов биологического происхождения".
Штамм микроорганизма Ulocladium botrytis Preuss BKM F-4032D.
Свойство микроорганизма. Способность вызывать повреждения конструкционных материалов, используемых в авиа-космической технике (алюминиево-магниевые сплавы, полимерные материалы), и происхождение - из гермозамкнутого объема космического аппарата.
Родословная штамма (место выделения, источник выделения и другая информация о движении штамма). Штамм выделен из пыли, собранной воздушным фильтром на Российском Сегменте Международной Космической Станции (PC MKC) в период работы станции МКС-8, 30 апреля 2004 г.
Способ получения штамма. Посев проводили на твердую питательную среду методом отпечатка фрагмента фильтра.
Метод идентификации, определитель, по которому проводилась идентификация. Идентификация по морфологическим признакам. Определитель: Ellis M.В. More Dematiaceous Hyphomycetes. Commonwealth Mycologigical institute Kew., Kew: Surrey, 1976. Simmons E.G. Typification of Altemaria, Stemphylium and Ulocladium // Mycologia. 1967. Vol.59. P.67-92.
Культурально-морфологические и микроскопические особенности штамма. Колонии на картофельно-декстрозном и сусло-агаре быстрорастущие, достигают 5-6 см в диаметре за 7 дней. Бархатистые, слегка порошащие, мучнистые, могут быть слегка пушистыми. Оливково-коричневого до черного цвета. На среде Чапека колонии более ограниченные. Конидиеносцы прямостоячие или распростертые, короткие, сильно ветвящиеся, коленчато-изогнутые, с конидиями, образующимися в узлах. Окраска от практически неокрашенных до коричневых, конидиальный рубец, остающийся вокруг поры бесцветный. Размеры конидиеносцев до 50×4.5 µm. Конидии муральные (многоклеточные с продольными и поперечными септами) образуются одиночно, очень редко в коротких цепочках, яйцевидной формы без носика, вначале светло-коричневые, оливковые, быстро темнеющие до практически черных, поверхность грубо бородавчатая до бугорчатой. Размеры варьируют в пределах 19-25×7-12 µm, с (1-)2-3 поперечными и 0-2 косыми или продольными септами. Вторичные конидиеносцы образуются крайне редко.
Описание условий, необходимых для культивирования штамма (состав среды, температура, срок выращивания и т.д.). Условия культивирования штамма особенностей не имеют и стандартные для большинства мицелиальных грибов.
Среды:
- среда Чапека с 3% содержанием сахарозы (сахароза - 30 г; NaNO3 - 2 г; KH2PO4 - 1 г; KCl - 0,5 г; MgSO4 7H2O - 0,5 г; FeSO4 7Н2О - 0,001 г; агар - 20 г; водопроводная вода - 1 литр);
- сусло-агар (16-баллинговое не охмеленное пивное сусло - 150 мл; агар - 20 г; водопроводная вода - 800 мл); температура 22-25°С; срок выращивания 7-10 дней.
Оптимум рН среды культивирования: 6-6,5.
Описание режима хранения штамма (среды, условия, предельный срок и т.д.). Для хранения подходят все методы. Штамм сохранялся методом периодических пересевов на среде сусло-агар.
Данный вид мицелиального гриба не числится в качестве патогенного в "Положении о порядке учета, хранения, обращения, отпуска и пересылки культур бактерий, вирусов, риккетсий, грибов, простейших, микоплазм, бактериальных токсинов, ядов биологического происхождения".
Штамм микроорганизма Penicillium chrysogenum Thom BKM F-4034D.
Свойство микроорганизма. Способность вызывать повреждения конструкционных материалов, используемых в авиа-космической технике (алюминиево-магниевые сплавы, полимерные материалы), и происхождение - из гермозамкнутого объема космического аппарата.
Родословная штамма (место выделения, источник выделения и другая информация о движении штамма). Штамм выделен из пыли, собранной пылесборником на Российском Сегменте Международной Космической Станции (PC MKC) в период работы станции МКС-9, 24 октября 2004 г.
Способ получения штамма (мутанта). Посев на твердую питательную среду из суспензии пыли.
Метод идентификации, определитель, по которому проводилась идентификация. Идентификация по морфологическим признакам. Определитель: Raper K.B., Thom С.A Manual of the Penicillia. New York: Heftier Publishing Co. 1968. 875 p. Ramirez C. Manual and Atlas of the Penicillia. Amsterdam; New York; Oxford: Elsiveier Biomedical Press, 1982. 874 p. Pitt G.I. A laboratory guide to common Penicillium species (sec. ed.). North Ryde, U.S.W., Australia: CSIRO, Division of Food Processing, 1991. 188 p.
Культурально-морфологические и микроскопические особенности штамма. Колонии быстрорастущие на среде Чапека с 3% содержанием сахарозы, на 7 сутки роста, при температуре 25°С, достигают 35-50 мм в диаметре. Поверхность бархатистая, колония радиально складчатая, тускло-зеленая, массы конидий формируют характерные корочки, экссудат обычно образуется, мицелий бесцветный. Обратная сторона неокрашенная, кремовая или желто-коричневая. На сусло-агаре колонии более быстрорастущие, бархатистые. Конидиеносцы агрегированы в плотные пучки на субстратном мицелии, грубо шероховатые, 200-400 µm в длину. Кисточки обычно трехъярусные с прижатой веточкой, компактные, метулы по 3-5 в мутовке 10-15×3-3,5 µm, несут по 5-8 бутылевидных фиалид 9-12×2.5-3 µm. Конидии практически шаровидные 3.5-4.0 µm.
Описание условий, необходимых для культивирования штамма (состав среды, температура, срок выращивания и т.д.). Условия культивирования штамма особенностей не имеют и стандартные для большинства мицелиальных грибов.
Среды:
- среда Чапека с 3% содержанием сахарозы (сахароза - 30 г; NaNO3 - 2 г; KH2PO4 - 1 г; KCl - 0,5 г; MgSO4 7Н2О - 0,5 г; FeSO4 7H2O - 0,001 г; агар - 20 г; водопроводная вода - 1 литр);
- сусло-агар (16-баллинговое не охмеленное пивное сусло - 150 мл; агар - 20 г; водопроводная вода - 800 мл); температура 22-25°С; срок выращивания 7-10 дней.
Оптимум рН среды культивирования: 6-6,5.
Описание режима хранения штамма (среды, условия, предельный срок и т.д.). Для хранения подходят все методы. Штамм сохранялся методом периодических пересевов на среде сусло-агар.
Данный вид мицелиального гриба не числится в качестве патогенного в "Положении о порядке учета, хранения, обращения, отпуска и пересылки культур бактерий, вирусов, риккетсий, грибов, простейших, микоплазм, бактериальных токсинов, ядов биологического происхождения".
Штамм микроорганизма Aspergillus sydowii (Bainier et Sartory) Thom et Church BKMF-4037D.
Свойство микроорганизма. Способность вызывать повреждения конструкционных материалов, используемых в авиа-космической технике (алюминиево-магниевые сплавы, полимерные материалы), и происхождение - из гермозамкнутого объема космического аппарата.
Родословная штамма (место выделения, источник выделения и другая информация о движении штамма). Штамм выделен из пыли, собранной пылесборником на Российском Сегменте Международной Космической Станции (PC MKC) в период работы станции МКС-9, 24 октября 2004 г.
Способ получения штамма (мутанта). Посев на твердую питательную среду из суспензии пыли.
Метод идентификации, определитель, по которому проводилась идентификация. Идентификация по морфологическим признакам. Определитель: Raper K.B., Fennel D.I. The genus Aspergillus. Baltimore: Williams & Wilkins, 1965. 686 p. Klich M.A. Identification of common Aspergillus species. CBS 2002. 116 р.
Культурально-морфологические и микроскопические особенности штамма. Колонии на среде Чапека при 25°С растут хорошо, достигая 3-4 см в диаметре за 10 дней, складчатые, в центре приподнятые. Структура колонии плотная бархатистая, мицелий белый, цвет спороношения сине-зеленый, экссудат обычно обильный, соломенно-желтый до темно-красно-коричневого. Обратная сторона колонии от бесцветной до коралово-розовой, темно-бордовой или красновато-черной при старении. На среде сусло-агар колонии более быстрорастущие плоские бархатистые. Конидиальные головки радиальные до 100-150 µm в диаметре. Конидиеносцы бесцветные, толстостенные, гладкие, до 500 µm в длину. От воздушного мицелия отходят короткие конидиеносцы с частично редуцированными конидиогенными структурами. Пузырь округлый до 20 µm в диаметре. Головки двурядные, метулы 6-7×2-3 µm, фиалиды 7-10 х 2-2.5 µm. Конидии сферические, заметно шиповатые, 2.5-3(3.5) µm. Иногда образуются стекловидные клетки округлой формы.
Описание условий, необходимых для культивирования штамма (состав среды, температура, срок выращивания и т.д.). Условия культивирования штамма особенностей не имеют и стандартные для большинства мицелиальных грибов.
Среды:
- среда Чапека с 3% содержанием сахарозы (сахароза - 30 г; NaNO3 - 2 г; KH2PO4 - 1 г; KCl - 0,5 г; MgSO4 7H2O - 0,5 г; FeSO4 7H2O - 0,001 г; агар - 20 г; водопроводная вода - 1 литр);
- сусло-агар (16-баллинговое не охмеленное пивное сусло - 150 мл; агар - 20 г; водопроводная вода - 800 мл); температура 22-25°С; срок выращивания 7-10 дней.
Оптимум рН среды культивирования: 6-6,5.
Описание режима хранения штамма (среды, условия, предельный срок и т.д). Для хранения подходят все методы. Штамм сохранялся методом периодических пересевов на среде сусло-агар.
Данный вид мицелиального гриба не числится в качестве патогенного в "Положении о порядке учета, хранения, обращения, отпуска и пересылки культур бактерий, вирусов, риккетсий, грибов, простейших, микоплазм, бактериальных токсинов, ядов биологического происхождения".
Штамм микроорганизма Cladosporium sphaerospermum Penz. BKM F-4041D.
Свойство микроорганизма. Способность вызывать повреждения конструкционных материалов, используемых в авиа-космической технике (алюминиево-магниевые сплавы, полимерные материалы), и происхождение - из гермозамкнутого объема космического аппарата.
Родословная штамма (место выделения, источник выделения и другая информация о движении штамма). Штамм выделен из пыли, собранной пылесборником на Российском Сегменте Международной Космической Станции (PC MKC) в период работы станции МКС-11, 15 октября 2005 г.
Способ получения штамма (мутанта). Посев на твердую питательную среду из суспензии пыли.
Метод идентификации, определитель, по которому проводилась идентификация. Определитель: Ellis М.В. Dematiaceous Hyphomycetes. Commonwealth Mycologigical institute Kew., Kew: Surrey, 1971. 609 p. Zalar P, Hoog GS de, Schroers H-J, Crous PW, Groenewald JZ, Gunde-Cimerman N (2007). Phylogeny and ecology of the ubiquitous saprobe Cladosporium sphaerospermum, with descriptions of seven new species from hypersaline environments. Studies in Mycology 58:157-183.
Культурально-морфологические и микроскопические особенности штамма. Колонии на картофельно-декстрозном агаре при 25°С на 7 сутки достигают 21-44 мм в диаметре. Бархатистые, ровные или складчатые, темно-оливково-коричнево-черные. Экссудат не образуется, реверс коричнево-черный. Мицелий плотный темноокрашенный, воздушный мицелий обычно отсутствует. Конидиеносцы слабо ветвящиеся прямостоячие, оливково-коричневые гладкостенные или нежно шероховатые, с несколько расширенной верхушкой с темными рубчиками от конидий, длина сильно варьирует (10-)45-130(-300)×(2.5-)3-4(-6) µm. Конидиальные цепочки древовидно разветвленные. Рамоконидии с 2-3 септами, конидии следующих порядков с 1-0 септами, терминальные конидии яйцевидные или почти сферические, гладкие или нежно бородавчатые, приостренные к обоим концам с заметными рубчиками. Размер терминальных конидий (2.5-)3-4(-7)×(2-)3-3.5(-4.5) µm. Рамоконидии второго порядка цилиндрические (4-)9-17.5(-48.5)×(2-)3-3.5(-8.5) µm.
Описание условий, необходимых для культивирования штамма (состав среды, температура, срок выращивания и т.д.). Условия культивирования штамма особенностей не имеют и стандартные для большинства мицелиальных грибов.
Среды:
- среда Чапека с 3% содержанием сахарозы (сахароза - 30 г; NaNO3 - 2 г; КH2PO4 - 1 г; KCl - 0,5 г; MgSO4 7H2O - 0,5 г; FeSO4 7H2O - 0,001 г; агар - 20 г; водопроводная вода - 1 литр);
- сусло-агар (16-баллинговое не охмеленное пивное сусло - 150 мл; агар - 20 г; водопроводная вода - 800 мл); температура 22-25°С; срок выращивания 7-10 дней.
Оптимум рН среды культивирования: 6-6,5.
Описание режима хранения штамма (среды, условия, предельный срок и т.д.). Для хранения подходят все методы. Штамм сохранялся методом периодических пересевов на среде сусло-агар.
Данный вид мицелиального гриба не числится в качестве патогенного в "Положении о порядке учета, хранения, обращения, отпуска и пересылки культур бактерий, вирусов, риккетсий, грибов, простейших, микоплазм, бактериальных токсинов, ядов биологического происхождения".
Вышеприведенные штаммы микроорганизмов: Paecilomyces variotii Bainier BKM F-4039D, Ulocladium botrytis Preuss BKM F-4032D, Penicillium chrysogenum Thom BKM F-4032D, Aspergillus sydowii (Bainier et Sartory) Thom et Church BKM F-4037D, Cladosporium sphaerospermum Penz. BKM F-4041D депонированы Всероссийской коллекцией микроорганизмов института биохимии и физиологии микроорганизмов имени Г.К.Скрябина (142290 г. Пущино Московской области, проспект Науки, 5).
Сущность изобретения заключается в следующем.
За основу метода проведения испытаний и нанесения суспензии спор грибов на поверхность образцов алюминиево-магниевых сплавов взяты методы, описанные в ГОСТах 9.048-89 и 9.049-91. Испытания по биокоррозионным поражениям проводят в ускоренном режиме, который характеризуется повышенными температурами (29±2)°С и влажностью более 90%, в течение 40, 120, 180 суток, при воздействии этих факторов. Испытания проводят во влажной камере (эксикаторе).
Для испытаний используют две выборки образцов: испытательную и контрольную. Испытательная выборка предназначена для определения интенсивности развития грибов и их действия на параметры изделий, контрольная выборка - для определения действия на параметры изделий повышенной влажности и повышенной температуры воздуха без действия грибов, с целью сопоставления с результатами испытаний с испытательной выборки. Испытательные и контрольные образцы изготавливают из цилиндрических заготовок конструкционного материала - алюминиево-магниевого сплава толщиной 5 мм и диаметром 16 мм (ГОСТ/ТУ - 1-90395-91, плавка партии №89606) с различным видом обработки поверхности: механически обработанной, химически полированной, анодированной.
Подготовленные образцы высушивают и стерилизуют при температуре 165°С в течение 2 часов.
Для выращивания спор культуры грибов - штаммов микроорганизмов Paecilomyces variotii Bainier BKM F-4039D, Ulocladium botrytis Preuss BKM F-4032D, Penicillium chrysogenum Thom BKM F-4034D, Aspergillus sydowii (Bainier et Sartory) Thom et Church BKM F-4037D, Cladosporium sphaerospermum Penz. BKM F-4041D - засевают в пробирки со скошенной агаризованной средой Чапека-Докса, затем термостатируют пробирки при температуре (29±2)°С в течение 14-28 суток до появления зрелого спороношения. Культуры грибов поддерживаются на среде сусло-агар.
Для приготовления суспензии спор используют полученные 14-28-суточные культуры грибов. Суспензию спор готовят отдельно для каждого вида гриба с использованием среды Чапека-Докса. Для этого в пробирку или колбу, содержащую 25 см3 среды Чапека-Докса, переносят споры с поверхности выросшей культуры с помощью петли. В качестве жидкой дисперсионной среды используют воду. Суспензию каждого штамма гриба готовят отдельно: Paecilomyces variotii Bainier BKM F-4039D, Ulocladium botrytis Preuss BKM F-4032D, Penicillium chrysogenum Thom BKM F-4034D, Aspergillus sydowii (Bainier et Sartory) Thom et Church BKM F-4037D, Cladosporium sphaerospermum Penz. BKM F-4041D. Суспензию тщательно встряхивают и отфильтровывают через 4 слоя стерильной марли. Концентрацию спор каждого вида гриба подсчитывают отдельно в камере Горяева или на фотоэлектрическом колориметре. Для определения концентрации спор с помощью фотоэлектрического колориметра используют светофильтр, создающий длину волны λ=400 нм, и кювету (50±0,5) мм. Оптическая плотность, соответствующая концентрации 1-2×106/см3 для Paecilomyces variotii, 0,28-0,55. Плотность суспензий других штаммов оценивают с помощью камеры Горяева, ввиду особенностей спороношения этих видов.
Суспензию спор каждого вида гриба смешивают в равных объемах и используют для заражения образцов металла. Суспензию наносят на стерильные испытательные образцы равномерно с помощью распылителя (например, пульверизатора). Обработанные таким образом образцы выдерживают в ламинарном боксе при температуре 25°С до высыхания. Суспензия наносится с двух сторон, которые последовательно высушиваются в ламинарном боксе. Контрольные образцы обрабатывают стерильными средами и так же, как и испытательные, помещают на поверхность стерильной агаризованной среды Чапека-Докса в чашки Петри, которые затем ставят в эксикаторы.
Затем образцы зараженного металла (испытательные образцы) помещают в центр чашки Петри (по одному образцу на чашку), предварительно залитой агаризованной средой Чапека-Докса. Чашки Петри с испытательными и контрольными образцами помещают в разные эксикаторы, на дно которых налита вода для создания 90%-ной влажности, и выдерживают при температуре (29±2)°С для наблюдения за начальными этапами биокоррозионного повреждения. Каждые 7 суток эксикаторы приоткрывают на 3 минуты для доступа воздуха. Сроки инкубации 40, 120 и 180 суток.
После окончания сроков инкубации образцы извлекают из чашек Петри, а образовавшийся мицелий и продукты коррозии удаляют с поверхности образцов (в соответствии со стандартом ИСО 8407) путем легкой механической очистки при помощи мягкой щетки с последующим интенсивным промыванием в проточной воде. Затем образцы выдерживают в 70%-ном этиловом спирте в течение 30 минут, после чего промывают детергентом (например, «Fairy Plus», Procter & Gamble) и снова проточной водопроводной водой с последующей промывкой в дистиллированной воде. После этого образцы высушивают в боксе. Контрольные образцы подвергают точно такой же обработке. Эксперименты проводят в трехкратной повторности.
Испытательные и контрольные образцы хранят в стерильных чашках Петри до исследования в сканирующем электронном микроскопе.
В результате проведенных экспериментов наблюдалось полное обрастание образцов мицелием в присутствии минеральной среды с сахарозой, являющейся источником углерода для роста грибов и способствующей образованию кислых продуктов их жизнедеятельности. Таким образом, создается возможность исследования направления и характера повреждения алюминиево-магниевых сплавов при воздействии такого фактора, как обрастание, которое может возникнуть в условиях нарушений температурно-влажностного режима (повышения температуры и влажности) в системе жизнеобеспечения в гермозамкнутых объемах.
Высушенные образцы исследуют с помощью сканирующего электронного микроскопа (СЭМ), используемого для наблюдения микрорельефа различных поверхностей.
Микроскопическое исследование образцов было проведено на сканирующем электронном микроскопе САМ SCAN фирмы CAMBRIG (ускоряющее напряжение 20 киловольт, режим регистрации - secondary electron image). Образцы сплава, на которых не могло остаться остатков органических соединений, помещали в микроскоп без предварительной обработки, а на образцы с остатками микроорганизмов предварительно напыляли сплав золота и палладия методом ионного распыления металла в атмосфере аргона (толщина слоя 25 нанометров).
Сущность изобретения поясняется таблицами.
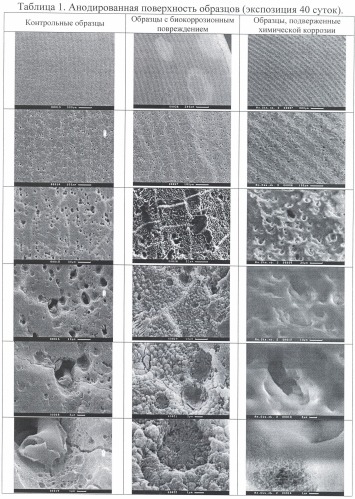
В таблицах 1, 5, 9 «Анодированная поверхность образцов» представлены сделанные с помощью сканирующего электронного микроскопа фотографии с различной степенью увеличения фрагментов анодированных поверхностей испытательных образцов: с биокоррозионным повреждением, с химической коррозией и контрольных образцов с экспозицией 40 суток (таблица 1), 120 суток (таблица 5) и 180 суток (таблица 9).
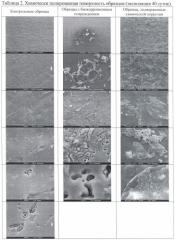
В таблицах 2, 6, 8 «Химически полированная поверхность образцов» представлены фотографии с различной степенью увеличения фрагментов химически полированных поверхностей испытательных образцов: с биокоррозионным повреждением, с химической коррозией и контрольных образцов с экспозицией 40 суток (таблица 2), 120 суток (таблица 6) и 180 суток (таблица 8).
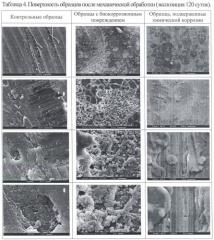
В таблицах 3, 4, 7 «Поверхность образцов после механической обработки (экспозиция 40 суток)» представлены фотографии с различной степенью увеличения фрагментов поверхностей испытательных образцов после механической обработки: с биокоррозионным повреждением, с химической коррозией и контрольных образцов с экспозицией 40 суток (таблица 3), 120 суток (таблица 4) и 180 суток (таблица 7).
В результате проведенных испытаний показано, что на поверхности алюминиево-магниевого сплава в результате биологической коррозии происходят заметные изменения поверхности, нарастающие с увеличением срока воздействия консорциума микроорганизмов.
Оценку биокоррозии образцов: определение типа биокоррозии, а также распределение коррозионного поражения на поверхности образцов, проводят согласно ГОСТу 9.908-85.
Так, на анодированной поверхности испытательного образца видны пятна овальной формы, трещинки, крупные и мелкие углубления (таблица 1); заметны глубокие