Способ определения оксидантной/антиоксидантной активности веществ и устройство для его осуществления
Иллюстрации
Показать всеИзобретение относится к способу определения оксидантной/антиоксидантной активности веществ. Способ включает приготовление исходного раствора с медиаторной системой, содержащей одновременно окисленную и восстановленную формы реагента и оценку оксидантной/антиоксидантной активности по электрохимическим параметрам экстракта анализируемого вещества, введенного в исходный раствор, и характеризуется тем, что исходный раствор разделяют на два объема, сообщающихся между собой через полупроницаемую мембрану, а экстракт анализируемого вещества вводят в один из объемов исходного раствора, при этом в качестве электрохимического параметра оценки оксидантной/антиоксидантной активности служит установившееся значение электродвижущей силы в измерительной системе. Также изобретение относится к устройству для осуществления способа. Использование настоящего способа позволяет повысить точность и достоверность получаемой информации. 2 н. и 4 з.п., 3 пр., 4 ил.
Реферат
Изобретение относится к области электрохимических методов анализа, в частности к анализу оксидантной/антиоксидантной активности веществ.
Существует способ определения оксидантной активности, в котором проводят анализ биологических объектов по 54 параметрам, являющимся индикаторами оксидантного стресса, и сравнивают полученные значения с нормальным уровнем, используя специальные диаграммы (патент США 5950634).
Недостатком известного способа является необходимость определения большого количества параметров в исследуемых объектах, что определяет его высокую сложность и неоднозначность результатов.
Известен способ определения антиоксидантной активности, включающий оценку антиоксидантной активности по электрохимическим параметрам раствора ("Free Radical Biology & Medicine", Vol.28, №6, pp.860-870).
К недостаткам данного способа следует отнести то, что не все антиоксиданты обладают электрохимической активностью и соответственно не дают волну окисления при использовании циклической вольтамперометрии. В то же время они могут быть химически активны по отношению к основным оксидантам. Также не может быть получена информация об активности (концентрации) оксидантов.
Известен способ определения суммарной концентрации антиоксидантов, в котором в качестве окислителя, взаимодействующего с антиоксидантами, используются ионы железа Fe3+ в составе комплексного соединения. Измерения «железовосстанавливающей/антиоксидантной способности/Ferric reducing/antioxidant power assay (FRAP)» проводят методом спектрофотометрии, используя реакцию восстановления Fe(III)-трипиридилтриазина до Fe(II)-трипиридилтриазина, который окрашен в интенсивно синий цвет (максимум поглощения при 593 нм) (Патент США 6177260 В1).
Недостатком этого способа является то, что в круг определяемых соединений не входят важнейшие сульфгидрильные SH-содержащие антиоксиданты, такие как глутатион и цистеин, поэтому этот метод не позволяет судить об общем содержании антиоксидантов в объекте исследования.
Наиболее близким техническим решением по способу, выбранному в качестве прототипа, является способ определения оксидантной/антиоксидантной активности растворов, заключающийся в измерении сдвига потенциала платинового электрода относительно хлорид-серебряного электрода, возникающего при введении в раствор медиаторной системы исследуемого образца (Патент РФ 2235998).
Данный способ имеет следующие недостатки. Способ применим для анализа только водорастворимых объектов и для определения только водорастворимых антиоксидантов. Использование органических растворителей лимитируется тем, что они неконтролируемо смещают потенциал измерительного электрода, что делает невозможной оценку оксидантной/антиоксидантной активности исследуемого объекта. Кроме того, на границе раздела (электрод-раствор) в растворе, содержащем органический растворитель, в который погружен хлорид-серебряный электрод сравнения, возникает диффузионный потенциал, чей вклад в измеряемую величину практически невозможно учесть. Процесс измерения является двухступенчатым. Измеряется исходный потенциал электрода, погруженного в медиаторную систему, затем потенциал электрода, погруженного в медиаторную систему, после введения в раствор исследуемого образца.
Задачей, решаемой настоящим изобретением, служит расширение спектра анализируемых веществ (возможность исследования веществ, нерастворимых в водной среде), повышение достоверности, точности и воспроизводимости получаемых результатов, упрощение процедуры анализа и сокращение времени его проведения (сокращение числа стадий анализа).
Технический результат, обеспечиваемый настоящим изобретением, заключается в возможности достоверно измерять сдвиг потенциала, определяемый наличием в системе именно оксидантов или антиоксидантантов, исключить влияние растворителя на измеряемый потенциал, исключить вклад диффузионного потенциала в измеряемую величину, определять интегральные значения антиоксидантной и оксидантной активности в одном измерении, что повышает точность и достоверность получаемой информации.
Технический результат и решение поставленной задачи достигаются тем, что емкость, содержащую исходный раствор, разделяют на две части, сообщающиеся между собой через полупроницаемую мембрану, а экстракт анализируемого вещества вводят в одну из частей емкости, при этом в качестве электрохимического параметра оценки оксидантной/антиоксидантной активности служит установившееся значение электродвижущей силы в измерительной системе (разность потенциалов электродов, помещенных в разные части емкости). В исходный раствор дополнительно вводят электролит. Оксидантную/антиоксидантную активность рассчитывают, используя установившееся значение ЭДС в измерительной системе
A O A = C O x − α C Re d 1 + α , причем α = ( C O x / C Re d ) ⋅ 10 E ⋅ n ⋅ F / 2,3 ⋅ R ⋅ T
O A = α C Re d − C O x 1 + α , причем α = ( C O x / C Re d ) ⋅ 10 E ⋅ n ⋅ F / 2,3 ⋅ R ⋅ T , где
Е - установившееся значение ЭДС, В; COx - концентрация окисленной формы медиаторной системы, М; CRed - концентрация восстановленной формы медиаторной системы, М; AOA - антиоксидантная активность, М-экв; OA - оксидантная активность, М-экв; n - число электронов, участвующих в окислительно-восстановительной реакции; F - число Фарадея (F=96484,56 Кл/моль); R - универсальная газовая постоянная (R=8.31441 Дж/моль·K); T - абсолютная температура, К.
Способ реализуют посредством устройства, в котором емкость для раствора, содержащая измерительный электрод и электрод сравнения, выполнена в виде двух отдельных частей и снабжена полупроницаемой мембраной, через которую части емкости для раствора сообщаются между собой, при этом одна из частей емкости содержит исходный раствор, а другая - исходный раствор с экстрактом, содержащим определяемые вещества, причем один из электродов размещен в одной части емкости, а второй - в другой части емкости. Электроды выполнены из одного материала. В качестве электродов используют платиновые планарные, объемные, толстопленочные или наноэлектроды.
Указанные отличительные признаки существенны.
Медиаторная система, состоящая из пары соединений с химическим элементом в разных степенях окисления или окисленной и восстановленной форм органического вещества, обеспечивает возможность окислять известные антиоксиданты и восстанавливать продукты окисления и гидропероксиды, что позволяет определять интегральные антиоксидантную и оксидантную активности в одном измерении. Использование емкости из двух частей, разделенных полупроницаемой мембраной, заполненными исходно одинаковым по составу раствором, содержащим растворитель (водный, смешанный или органический), электролит, например, KCl в растворе, содержащем водный, или LiClO4 - органический или смешанный растворитель и медиаторную систему, включающую окисленную и восстановленную формы соединения, а также использование двух электродов из одного и того же материала - в одной части электрод сравнения и в другой части - измерительный электрод, позволяют определять интегральные значения антиоксидантной и оксидантной активности по величине ЭДС за одну измерительную стадию, исключить влияние растворителя на измеряемый потенциал, исключить вклад диффузионного потенциала в измеряемую величину, что повышает точность и достоверность получаемой информации и позволяет использовать водные, смешанные и органические растворители и анализировать как водорастворимые, так и жирорастворимые вещества. Введение электролита в исходно используемый раствор уменьшает омическое падение напряжения в растворе, повышает стабильность установившегося значения ЭДС, что в совокупности повышает точность измерения.
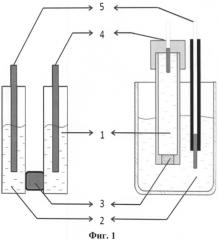
На фиг.1 схематически изображены возможные варианты устройства для реализации способа.
Обозначения:
1 - часть емкости, содержащая электрод сравнения (заполнено исходным раствором);
2 - часть емкости, заполненой исходным раствором с экстрактом, содержащим исследуемый объект;
3 - полупроницаемая мембрана;
4 - электрод сравнения;
5 - измерительный электрод.
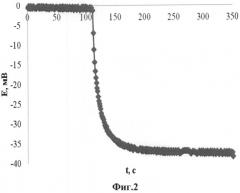
На фиг.2 приведена зависимость потенциала медиаторной системы в водном растворе при добавлении аскорбиновой кислоты в качестве антиоксиданта. Исходный раствор содержит 0,1 М KCl и медиаторную систему (концентрации 0,001 М K3[Fe(CN)6] и 0,00005 М K4[Fe(CN)6]). В измерительное пространство (10 мл) добавлен 0,1 мл 0,01 М аскорбиновой кислоты. Уменьшение потенциала свидетельствует о наблюдающемся увеличении антиоксидантной активности исследуемого раствора.
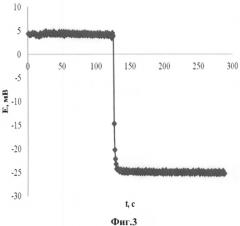
На фиг.3 приведена зависимость потенциала медиаторной системы в смешанном растворителе (вода/этанол) при добавлении K4[Fe(CN)6] в качестве вещества, моделирующего антиоксидантную активность раствора. Исходный раствор содержит смешанный растворитель этанол/вода (1/4), 0,15 М LiClO4 и медиаторную систему (концентрации 0,001 М K3[Fe(CN)6] и 0,00005 М K4[Fe(CN)6]). В измерительное пространство (10 мл) добавлен 0,1 мл 0,01 М K4[Fe(CN)6]. Уменьшение потенциала свидетельствует о наблюдающемся увеличении антиоксидантной активности исследуемого раствора.
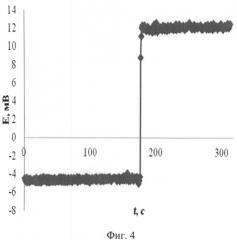
На фиг.4 приведена зависимость потенциала медиаторной системы в водном растворе при добавлении Н2О2 в качестве оксиданта. Исходный раствор содержит 0,1 М KCl и медиаторную систему (концентрации 0,0001 М K3[Fe(CN)6] и 0,01 М K4[Fe(CN)6]). В измерительное пространство (10 мл) добавлен 0,1 мл 0,01 М Н2О2. Увеличение потенциала свидетельствует о наблюдающемся увеличении оксидантной активности исследуемого раствора.
Реализация способа с использованием устройства заключается в следующем.
Готовят исходный раствор, содержащий водный, органический или смешанный растворитель, в который вводят медиаторную систему и электролит (KCl, LiClO4), помещают его в одну часть емкости 1. Во вторую (измерительную) часть 2 помещают раствор исходно того же состава, в который вводят экстракт, содержащий исследуемый образец. Раствор, помещаемый в измерительную часть емкости 2, может быть также приготовлен заранее. Части емкости 1 и 2 сообщаются между собой через полупроницаемую мембрану 3, через которую проходят ионы раствора, создавая электродвижущую силу, возникающую между электродами 4 и 5. Измеряют установившееся в системе значение электродвижущей силы (разности потенциалов на электродах). Оксидантную/антиоксидантную активность рассчитывают, используя величину установившегося значения ЭДС, по формулам
A O A = C O x − α C Re d 1 + α , причем α = ( C O x / C Re d ) ⋅ 10 E ⋅ n ⋅ F / 2,3 ⋅ R ⋅ T
O A = α C Re d − C O x 1 + α , причем α = ( C O x / C Re d ) ⋅ 10 E ⋅ n ⋅ F / 2,3 ⋅ R ⋅ T , где
Е - установившееся значение ЭДС, В; COx - концентрация окисленной формы медиаторной системы, М; CRed - концентрация восстановленной формы медиаторной системы, М; АОА - антиоксидантная активность, М-экв; ОА - оксидантная активность, М-экв; n - число электронов, участвующих в окислительно-восстановительной реакции; F - число Фарадея (F=96484,56 Кл/моль); R - универсальная газовая постоянная (R=8.31441 Дж/моль·K); Т - абсолютная температура, К.
Способ иллюстрируется следующими примерами.
Пример 1.
Готовили раствор 0,1 М KCl и медиаторную систему (концентрации 0,001 М K3[Fe(CN)6] и 0,00005 М K4[Fe(CN)6]), помещали его в часть емкости 1 с электродом сравнения 4. В 10 мл такого же раствора добавляли 0,1 мл 0,01 М аскорбиновой кислоты (что соответствует АОАпробы=2×10-2 М-экв) и помещали его в часть емкости 2 с измерительным электродом 5. Измеренное установившееся значение ЭДС оказалось равным 43 мВ. Антиоксидантную активность рассчитывали, используя величину установившегося значения ЭДС, по формуле
A O A = C O x − α C Re d 1 + α , причем α = ( C O x / C Re d ) ⋅ 10 E ⋅ n ⋅ F / 2,3 ⋅ R ⋅ T
Е - установившееся значение ЭДС, В, COx - концентрация окисленной формы медиаторной системы, М; CRed - концентрация восстановленной формы медиаторной системы, М; АОА - антиоксидантная активность, М-экв; ОА - оксидантная активность, М-экв.
Расчет показывает, что полученные значения потенциалов при использованной концентрации медиаторной системы соответствуют АОА=0,019 М-экв при АОАпробы=2×10-2 М-экв. Данные хорошо согласуются между собой.
Пример 2.
Готовили раствор 0,15 М LiClO4 и медиаторную систему (концентрации 0,001 М K3[Fe(CN)6] и 0,00005 М K4[Fe(CN)6]) в смешанном растворителе этанол/вода, помещали его в часть емкости 1 с электродом сравнения 4. В 10 мл такого же раствора добавляли 0,1 мл 0,01 М K4[Fe(CN)6] (что соответствует АОАпробы=1×10-2 М-экв) и помещали его в другую часть емкости 2, содержащую измерительный электрод 5.
Установившееся значение ЭДС составляет 30 мВ. Расчет показывает, что найденная АОАпробы=1×10-2 М-экв.
Пример 3.
Готовили раствор 0,15 М LiClO4 и медиаторную систему (концентрации 0,001 М K3[Fe(CN)6] и 0,00005 М K4[Fe(CN)6]) в смешанном растворителе этанол/вода 1:4, помещали его в часть емкости 1, содержащей электрод сравнения 4. В 10 мл такого же раствора вводили образец косметического крема и помещали его в часть емкости 2, содержащей измерительный электрод 5. Установившееся значение ЭДС составляет 23 мВ. Найденная АОА крема составляет 0,0009 М-экв.
Предлагаемые способ и устройство обеспечивают быстрое и точное определение оксидантной/антиоксидантой активности веществ как в водном, так и в неводном растворах.
1. Способ определения оксидантной/антиоксидантной активности веществ, включающий приготовление исходного раствора с медиаторной системой, содержащей одновременно окисленную и восстановленную формы реагента и оценку оксидантной/антиоксидантной активности по электрохимическим параметрам экстракта анализируемого вещества, введенного в исходный раствор, отличающийся тем, что исходный раствор разделяют на два объема, сообщающихся между собой через полупроницаемую мембрану, а экстракт анализируемого вещества вводят в один из объемов исходного раствора, при этом в качестве электрохимического параметра оценки оксидантной/антиоксидантной активности служит установившееся значение электродвижущей силы в измерительной системе.
2. Способ по п.1, отличающийся тем, что оксидантную/антиоксидантную активность определяют по формулам: A O A = C O x − α C Re d 1 + α , причем α = ( C O x / C Re d ) ⋅ 10 E ⋅ n ⋅ F / 2,3 ⋅ R ⋅ T O A = α C Re d − C O x 1 + α , причем α = ( C O x / C Re d ) ⋅ 10 E ⋅ n ⋅ F / 2,3 ⋅ R ⋅ T ,где Е - установившееся значение ЭДС, В; COx - концентрация окисленной формы медиаторной системы, М; CRed - концентрация восстановленной формы медиаторной системы, М; АОА - антиоксидантная активность, М-экв; ОА - оксидантная активность, М-экв; n - число электронов, участвующих в окислительно-восстановительной реакции; F - число Фарадея; R - универсальная газовая постоянная; Т - абсолютная температура, К.
3. Способ по п.1, отличающийся тем, что в исходный раствор дополнительно вводят электролит.
4. Устройство для реализации способа по п.1, включающее емкость для раствора с измерительным электродом и электродом сравнения, соединенными с прибором для измерения электродвижущей силы, отличающееся тем, что емкость для раствора выполнена в виде двух отдельных частей и снабжена полупроницаемой мембраной, через которую части емкости для раствора сообщаются между собой, при этом одна из частей емкости содержит исходный раствор, а другая - исходный раствор с экстрактом, содержащим определяемые вещества, причем один из электродов размещен в одной части емкости, а второй - в другой части емкости.
5. Устройство по п.4, отличающееся тем, что электроды изготовлены из одного материала.
6. Устройство по п.4, отличающееся тем, что в качестве электродов используют платиновые планарные, объемные, толстопленочные или наноэлектроды.