Способ моделирования тканевой структуры сетчатки глаза человека
Иллюстрации
Показать всеИзобретение относится к биотехнологии и медицине, и может быть использовано в тканевой инженерии и клеточной трансплантологии с целью моделирования тканевой структуры сетчатки. Для этого энуклиируют глазное яблоко при аутопсии, промывают его в спиртовом растворе и в растворе Хэнкса с антибиотиками. Затем удаляют по зубчатой линии передний сегмент глазного яблока. Отделяют стекловидное тело и нейтральную сетчатку от ретинального пигментного эпителия (РПЭ). Выделенную сетчатку подвергают девитализирующей обработке для создания бесклеточного каркаса сетчатки глаза. Этот каркас промывают в питательной среде с антибиотиками. Затем каркас переносят в слайд-камеру и колонизируют клетками РПЭ. Для получения культуры клеток РПЭ глазную чашу глазного яблока заполняют раствором Хэнкса с ЭДТА. Затем собирают клетки нативного РПЭ. Часть клеток РПЭ переносят в стерильную среду, для выделения, центрифугируют. Затем выделенные клетки ресуспендируют в ростовой среде, пипетируют, распределяют во флаконы и культивируют со сменой среды до образования первичной культуры. Далее проводят пассирование клеток первичной культуры. Затем эти клетки культивируют в культуральных флаконах. Культивированные клетки 1-5 пассажа в виде монослойных культур снимают с культуральной поверхности и в виде суспензии культивированных клеток РПЭ направляют на колонизирование бесклеточного каркаса сетчатки. При этом, наблюдение за сетчаткой и контроль девитализирующей обработки осуществляли методом микроскопии. Для наблюдения за клеточными культурами проводят ИГХ опенку, ПЦР опенку, микроскопию. Способ обеспечивает создание трехмерной модели культуры клеток РПЭ с заданными параметрами количества, плотности и тканевой дифференцировки, благодаря поэтапному контролированию процесса моделирования. 13 з.п. ф-лы, 2 пр., 3 табл., 28 ил.
Реферат
Изобретение относится к биотехнологии, может быть использовано в тканевой инженерии и клеточной трансплантологии с целью получения тканевой структуры сетчатки для исследования клеточных и молекулярных механизмов регенерации сетчатки и тестирования лекарств in vitro, а также для восстановления сетчатки при различных нейродегенеративных заболеваниях.
На сегодняшний день возрастная макулярная дегенерация (ВМД) - одно из самых распространенных и малоизученных заболеваний глаз, угрожающих значительным снижением зрения, слепотой и инвалидностью. ВМД характеризуется постепенным снижением центрального зрения у лиц старше 50-60 лет, приводящего к значительной потере зрения в пожилом возрасте. Существует две основные формы ВМД - «сухая» и «влажная». В 9 из 10 случаев ВМД встречается «сухая» форма. Она, как правило, характеризуется медленным прогрессирующим снижением зрения. «Влажная» форма ВМД развивается примерно в 1 из 10 случаев и может вызвать серьезную потерю зрения в довольно короткий промежуток времени - иногда за несколько месяцев. Лечение ВМД (макулодистрофии) остается актуальной проблемой современной офтальмологии.
Известен способ лечения «влажной» формы возрастной макулярной дегенерации, включающий интравитреальное введение препарата Авастин [Э.В.Бойко, О.В.Филохина, С.В.Сосновский и др. Первый опыт применения препарата Авастин в лечении влажной формы возрастной макулярной дегенерации, Современные технологии лечения витреоретинальной патологии - 2007. Сборник научных статей по материалам научно-практической конференции (Москва, 23 марта 2007 г.) под редакцией Х.П.Тахчиди. Москва, 2007 г., С.54-58]. Препарат Авастин представляет собой рекомбинантное моноклональное антитело, которое селективно связывается с биологически активным фактором роста эндотелия сосудов (VEGF) и нейтрализует его, ингибируя взаимодействие VEGF с его рецепторами на поверхности эндотелиальных клеток, что приводит к снижению роста новообразованных сосудов. Недостатком способа является непродолжительность действия, что требует повторных инъекций препарата.
Известен способ лечения возрастной макулярной дегенерации сетчатки, по которому выполняют частичную витрэктомию премакулярного отдела стекловидного тела, индуцируют отслойку задней гиалоидной мембраны без ее удаления и в сформировавшееся ретрогиалоидное пространство вводят препарат Авастин [патент RU №2368359, МПК A61F 9/00].
Известен способ лечения возрастной макулярной дегенерации сетчатки [патент RU №2408335, МПК A61F 9/00]. Способ включает лазерное воздействие и введение ретиналамина, представляющего собой лиофилизат, полученный путем уксуснокислой экстракции из сетчатки глаза крупного рогатого скота или свиней, содержащий комплекс низкомолекулярных пептидов.
Однако все эти методы лечения направлены только на поддержание зрения и предотвращение его ухудшения.
Достижения клеточной биологии в конце XX века стали основой для разработки биомедицинских технологий. Они позволили использовать культивируемые клетки человека в медицине для восстановления структурной и функциональной активности поврежденных тканей в ситуациях, где традиционные методы лечения малоэффективны или бессильны.
Известен способ лечения «сухой» формы возрастной макулярной дегенерации сетчатки, по которому макулярную область сетчатки облучают низкоинтенсивным лазерным излучением и через 3 часа проводят внутривенное введение аутологичных культивированных мезенхимальных стволовых клеток костного мозга пациента [патент RU 2333737, МПК A61F 9/00].
Известен способ лечения «сухой» формы возрастной макулярной дегенерации сетчатки [патент RU 2375016, МПК A61F 9/00]. Способ заключается в интравитреальном введении взвеси аутологичных культивированных мезенхимальных стволовых клеток собственного костного мозга пациента.
Считается, что клетки предшественники, выделенные вне сетчатки и трансплантированные путем системного введения или инъекции субретинально или в полость стекловидного тела взрослого глаза, могут интегрироваться в сетчатку и тем самым улучшать ее функцию.
Однако недостатком известных способов является то, что полученные результаты в основном неоднозначны, маргинальны или негативны и указывают, что простые трансплантации взрослых не ретинальных предшественников в патологически измененную сетчатку не способны приводить к существенным долговременным клиническим улучшениям.
В качестве лечебной терапии в последнее десятилетие интенсивно исследуется идея трансплантирования здоровых клеток ретинального пигментного эпителия (РПЭ) [Sommer F. Hyalocytes in Tissue Engineering First Steps Towards a Cell-based Vitreous Substitute, Dissertation, 2006, p.14-15]. Попытки использовать слои клеток РПЭ без какого-нибудь поддерживающего матрикса связаны с некоторыми недостатками. Во-первых, более трудно управлять клетками в течение трансплантации [Lu L., Nyalakonda К., Kam L., Bizios R., Goepferich A., Mikos A.G. Retinal pigment epithelial cell adhesion on novel micropatterned surfaces fabricated from synthetic biodegradable polymers // Biomaterials. - 2001. - Vol.22. - P.291-297]. В дополнении неспецифическая ферментативная обработка (например, использование трипсина/ЭДТА) культивированных слоев РПЭ приводит к существенному снижению метаболизма ретиноидов [Recum Н.А., Okano Т., Kim S.W., Bernstein P.S. Maintenance of retinoid metabolism in human retinal pigment epithelium cell culture // Exp. Eye Res. - 1999. - Vol.69. - Р.97-107].
Одним из направлений биотехнологии, которое занимается созданием биологических заместителей тканей и органов, является тканевая инженерия. Тканевая инженерия - создание новых тканей и органов для терапевтической реконструкции поврежденного органа посредством доставки в нужную область опорных структур, клеток, молекулярных и механических сигналов для регенерации. На первом этапе создания тканеинженерной конструкции отбирают собственный или донорский клеточный материал (биопсия или аутопсия), выделяют тканеспецифичные клетки и культивируют их.
Одной из центральных задач по лечению патологически измененной сетчатки является идентификация оптимального типа клеток, чтобы активно управлять репаративной функцией сетчатки. Идеальным типом клеток должны быть клетки, полностью детерминированные к судьбе клеток сетчатки и еще сохраняющие способность к экспансии in vivo или in vitro. Кроме того, важна для интересующего типа клеток способность дифференцироваться в функциональную специализированную ткань. Так как эпителиальные клетки обычно не выживают в суспензии, клетки РПЭ должны прикрепляться к поверхности для того чтобы избежать апоптоз [Tezel Т.Н., Del Priore L.V. Reattachment to a substrate prevents apoptosis of human retinal pigment epithelium // Graefes. Arch. Clin. Exp. Ophthalmol. - 1997. - Vol.235. - Р.41-47].
Поэтому в состав тканеинженерной конструкции, или трансплантата, кроме культуры клеток входит специальный носитель (матрица). Матрицы могут быть выполнены из различных биосовместимых материалов. Клетки полученной культуры наносятся на матрицу, после чего такая трехмерная структура переносится в биореактор с питательной средой, где инкубируется в течение определенного времени. При формировании сложных пространственных структур необходим специальный матрикс, повторяющий форму восстанавливаемой ткани. Биоматериалы, используемые для получения матриц, должны быть биологически инертными и после перенесения в организм обеспечивать локализацию нанесенного на них клеточного материала в определенном месте. Для создания тканей и органов применяются синтетические материалы, материалы на основе природных полимеров (хитозан, альгинат, коллаген), а также биокомпозитные материалы. Одними из первых в тканевой инженерии стали применяться биодеградируемые синтетические биоматериалы на основе полимеров органических кислот, например молочной (PLA, полилактат) и гликолевой (PGA, полигликолид). Матрицы на основе органических кислот легли в основу создания таких органов и тканей, как кожа, кость, хрящ, сухожилие, мышцы (поперечно-полосатая, гладкая и сердечная), тонкая кишка и др.
Группа исследователей под руководством A.G.Mikos предложила использовать биодеградируемые полимерные пленки как временные субстраты для культивируемых клеток РПЭ и последующую трансплантацию этих полимер-клеточных комплексов в субретинальное пространство. Однако культивированные клетки РПЭ на этих пленках, сделанных из комбинации молочной и гликолевой кислоты (PLGA), теряли свою характерную кубическую морфологию в течение 7 дней культивирования [Thomson R.C., Giordano G. G., Collier J.H., Ishaug S.L., Mikos A.G., Lahiri-Munir D., Garcia C.A. Manufacture and characterization of poly(alpha-hydroxy ester) thin films as temporary substrates for retinal pigment epithelium cells // Biomaterials. - 1996. - Vol.17. - P.321-327].
Для того чтобы сохранить нормальную морфологию и функцию клеток РПЭ in vitro исследователи разработали новый деградируемый микросубстрат из PLGA и блокатор кополимеров из полиэтиленгликоля (PEG) и PLA, используя микроконтактную печать. Поверхности этой пленки, состоящие из адгезивного (PLGA) и неадгезивного (PEG/PLGA) доменов, позволяли клеткам прикрепляться и распространяться, и разрешали поддерживать дифференцированный клеточный фенотип в течение 8-часового периода исследования. Полимерный субстрат должен был облегчить обращение с клетками в течение трансплантации и обеспечить корректную ориентацию трансплантата в субретинальном пространстве [Lu L., Kam L., Hasenbein М., Nyalakonda К., Bizios R., Goepferich A., Young J.F., Mikos A.G. Retinal pigment epithelial cell function on substrates with chemically micropatterned surfaces // Biomaterials. - 1999. - Vol.20. - Р.2351-2361]. Хотя PLA и PLGA являются биодеградируемыми, у этих материалов имеются недостатки: изменение pH окружающих тканей при расщеплении в организме и недостаточная механическая прочность, что не позволяет использовать их как универсальный материал для матриц и подложек.
Известно использование амниотических мембран, которые модулируют пролиферацию и дифференцировку клеток РПЭ в культуре [Ohno-Matsui К., Ichinose S., Nakahama К., Yoshida Т., Kojima A., Mochizuki М., Morita I. The effects of amniotic membrane on retinal pigment epithelial cell differentiation // Mol. Vis. - 2005. - Vol.11. - P.1-10]. Амниотические мембраны при трансплантации действуют как соответствующий субстрат для эпителизации и получили широкое использование в офтальмологии для лечения персистирующих эпителиальных дефектов [Dua H.S. Amniotic membrane transplantation // Br. J. Ophthalmol. - 1999. - Vol.83. - Р.748-752]. В работе [Stanzel B.V., Espana E.M., Grueterich M., Kawakita T., Parel J.M., Tseng S.C., Binder S. Amniotic membrane maintains the phenotype of rabbit retinal pigment epithelial cells in culture // Exp. Eye Res. - 2005. - Vol.80. - P.103-112.] было показано, что лишенные эпителия амниотические мембраны повышают образование монослоя из РПЭ с плотными контактами. Их рекомендовали использовать как матрикс, содержащий базальную мембрану, для того чтобы облегчить трансплантацию РПЭ при лечении ВМД.
Изоляция клеток РПЭ с использованием ферментов (таких как коллагеназа 3 типа/гиалуронидаза) и последующее пассирование на термически чувствительной поверхности является подходящим методом для того, чтобы сохранить метаболическую активность культивированных клеток РПЭ для трансплантации [von Recum Н.А., Okano Т., Kim S.W., Bernstein P.S. Maintenance of retinoid metabolism in human retinal pigment epithelium cell culture // Exp. Eye Res. - 1999. - Vol.69. - Р.97-107].
Белки внеклеточного матрикса, в том числе коллагеновые структуры успешно используются в качестве подложки для культивирования. Однако создать искусственную объемную конструкцию из коллагена, повторяющую структуру любого органа, в том числе и сетчатки глаза, не представляется возможным.
Это обстоятельство инициировало исследования, направленные на разработку способа, позволяющего получать децеллюлированные матриксы органов с сохранением их пространственной организации. Технология, предусматривающая девитализацию ткани аллографта длительной мягкой обработкой растворами детергентов, приводит к разрушению всех клеточных элементов донора, оставляя неизменным соединительнотканный остов органа. Ацеллюлярность полученного каркаса обеспечивает его неиммуногенность, а остутствие поперечных сшивок не препятствует заселению его клетками реципиента. Кроме того, пространственные особенности подложки и химический состав матрикса служат дополнительными стимулами для их поддержания пролиферации, самоорганизации и выполнения дифференцировочных функций. Трехмерные модели (3D матрикс), представляющие собой тканеинженерные конструкции, на сегодняшний день являются наилучшими моделями для оценки поведения и дифференцировки предетерминированных клеток.
Известен способ получения соединительнотканного каркаса кровеносного сосуда. Способ позволяет эффективно отмывать клетки сосуда без повреждения коллагеновых и эластических волокон [Егорова М.В., Роговская Ю.В., Иванов А.В., Андреев С.Л., Ахмедов Ш.Д., Афанасьев С.А., Экономичная технология получения бесклеточной матрицы артериального сосуда животных и человека, Клеточные технологии в биологии и медицине, №2, 2011, с.110-113].
Известен метод экстракции клеточных компонентов из тканей тела и структур, которые должны быть использованы как материал для имплантации. Децеллюляризация улучшает биосовместимость и уменьшает иммунологическую реакцию против тканевого трансплантата [заявка GB №2375771, МПК A61L 27/26].
Известен способ совмещения культивированных остеогенных клеток и трехмерного материала-носителя путем иммобилизации клеток на поверхности материала-носителя (деминерализованный костный матрикс). Изобретение обеспечивает получение тканеинженерного эквивалента кости, включающего полноценное совмещение предифференцированных в условиях in vitro остеогенных клеток и трехмерного материала-носителя, изготовленного из деминерализованного костного матрикса [патент RU №2414916, МПК A61K 35/32].
Известна гелевая модель внеклеточного матрикса для изучения развития и дифференцировки эмбриональных СК (ЭСК) in vitro и метод для изучения механизмов развития ЭСК [заявка CN №101711890, МПК A61L 27/38]. В заявке описана трехмерная модель дифференцировки и развития ЭСК, внедрение ЭСК в эту модель в различной клеточной плотности, обнаружение феномена образования эмбриоидных телец.
Учитывая ключевую роль РПЭ в сохранности и жизнеспособности всей сетчатки, пересадка РПЭ может решить проблему ВМД.
Чтобы выяснить биологическую сложность органогенеза сетчатки и ее все увеличивающееся пересечение с регенеративной функцией сетчатки, а также для решения целесообразности внедрения в клиническую практику клеточных трансплантатов на основе клеток РПЭ, необходимы новые модельные системы, в которых могут быть проанализированы индивидуальные вариации типов клеток предшественников, в том числе культивированных клеток РПЭ, сигналы внеклеточного матрикса, двух- и трехмерные структуры и тканевая функция в отношении их эффектов на глобальную физиологическую функцию интактного органа. В частности необходимо разработать способ моделирования репаративной функции сетчатки для оценки поведения и дифференцировки культивируемых клеток РПЭ при проведении доклинических исследований.
Задачей, на решение которой направлено предлагаемое изобретение, является разработка способа моделирования тканевой структуры сетчатки глаза человека.
Техническим результатом изобретения является создание ex vivo трехмерной модели культуры клеток РПЭ с заданными параметрами количества, плотности и тканевой дифференцировки на биологически инертном матриксе, не ухудшающем рост и дифференцировку клеточной культуры.
Для решения поставленной задачи способ моделирования тканевой структуры сетчатки глаза человека путем колонизирования бесклеточного каркаса сетчатки глаза клетками ретинального пигментного эпителия заключается в том, что бесклеточный каркас сетчатки глаза получают девитализирующей обработкой сетчатки из энуклиированного при аутопсии глазного яблока путем последовательного промывания его в спиртовом растворе при концентрации 70% и в холодном растворе Хэнкса с антибиотиками, удаления по зубчатой линии переднего сегмента глазного яблока, отделения стекловидного тела и нейральной сетчатки от ретинального пигментного эпителия и выделения сетчатки, подрезая ее в области зрительного нерва, выделенную сетчатку для девитализирующей обработки помещают в 10-15 мл 10 мМ ЭДТА в среде DMEM на 20 часов при температуре 4°C, затем обрабатывают 3% раствором Тритона X-100 в течение 2 часов при температуре 4°C и отмывают в дистиллированной воде, далее сетчатку последовательно помещают в 0,025% раствор ДНазы I в 1 М растворе NaCl на 1 час при температуре 4°C и в 4% дезоксихолат натрия на 1-2 часа при температуре 22°C и затем отмывают в дистиллированной воде для удаления детергента и клеточного дебриса, глазную чашу наполняют холодным раствором Хэнкса с ЭДТА и через 15-30 мин собирают клетки нативного ретинального пигментного эпителия, часть собранных клеток переносят в лизирующий раствор TRI®-Reagent из расчета 1 мл раствора на 50-100 мг ткани, пипетируют до гомогенного состояния раствора и лизат клеток нативного ретинального пигментного эпителия инкубируют 5-7 мин при температуре 22°C, другую часть собранных клеток переносят в стерильную среду для выделения, состоящую из питательной среды DMEM/F12 (1:1), дополненной 15% эмбриональной телячьей сывороткой, 2 мМ L-глутамина и антибиотиками и центрифугируют в течение 5-7 мин при 600-800 об/мин, затем клетки ресуспендируют в полной культуральной среде, состоящей из питательной среды DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 1%-ного раствора заменимых аминокислот, 1%-ного раствора нейральной добавки N2, 20 нг/мл основного фактора роста фибробластов и антибиотиков, и после пипетирования распределяют в культуральных флаконах без покрытия и культивируют при температуре 37°C и 5% CO2, через 5-7 суток проводят первую смену среды и продолжают культивировать со сменой среды через 2-3 суток до достижения клетками конфлюэнтного монослоя и образования первичной культуры, затем проводят пассирование клеток первичной культуры, используя раствор трипсина-версена (1:3), далее клетки помещают в культуральные флаконы и в слайд-камеры в плотности 1 - 2×104 кл./см2 и культивируют, культивированные в культуральных флаконах клетки 1-5 пассажа в виде адгезивных монослойных культур, коммитированные в нейральном направлении, снимают с культуральной поверхности раствором трипсина-версена (1:3) и в виде суспензии культивированных клеток ретинального пигментного эпителия направляют на колонизирование бесклеточного каркаса сетчатки, причем бесклеточный каркас сетчатки перед колонизированием промывают в питательной культуральной среде DMEM/F12 (1:1) с антибиотиками, переносят в слайд-камеру и заливают полной культуральной средой, а колонизирование бесклеточного каркаса сетчатки глаза осуществляют посредством диффузионного осаждения суспензии культивированных клеток ретинального пигментного эпителия в плотности 4 - 5,5×104 кл./см2 в полной культуральной среде того же состава и культивирования при температуре 37°C и 5% CO2, со сменой среды через 2-3 суток до колонизирования культивированными клетками бесклеточного каркаса сетчатки и формирования монослоя клеток на его поверхности с получением тканевой структуры сетчатки глаза, которую направляют на изучение локализации культивируемых клеток и на иммуногистохимическую (ИГХ) оценку потенциала дифференцировки культивируемых клеток в бесклеточном каркасе сетчатки глаза.
В частном варианте для изучения локализации культивируемых клеток проводят окрашивание ядер клеток витальным красителем Hoechst 33342 для люминесцентной микроскопии.
В другом частном варианте для изучения локализации культивируемых клеток колонизированный клетками бесклеточный каркас сетчатки через 12-25 суток фиксируют 4% параформальдегидом, промывают его в фосфатно-солевом буфере (PBS, pH 7.4), проводят по спиртам с восходящей концентрацией 70, 96 и 100%-ный спирт, заливают в парафин, изготавливают гистологические срезы и окрашивают гематоксилином и эозином для световой микроскопии.
В другом частном варианте ИГХ оценку потенциала дифференцировки культивируемых клеток в бесклеточном каркасе сетчатки проводят методом иммунопероксидазного окрашивания, используя мышиные моноклональные антитела к CD31, CD34, тирозиназе, СК7, СК8, СК18, СК19, виментину, GFAP, S100 и NSE.
В другом частном варианте используют антибиотики пенициллин-стрептомицин в стандартной концентрации - пенициллин 100 Ед./мл и стрептомицин 100 мкг/мл.
В другом частном варианте бесклеточный каркас сетчатки глаза после удаления детергента и клеточного дебриса помещают в питательную культуральную среду DMEM/F12 с антибиотиками при температуре 4-8°C на хранение в течение 2-20 суток до фиксации 4% параформальдегидом или колонизирования культвированными клетками.
В другом частном варианте фиксированный бесклеточный каркас сетчатки промывают в фосфатно-солевом буфере (PBS, pH 7.4), проводят по спиртам с восходящей концентрацией 70, 96 и 100%-ный спирт, заливают в парафин, изготавливают гистологические срезы, которые монтируют на предметные стекла и окрашивают гематоксилином и эозином для контроля адекватности девитализирующей обработки с помощью световой и/или люминесцентной микроскопии.
В другом частном варианте после инкубирования лизат клеток нативного ретинального пигментного эпителия хранят при температуре минус 20°C до проведения полимеразной цепной реакции (ПЦР) - ПЦР оценки.
В другом частном варианте клетки первичной культуры и культивированные клетки 1-5 пассажа направляют для проведения ПЦР оценки.
В другом частном варианте для проведения ПЦР оценки определяют уровень экспрессии генов, кодирующих транскрипционные факторы Oct4 (POU5F1), Nanog, Рах6 и маркеры дифференцировки Musashi 1, β tubulin III, RPE65 выделением тотальной РНК и синтеза кДНК, при этом уровень экспрессии генов оценивают по интенсивности свечения полос, полученных при электрофоретическом разделении ПЦР-продуктов в 1%-ном агарозном геле на анализаторе гелей.
В другом частном варианте культивирование клеток в слайд-камерах проводят в 1-, 2-, 4- или 8-луночных слайд-камерах, через 2-3 суток, при достижении клетками субконфлюэнтного слоя, их фиксируют охлажденным ацетоном и направляют на ИГХ оценку потенциала дифференцировки клеток.
В другом частном варианте ИГХ оценку потенциала дифференцировки культивированных клеток осуществляют методами иммунопероксидазного и иммунофлуоресцентного окрашивания, используя первичные мышиные моноклональные и кроличьи поликлональные антитела, Рах6, Sox2, виментин, Nestin, β tubulin III, nNOS, тирозин гидроксилаза, NF 68 and 200 kDa, GFAP, CNPase, Iba, N-cadherin, Коннексин-43, RPE65, CRALBP, Recoverin, PanCK, Macrophage antigen, Фибронектин, Factor Von Willebrand, Ki67, а также полимер из набора EnVision™, конъюгированный с пероксидазой хрена, (Dako, Дания) или вторичные антитела: набор SFX с антителами козы против мыши, меченные Alexa Fluor® 488, антитела против иммуноглобулинов кролика, конъюгированные с флуорохромом Texas Red, разведенные в 0,1%-ном растворе бычьего сывороточного альбумина.
В другом частном варианте бесклеточный каркас сетчатки глаза, перенесенный в слайд-камеру, заливают полной культуральной средой, состоящей из питательной среды DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 1%-ным раствором заменимых аминокислот, 1%-ным раствором нейральной добавки N2, 20 нг/мл основного фактора роста фибробластов и антибиотиками.
В другом частном варианте бесклеточный каркас сетчатки глаза, перенесенный в слайд-камеру, заливают полной культуральной средой, состоящей из питательной среды DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина и антибиотиками, и помещают в CO2-инкубатор, имеющий температуру 37°C, 5% CO2 в воздухе для уравновешивания pH среды.
Предлагаемое изобретение иллюстрируется на следующих фигурах.
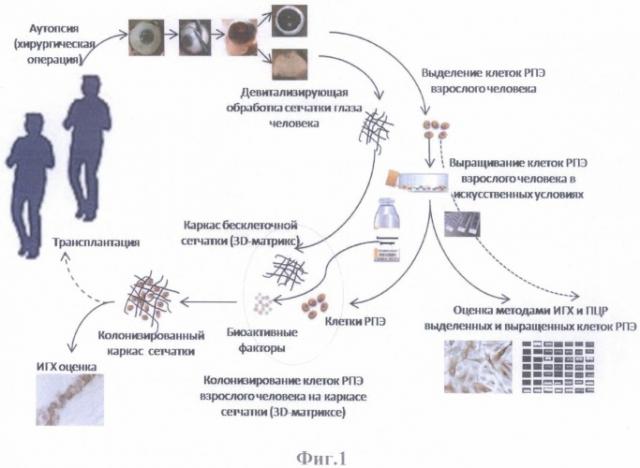
На фиг.1 представлена схема моделирования тканевой структуры сетчатки глаза человека.
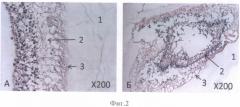
На фиг.2 представлен гистологический препарат нейральной части сетчатки глаза взрослого человека в тесной связи со стекловидным телом, фиксация 4% параформальдегидом, парафиновый срез (контроль). Окраска гематоксилином и эозином, масштабное увеличение Х200.
А - поперечный срез,
Б - продольный срез.
На фиг.3 представлена бесклеточная сетчатка глаза взрослого человека непосредственно после девитализирующей обработки, фазовый контраст.
А - масштабное увеличение Х40,
Б - масштабное увеличение Х200.
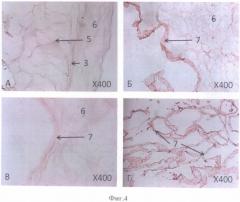
На фиг.4 представлена бесклеточная сетчатка глаза взрослого человека на границе с бесклеточным каркасом стекловидного тела, парафиновый срез. Окраска гематоксилином и эозином, масштабное увеличение Х400.
А - через 2 суток после девитализирующей обработки,
Б-Г - через 20 суток после девитализирующей обработки.
На фиг.5 представлена культура клеток ретинального пигментного эпителия глаза взрослого человека 2-го пассажа. Иммунопероксидазное окрашивание, ядра докрашены гематоксилином. Масштабное увеличение Х200.
А - маркер Nestin - коричневое окрашивание,
Б - маркер β tubulin III - коричневое окрашивание,
В - маркер NF 68 and 200 kDa - коричневое окрашивание.
На фиг.6 представлена культура клеток ретинального пигментного эпителия глаза взрослого человека 2-го пассажа. Иммунофлуоресцентное исследование, ядра окрашены DAPI (синее свечение). Масштабная линейка 200 µm.
А - маркер nNOS - красное свечение,
Б - маркер GFAP - красное свечение,
В - маркер CNPase - зеленое свечение.
На фиг.7 представлены результаты ПЦР-анализа, иллюстрирующие характер экспрессии генов RPE65, Oct4, Nanog, Musashi 1, Рах6, β Tubulin III в первичных (ПК) и пассируемых (Р1-Р4) адгезивных клеточных культурах ретинального пигментного эпителия глаза взрослого человека, а также в контролях - в клеточной культуре постнатальных фибробластов (К) и нативном ретинальном пигментном эпителии (Н). В качестве гена для нормировки использован RPL19.
На фиг.8-10 представлена колонизация бесклеточной сетчатки и бесклеточного каркаса стекловидного тела глаза взрослого человека аутологичными клетками ретинального пигментного эпителия 2-го пассажа.
На фиг.8 на 7-е сутки, фазовый контраст.
А - скопления округлых клеток на поверхности бесклеточного каркаса сетчатки, масштабное увеличение X100,
Б - округлые образования, соединенные между собой клетками вытянутой формы, масштабное увеличение Х200.
На фиг.9 - на 7-е сутки, фазовый контраст.
А - округлые образования, соединенные между собой клетками вытянутой формы, масштабное увеличение X100,
Б - две субпопуляции, масштабное увеличение X100.
На фиг.10 - на 12-е сутки, монослой клеток ретинального пигментного эпителия на поверхности бесклеточного каркаса сетчатки глаза, фазовый контраст, масштабное увеличение X100.
На фиг.11 - на 12-е сутки, ядра клеток ретинального пигментного эпителия, образующих монослой на поверхности бесклеточного каркаса сетчатки глаза, окрашены витальным ядерным красителем Hoechst 33342, люминесцентная микроскопия, масштабное увеличение X100.
На фиг.12-16 представлены гистологические срезы бесклеточного каркаса сетчатки глаза взрослого человека, интимно связанного с бесклеточным каркасом стекловидного тела; бесклеточные каркасы колонизированы аутологичными клетками ретинального пигментного эпителия 2-го пассажа, окраска гематоксилином и эозином.
На фиг.12 представлено
А - конгломераты клеток ретинального пигментного эпителия округлой формы на каркасе стекловидного тела, квадратом выделен фрагмент с одним из клеточных конгломератов, масштабное увеличение Х40,
Б - увеличение фрагмента, масштабное увеличение Х400.
На фиг.13 - клетки ретинального пигментного эпителия заселили всю внутреннюю пограничную мембрану сетчатки глаза, граничащую с задней гиалоидной мембраной стекловидного тела, масштабное увеличение X100.
На фиг.14 - монослой кубовидной формы клеток ретинального пигментного эпителия, плотно прилежащих друг к другу; видна миграция клеток в каркас стекловидного тела, масштабное увеличение Х400.
На фиг.15 - клетки ретинального пигментного эпителия уплощенной формы, заселивших внутреннюю пограничную мембрану сетчатки глаза, прилежащей к задней гиалоидной мембране стекловидного тела, масштабное увеличение Х400.
На фиг.16 - конгломерат клеток ретинального пигментного эпителия на поверхности каркаса стекловидного тела, масштабное увеличение Х200.
На фиг.17-28 представлен бесклеточный каркас сетчатки глаза взрослого человека, интимно связанный с бесклеточным каркасом стекловидного тела; бесклеточные каркасы колонизированы аутологичными клетками ретинального пигментного эпителия 2-го пассажа. Иммунопероксидазное окрашивание на серийных парафиновых срезах.
На фиг.17 - без первичных антител (контроль), масштабное увеличение Х200.
На фиг.18 - негативное окрашивание на маркер эндотелиальных клеток CD31.
А - на поверхности внутренней пограничной мембраны бесклеточной сетчатки глаза, граничащей с бесклеточным каркасом стекловидного тела, масштабное увеличение Х200,
Б - в клеточных конгломератах, располагающихся на бесклеточном каркасе стекловидного тела, масштабное увеличение Х200.
На фиг.19 - негативное окрашивание на маркер эндотелиальных клеток CD34.
А - на поверхности внутренней пограничной мембраны бесклеточной сетчатки глаза, граничащей с бесклеточным каркасом стекловидного тела, масштабное увеличение Х400,
Б - на поверхности бесклеточной сетчатки глаза и в клеточных конгломератах, масштабное увеличение X100.
На фиг.20 - негативное окрашивание на маркер клеток, синтезирующих меланин, тирозиназу.
А - на поверхности бесклеточной сетчатки, масштабное увеличение Х200,
Б - в клеточных конгломератах, располагающихся на бесклеточном каркасе стекловидного тела, масштабное увеличение Х200.
На фиг.21 - коричневое (позитивное) окрашивание дедифференцированных клеток ретинального пигментного эпителия на маркер эпителия СК7.
А - на поверхности внутренней пограничной мембраны бесклеточной сетчатки глаза, граничащей с бесклеточным каркасом стекловидного тела, масштабное увеличение Х200,
Б - на поверхности бесклеточной сетчатки глаза и в клеточных конгломератах, масштабное увеличение Х200.
На фиг.22 - коричневое (позитивное) окрашивание мигрирующих клеток ретинального пигментного эпителия на маркер эпителия СК19.
А - на поверхности внутренней пограничной мембраны бесклеточной сетчатки, граничащей с бесклеточным каркасом стекловидного тела, масштабное увеличение X100,
Б - на поверхности бесклеточной сетчатки глаза в клеточных конгломератах, масштабное увеличение Х200.
На фиг.23 - коричневое (позитивное) окрашивание дифференцированных клеток ретинального пигментного эпителия на маркер эпителия СК8.
А - на поверхности внутренней пограничной мембраны бесклеточной сетчатки глаза, граничащей с бесклеточным каркасом стекловидного тела, масштабное увеличение Х200,
Б - на поверхности бесклеточной сетчатки глаза в клеточных конгломератах, масштабное увеличение Х400.
На фиг.24 - коричневое (позитивное) окрашивание дифференцированных клеток ретинального пигментного эпителия на маркер эпителия СК18.
А - на поверхности внутренней пограничной мембраны бесклеточной сетчатки глаза, граничащей с бесклеточным каркасом стекловидного тела, масштабное увеличение X100,
Б, В, Г - на поверхности бесклеточной сетчатки глаза и в клеточных конгломератах, масштабное увеличение Х200.
На фиг.25 - коричневое (позитивное) окрашивание на маркер глиальных клеток виментин.
А - на поверхности внутренней пограничной мембраны бесклеточной сетчатки глаза, граничащей с бесклеточным каркасом стекловидного тела, масштабное увеличение Х200,
Б - на поверхности бесклеточной сетчатки глаза, масштабное увеличение Х200.
На фиг.26 - коричневое (позитивное) окрашивание на маркер дифференцированных глиальных клеток S100.
А - на поверхности внутренней пограничной мембраны бесклеточной сетчатки глаза, граничащей с бесклеточным каркасом стекловидного тела, масштабное увеличение Х200,
Б - на поверхности бесклеточной сетчатки глаза и в клеточных конгломератах, масштабное увеличение Х40.
На фиг.27 - коричневое (позитивное) окрашивание на нейрональный маркер NSE.
А - на поверхности внутренней пограничной мембраны бесклеточной сетчатки глаза, граничащей с бесклеточным каркасом стекловидного тела, масштабное увеличение Х200,
Б - на поверхности бесклеточной сетчатки глаза и в клеточных конгломератах, масштабное увеличение Х40.
На фиг.28 - окрашивание на маркер глиальных клеток GFAP.
A, Б - негативное окрашивание в клетках ретинального пигментного эпителия, располагающихся на поверхности внутренней пограничной мембраны бесклеточной сетчатки, граничащей с бесклеточным каркасом стекловидного тела, масштабное увеличение Х200,
B, Г - негативное окрашивание в клетках ретинального пигментного эпителия, располагающихся на поверхности внутренней пограничной мембраны бесклеточной сетчатки глаза, граничащей с бесклеточным каркасом стекловидного тела, и коричневое (позитивное) окрашивание в бесклеточном каркасе сетчатки (в виде сети), масштабное увеличение Х200,
Д - коричневое (позитивное) окрашивание в отдельных клеточных конгломератах, масштабное увеличение X100,
Е - коричневое (позитивное) окрашивание в отдельных клеточных конгломератах, масштабное увеличение Х400.
На фигурах показано:
1 - гиалоидная строма стекловидного тела;
2 - нейральная сетчатка;
3 - соединение внутренней пограничной мембраны сетчатки с задней гиалоидной мембраной стекловидного тела;
4 - сосудистый каркас;
5 - каркас нейральной части сетчатки, состоящий из базальных мембран клеток Мюллера;
6 - каркас стекловидного тела;
7 - внутренняя пограничная мембрана сетчатки;
8 - субпопуляция клеток ретинального пигментного эпителия, прикрепленная к поверхности бесклеточного каркаса сетчатки;
9 - субпопуляция клеток ретинального пигментного эпителия, распластанная на поверхности культурального пластика и образовавшая монослой;
10 - монослой кубовидной формы клеток, плотно прилежащих друг к другу;
11 - слой клеток уплощенной формы.
Моделирование тканевой структуры сетчатки глаза человека (трехмерной модели) осуществляли по схеме, представленной на фиг.1.
Получение бесклеточного каркаса сетчатки из трупного материала осуществляли путем очищения ее от функционирующих клеток (девитализирующей обработкой).
Глазные яблоки взрослого человека энуклиировали при аутопсии, освобождали от окружающих тканей и промывали один раз в 70%-ном спирте и 3 раза в холодном растворе Хэнкса с антибиотиками в стандартной концентрации - пенициллин 100 Ед./мл и стрептомицин 100 мкг/мл. Передний сегмент глазного яблока удаляли круговым разрезом позади зубчатой линии, которая хорошо определялась при обычном освещении, как граница между темным и светлым участками. Стекловидное тело и нейральную сетчатку отделяли от ретинального пигментного эпителия (РПЭ) и выделяли, подрезая нейральную сетчатку в области зрительного нерва.
Выделенную сетчатку обрабатывали по методике Carlson [Carlson Е.С. 1989. Fenestrated subendothelial basement membranes in human retinal capillaries. Invest. Ophthalmol. Vis. Sci. 30 (9): 1923-1932]. Сетчатку целиком помещали в 10-15 мл 10 мМ ЭДТА в среде DMEM на 20 часов при температуре 4°C. Затем сетчатку обрабатывали 3% раствором Тритона Х-100 в течение 2 часов при температуре 4°C, несколько (3-4) раз отмывали в дистиллированной воде. Далее ее последовательно помещали в 0,025% раствор ДНазы I в 1 М растворе NaCl на 1 час при 4°C, затем в 4% дезоксихолат натрия на 1-2 часа при температуре 22°C и затем помещали несколько (3-5) раз в дистиллированную воду для того, чтобы удалить детергент и клеточный дебрис.
Все растворы были предварительно стерилизованы через 0,22 мкм фильтр.
Наблюдение за сетчаткой проводили с помощью инвертированного микроскопа Olympus СКХ31 (Япония), а фотографирование с помощью камеры Olympus DP70 (Япония).
После последовательной обработки детергентами и ДНазой сетчатка уменьшалась в размере и при исследовании с помощью фазово-контрастной микроскопии представляла собой бесклеточный каркас, состоящий из волокон внеклеточного матрикса, компонентов внутренней пограничной мембраны сетчатки (коллагеновых фибрилл и базальных мембран Мюллеровских клеток) и базальных мембран капилляров.
Бесклеточный каркас сетчатки после отмывания в дистиллированной воде для удаления детергента и клеточного дебриса помещали в питательную культуральную среду DMEM/F12 с антибиотиками при температуре 4-8°C на хранение в течение 2-20 суток до фиксации 4% параформальдегидом или колонизирования культ