Способ стимулирования восстановления периферической иннервации тканей с помощью векторных конструкций
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и генной терапии и может быть использовано в регенеративной медицине, травматологии, трансплантологии и нейробиологии. Способ стимуляции восстановления периферической иннервации ткани после травмы заключается во введении терапевтически эффективного количества плазмидного вектора, содержащего нуклеотидную последовательность SEQ ID NO:1, кодирующую BDNF, или плазмидного вектора, содержащего нуклеотидную последовательность, кодирующую человеческую uPA дикого типа (NM_002658), или их комбинации, или комбинации плазмидного вектора, содержащего нуклеотидную последовательность SEQ ID NO:1, кодирующую BDNF с плазмидным вектором, содержащим оптимизированную нуклеотидную последовательность SEQ ID NO:2, кодирующую фактор стромальных клеток SDF-1. Способ позволяет ускорить восстановление структуры и проводимости периферических нервов после травм за счет локального увеличения продукции нейротрофических факторов. 2 з.п. ф-лы, 9 ил., 4 пр.
Реферат
Настоящее изобретение относится к области генной инженерии и генной терапии и может быть использовано в регенеративной медицине, травматологии, трансплантологии и нейробиологии для стимуляции роста и регенерации нервов и восстановления периферической иннервации тканей. Предлагается способ, позволяющий ускорить восстановление структуры и проводимости периферических нервов после травм путем трансфекции мышц, иннервируемых поврежденным нервом, новыми плазмидными конструкциями, кодирующми мозговой нейротрофический фактор (BDNF), активатор плазминогена урокиназного типа (uPA) и стромальный фактор SDF-1α, используемыми либо поодиночке, либо в комбинации друг с другом.
Введение
Нарушения периферической иннервации, вызванные травмами, ишемией и нейродегенеративными заболеваниями, являются важнейшей причиной временной и стойкой инвалидности населения России трудоспособного возраста [1]. Недостаточное восстановление иннервации также существенно снижает успешное приживление трансплантированных тканей и органов (печени, почек, сердца).
Стимуляция роста и восстановления периферического нерва - результат сложнейшего процесса, включающего множество физиологических и биохимических реакций. Для его осуществления, прежде всего, требуется поддержка выживания и регенерации нейронов и регуляция направления роста аксонов, в обеспечении которых основную роль, нейротрофические факторы: мозговой нейротрофический фактор (BDNF), глиальный фактор роста (GDNF) и фактор роста нервов (NGF). Необходимым условием для нормального протекания процесса регенерации нерва является также проходимость эндоневральных каналов, в создании которой задействованы активаторы плазминогена, в том числе урокиназа (uPA) и матриксные металлопротеиназы. Кроме того, рост нервных окончаний не может происходить без параллельной стимуляции ангиогенеза в месте травмы и, соответственно, нуждается в индукторах неоваскуляризации, значительная часть которых поставляется мезенхимальными стволовыми клетками, привлечение которых в участок повреждения осуществляется, как теперь известно, с помощью хемокинов, в частности SDF-1α.
Таким образом, уже на основе теоретического анализа вопроса можно заключить, что на процесс регенерации нерва и восстановления периферической иннервации в участке повреждения стимулирующее воздействие может оказать локальное повышение продукции нейротрофических факторов, компонентов системы протеолиза и хемокинов.
Уровень техники
Одним из наиболее разработанных подходов к решению вопроса локального обеспечения определенных органов, тканей и их отдельных зон необходимыми полипептидными продуктами (гормонами, ферментами, ростовыми факторами и т.д.) является применение векторных конструкций, включающих гены, которые кодируют нужные белки, в данном случае ключевые факторы, стимулирующие рост нервов и восстановление периферической иннервации.
Известны способы стимуляции восстановления периферической иннервации, предусматривающие введение пациенту последовательности, кодирующей BDNF, в составе адено- и аденоассоциированных вирусов, а также в виде лентивирусных конструкций [2].
В отношении урокиназы известно только, что она необходима для восстановления поврежденного периферического нерва [3], а астроциты, трансфицированные плазмидой, кодирующий uPA, стимулируют рост аксонов in vitro [4]. Однако влияние плазмидных конструкций, экспрессирующих uPA, на регенерацию периферического нерва до настоящего времени не исследовалось.
Об использовании для восстановления периферической иннервации генетических конструкций, содержащих ген SDF-1α, данных в литературе не имеется.
Что касается попыток осуществить котрансформацию области нарушения периферической иннервации сразу двумя или более векторами, экспрессирующими различные необходимые для регенерации факторы, в частности из группы, включающей BDNF, uPA и SDF-1α, то информация о такого рода экспериментах в литературе также не представлена.
В силу указанных выше причин наиболее близким аналогом предлагаемого изобретения можно считать работу Alrashdan [5], где описан способ регенерации периферического нерва после травмы, в основе которого лежит стимуляция процесса путем инъекции в область нарушения иннервации аденовирусной конструкции, содержащей ген BDNF (BDNF-Ad), с целью локального повышения содержания данного клеточного фактора, участвующего в восстановлении нервных клеток. При этом кроме того, что использование рекомбинантных вирусов для трансфекции не может считаться абсолютно безопасным, предложенное использование конструкции BDNF-Ad оказалось ещё и недостаточно эффективным: период восстановления иннервации, по оценкам авторов, составлял примерно 3 недели.
В связи с этим нами была предпринята попытка усовершенствовать способ стимуляции восстановления периферической иннервации с помощью метода рекомбинантных ДНК в направлении повышения его эффективности.
Раскрытие изобретения
При разработке настоящего изобретения во внимание были приняты следующие факты.
Первое. Для успешной стимуляции роста и восстановления периферического нерва требуется поддержка выживания и регенерации нейронов, а также регуляция направления роста аксонов. Данную функцию выполняют нейротрофические факторы, такие как BDNF, глиальный фактор роста (GDNF) и фактор роста нервов (NGF). Кроме того, для успешной регенерации периферического нерва необходима проходимость эндоневральных каналов, которая обеспечивается системой активаторов плазминогена, в том числе урокиназы (uPA), а также матриксными металлопротеиназами. Рост нервных окончаний также требует параллельной стимуляции ангиогенеза в месте травмы. Наиболее активными стимуляторами ангиогенеза являются мезенхимальные стволовые клетки, поэтому привлечение этих клеток в участок повреждения с помощью хемокинов, таких как SDF-1α, также способствует активации процессов репарации нервов. Соответственно, можно заключить, что стимуляции роста нервных окончаний и восстановления нервов с высокой степенью вероятности можно достичь, обеспечив долговременную продукцию нейротрофических факторов и/или протеаз, и/или хемоаттрактантов для МСК в участке повреждения.
Второе. Известно, что долговременная продукция нейротрофических факторов может быть обеспечена путем введения в поврежденную ткань генно-инженерных конструкций, содержащих кДНК этих белков. Ранее в нашей лаборатории было показано, что плазмидные конструкции с кДНК uPA дикого типа (без внесения них дополнительных модификаций) обеспечивают достаточно эффективную продукцию этого белка в поврежденных скелетных мышцах [6]. В отношении последовательностей человеческого BDNF и SDF-1 следует иметь в виду, что кодирующие их последовательности отличаются высоким содержанием т.н. «редких триплетов», что может негативно влиять на эффективность их экспрессии. Благодаря вырожденности генетического кода такие триплеты могут быть заменены на те, которые встречаются в генах человека наиболее часто, без изменения кодируемой аминокислотной последовательности, что в данной ситуации представляется целесообразным.
Известно также, что уровень продукции целевых белков напрямую зависит от эффективности способа введения в ткань плазмидных конструкций. В настоящее время существует множество подходов, позволяющих повысить кпд трансфекции. При этом следует иметь в виду, что для мышечной ткани наиболее подходящим подходом считается электропорация. Учитывая перечисленные факты, добиться повышения эффективности экспрессии стимуляторов роста нервов в участках повреждения можно, во-первых, путем оптимизации последовательностей кДНК, а также с помощью подбора эффективного метода введения плазмидных конструкций в клетки поврежденной мышцы.
Третье. Как уже было отмечено выше, для успешной регенерации периферического нерва необходимо одновременно стимулировать несколько процессов, обеспечивающих его трофику, миграцию окончаний аксонов и кровоснабжение поврежденного нерва. Эти процессы в природе регулируют несколько факторов, стимулирующих различные механизмы регенерации. Соответственно, эффективным способом стимуляции восстановления периферической иннервации с высокой вероятностью могло бы быть применение сочетания плазмидных конструкций, кодирующих белковые факторы, оказывающие разноплановое действие на регенерацию нерва.
С учетом этого решение поставленной задачи предполагало:
а) создание плазмидных конструкций, включающих ген урокиназы (uPA), а также оптимизированные последовательности кДНК мозгового нейротрофического фактора (BDNF) и стромального фактора (SDF-1α);
б) выбор плазмидных конструкций, наиболее эффективно экспрессиирующих трансгены;
в) подбор оптимального режима трансфекции мышц, иннервируемых поврежденным нервом, полученными плазмидными конструкциями;
г) оценка эффективности экспрессии и биологической активности плазмидных конструкций, выбранных на стадии «б» in vivo; и
д) определение результата введения плазмидных конструкций, выбранных на стадии «б», и их сочетаний на скорость восстановления периферического нерва после травмы.
При осуществлении изобретения впервые были сконструированы (пример 1) рекомбинантные плазмиды, содержащие оптимизированные последовательности кДНК (BDNFopt с SEQ ID NO:1, приведенной на фиг.1) и стромального фактора человека (SDF-1opt с SEQ ID NO:2, приведенной на фиг.2). При этом наилучшие результаты были получены при использовании в качестве вектора плазмиды pVax1 (#V260-20, Invitrogen), однако для клонирования могут быть использованы и другие плазмидные векторы, для которых характерна высококопийная репликация в E. coli и высокий уровень экспрессии клонируемого гена в клетках млекопитающих.
В результате исследования экспрессии полученных плазмидных конструкций было показано, что через 48 часов после трансфекции клеток наблюдается секреция соответствующих белков в среду культивирования. Благодаря включению оптимизированных нуклеотидных последовательностей применение плазмидных конструкций для экспрессии BDNF и SDF-1α человека позволило достичь повышения продукции целевых белков примерно в 2 и 1,5 раза, соответственно (пример 1). На основании полученных данных в дальнейших экспериментах нами были использованы плазмидные конструкции, несущие ген дикого типа uPA(pVax1-uPA) и оптимизированные последовательности BDNF(pVax1-BDNFopt) и SDF-1α (pVax1-SDF1opt) человека.
Применение электропорации после инъекции рекомбинантных плазмид в иннервируемую поврежденным нервом мышечную ткань и отработка оптимальных условий её осуществления, в частности выбор оптимального интервала значений напряжения (100-175 В/см), позволили существенно повысить эффективность способа по изобретению.
На адекватной животной модели было получено экспериментальное подтверждение того, что все сконструированные плазмидные конструкции после введения их в мышечную ткань обеспечивают in vivo продукцию активных целевых белков (примеры 2 и 3), а две из них (pVax1-uPA и pVax1-BDNFopt) существенно ускоряют восстановление структуры и проводимости поврежденного нерва (пример 4).
Впервые при восстановлении нарушенной периферической иннервации были применены различные сочетания плазмидных конструкций по изобретению. При этом было установлено, что комбинация (1:1 по весу кДНК) плазмид pVax1-BDNFopt + pVax1-uPA обеспечивает дополнительное 1,5 -2-кратное (в сравнении с экспрессией только BDNF или uPA) ускорение восстановления проводимости и структуры нерва, а следовательно, и иннервации соответствующих скелетных мышц. Аналогичный эффект наблюдался и при использовании комбинации (1:1) плазмид pVax1-BDNFopt + pVax1-SDF1-opt.
Таким образом, в результате создания настоящего изобретения разработан способ стимулирования регенерации периферических нервов после травмы, сущность которого состоит в том, что в мышцу, иннервируемую поврежденным нервом, вводят терапевтически эффективное количество
(а) плазмидного вектора, содержащего оптимизированную нуклеотидную последовательность SEQ ID NO:1, кодирующую BDNF , или
(б) плазмидного вектора, содержащего нуклеотидную последовательность, кодирующую человеческую uPA дикого типа (NM_002658), или
(в) комбинации (1:1) рекомбинантных плазмид , охарактеризованных в (а) и (б), или
(г) комбинации (1:1) рекомбинантной плазмиды, охарактеризованной в (а) с плазмидным вектором, содержащим оптимизированную нуклеотидную последовательность SEQ ID NO:2, кодирующую фактор стромальных клеток SDF-1, а после введения плазмидной ДНК в области инъекции дополнительно проводят процедуру электропорации.
При этом основным техническим результатом является повышение эффективности способа: при использовании по существу одной и той же модели травматизации перферического нерва период восстановления основных показателей иннервации ткани сократился в сравнении с прототипом до одной недели, т.е. примерно втрое. Дополнительным результатом данного способа следует считать отказ от применения небезопасных аденовирусных конструкций.
Краткое описание рисунков
Фиг.1. Результат оптимизации последовательности BDNF человека - SEQ ID NO:1.
Фиг. 2. Результат оптимизации последовательности SDF-1α человека - SEQ ID NO:2.
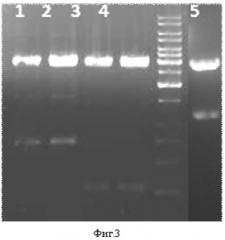
Фиг.3. Электрофорез продуктов рестрикции плазмид, содержащих кДНК uPA и оптимизированные кДНК BDNF и SDF-1α человека, эндонуклеазами EcoRI и EcoRV. 1 - природная кДНК BDNF; 2 - оптимизированная кДНК BDNF; 3- природная кДНК SDF-1α; 4 - оптимизированная кДНК SDF-1α; 5- кДНК uPA.
Фиг 4. Анализ эффективности трансфекции скелетных мышц плазмидой, кодирующей бета-галактозидазу. А. - без элетропорации; Б. - в сочетании с электропорацией.
Фиг.5. Анализ отрастания нейритов под действием кондиционированной среды эксплантов мышцы мыши. А., Б. - Репрезентативные изображения спинальных ганглиев через 7 дней инкубации в кондиционированной среде эксплантов мышц, трансфицированных «пустой плазмидой» pVAX1 (А.) или pVAX1-BDNFopt (Б.). В. - результаты морфометрического анализа длины нейритов через 3 и 7 дней инкубации в кондиционированных средах.
Фиг.6. Анализ активности урокиназы в кондиционированной среде эксплантов трансфицированной pVAX1-uPA мышцы мыши.
Фиг.7. Восстановление функции мышц-разгибателей стопы.
Фиг.8. Результаты морфометрического анализа количества аксонов на срезе поврежденного нерва. Количество аксонов оценивали с помощью окрашивания кроличьими антителами к цитоскелету аксонов, белку NF200.
Фиг.9. Восстановление проводимости нерва. А. - восстановление латентного периода, Б. - восстановление амплитуды СПДН.
Осуществление изобретения
При осуществлении изобретения помимо методов, подробно раскрытых в нижеследующих примерах, были использованы стандартные технологии генной инженерии, а также опубликованные нами ранее методики выделения и культивирования мезенхимальных стволовых клеток (МСК) из жировой ткани.
Пример 1. Создание плазмидных конструкций, кодирующих BDNF, uPA или SDF-1α человека
Создание плазмидных конструкций, кодирующих кДНК uPA, оптимизированные кДНК BDNF или SDF-1α человека
Синтез кДНК uPA человека осуществляли с помощью прямого химического синтеза фрагментов в соответствии с последовательностью, опубликованной в базе данных NCBI (http://www.ncbi.nlm.nih.gov, ref.#NM_002658) и последующей их сборки. Идентичность полученной последовательности и опубликованной последовательности определяли с помощью секвенирования.
Первоначально кДНК BDNF человека получали с помощью прямого химического синтеза фрагментов в соответствии с последовательностью, опубликованной в базе данных NCBI (http://www.ncbi.nlm.nih.gov), с заменами С→Т в позиции 271 и Т→С в позиции 718, не вызывающих изменений аминокислотных остатков. кДНК BDNF человека получали с помощью прямого химического синтеза фрагментов и последующей их сборки. Идентичность полученной последовательности - опубликованной определяли с помощью секвенирования.
Дизайн оптимизированной последовательности нуклеотидов, кодирующей BDNF человека, производили следующим образом. Используя частоты встречаемости кодонов, приведенные на вэб-сайте http://de1.mediaglyphs.org/mg/bf/nucs_aa.html, среди триплетов нуклеотидов, кодирующих аминокислоты белковой последовательности природной кДНК BDNF, выявляли такие, которые встречаются в генах человека наиболее редко. Выявленные редкие триплеты, а также соседние с ними триплеты меняли на триплеты, кодирующие те же аминокислоты, но при этом встречающиеся в генах человека наиболее часто. Полученная «оптимизированная» последовательность нуклеотидов, кодирующая BDNF, представлена на фиг. 1. Эту последовательность также получали с помощью прямого химического синтеза фрагментов и последующей их сборки. Идентичность полученной последовательности ожидаемой определяли с помощью секвенирования.
Первоначально кДНК SDF-1α человека получали с помощью прямого химического синтеза фрагментов в соответствии с последовательностью, опубликованной в базе данных NCBI (http://www.ncbi.nlm.nih.gov, NM_199168), и последующей их сборки. Идентичность полученной последовательности опубликованной определяли с помощью секвенирования.
Дизайн оптимизированной последовательности нуклеотидов, кодирующей SDF-1α человека, производили описанным выше образом, использованным для получения оптимизированной последовательности кДНК BDNF человека. Идентичность полученной последовательности расчетной определяли с помощью секвенирования. Полученная последовательность нуклеотидов представлена на фиг. 2.
Для клонирования в экспрессионный вектор природных и оптимизированных кДНК, которые были получены в результате синтеза, к их 5`- и 3`-концам добавляли последовательности, распознаваемые эндонуклеазами EcoRI и EcoRV (5`-GAATTC-3` и 5`-GATATC-3`, соответственно). В данном примере в качестве вектора использовали плазмиду pVax1 (#V260-20, Invitrogen), однако для клонирования могли быть использованы и другие плазмидные векторы, для которых характерна высококопийная репликация в E. coli и высокий уровень экспрессии клонируемого гена в клетках млекопитающих.
Полученные синтетические олигонуклеотидные последовательности и плазмиду pVax1 подвергали рестрикции эндонуклеазами EcoRI и EcoRV (#R010 и # R0195, New England Biolabs) в буфере рестрикции 3 (#B7003S, New England Biolabs), очистке и последующему лигированию.
Полученные плазмиды pVax1-BDNF, pVax1-BDNFopt, pVax1-uPA, pVax1-SDF1 и pVax1-SDF1opt наращивали в E. coli и очищали с помощью набора Qiagen (EndoFree Plasmid Giga Kit, кат. № 12391). Плазмидные ДНК были проанализированы электрофорезом в 1,5 %-ном агарозном геле. Наличие в плазмидах фрагментов, соответствующих по размерам кДНК BDNF, uPA или SDF-1α, подтверждали с помощью рестрикции плазмидных конструкций эндонуклеазами EcoRI и EcoRV (#R010 и # R0195, New England Biolabs) в буфере рестрикции 3 (#B7003S, New England Biolabs) (фиг.3).
Анализ эффективности полученных плазмидных конструкций, кодирующих природные или оптимизированные кДНК BDNF, uPA или SDF-1alpha человека
Клетки HEK293, высеянные в лунки 24-луночной плашки (50000 клеток на лунку) в среде DMEM, содержащей 2% эмбриональной телячьей сыворотки, трансфицировали плазмидами pVax1-BDNF, pVax1-BDNFopt, pVax1-uPA, pVax1-SDF1 или pVax1-SDF1opt. Трансфекцию проводили с использованием по 1 мкг одной из плазмидных ДНК и по 1 мкл реагента Липофектамин 2000 (Invitrogen) в соответствии с протоколом производителя. Через 24ч после трансфекции культуральную среду заменяли на свежую. Концентрацию BDNF, uPA или SDF-1α в среде анализировали через следующие 48 часов культивирования.
Концентрацию uPA в культуральной среде измеряли при помощи набора для иммуноферментного анализа (CSI19849A, Cell Sciences, США) в соответствии с протоколом производителя. Согласно этим измерениям концентрация uPA в культуральной среде составляла примерно 12 нг белка на 1 млн клеток.
Концентрацию BDNF в культуральной среде измеряли при помощи набора «ChemikineTM BDNF ELISA Kit»(Millipore, США) в соответствии с протоколом производителя. Согласно этим измерениям продукция BDNF в культуральную среду клеток, трансфицированных плазмидой, несущей природную кДНК, составляла не более 210 пг белка на 1 млн клеток. При использовании плазмиды, кодирующей оптимизированную кДНК, концентрация BDNF в культуральной среде составляла около 395 пг белка на 1 млн клеток. При использовании плазмиды с оптимизированной кДНК выход целевого белка увеличивается примерно в 2 раза по сравнению с использованием плазмиды с природным геном, что свидетельствует о высокой эффективности плазмиды pVax1-BDNFopt, несущей модифицированную кДНК (BDNFopt).
Концентрацию SDF-1α в культуральной среде измеряли при помощи набора для иммуноферментного анализа (кат. №DSA00, R&DSystems, США) в соответствии с протоколом производителя. Согласно этим измерениям концентрация SDF-1α в культуральной среде клеток, трансфицированных плазмидой, несущей природную кДНК составляла не более 5,5 нг белка на 1 млн клеток. При использовании плазмиды, кодирующей оптимизированную кДНК, концентрация SDF-1α в культуральной среде составляла около 7,6 нг белка на 1 млн клеток. При использовании плазмиды с оптимизированной кДНК выход целевого белка увеличивается примерно в 1,5 раза по сравнению с использованием плазмиды с природным геном, что свидетельствует о высокой эффективности плазмиды pVax1-SDF-1opt, несущей модифицированную кДНК(SDF-1αopt).
Поскольку при использовании плазмид, несущих оптимизированные последовательности кДНК BDNF и SDF-1α, был достигнут наибольший выход целевых белков, то именно эти конструкции были использованы в последующем для стимуляции восстановления периферических нервов.
Пример 2
Подбор оптимального метода введения плазмидных конструкций в зону поражения
Анализ влияния электропорации на эффективность трансфекции скелетных мышц
Эффективность введения плазмидных конструкций во многом определяет их терапевтический эффект на регенерацию нерва. Поэтому нами был проведен подбор метода введения плазмидных конструкций в мышцу, иннервируемую поврежденным нервом.
Для этого была использована контрольная плазмидная конструкция, несущая ген β-галактозидазы. Эксперименты проводили на самцах мышей гибридов F1 линий CBA/C57Bl6 в возрасте 8-9 недель.
Готовили раствор плазмиды с концентрацией ДНК 1 мг/мл на стерильном физиологическом растворе, затем 60 мкл полученного раствора инъецировали с помощью инсулинового шприца (BD) с толщиной иглы 29G в 3-5 участков передней большеберцовой мышцы мыши.
Для повышения эффективности трансфекции в течение 20-30 секунд после инъекции генетической конструкции на кожу по обе стороны от передней большеберцовой мышцы накладывали электроды, смазанные для большей электропроводности Униагелем (Гельтек, Россия). На электроды подавали 6 импульсов электрического тока с напряжением от 75 до 175 В/см, длительностью 20 мкс и частотой 1 Гц. После третьего импульса полярность меняли. Количество мышечных волокон, экспрессирующих бета-галактозидазу, и количество некротизированных волокон оценивали через 3 суток после трансфекции.
Было обнаружено, что применение электропорации повышает эффективность трансфекции примерно в 2 раза. При этом оптимальным для трансфекции является применение электрического тока с напряжением в интервале от 100 до 175 В/см (фиг.4), а наиболее предпочтительными (с учетом минимальной доли некротизированных волокон) - значения, располагающиеся ближе к нижней из указанных границ интервала.
Оценка продукции целевых белков в трансфицированной мышце
Для оценки эффективности экспрессии pVax1-BDNFopt, pVax1-uPA, или pVax1-SDF1opt, переднюю большеберцовую мышцу мыши трансфицировали плазмидами так, как описано для плазмиды, содержащей ген бета-галактозидазы. Продукцию целевых белков оценивали с помощью иммуноферментного анализа.
Для этого через 3 суток после инъекции плазмид с последующей электропорацией у животных изымали передние большеберцовые мышцы, которые тщательно отмывали в нескольких сменах стерильного фосфатно-солевого буфера. После этого каждую мышцу рассекали на 3 части и помещали на чашку, покрытую Матригелем (BD). Экспланты культивировали в среде DMEM c 2% фетальной телячьей сыворотки. Через 3 суток анализировали содержание uPA, BDNF и SDF1 человека в кондиционированных средах эксплантов мышц мыши, как описано в примере 1. Концентрация BDNF составила примерно 2,6 нг/мл; концентрация uPA - 25 нг/мл, а концентрация SDF-1α - примерно 8 нг/мл.
Таким образом, мы показали, что эффективным способом введения pVax1-BDNFopt, pVax1-uPA, и pVax1-SDF1opt является инъекция этих плазмид в мышцы с последующей электропорацией, что позволяет достичь высокого уровня продукции целевых белков трансфицированными мышцами.
Пример 3
Анализ биологической активности плазмидных конструкций, кодирующих BDNF, uPA или SDF-1α человека
Оценка влияния кондиционированной среды эксплантов мышц, трансфицированных pVAX1-BDNFopt, на рост нейритов
Биологическую активность BDNF человека оценивали на модели отрастания нейритов от спинальных ганглиев. Для этого кондиционированную среду эксплантов мышцы, трансфицированной pVAX1-BDNFopt, подготавливали, как описано в примере 2.
Спинальные ганглии мыши в стерильных условиях извлекали на уровне грудных и поясничных позвонков спинного мозга с использованием манипуляционного стереомикроскопа Olympus SZX16 и светового блока KL1500LCD. Ганглии очищали от соединительнотканных оболочек, и каждый ганглий помещали в каплю Матригеля (Matrigel™) объёмом 60 мкл (BD, USA) в 8-луночные планшеты со стеклянным дном толщиной 0,1 мм. После полимеризации Матригеля в культуру добавляли среду RPMI1640 и кондиционированную среду эксплантов в соотношении 1:1. Визуализацию эксплантов осуществляли методом световой темнопольной микроскопии с использованием инвертированного микроскопа Zeiss модели Axiovert200 на 3-и и 7-е сутки. Количественный подсчёт длины нейритов и число клеток, мигрировавших в Матригель, осуществляли путём обработки полученных изображений с использованием программы MetaMorph6.0 (Meta Imaging Series, NIH, USA). На чертежах представлены данные 10-ти независимых экспериментов. Результаты представлены как среднее ± ошибка среднего. Данные считали статистически достоверными при p<0.05.
Было установлено, что через 3 суток культивирования длина нейритов ганглиев, культивируемых в кондиционированной среде эксплантов мышц, трансфицированных pVAX1-BDNFopt, была примерно в 1,5 раза больше по сравнению с ганглиями, культивируемыми в кондиционированной среде эксплантов мышц, трансфицированных плазмидой pVAX1, не несущей трансгена. Через 7 суток культивирования длина нейритов ганглиев, культивируемых в кондиционированной среде эксплантов мышц, трансфицированных pVAX1-BDNFopt, была примерно в 2 раза больше по сравнению с контрольными ганглиями (фиг.5). Это свидетельствует о биологической активности BDNF, продуцируемого мышцей, после трансфекции её pVAX1-BDNFopt.
Анализ активности урокиназы в кондиционированной среде эксплантов мышц, трансфицированных pVAX1-uPA с помощью зимографии
Биологическую активность uPA человека в кондиционированной среде эксплантов мышц, трансфицированных pVAX1-uPA, оценивали с помощью зимографии. Для этого кондиционированную среду эксплантов концентрировали и разделяли с помощью ДС-Na-ПААГ в невосстанавливающих условиях в 7.5% разделяющем геле, содержащем 1% молоко и 20 мкг/мл плазминогена. Гель последовательно инкубировали в буфере для ренатурации (Invitrogen) в течение 60 мин при +25°С и в проявляющем буфере (Invitrogen) 24 часа при +37°С. Для подавления активности металлопротеиназ в ренатурирующий и проявляющий буферы добавляли 5 mM ЭДТА. Гель окрашивали с помощью красителя GelCode Blue (Pierce).
Как следует из полученных данных (фиг.6), трансфекция мышцы pVAX1-uPA приводит к возрастанию в среде культивирования эксплантов активной урокиназы по сравнению с трансфекцией контрольной плазмидой.
Анализ миграции мезенхимальных стволовых клеток в ответ на кондиционированную среду эксплантов трансфицированной pVAX1-SDF-1opt мышцы мыши.
Биологическую активность SDF-1α оценивали с помощью анализа влияния кондиционированной среды эксплантов мышц, трансфицированных pVAX1-SDF-1opt на миграцию мезенхимальных стволовых клеток (МСК). Для этого использовали вставку Transwell® (Millipore, США) с мембраной, диаметр пор в которой составлял 8 мкм. Мембрану вставки перед экспериментом покрывали коллагеном I (0,1 мкг/мл) (Имтек, Россия). МСК в концентрации 5х104/мл помещали в верхнюю камеру вставки в 200 мкл среды RPMI1640, содержащей 0,1% FBS. В нижние камеры (в лунки 24-луночного планшета) помещали кондиционированную среду эксплантов скелетных мышц, трансфицированных pVAX1-SDF-1opt или контрольной плазмидой. Инкубировали 48 часов, после чего МСК, промигрировавшие на нижнюю сторону мембраны вставки, промывали PBS, фиксировали 4% формалином и окрашивали гематоксилином. На окрашенных мембранах осуществляли подсчёт количества клеток, число которых отражает влияние кондиционированной среды эксплантов скелетных мышц на миграцию МСК.
Было определено, что в контрольной среде на нижнюю сторону мембраны промигрировало не более 36 клеток (в поле зрения), тогда как в кондиционированной среде эксплантов мышц, трансфицированных pVAX1-SDF-1opt, на нижнюю сторону мембраны, примерно 180 клеток (в поле зрения).
Таким образом, удалось показать, что трансфекция мышц плазмидными конструкциями pVax1-BDNFopt, pVax1-uPA, и pVax1-SDF1opt приводит к продукции биологически активных целевых белков.
Пример 4
Влияние плазмид pVax1-BDNFopt, pVax1-uPA, и pVax1-SDF1opt и их комбинаций на восстановление периферического нерва и иннервации мышцы
В качестве модели для исследования процесса регенерации перферического нерва использовали мышь с повреждением общего малоберцового нерва, которое получали следующим образом. Гибридов F1 мышей линий CBA×C57Bl в возрасте 8-12 недель анастезировали инъекцией 2,5% авертина. После этого кожу на левой задней конечности очищали от шерсти и тщательно дезинфицировали спиртом. Выделенный общий малоберцовый нерв однократно раздавливали на уровне его перехода на латеральную головку икроножной мышцы при помощи пинцета с силиконовыми насадками на браншах шириной 1 мм в течение 20 секунд. Рану промывали стерильным физиологическим раствором и осуществляли гемостаз.
Сразу после этого в переднюю большеберцовую мышцу вводили по 60 мкг плазмидной ДНК pVax1, pVax1-BDNFopt, pVax1-uPA или pVax1-SDF1opt, как описано в Примере 2. Данная терапевтически эффективная концентрация была подобрана по результатам предварительных экспериментов.
Восстановление иннервации мышц оценивали через 1, 2, 4 и 7 суток по восстановлению функции мышц-разгибателей пальцев стопы. Восстановление функции мышц-разгибателей стопы анализировали с помощью измерения функционального индекса малоберцового нерва (PFI) согласно ранее опубликованному протоколу [7]. Для этого задние конечности мышей смазывали чернилами и мышей выпускали в туннель 6×50 см, позволяя им свободно бежать. Отпечатки следов сканировали, а их ширину и длину измеряли при помощи программы Metamorph 7.1. PFI вычисляли по формуле:
PFI = 174,9*(EPL-NPL)/NPL + 80,3*(ETS-NTS)/NTS - 13,4, где EPL и ETS - это соответственно длина и ширина следа, измеренные через 1, 2, 4, 7 дней после повреждения нерва, а NPL и NTS - соответственно длина и ширина отпечатка стопы, измеренные до его повреждения.
Для неповрежденного нерва PFI равен -13,4 усл.ед. На первый день после повреждения нерва значение PFI составляло около -140 усл.ед.
Было обнаружено, что уже через 2 суток у животных, которым была инъецирована pVax1-BDNFopt или pVax1-uPA, значение PFI было примерно в 2 раза выше, чем в контроле. У таких животных восстановление PFI до нормальных значений происходило уже к 7 дню после повреждения, тогда как в контроле полного восстановления не наблюдалось даже через 11 дней после повреждения (фиг. 7). При этом инъекция только pVax1-SDF1opt не вызывала значимой стимуляции восстановления иннервации.
Одновременная инъекция плазмиды, кодирующей нейротрофный фактор BDNF, и плазмиды для экспрессии uPA, а также использование комбинации плазмид pVax1-BDNFopt и pVax1-SDF1opt позволило достичь еще большего эффекта восстановления значений PFI через 2 суток после повреждения (PFI у таких животных был примерно в 1,2 раза выше, чем после инъекции плазмиды, кодирующей только BDNF или только uPA, и в 1,44 раза выше, чем после инъекции плазмиды кодирующей только SDF-1), что указывает на более быструю динамику восстановления иннервации по сравнению с контрольной плазмидой или инъекцией плазмид, кодирующих только один из перечисленных факторов.
Восстановление структурной целостности нерва оценивали с помощью иммуннофлуоресцентного окрашивания замороженных срезов поврежденных нервов. Для этого на 4 сутки после операции изолировали поврежденные участки нервов и фиксировали их 4% раствором формальдегида на фосфатном буфере. Срезы приготовляли из участка нерва, расположенного на 3 мм дистальнее места повреждения. Количество аксонов оценивали с помощью окрашивания кроличьими антителами к цитоскелету аксонов, белку NF200 (Abcam, ab8135). В качестве вторых антител использовали антитела против иммуноглобулинов кролика, конъюгированные с Alexa 488 (Invitrogen, Lot 702323). Окраску ядер производили при помощи 4-, 6-диамидино-2-фенилиндола (DAPI) (Molecular Probes). В качестве отрицательного контроля использовали кроличьи неспецифические IgG. Съемку изображений осуществляли с помощью микроскопа Leica6000, оборудованного CCD камерой (Leica Microsystems). Плотность окрашенных аксонов на площадь среза подсчитывали при помощи программы Metamorph 7.1.
Уже через 4 дня после повреждения у животных, которым были инъецированы pVax1-BDNFopt или pVax1-uPA, наблюдали примерно в 1,9 раза больше аксонов, содержащих NF200, по сравнению с нервами животных, которым вводили плазмиду pVax1, не содержащую трансгена (p<0,05; n=18). Инъекция сочетания плазмид pVax1-BDNFopt с pVax1-uPA приводила к еще лучшему восстановлению структуры нерва. Так, у животных, получивших указанное сочетание плазмид, количество аксонов было примерно в 1,3 раза больше, чем у животных, которым были инъецированы только pVax1-BDNFopt или только pVax1-uPA (Фиг. 8).
Однако введение плазмиды pVax1-SDF1opt не вызывало достоверного увеличения числа аксонов в поврежденном нерве. В то время как инъекция сочетания плазмид pVax1-BDNFopt с pVax1-SDF1opt приводила к восстановлению структуры нерва. Так, у животных, получивших указанное сочетание плазмид, количество аксонов было примерно в 1,3 раза больше, чем у животных, которым была инъецирована только pVax1-BDNFopt и в 2,3 раза больше, чем у животных, которым была инъецирована только pVax1-SDF1opt. Эти данные свидетельствуют о более быстром росте и лучшей выживаемости аксонов в поврежденных нервах животных, которым были инъецированы pVax1-BDNFopt, pVax1-uPA, комбинация pVax1-BDNFopt + pVax1-uPA или комбинация pVax1-BDNFopt + pVax1-SDF1opt.
Восстановление функции чувствительных нервных волокон оценивали с помощью вызванных потенциалов действия, регистрируемых с поверхностной веточки общего малоберцового нерва. Мышей умерщвляли передозировкой наркоза после оценки функции моторных волокон на 7-е сутки после операции. Седалищный нерв изолировали вместе с поверхностной веточкой общего малоберцового нерва. Стимуляцию нерва проводили в растворе Лайли для теплокровных животных (135,0 мМ NaCl, 4,0 мМ KCl, 2,2 мМ CaCl2, 1,0 мМ MgCl2, 0,9 мМ NaH2PO4, 16,3 мМ NaHCO3, 11,0 мМ D-глюкозы) на расстоянии 7-8 мм проксимальнее места повреждения (параметры стимуляции: частота - 1 Гц, продолжительность импульса- 0,05 мс и супрамаксимальная амплитуда 2,5 - 10 В) с использованием пары серебряных электродов (дистанция между электродами составляла 1,5 мм). Промежуток времени от забоя животного до момента регистрации вызванных потенциалов действия был стандартным - около 35-45 минут для каждого животного. Длительность латентного периода и величину амплитуды суммарного потенциала действия нерва (СПДН) регистрировали трехкратно для каждого нерва с использованием монополярного аспирирующего электрода, который располагался на 10 мм дистальнее места повреждения. Регистрирующий электрод был связан с АЦП Е14-140 (L-card) и персональным компьютером. Регистрацию и анализ данных осуществляли с помощью программы PowerGraph Professional 3.3.
Полученные данные анализировали следующим образом. Регистрируемый СПДН содержит два параметра, позволяющие судить о степени восстановления нерва: латентный период и амплитуду.
Латентный период - промежуток времени от момента стимуляции нерва до момента регистрации вызванного потенциала действия, измеряется в миллисекундах (мс). Исходя из опреде