Способ определения активности пируватдегидрогеназы (pdh) и среды визуализации для применения в указанном способе
Иллюстрации
Показать всеИзобретение относится к биохимии, в частности к определению активности пируватдегидрогеназного комплекса (PDH комплекса) путем 13C-МР обнаружения (магнитно-резонансного обнаружения на основе изотопа 13C). Сущность способа заключается в том, что определяют изменение активности PDH комплекса у подлежащего исследованию субъекта путем 13C-МР обнаружения (магнитно-резонансного обнаружения на основе изотопа 13C) с использованием среды визуализации, содержащей гиперполяризованный 13C-пируват и при обнаружении сигнала 13C-бикарбоната либо сигнала 13C-бикарбоната и сигнала 13C-пирувата, где указанный гиперполяризованный 13C-пируват выбран из группы, состоящей из гиперполяризованного 13С1-пирувата, 13C1,2-пирувата, 13C1,3-пирувата или 13C1,2,3-пирувата, или любой их комбинации, определяют активность PDH комплекса. Использование заявленного способа позволяет достоверно определить изменения активности PDH комплекса у подлежащего исследованию субъекта. 10 з.п. ф-лы, 7 ил., 5 пр.
Реферат
Изобретение относится к способу определения активности пируватдегидрогеназы (PDH) путем 13C-МР обнаружения (магнитно-резонансного обнаружения на основе изотопа 13C) с использованием сред визуализации, которые содержат гиперполяризованный 13C-пируват, и к средам визуализации для применения в указанном способе.
В тканях аденозинтрифосфат (АТФ) обеспечивает энергию для синтеза сложных молекул, а в мышцах для сокращения. АТФ образуется в результате метаболизма богатых энергией субстратов, таких как глюкоза или длинноцепочечные жирные кислоты. В окислительных тканях, таких как мышца, основная часть АТФ образуется из ацетил-CoA, который вступает в цикл лимонной кислоты, поэтому обеспечение ацетил-CoA является критической детерминантой продуцирования АТФ в окислительных тканях.
Ацетил-CoA продуцируется либо путем β-окисления жирных кислот, либо в результате метаболизма глюкозы посредством гликолитического биохимического пути. Ключевым регуляторным ферментом при регуляции скорости образования ацетил-CoA из глюкозы является пируватдегидрогеназа (PDH), которая катализирует окисление пирувата до ацетил-CoA и диоксида углерода при сопутствующем восстановлении никотинамидаденин-динуклеотида (NAD) до его восстановленной формы (NADH). Таким образом, PDH является ключевым ферментом в регуляции скорости окислительного гликолиза и регуляции равновесия между окислением углеводных и липидных источников энергии.
Недавно возобновлен интерес к структуре и функционированию комплекса PDH благодаря пониманию того, что измененная активность комплекса PDH является характерным признаком при многих заболеваниях человека в диапазоне от относительно нераспространенной первичной недостаточности PDH до основных причинных факторов заболеваемости и смертности, таких как диабет, истощение, сепсис и болезнь Альцгеймера.
PDH представляет собой внутримитохондриальный полиферментный комплекс, состоящий из множественных копий нескольких субъединиц, включая три ферментативных активности Е1, Е2 и Е3, необходимых для завершения преобразования пирувата в ацетил-CoA (Patel et al., FASEB J. 4, 1990, 3224-3233). Е1 катализирует необратимую потерю диоксида углерода из пирувата; Е2 образует ацетил-CoA, и Е3 восстанавливает NAD до NADH. С этим комплексом связаны две дополнительных ферментативных активности: специфичная киназа, которая способна к фосфорилированию Е1 по трем остаткам серина, и слабо связанная специфичная фосфатаза, которая вызывает обратное протекание реакции фосфорилирования. Фосфорилирование единственного остатка из трех остатков серина делает Е1 неактивным. Доля PDH в ее активном (дефосфорилированном) состоянии определяется равновесием между активностью киназы (PDH-киназы, PDHK) и фосфатазы. Активность киназы может регулироваться in vivo относительными концентрациями метаболических субстратов, таких как [NADH]/[NAD+],
[ацетил-CoA]/[СоА] и [АТР]/[аденозиндифосфат (АДФ)], а также доступностью самого пирувата.
Реакции PDH служат для взаимосвязи путей метаболизма гликолиза, глюконеогенеза и синтеза жирных кислот с циклом лимонной кислоты. Как следствие, активность PDH в высокой степени регулируется рядом аллостерических эффекторов и ковалентной модификацией.
При болезненных состояниях, таких как диабет типа 1 и типа 2, повышено окисление липидов при сопутствующем снижении утилизации глюкозы, которое вносит вклад в гипергликемию. Сниженная утилизация глюкозы при обоих типах диабета 1 и 2 ассоциирована со снижением активности PDH. Кроме того, дополнительным следствием сниженной активности PDH может быть то, что повышение концентрации пирувата приводит в результате к повышенной доступности лактата в качестве субстрата печеночного глюконеогенеза. Резонно ожидать, что повышение активности PDH может повысить скорость окисления глюкозы и, следовательно, общую утилизацию глюкозы в дополнение к сниженной выработке глюкозы в печени.
Другим фактором, вносящим вклад в сахарный диабет, является нарушенная секреция инсулина, которая, как показано, ассоциирована с пониженной активностью PDH в β-клетках поджелудочной железы (Zhou et al., Diabetes 45, 1996, 580-586).
Окисление глюкозы может давать больший выход АТФ на моль кислорода, чем окисление жирных кислот. В условиях, где потребность в энергии может превышать обеспечение энергии, таких как сердечная недостаточность и некоторые кардиомиопатии, ишемия миокарда, периферическое сосудистое заболевание (включая перемежающуюся хромоту), церебральная ишемия и реперфузия, мышечная слабость, гиперлипидемия, болезнь Альцгеймера и атеросклероз, можно ожидать, что сдвиг в равновесии утилизации субстрата в пользу метаболизма глюкозы за счет повышения активности PDH улучшит способность к поддержанию уровней АТФ и, следовательно, функции.
Как упомянуто выше, при диабетическом состоянии может быть полезна активация PDH посредством ингибирования глюконеогенеза и стимуляции расходования глюкозы в периферических тканях. Предварительные данные в подтверждение этого предположения были получены с использованием дихлорацетата (ДХА). Поиск новых низкомолекулярных ингибиторов PDHK, дающих возможность улучшенной эффективности и специфичности, идет в настоящее время на протяжении нескольких лет.
На основании вышесказанного очевидно, что определение активности PDH играет ключевую роль в диагностике некоторых расстройств и заболеваний. Кроме того, определение активности PDH является критическим при оценке ответа на лечение, например ответа на лечение лекарственными средствами, которые влияют на активность PDH, а именно повышают ее, а также при скрининге лекарственных средств, которые влияют на активность PDH.
Известны различные способы определения активности PDH, которые в целом могут быть разделены на тесты in vitro и in vivo.
В WO-A-2004/021000 раскрыты антитела, специфичные к PDH, которые могут быть использованы для иммунопреципитации PDH из образца от пациента в активном состоянии. Количество и/или активное состояние PDH может быть определено in vitro в иммунологическом анализе.
Тесты на активность PDH in vitro дополнительно раскрыты в WO-A-99/62506. Эти анализы представляют собой либо анализы in vitro с выделенными ферментами, которые включают подготовки, требующие затрат времени, такие как выделение посредством полимеразной цепной реакции (ПЦР) и клонирование PDH-киназы, либо клеточные анализы, которые требуют выделения первичных клеток.
Активность PDH in vivo может быть определена в анализе ex vivo путем извлечения образцов ткани (например, мышечной ткани или печеночной ткани), которые экстрагируют, как описано в WO-A-99/62506. Часть экстракта обрабатывают PDH-фосфатазой, полученной из свиных сердец, и активность необработанного образца сравнивают с активностью дефосфорилированного образца, полученного таким образом Stansbie et al., Biochem. J. 154 (1976), 225.
Следовательно, существует необходимость в новых и усовершенствованных способах определения активности PDH, особенно активности PDH in vivo.
В настоящее время обнаружено, что гиперполяризованный 13C-пируват может быть использован в качестве агента для определения активности PDH in vivo и in vitro путем использования 13C-МР обнаружения.
Как упомянуто выше, пируват является предшественником в цикле лимонной кислоты, и PDH катализирует окисление пирувата до ацетил-CoA и диоксида углерода (CO2), который находится в быстром равновесии с бикарбонатом (HCO3 -).
Обнаружено, что метаболическое преобразование гиперполяризованного 13C-пирувата в его метаболит гиперполяризованный 13C-лактат, гиперполяризованный 13C-бикарбонат (только в случае 13C1пирувата, 13C1,2-пирувата, 13C1,3-пирувата или 13C1,2,3-пирувата) и гиперполяризованный 13C-аланин можно использовать для исследования метаболических процессов в организме человека и животного, отличного от человека, используя МР. 13C1-пируват имеет T1 релаксации (время релаксации) в цельной крови человека при 37°C примерно 42 с, однако обнаружено, что преобразование гиперполяризованного 13C-пирувата в гиперполяризованный 13C-лактат, гиперполяризованный 13C-бикарбонат и гиперполяризованный 13C-аланин является достаточно быстрым, чтобы дать возможность обнаружения сигнала исходного соединения 13C-пирувата и его метаболитов. Количество аланина, бикарбоната и лактата зависит от метаболического статуса ткани при исследовании. Интенсивность МР-сигнала гиперполяризованного 13C-лактата, гиперполяризованного 13C-бикарбоната и гиперполяризованного 13C-аланина связана с количеством этих соединений и степенью поляризации, остающейся в момент обнаружения, следовательно, путем мониторинга преобразования гиперполяризованного 13C-пирувата в гиперполяризованный 13C-лактат, гиперполяризованный 13C-бикарбонат и гиперполяризованный 13C-аланин возможно исследовать метаболические процессы in vivo в организме человека или животного, отличного от человека, путем использования неинвазивной МР-визуализации или МР-спектроскопии.
Кроме того, обнаружено, что амплитуды МР-сигнала, возникающего от различных метаболитов пирувата, варьируют в зависимости от типа ткани. Уникальная картина метаболического пика, образуемого аланином, лактатом, бикарбонатом и пируватом, может быть использована в качестве характерного признака метаболического состояния исследуемой ткани и, таким образом, дает возможность отличить здоровую ткань от опухолевой ткани. Использование гиперполяризованного 13C-пирувата для визуализации опухоли, где опухолевая ткань проявляет высокую метаболическую активность, подробно описано в WO-A-2006/011810.
Кроме того, использование гиперполяризованного 13C-пирувата для визуализации сердца описано в WO-A-2006/054903.
Таким образом, в первом аспекте изобретения предложен способ определения активности PDH путем 13C-МР обнаружения с использованием среды визуализации, содержащей гиперполяризованный 13C-пируват, при котором обнаруживают сигнал 13C-бикарбоната и возможно 13C-пирувата.
Термин "определение активности PDH" означает исходное измерение активности PDH, включая измерение исходной скорости и определение константы скорости.
Термин "13C-МР обнаружение" означает 13C-МР визуализацию или 13C-МР спектроскопию либо комбинированную 13C-МР визуализацию и 13C-МР спектроскопию, то есть 13C-МР спектроскопическую визуализацию. Этот термин дополнительно означает 13C-МР спектроскопическую визуализацию в различные моменты времени.
Термин "среда визуализации" означает жидкую композицию, содержащую гиперполяризованный 13C-пируват в качестве МР-активного агента, то есть агента визуализации.
Среду визуализации, используемую в способе по изобретению, можно использовать в качестве среды визуализации для 13C-МР обнаружения in vivo, то есть у живых людей и животных, отличных от людей. Кроме того, среду визуализации, используемую в способе по изобретению, можно использовать в качестве среды визуализации для 13C-МР обнаружения in vitro, например, в клеточных культурах образцов организма, таких как кровь или цереброспинальная жидкость, ткань ех vivo, например ткань ех vivo, полученная в результате биопсии, или изолированные органы, все из которых имеют происхождение из организма человека или животного, отличного от человека.
Термин "13C-пируват" означает соль 13C-пировиноградной кислоты, которая является обогащенной изотопом 13C, то есть в которой количество изотопа 13C выше, чем его природное относительное содержание.
Изотопное обогащение гиперполяризованного 13C-пирувата, используемого в способе по изобретению, предпочтительно составляет по меньшей мере 75%, более предпочтительно по меньшей мере 80% и особенно предпочтительно по меньшей мере 90%, причем наиболее предпочтительно изотопное обогащение более 90%. Идеально, изотопное обогащение составляет 100%. 13C-пируват, используемый в способе по изобретению, должен быть обогащен изотопом по меньшей мере по С1-положению (далее обозначен как 13C1-пируват), поскольку именно C1-атом пирувата составляет часть диоксида углерода (и, следовательно, бикарбоната), образованного в результате PDH-катализируемого окисления пирувата. Кроме того, 13C-пируват, используемый в способе по изобретению, может быть обогащен изотопом по С1- и С2-положению (далее обозначен как 13C1,2-пируват), по С1- и С3-положению (далее обозначен как 13C1,3-пируват) или по С1-, С2- и С3-положению (далее обозначен как 13C1,2,3-пируват). Изотопное обогащение только по С1-положению предпочтительно, поскольку 13C1-пируват легко доступен и имеет благоприятно высокое время релаксации T1 в цельной крови человека при 37°C (примерно 42 с).
Термины "гиперполяризованный" и "поляризованный" здесь далее используют взаимозаменяемо и обозначают ими уровень ядерной поляризации свыше 0,1%, более предпочтительно свыше 1% и наиболее предпочтительно свыше 10%.
Уровень поляризации можно, например, определить путем измерений 13C-ЯМР твердого состояния в твердом гиперполяризованном 13C-пирувате, например в твердом гиперполяризованном 13C-пирувате, полученном путем динамической поляризации ядер (ДПЯ) 13C-пирувата. Измерение 13C-ЯМР твердого состояния предпочтительно состоит в записи ЯМР с простой импульсной последовательностью с использованием низкого угла отклонения вектора намагниченности. Интенсивность сигнала гиперполяризованного 13C-пирувата в ЯМР-спектре сравнивают с интенсивностью сигнала 13C-пирувата в ЯМР-спектре, снятом до процесса поляризации. Затем уровень поляризации вычисляют из отношения интенсивностей сигнала до и после поляризации.
Подобным образом, уровень поляризации для растворенного гиперполяризованного 13C-пирувата можно определить путем измерений ЯМР жидкого состояния. Снова интенсивность сигнала растворенного гиперполяризованного 13C-пирувата сравнивают с интенсивностью сигнала сравнительного образца известной композиции, например жидкой пировиноградной кислоты или пирувата натрия, растворенных в водном растворе. Затем уровень поляризации вычисляют из отношения интегралов сигнала гиперполяризованного 13C-пирувата и известного сравнительного образца, возможно скорректированного на относительные концентрации. Поляризацию можно также определить путем сравнения с сигналом термического равновесия того же образца 13C-пирувата после затухания гиперполяризации.
Гиперполяризация ЯМР активных 13C-ядер может быть достигнута различными способами, которые, например, описаны в WO-A-98/30918, WO-A-99/24080 и WO-A-99/35508, которые включены в данную заявку посредством ссылки, и способы гиперполяризации представляют собой перенос поляризации из инертного газа, "поляризацию накачкой", поляризацию охлаждением спинов, параводородный способ и динамическую поляризацию ядер (ДПЯ).
Для получения гиперполяризованного 13C-пирувата предпочтительно либо поляризовать 13C-пируват непосредственно, либо поляризовать 13C-пировиноградную кислоту и преобразовать поляризованную 13C-пировиноградную кислоту в поляризованный 13C-пируват, например, путем нейтрализации основанием.
Одним из подходящих путей получения гиперполяризованного 13C-пирувата является перенос поляризации из гиперполяризованного инертного газа, который описан в WO-A-98/30918. Инертные газы, имеющие ненулевой ядерный спин, можно подвергать гиперполяризации путем использования света с круговой поляризацией. Гиперполяризованный инертный газ, предпочтительно Не или Хе, или смесь таких газов можно использовать для осуществления гиперполяризации 13C-ядер. Гиперполяризованный газ может находиться в газовой фазе, либо он может быть растворен в жидкости/растворителе, либо сам гиперполяризованный газ может служить в качестве растворителя. Альтернативно, газ можно конденсировать на охлажденной твердой поверхности и использовать в этой форме, либо дать возможность его сублимации. Предпочтительно тщательное смешивание гиперполяризованного газа с 13C-пируватом или 13C-пировиноградной кислотой. Следовательно, если поляризуют 13C-пировиноградную кислоту, которая является жидкой при комнатной температуре, гиперполяризованный газ предпочтительно растворяют в жидкости/растворителе, либо она служит в качестве растворителя. Если поляризуют 13C-пируват, гиперполяризованный газ предпочтительно растворяют в жидкости/растворителе, который также растворяет пируват.
Другой подходящий путь для получения гиперполяризованного 13C-пирувата состоит в том, что поляризацию придают 13C-ядрам путем термодинамического равновесия при очень низкой температуре и сильном поле. Гиперполяризацию по сравнению с рабочим полем и температурой ЯМР-спектрометра осуществляют путем использования очень сильного поля и очень низкой температуры (поляризации накачкой). Используемая сила магнитного поля должна быть насколько возможно высокой, соответственно, выше 1 Т, предпочтительно выше 5 Т, более предпочтительно выше 15 Т или еще более и особенно предпочтительно 20 Т или более. Температура должна быть очень низкой, например 4,2 К или менее, предпочтительно 1,5 К или менее, более предпочтительно 1,0 К или менее, особенно предпочтительно 100 мК или менее.
Другим подходящим путем получения гиперполяризованного 13C-пирувата является способ поляризации охлаждением спинов. Этот способ охватывает поляризацию ядерных спинов твердого соединения или системы путем охлаждения. В систему вводят подходящие кристаллические парамагнитные вещества, такие как ионы Ni2+, лантаноида или актиноида с осью симметрии порядка трех или более, или тщательно смешивают с ними. Оборудование является более простым, чем необходимо для ДПЯ, без необходимости в однородном магнитном поле, поскольку поле возбуждения резонанса не прилагают. Этот процесс проводят путем физического вращения образца вокруг оси, перпендикулярной направлению магнитного поля. Предпосылка данного способа состоит в том, что парамагнитные частицы обладают высоким анизотропным g-фактором. В результате вращения образца электронный парамагнитный резонанс вступит в контакт с ядерными спинами, приводя к снижению температуры ядерных спинов. Вращение образца проводят до тех пор, пока поляризация ядерных спинов не достигнет нового равновесия.
В предпочтительном воплощении для получения гиперполяризованного 13C-пирувата используют ДПЯ (динамическую поляризацию ядер). При ДПЯ на поляризацию МР активных ядер в соединении, которое должно быть поляризовано, воздействует агент поляризации или так называемый ДПЯ-агент, соединение, содержащее неспаренные электроны. В процессе ДПЯ обеспечивают энергию, обычно в форме микроволнового излучения, которая исходно возбуждает ДПЯ-агент. При распаде до основного состояния происходит перенос поляризации от неспаренного электрона ДПЯ-агента на ЯМР активные ядра соединения, которое должно быть поляризовано, например на ядра 13C в 13C-пирувате. Как правило, в процессе ДПЯ используют среднее или сильное магнитное поле и очень низкую температуру, например, путем проведения процесса ДПЯ в жидком гелии и в магнитном поле примерно 1 Т или выше. Альтернативно, можно использовать среднее магнитное поле и любую температуру, при которой достигается достаточное усиление поляризации. Методика ДПЯ дополнительно описана, например, в WO-A-98/58272 и в WO-A-01/96895, оба документа включены в данную заявку посредством ссылки.
Для поляризации соединения способом ДПЯ готовят смесь соединения, которое должно быть поляризовано, и ДПЯ-агента ("образец"), которую либо замораживают и вносят в ДПЯ-поляризатор для поляризации, либо вносят в ДПЯ-поляризатор в виде жидкости, и она замерзает внутри указанного поляризатора вследствие очень низкой окружающей температуры. После поляризации замороженный твердый гиперполяризованный образец быстро переводят в жидкое состояние либо путем оттаивания, либо путем растворения его в подходящей среде растворения. Растворение является предпочтительным, и процесс растворения замороженного гиперполяризованного образца и подходящие устройства, таким образом, подробно описаны в WO-A-02/37132. Процесс оттаивания и подходящие устройства для оттаивания описаны, например, в WO-A-02/36005.
С целью получения высокого уровня поляризации в соединении, которое должно быть поляризовано, указанное соединение и ДПЯ-агент необходимо привести в тесный контакт во время процесса ДПЯ. Недопустимо, чтобы образец кристаллизовался при замораживании или охлаждении. Во избежание кристаллизации либо необходимо, чтобы в образце присутствовали стеклообразователи, либо для поляризации необходимо выбирать соединения, которые не кристаллизуются при замораживании, но вероятнее образуют стекловидное вещество.
Как упомянуто выше, 13C-пировиноградная кислота или 13C-пируват являются подходящими исходными веществами для получения гиперполяризованного 13C-пирувата.
Обогащенный изотопами 13C-пируват имеется в продаже, например, в виде 13C-пирувата натрия. Альтернативно, его можно синтезировать, как описано S.Anker, J. Biol. Chem 176, 1948, 133-1335.
В данной области техники известно несколько способов синтеза 13C1-пировиноградной кислоты. Вкратце, авторами Seebach et al., Journal of Organic Chemistry 40(2), 1975, 231-237 описан путь синтеза, который основан на защите и активации карбонилсодержащего исходного вещества, такого как S,S-ацеталь, например 1,3-дитиан или 2-метил-1,3-дитиан. Дитиан металлируют и подвергают взаимодействию с метилсодержащим соединением и/или 13CO2. Путем использования соответствующего обогащенного изотопами 13C-компонента, как подчеркнуто в данной ссылке, возможно получить 13C1-пируват или 13C1,2-пируват. Затем карбонильную функциональную группу высвобождают путем использования общепринятых способов, описанных в литературе. Другой путь синтеза начинается с уксусной кислоты, которую сначала преобразуют в ацетилбромид, а затем подвергают взаимодействию с Cu13CN. Полученный нитрил преобразуют в пировиноградную кислоту через амид (см., например, S.H.Anker et al., J. Biol. Chem. 176 (1948), 1333 или J.E.Thirkettle, Chem Commun. (1997), 1025). Кроме того, 13C-пировиноградная кислота может быть получена путем протонирования имеющегося в продаже 13C-пирувата натрия, например, способом, описанным в US 6232497, или способом, описанным в WO-A-2006/038811.
Гиперполяризация 13C-пировиноградной кислоты посредством ДПЯ подробно описана в WO-A1-2006/011809, которая включена в данную заявку путем ссылки. Вкратце, 13C-пировиноградную кислоту можно непосредственно использовать для ДПЯ, поскольку она образует стекловидное вещество при замораживании. После ДПЯ замороженную гиперполяризованную 13C-пировиноградную кислоту необходимо растворить и нейтрализовать, то есть преобразовать в 13C-пируват. Для этого преобразования необходимо сильное основание. Кроме того, поскольку 13C-пировиноградная кислота является сильной кислотой, необходимо выбрать ДПЯ-агент, который устойчив к данной сильной кислоте. Предпочтительным основанием является гидроксид натрия, и преобразование гиперполяризованной 13C-пировиноградной кислоты гидроксидом натрия приводит в результате к гиперполяризованному 13C-пирувату натрия, который является предпочтительным 13C-пируватом для среды визуализации, которую используют для МР-визуализации и/или спектроскопии in vivo, то есть МР-визуализации и/или спектроскопии, осуществляемой у живых людей или животных, отличных от людей.
Альтернативно, 13C-пируват, то есть соль 13C-пировиноградной кислоты, можно использовать для ДПЯ. Предпочтительными солями являются 13C-пируваты, которые содержат неорганический катион из группы, состоящей из NH4 +, K+, Rb+, Cs+, Ca2+, Sr2+ и Ва2+, предпочтительно NH4 +, K+, Rb+ или Cs+, более предпочтительно K+, Rb+, Cs+ и наиболее предпочтительно Cs+, как подробно описано в WO-A2-2007/111515, включенной в данную заявку посредством ссылки. Синтез этих предпочтительных 13C-пируватов также раскрыт в WO-A2-2007/111515. Если гиперполяризованный 13C-пируват используют в среде визуализации для МР-визуализации и/или спектроскопии in vivo, предпочтителен обмен неорганического катиона из группы, состоящей из NH4 +, К+, Rb+, Cs+, Са2+, Sr2+ и Ва2+, на физиологически очень хорошо переносимый катион, подобный Na4+ или меглумину. Это можно осуществить способами, известными в данной области техники, например использованием катионообменной колонки.
Дополнительными предпочтительными солями являются 13C-пируваты органического амина или аминного соединения, предпочтительно TRIS-13C1-пируват или меглумин-13C1-пируват, как подробно описано в WO-A2-2007/069909, включенной в данную заявку посредством ссылки. Синтез этих предпочтительных 13C-пируватов также раскрыт в WO-A2-2007/069909.
Если гиперполяризованный 13C-пируват, используемый в способе по изобретению, получают путем ДПЯ, образец для поляризации, содержащий 13C-пировиноградную кислоту или 13C-пируват и ДПЯ-агент, может дополнительно содержать ион парамагнитного металла. Обнаружено, что результатом присутствия ионов парамагнитного металла в композиции для поляризации путем ДПЯ являются повышенные уровни поляризации в 13C-пировиноградной кислоте/13C-пирувате, как подробно описано в WO-A2-2007/064226, которая включена в данную заявку посредством ссылки.
В другом воплощении среда визуализации, используемая в способе по изобретению, содержит гиперполяризованный 13C-пируват и малат. Таким образом, во втором аспекте изобретения предложен способ определения активности PDH путем 13C-МР обнаружения с использованием среды визуализации, содержащей малат и гиперполяризованный 13C-пируват, при котором обнаруживают сигнал 13C-бикарбоната и возможно 13C-пирувата.
В контексте данного изобретения термин "малат" означает соль яблочной кислоты. Малат не является гиперполяризованным.
Малат подходящим образом добавляют к гиперполяризованному 13C-пирувату после процесса поляризации. Возможно несколько путей добавления малата. Когда результатом процесса поляризации является жидкая композиция, содержащая гиперполяризованный 13C-пируват, малат можно растворить в указанной жидкой композиции, либо к жидкой композиции можно добавить раствор малата в подходящем растворителе, предпочтительно в водном носителе. Если результатом процесса поляризации является твердая композиция, содержащая гиперполяризованный 13C-пируват или 13C-пировиноградную кислоту, например, когда использована ДПЯ, малат можно добавить в среду растворения, которую используют для растворения твердой композиции, и растворить в ней. Например, 13C-пируват, поляризованный способом ДПЯ, можно растворить в водном носителе, таком как вода или буферный раствор, содержащий воду, включающем малат, либо 13C-пировиноградную кислоту, поляризованную способом ДПЯ, можно растворить в среде растворения, содержащей основание, для преобразования пировиноградной кислоты в пируват и малат. Альтернативно, малат можно добавить в конечную жидкую композицию, то есть в жидкую композицию после растворения/оттаивания, или в жидкую композицию после удаления ДПЯ-агента и/или возможного иона парамагнитного металла. Снова малат можно добавить в виде твердого вещества в жидкую композицию или предпочтительно растворить в водном растворителе, например в водном носителе, таком как вода или буферный раствор. Для стимуляции растворения малата в данной области техники известно несколько способов, таких как встряхивание, перемешивание, перемешивание на вортексе или обработка ультразвуком. Однако предпочтительны способы, которые являются быстрыми и не требуют перемешивающего устройства или способствуют приведению в контакт с жидкой композицией.
Соответственно, малат добавляют в форме яблочной кислоты или соли яблочной кислоты, предпочтительно малата натрия. Концентрация гиперполяризованного 13C-пирувата и малата в среде визуализации, используемой в способе по изобретению, примерно одинакова, либо малат присутствует при более низкой или более высокой концентрации, чем 13C-пируват. Если, например, среда визуализации содержит х М 13C-пирувата, она содержит х М или примерно х М или меньшее количество малата, но предпочтительно не менее чем одну десятую х М малата или большее количество малата, но предпочтительно не более чем трижды х М малата. В предпочтительном воплощении концентрация малата в среде визуализации, используемой в способе по изобретению, примерно равна или равна концентрации гиперполяризованного 13C-пирувата. Термин "примерно равная концентрация" означает концентрацию малата, которая составляет +/-30% концентрации 13C-пирувата, предпочтительно +/-20%, более предпочтительно +/-10%.
Используя среду визуализации, содержащую малат и гиперполяризованный 13C-пируват, можно установить природу регуляции PDH. Поток PDH может быть ингибирован либо посредством инактивации ферментного комплекса PDK, как описано ранее, либо также мгновенно посредством ингибирования конечным продуктом. Продемонстрировано, что повышенные соотношения NADH/NAD+ или ацетил-CoA/СоА снижают PDH-опосредованное окисление пирувата, и доступность оксалоацетата для включения ацетил-CoA в цикл Кребса является основной детерминантой внутримитохондриальной концентрации ацетил-CoA. Малат является промежуточным соединением окислительного метаболизма глюкозы и может поступать в цикл Кребса в виде оксалоацетата посредством анаплеротических последовательностей реакций для повышения общего углеродного потока. Не желая быть связанными этой гипотезой, авторы изобретения предполагают, что в результате введения среды визуализации, содержащей малат и гиперполяризованный 13C-пируват, степень ингибирования конечным продуктом на PDH может быть ограничена, и в случаях высокой активности PDH увеличен поток пирувата через ферментный комплекс, который можно определить способом по изобретению. В ситуациях низкой активности PDH авторы изобретения могут предположить, что ингибирование конечным продуктом менее важно, и что малат, присутствующий в среде визуализации, не должен влиять на поток пирувата через ферментный комплекс, который можно определить способом по изобретению.
В еще одном воплощении сам малат не присутствует в среде визуализации, но его вводят субъекту, подлежащему исследованию, то есть живому человеку или животному, отличному от человека, в клеточную культуру, в образец организма, такой как образцы крови, ткань ex vivo, такая как ткань, полученная в результате биопсии, или изолированный орган, перед введением среды визуализации, используемой в способе по изобретению.
Как упомянуто выше, среду визуализации согласно способу по изобретению можно использовать в качестве среды визуализации для определения активности PDH in vivo путем 13C-МР обнаружения, то есть у живых людей или животных, отличных от людей. Для этой цели среда визуализации предложена в виде композиции, которая подходит для введения в организм живого человека или животного, отличного от человека. Такая среда визуализации предпочтительно содержит в дополнение к МР активному агенту 13C-пирувату водный носитель, предпочтительно физиологически переносимый и фармацевтически приемлемый водный носитель, такой как вода, буферный раствор или физиологический раствор. Такая среда визуализации может дополнительно содержать общепринятые фармацевтические или ветеринарные носители или эксципиенты, например добавки для препаратов, которые являются общепринятыми для диагностических композиций в медицине или ветеринарии.
Кроме того, среду визуализации в соответствии со способом по изобретению можно использовать в качестве среды визуализации для определения активности PDH in vitro путем 13C-МР обнаружения, например, в клеточных культурах, образцах организма, таких как образцы крови, ткани ех vivo, такие как ткани, полученные в результате биопсии, или изолированные органы. Для этой цели среда визуализации предложена в виде композиции, которая подходит для добавления, например, к клеточным культурам, образцам крови, тканям ех vivo, таким как ткани, полученные в результате биопсии, или изолированным органам. Такая среда визуализации предпочтительно содержит, в дополнение к МР активному агенту 13C-пирувату, растворитель, который совместим с клеточными или тканевыми анализами in vitro, и который используют в этих анализах, например ДМСО, или метанол, или смесь растворителей, содержащую водный носитель и неводный растворитель, например смесь ДМСО и воды, либо буферного раствора или метанола и воды, либо буферный раствор. Как очевидно специалистам в данной области техники, фармацевтически приемлемые носители, эксципиенты и добавки для препаратов могут присутствовать в такой среде визуализации, но не требуются для такой цели.
Если среду визуализации, используемую в способе по изобретению, используют для определения активности PDH in vivo, то есть в организме живого человека или животного, отличного от человека, указанную среду визуализации предпочтительно вводят в указанный организм парентерально, предпочтительно внутривенно. Как правило, исследуемый организм помещают в МР-магнит. Специализированные 13C-МР радиочастотные катушки располагают для покрытия интересующей области. Точная дозировка и концентрация среды визуализации будет зависеть от ряда факторов, таких как токсичность и путь введения. Подходящим образом, среду визуализации вводят при концентрации вплоть до 1 ммоль пирувата на кг массы тела, предпочтительно от 0,01 до 0,5 ммоль/кг, более предпочтительно от 0,1 до 0,3 ммоль/кг. Менее чем через 400 с после введения, предпочтительно менее чем через 120 с, более предпочтительно менее чем через 60 с после введения применяют последовательность МР-визуализации, предпочтительно последовательность, которая кодирует интересующий объем при составной частоте и пути пространственного выбора. Точное время применения последовательности МР в высокой степени зависит от интересующего объема и от вида.
Если среду визуализации, используемую в способе по изобретению, используют для определения активности PDH in vitro, указанная среда визуализации составляет от 1 мМ до 100 мМ по 13C-пирувату, более предпочтительно от 20 мМ до 90 мМ и наиболее предпочтительно от 40 до 80 мМ по 13C-пирувату.
Активность PDH может быть определена в соответствии со способом по изобретению путем обнаружения сигнала 13C-бикарбоната и возможно сигнала 13C-пирувата. Это определение основано на приведенной ниже реакции, которая проиллюстрирована для 13C1-пирувата; * обозначает 13C-метку:
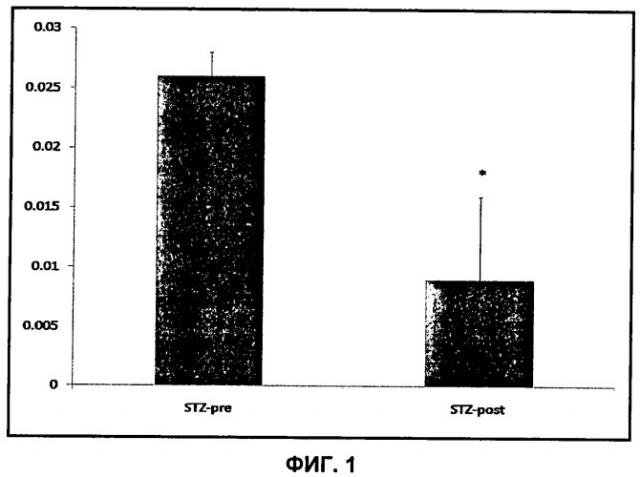
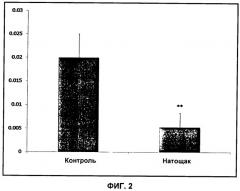
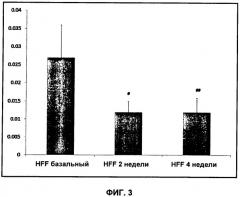
Согласно схеме 1 сниженная активность PDH проявляется в сниженном образовании диоксида углерода и, следовательно, в сниженном сигнале 13C-бикарбоната. При физиологическом pH равновесие CO2/бикарбонат сдвинуто в сторону бикарбоната.
Термин "сигнал" в контексте изобретения относится к амплитуде МР-сигнала либо к интегралу или площади пика по отношению к фону в спектре 13C-МР, который представляет 13C-бикарбонат и возможно 13C-пируват. В предпочтительном воплощении сигнал представляет собой площадь пика.
В предпочтительном воплощении обнаруживают сигналы 13C-бикарбоната и 13C-пирувата.
В предпочтительном воплощении способа по изобретению вышеупомянутый сигнал 13C-бикарбоната и возможно 13C-пирувата используют для создания метаболического профиля, который является показателем активности PDH. Если способ по изобретению осуществляют in vivo, то есть у живого человека или животного, отличного от человека, указанный метаболический профиль може