Слитый белок, способный индуцировать защитный иммунитет против стрептококка группы в, и вакцина, содержащая такой белок
Иллюстрации
Показать всеНастоящее изобретение относится к области микробиологии и касается слитого белка, способного индуцировать защитный иммунитет против стрептококка группы В, а также вакцины, содержащей такой белок. Описанный слитый белок содержит по меньшей мере две аминокислотные последовательности. Первая аминокислотная последовательность, имеющая 90%-ную идентичность последовательности с аминокислотной последовательностью, представленной в SEQ ID NO: 2, слита со второй аминокислотной последовательностью, имеющей по меньшей мере 90%-ную идентичность последовательности с аминокислотной последовательностью, представленной в SEQ ID NO: 4. Представленное изобретение позволяет обеспечить иммунитет против различных клинически важных штаммов стрептококков группы В (Streptococcus agalactiae). 2 н. и 7 з.п. ф-лы, 5 ил., 8 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области микробиологии и технологии вакцин и относится к разработке вакцины, способной формировать иммунитет к стрептококковым инфекциям группы В. Более конкретно, настоящее изобретение относится к новому слитому белку, который формирует иммунитет к инвазивным штаммам стрептококка группы В. Изобретение также относится к выделенной нуклеотидной последовательности, кодирующей указанный слитый белок, к вектору, к клетке-хозяину, к вакцине и к способу предупреждения или лечения стрептококковой инфекции группы В.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Стрептококк группы В (Streptococcus agalactiae) (GBS) является основной причиной инвазивных бактериальных инфекций, в том числе менингита, в неонатальном периоде. Только в Соединенных Штатах в настоящее время насчитывается примерно 5000 случаев в год инвазивного заболевания, вызываемого этой бактерией. Эти инфекции имеют общую смертность примерно 10%, и многие младенцы, которые выживают, имеют постоянные неврологические последствия. В связи с этим, прилагаются большие усилия, чтобы найти способы предупреждения и лечения и выяснить механизмы, по которым GBS вызывает инфекции.
GBS также вызывает мастит у коров, коровье заболевание, которое имеет большое экономическое значение. Поэтому разработка вакцины против GBS инфекций представляет интерес также в ветеринарии.
Примерно 20% всех женщин являются вагинальными носителями GBS, и вертикальный перенос из половых путей матери по всей вероятности является наиболее распространенным источником инфекции при неонатальном заболевании, вызываемом этой бактерией. Тем не менее, только примерно 1% младенцев, у которых GBS колонизируются при рождении, поражаются серьезной инфекцией. Поэтому иные факторы, нежели воздействие бактерии во время рождения, должны вносить вклад в развитие неонатального заболевания.
Стрептококковые штаммы группы В подразделяются на девять серотипов (Ia, Ib и II-VIII) по структуре полисахаридной капсулы (Baker, J.Inf. Dis. 1990, 161: 917). Четыре "классических" серотипа Ia, Ib, II и III встречаются в приблизительно равных пропорциях среди штаммов в нормальной флоре, но тип III является клинически самым важным серотипом, в частности из-за того, что он является причиной большинства случаев менингита.
Поскольку капсула является известным фактором вирулентности, она была исследована очень подробно, в частности в штаммах типа III. Были предприняты попытки разработать вакцину, в которой основным компонентом была бы полисахаридная капсула типа III.
В ЕР 0866133 раскрыта вакцина, способная защищать реципиента от инфекции, вызываемой стрептококком группы В. Это изобретение относится к применению комбинации полисахарида и фрагмента белка эпсилон. В этом документе также раскрыто, что эпидемиологические данные свидетельствуют о том, что типоспецифичная капсула играет важную роль в иммунитете к стрептококковым инфекциям группы В (смотри с.7, строки 2-3). Кроме того, в этом документе приводится целый ряд различных комбинаций разных белков с полисахаридом, упоминаемым в данной заявке, но все пункты формулы изобретения включают в себя полисахарид, что указывает на важность этого конкретного компонента. Однако применение полисахаридной капсулы в качестве вакцины может создавать проблемы из-за перекрестных реакций с тканями человека (Pritchard etal., Infect. Immun. 1992, 60: 1598). Следовательно, было бы очень ценно разработать вакцину на основе белков, а не на основе полисахаридов.
В документе Gravekamp et al., Infection and Immunity, Dec 1997, p 5216-5221, раскрыта оценка иммуногенности, а также защитного действия числа повторов альфа (α) С белка, а также только N-концевой части. Было обнаружено, что иммуногенность понижается с увеличением числа повторов (смотри Фиг.2В). Однако в анализе защиты было также обнаружено, что по сравнению с антителами против N-концевой области за защиту преимущественно ответственны антитела против области повторов (смотри с.5219, левая колонка, строка 6 снизу, и с.5220, правая колонка, строки 26-29).
В WO 9410317 описано применение белка альфа, являющегося поверхностным белком GBS, в разработке конъюгатной вакцины. Недостатком этого белка является то, что он обычно не экспрессируется штаммами типа III, которые являются причиной многих серьезных GBS-инфекций. Следовательно, вакцина на основе белка альфа не будет индуцировать защитный иммунитет против этих штаммов.
В WO 9421685 описано применение белка Rib, являющегося поверхностным белком GBS, в разработке вакцины. Этот белок индуцирует иммунитет при введении с квасцами. Однако белок Rib имеет недостаток, который заключается в том, что он не индуцирует защитный иммунитет против всех штаммов GBS.
Как указано выше, в настоящее время вакцина, пригодная для предупреждения заболевания, вызываемого GBS, еще не доступна, хотя множество работ было посвящено этой проблеме. Ясно, что в настоящее время существует назревшая, но не удовлетворенная потребность в разработке способов предупреждения и лечения GBS-инфекций. Поэтому остается потребность в стратегиях использования вакцин, способных вырабатывать защитный иммунитет против широкого разнообразия штаммов GBS.
Соответственно, основная задача настоящего изобретения заключается в том, чтобы создать вакцину, способную индуцировать защитный иммунитет против GBS-инфекций.
Задача настоящего изобретения заключается также в том, чтобы создать вакцину, которая индуцирует защитный иммунитет против многих клинически важных штаммов GBS.
Задача настоящего изобретения заключается также в том, чтобы создать вакцину, состоящую из одного слитого белка, который индуцирует защитный иммунитет против GBS-инфекций. Один белок имеет несколько преимуществ перед вакциной, состоящей из множества белков, например стоимость производства и безопасность.
Средства для решения каждой из вышеуказанных задач, а также других задач станут ясны из следующего далее описания изобретения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Неожиданно было обнаружено, что слитый белок, содержащий два разных неиммунодоминантных участка, таких как фрагмент N-концевой области белка Rib GBS, слитый с фрагментом N-концевой области белка альфа GBS, т.е. в результате слияния неиммунодоминантных участков двух разных белков, экспрессируемых двумя разными штаммами GBS, образуется слитый белок, который обеспечивает очень эффективную защиту от инфицирования двумя разными бактериальными штаммами при введении этого слитого белка млекопитающему в виде вакцины. Эту защиту осуществляют антитела.
В первом аспекте данное изобретение относится к слитому белку, содержащему по меньшей мере один первый фрагмент N-концевой области поверхностного белка стрептококка группы В или его аналог, гомолог, производное или иммунологически родственную аминокислотную последовательность или фрагменты, который слит с по меньшей мере одним вторым фрагментом N-концевой области поверхностного белка стрептококка группы В или его аналогом, гомологом, производным или иммунологической родственной аминокислотной последовательностью или фрагментами, где указанные по меньшей мере один первый и второй фрагменты N-концевой области поверхностных белков стрептококка группы В получены из разных штаммов стрептококка группы В, и где указанный слитый белок способен индуцировать защитный иммунитет против стрептококка группы В.
Главное преимущество слитого белка по изобретению заключается в том, что он включает в себя области из родственных поверхностных белков Rib и альфа, каждый из которых экспрессируется многими клинически важными штаммами стрептококка группы В, и, что самое важное, было показано, что он индуцирует защитный иммунитет против этих клинически важных штаммов.
Этот слитый белок имеет преимущество в том, что он является иммуногенным даже без адъюванта, индуцируя защитный иммунитет против Rib- и альфа-экспрессирующих штаммов. Более того, вакцину на основе слитого белка по изобретению можно вводить с квасцами в качестве адъюванта, разрешенного для применения у людей. Напротив, о ранее описанной "универсальной вакцине" известно только то, что она работает вместе с адъювантом Фрейнда, сильно раздражающим компонентом, который нельзя применять в медицине человека (Maione, D. et al, Science 2005, 309: 148-150).
Другое преимущество настоящего изобретения заключается в том, что вакцинная композиция по изобретению может состоять из одного слитого белка и все же индуцировать защитный иммунитет против разных GBS инфекций. Это дает несколько преимуществ по сравнению с вакциной, состоящей из множества белков. Например, один белок проще, безопаснее и дешевле в изготовлении, чем смесь, содержащая множество белков.
Более конкретно, настоящее изобретение относится к указанному слитому белку, к выделенной нуклеотидной последовательности, к вектору, к клетке-хозяину, к вакцине и к способу предупреждения или лечения стрептококковой инфекции группы В.
Ниже настоящее изобретение описано более подробно, inter alia, со ссылкой на графические материалы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
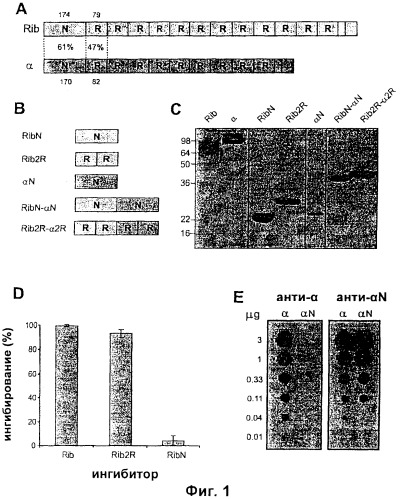
На Фиг.1 представлены белки, использованные в примерах. (А) демонстрирует белки Rib и альфа, включающие их уникальные N-концевые области (N-области) и их области длинных повторов (R-области). Количество аминокислотных остатков в разных областях и идентичность остатков указаны. (В) Рекомбинантные белки из Rib и альфа. (С) Анализ очищенных белков методом SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия). (D) Тест на ингибирование с использованием мышиных антител против Rib. (E) Дот-блот анализ.
На Фиг.2 представлены данные исследований с пассивной иммунизацией. (А) Реактивность кроличьих антисывороток против RibN или Rib2R с бактериями из Rib-экспрессирующего штамма ВМ110 (незакрашенные символы) или его Rib-негативного мутанта (закрашенные символы). (В) Пассивная вакцинация мышей кроличьим антителом против RibN или против Rib2R.
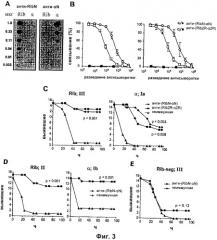
На Фиг.3 представлены: (А) Анализ перекрестной реактивности между N-концевыми областями Rib и альфа; (В) Характеризация кроличьих антител против RibN-альфаN и Rib2R-альфа2R; (С) Пассивная вакцинация мышей антителами к двум слитым белкам с последующей стимуляцией Rib-экспрессирующим штаммом типа III BM110 или альфа-экспрессирующим штаммом типа Ia A909; (D) Пассивная вакцинация слитым белком анти-(RibN-альфаN) с последующей стимуляцией Rib-экспрессирующим штаммом типа II или альфа-экспрессирующим штаммом типа Ib; (E) Пассивная вакцинация слитым белком анти-(RibN-альфаN) с последующей стимуляцией Rib-негативным мутантом BM110.
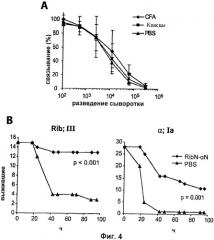
На Фиг.4 представлены результаты активной иммунизации слитым белком RibN-альфаN. (А) Иммуногенность RibN-альфаN при введении с адъювантом или без адъюванта. (В) Активная вакцинация слитым белком RibN-альфаN.
На Фиг.5 представлено сравнение бактерий по (А) способности инвазировать клетки человеческой цервикальной клеточной линии МЕ180. (В) Ингибирование инвазии эпителиальных клеток слитым белком анти-(RibN-альфаN).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термин "иммуногенный" означает "имеющий способность вызывать иммунный ответ". Новый слитый белок по изобретению является иммуногенным и характеризуется тем, что он обладает способностью вызывать защитный иммунный ответ против по меньшей мере GBS, содержащего Rib- и альфа-белок.
Термин "аналог" означает те белки, родственные Rib- и альфа-белкам, в которых один или более чем один аминокислотный остаток Rib- или альфа-белка (SEQ ID NO: 2 и 4) заменен другим аминокислотным остатком, при условии, что общая функциональность и иммуногенные свойства белка-аналога или слитого белка сохраняются. Такие аналоги могут быть природными или могут быть получены синтетическим путем или методом рекомбинантных ДНК, например посредством мутагенеза одной или обеих последовательностей SEQ ID NO: 1 и 3. Аналоги слитого белка имеют по меньшей мере один эпитоп, способный индуцировать антитела, который взаимодействует с Rib-белком, и по меньшей мере один эпитоп, который реагирует с альфа-белком. Такой аналог может иметь суммарную гомологию или идентичность со слитым белком, представленным в SEQ ID NO: 6, по меньшей мере 80%, например 80-99%-ную гомологию или идентичность, или любой диапазон в ней.
Процент гомологии может быть определен, например, путем сравнения информации о последовательностях с использованием компьютерной программы GAP, версия 6.0, доступной от University of Wisconsin Genetics Computer Group (UWGCG). Программа GAP использует метод выравнивания Нидлмана-Вунша (J.Mol.Biol. 1970, 48: 443), скорректированный Смитом и Уотерманом (Adv.Appl. Math. 1981, 2: 482). Кратко, программа GAP определяет сходство как число выровненных символов (т.е. нуклеотидов или аминокислот), которые сходны, деленное на общее число символов в более короткой из двух последовательностей. Предпочтительные параметры по умолчанию для программы GAP включают: (1) унитарную матрицу сравнения (содержащую числовое значение 1 для идентичностей и 0 для неидентичностей) и взвешенную матрицу сравнения Грибскова и Бургесса (Nucl. Acids Res. 1986, 14: 6745), как описано в Schwartz and Dayhoff, eds. Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington, D.C. 1979, pp.353-358; (2) штраф 3,0 за каждый гэп и дополнительный штраф 0,10 за каждый символ в каждом гэпе; и (3) без штрафа за концевые гэпы.
Используемый здесь термин "гомологи" относится к указанному слитому белку или Rib- и альфа-белку из вида Streptococcus agalactiae, где один или более чем один аминокислотный остаток в аминокислотной последовательности (SEQ ID NO: 2 или 4) заменен другим аминокислотным остатком, при условии, что общая функциональность и иммуногенные свойства белка-гомолога сохраняются. Такие гомологи могут быть природными или могут быть получены синтетическим путем или методом рекомбинантных ДНК. Гомологи SEQ ID NO: 2 или 4 будут иметь по меньшей мере один эпитоп, способный активировать антитела, который взаимодействуют с Rib- или альфа-белком. Такой гомолог может иметь суммарную гомологию (т.е. подобие) или идентичность с Rib- или альфа-белком по меньшей мере 80%, например 80-99%-ную гомологию (т.е. подобие) или идентичность, или любой диапазон в ней.
Используемое здесь "производное" представляет собой полипептид, в котором изменены одно или более физических, химических или биологических свойств. Такие изменения включают, но ими не ограничиваются: аминокислотные замены, модификации, присоединения или делеции; изменения в паттерне липидилирования, гликозилирования или фосфорилирования; реакции свободных амино, карбоксильных или гидроксильных боковых групп аминокислотных остатков, присутствующих в этом полипептиде, с другими органическими и неорганическими молекулами; и другие изменения, каждое из которых может приводить к изменению первичной, вторичной или третичной структуры.
"Фрагменты" по данному изобретению имеют по меньшей мере один иммуногенный эпитоп. Предпочтительные фрагменты по данному изобретению будут вызывать иммунный ответ, достаточный для предупреждения или ослабления тяжести инфекции.
Термин "фармацевтически приемлемый носитель" означает любой подходящий приемлемый эксципиент, адъювант, носитель, разбавитель, традиционно используемый в фармацевтических препаратах.
Изобретение относится к вакцине, защищающей от инфекций, вызываемых стрептококком группы В (GBS), который является самой важной причиной угрожающих жизни бактериальных инфекций у новорожденных. Настоящее изобретение основывается на знаниях изобретателя и осознании того, что слитый белок из субобластей в двух больших поверхностных белков стрептококка группы В, а именно белков Rib и альфа, индуцирует защитный иммунитет.
С долговременной целью разработать однокомпонентную вакцину на основе стрептококка группы В (GBS) автор изобретения проанализировал, может ли слитый белок из Rib и альфа индуцировать защитный иммунитет. Большой размер Rib и альфа и генетическая нестабильность областей повторов позволили придти к заключению, что слитый белок следует получать из субобластей. Однако выбор субобластей не был очевидным, поскольку защитные эпитопы присутствуют в области повторов белков альфа и Rib. Неожиданно было обнаружено, что слитый белок из N-концевых областей обладает свойствами, превосходящими свойства слитого белка из других областей этих белков, т.е. повторов, и индуцирует хороший защитный иммунитет.
В этом описании, если конкретно не указано иное, употребление существительного в единственном числе означает "один или более".
По всему тексту описания изобретения любой и все конкретные источники информации включены в данное описание посредством ссылки на них.
Слитый белок
В первом аспекте настоящее изобретение относится к слитому белку, содержащему по меньшей мере один первый фрагмент N-концевой области поверхностного белка стрептококка группы В, который слит с по меньшей мере одним вторым фрагментом N-концевой области поверхностного белка стрептококка группы В, где указанные первый и второй фрагменты N-концевой области поверхностного белка стрептококка группы В получены из разных поверхностных белков стрептококка группы В, и где указанный слитый белок способен индуцировать защитный иммунитет против стрептококка группы В.
Разные поверхностные белки стрептококка, которые могут входить в состав слитого белка по настоящему изобретению, включают, но не ограничиваются ими, Rib-белок стрептококка группы В, альфа-белок стрептококка группы В, бета-белок стрептококка группы В, эпсилон-белок стрептококка группы В и/или белок R28 стрептококка группы В.
Согласно одному из воплощений настоящее изобретение относится к слитому белку, содержащему фрагмент N-концевой области Rib-белка стрептококка группы В, который слит с фрагментом N-концевой области альфа-белка стрептококка группы В, где указанный слитый белок способен индуцировать защитный иммунитет против стрептококка группы В.
Согласно другому воплощению настоящее изобретение относится к слиянию, где указанный слитый белок содержит по меньшей мере одну первую аминокислотную последовательность SEQ ID NO: 2 или ее аналог, гомолог, производное или иммунологическую родственную аминокислотную последовательность или фрагменты, слитую с по меньшей мере одной второй аминокислотной последовательностью SEQ ID NO: 4 или ее аналогом, гомологом, производным или иммунологической родственной аминокислотной последовательностью или фрагментами. Указанная по меньшей мере одна первая аминокислотная последовательность содержит аминокислотную последовательность, имеющую по меньшей мере 80, 85, 90, 95, 96, 97, 98 или 99%-ную идентичность последовательности с аминокислотной последовательностью, которая представлена в SEQ ID NO: 2. Указанная по меньшей мере одна вторая аминокислотная последовательность содержит аминокислотную последовательность, имеющую по меньшей мере 80, 85, 90, 95, 96, 97, 98 или 99%-ную идентичность последовательности с аминокислотной последовательностью, которая представлена в SEQ ID NO: 4. Один пример слитого белка представлен в SEQ ID NO: 6, и другим примером является слитый белок, который содержит совокупность трех или более аминокислотных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 2 и SEQ ID NO: 4 или их частей.
Белок Rib стрептококка группы В, который также упоминается в данном описании как Rib и Rib-белок, представляет собой поверхностный белок, известный в данной области и описанный, например, в WO 9421685. Обозначение "Rib" расшифровывается как: устойчивость к протеазам (R), иммунитет (i) и группа В (b). Белок Rib впервые был выделен из стрептококкового штамма группы В серотипа III как отдельный белок с молекулярной массой 95 кДа. Белок Rib экспрессируется почти всеми стрептококковыми штаммами группы В клинически важного серотипа III, которые вызывают большинство случаев менингита, и некоторыми штаммами других серотипов, таких как серотип II. Более того, Rib экспрессируется всеми штаммами гипервирулентного клона типа III. Был разработан способ очистки белка Rib, и было продемонстрировано, что антитела к этому белку защищают от летальной инфекции, вызываемой штаммами, экспрессирующими белок Rib (дополнительные подробности, такие как ДНК и последовательности белка, смотри в WO 9421685).
Белок альфа стрептококка группы В, также упоминаемый в данном описании как альфа, альфа-белок и альфа-антиген, представляет собой поверхностный белок стрептококка группы В, известный в данной области. В WO 9410317 описана конъюгатная вакцинная композиция, содержащая белок альфа. Нативный белок-предшественник альфа стрептококка группы В, как описано в WO 9410317, имеет молекулярную массу 108 кДа. Расщепление предполагаемой сигнальной последовательности из 41 аминокислоты дает зрелый белок с молекулярной массой 104 кДа. (Следует отметить, однако, что впоследствии было показано, что эта сигнальная последовательность имеет длину 56 аминокислотных остатков (Stalhammar-Carlemalm et al., J.Exp.Med. 177, 1593; 1993)). N-концевая область 20 кДа альфа-антигена не демонстрирует гомологию с ранее описанными белковыми последовательностями, и за ней следует серия из девяти тандемных повторяющихся единиц, которые составляют 74% зрелого белка. Каждая повторяющаяся единица (здесь обозначенная как "R") идентична и состоит из 82 аминокислот с молекулярной массой примерно 8500 Дальтон, и кодируется 246 нуклеотидами. С-концевая область альфа-антигена содержит мотив якорного домена клеточной стенки, присутствующий в целом ряде грамположительных поверхностных белков.
Каждый из белков Rib и альфа GBS включает в себя уникальную N-концевую область (N) и область длинного повтора (R). Эти белки, экспрессируемые штаммами GBS BM110 и А909, имеют 12 и 9 повторов соответственно, как указано на Фиг.1А. Области фиксирования в клеточной стенке локализованы на С-концевых концах.
Тандемные повторы в Rib и альфа идентичны в пределах каждого белка, но не между белками, и варьируют по числу между изолятами. Кроме этой вариации, последовательности Rib и альфа стабильны среди штаммов. Несмотря на значительную идентичность аминокислотных остатков (Фиг.1А), эти два белка демонстрируют небольшую перекрестную реактивность или не демонстрируют перекрестную реактивность.
Белок R28 представляет собой поверхностный белок стрептококка группы В, который обеспечивает защитный иммунитет и стимулирует связывание с эпителиальными клетками человека (Stalhammar-Carlemalm et al. Molecular Microbiology 1999, 33, 208-219).
Белок эпсилон представляет собой подобный альфа-белку белок стрептококка группы В (Creti et al. Clin. Microbiol. 2004, 42: 1326-9).
Термин "N-концевая область" применительно к настоящему изобретению относится к области N-конца (N) белка. Примеры аминокислотных последовательностей Rib и альфа N-концевых областей такие, как указано в SEQ ID NO: 2 и SEQ ID NO: 4.
В целях настоящего изобретения термин "слитый белок" относится к ассоциату из двух или более областей белка или их фрагментов, содержащему, например, фрагмент N-концевой области белка Rib стрептококка группы В и фрагмент N-концевой области белка альфа стрептококка группы В. Например, это может быть фрагмент N-концевой области Rib-белка и один фрагмент N-концевой области альфа-белка, или 2, 3, 4 или 5 фрагментов N-концевой области Rib- и альфа-белков, где количества фрагментов из двух белков не равны.
Примеры фрагментов N-концевой области белка Rib стрептококка группы В и фрагментов N-концевой области белка альфа стрептококка группы В включают пептиды, кодирующие нативные аминокислотные последовательности N-концевых областей природных белков альфа и Rib (например SEQ ID NO: 2 и SEQ ID NO: 4), или это могут быть функциональные производные нативных последовательностей этих областей, причем эти функциональные производные сохраняют способность индуцировать защитный иммунитет против стрептококка группы В. Термин "функциональные производные" охватывает части последовательностей и фрагменты N-концевых областей. Он также охватывает варианты природных белков (таких как белки, которые имеют изменения в аминокислотной последовательности, но сохраняют способность проявлять иммуногенное свойство, вирулентность или антигенное свойство, которые проявляет природная молекула), например варианты с измененной фланкирующей последовательностью.
Согласно настоящему изобретению могут быть использованы фрагменты N-концевой области из разных штаммов стрептококка группы В. Это предполагает также легкую вариабельность в последовательности фрагментов N-концевой области, но не изменяет биологические свойства и их функциональную способность индуцировать защитный иммунитет. Например, имеется в виду, что антигены альфа и Rib стрептококка группы В, выделенные из разных штаммов стрептококка группы В, но не те, которые раскрыты в SEQ ID NO: 2 и SEQ ID NO: 4, входят в объем настоящего изобретения.
Объединение полипептидов с получением слитого белка может быть осуществлено несколькими методами, например: химически сочетанием, конъюгированием или поперечным связыванием, либо напрямую, либо через промежуточную структуру; физически сочетанием посредством захвата в или на макромолекулярную структуру; или молекулярным биологическим слиянием посредством объединения молекул рекомбинантных нуклеиновых кислот, которые содержат фрагменты нуклеиновой кислоты, способной кодировать каждую из двух, так что в конце образуется единый непрерывный экпрессионный продукт.
В целях настоящего изобретения термин "белок" относится к молекулярной цепи из аминокислот. Белок не имеет конкретной длины и может, если требуется, модифицироваться in vivo или in vitro, например в результате гликозилирования, амидирования, карбоксилирования или фосфорилирования. Помимо прочего, это определение охватывает пептиды, олигопептиды и полипептиды. Белок или пептид может иметь природное или синтетическое происхождение. В данном контексте под слитым белком подразумеваются два или более полипептидов, ковалентно связанных друг с другом либо напрямую, либо опосредованно несколькими способами, такими как способы, упомянутые выше. Термин "слитый" относится к созданию слитого белка, как упомянуто выше.
Штаммы стрептококка группы В, также упоминаемого здесь как GBS, общеизвестны и могут быть выделены из крови инфицированных живых существ. GBS является наиболее распространенной причиной неонатального сепсиса в Соединенных Штатах и ответственен примерно за 5000 случаев в год.
Обозначение "стрептококк группы В" вытекает из того, что стрептококки разделены на иммунологические группы исходя из присутствия специфических углеводных антигенов на их клеточных поверхностях. В настоящее время известны группы А-O (Davis, B.D. et al., In: Microbiology, 3rd. Edition, page 609, (Harper & Row, 1980)).
Термин "защитный иммунитет" применительно к настоящему изобретению относится к способности сывороточных антител и/или цитотоксического Т-клеточного ответа, вызываемого при иммунизации, защищать (частично или тотально) от заболевания, вызываемого инфекционным агентом, таким как стрептококк группы В. То есть, у позвоночного животного, подвергнутого иммунизации вакцинами по изобретению, рост и распространение стрептококка группы В будут ограничены. Чтобы определить, индуцирован ли защитный иммунитет слитым белком или вакциной, можно использовать методики, известные специалисту в данной области. Например, чтобы определить, индуцирует ли иммунизация слитым белком или вакциной по изобретению защитный иммунитет против инфекции, вызываемой стрептококком группы В, тестируемых иммунизированных животных подвергают воздействию стрептококка группы В и измеряют рост и распространение стрептококка группы В. Например, чтобы определить, индуцирован ли защитный иммунитет, могут быть использованы способы, описанные в примерах ниже.
В одном из воплощений данного изобретения слитый белок дополнительно содержит фрагмент N-концевой области белка R28 стрептококка группы В (Gene bank acc no: AAD39085.1) и/или фрагмент N-концевой области белка эпсилон стрептококка группы В.
В одном из воплощений данного изобретения слитый белок по настоящему изобретению содержит повторяющиеся пептидные последовательности фрагментов N-концевых областей белков стрептококка группы В (т.е. альфа и Rib).
Согласно одному из воплощений данного изобретения слитый белок содержит аминокислотную последовательность, имеющую по меньшей мере 80%-ную, 85%-ную, предпочтительно 90%-ную, более предпочтительно 95%-ную идентичность последовательности с аминокислотной последовательностью, которая представлена в SEQ ID NO: 6.
Термин "идентичность последовательности" указывает количественную меру степени гомологии между двумя аминокислотными последовательностями равной длины или между двумя нуклеотидными последовательностями равной длины. Если две последовательности, которые сравнивают, не равной длины, то они должны быть выровнены до возможного наилучшего соответствия. Идентичность последовательности можно вычислить, например, с помощью программы BLAST, например программы BLASTP или программы BLASTN (Pearson W.R and D.J. Lipman (1988) PNAS USA 85:2444-2448) (www.ncbl.nlm.nlh.gov/BLAST).
Согласно еще одному воплощению данного изобретения слитый белок содержит аминокислотную последовательность, которая представлена в SEQ ID NO: 6.
Выделенная ДНК и системы экспрессии
Во втором аспекте настоящего изобретения предложена выделенная нуклеотидная последовательность/молекула ДНК, содержащая нуклеотидную последовательность/последовательность ДНК, которая кодирует слитый белок по изобретению. Одним из примеров является нуклеотидная последовательность, содержащая по меньшей мере одну первую нуклеотидную последовательность, представленную в SEQ ID NO: 1, или ее фрагменты, слитую с по меньшей мере одной второй нуклеотидной последовательностью, представленной в SEQ ID NO: 3, или ее фрагментами.
Предложена также рекомбинантная система экспрессии, включающая векторы и клетки-хозяева.
В экспрессировании нуклеотидных последовательностей по данному изобретению может быть использовано широкое разнообразие экспрессионных комбинаций хозяин/вектор. Полезные векторы экспрессии для эукариотических хозяев включают, например, векторы, содержащие последовательности, контролирующие экспрессию, из SV40, вируса бычьей папилломы, аденовируса, аденоассоциированного вируса, цитомегаловируса и ретровирусов. Полезные векторы экспрессии для бактериальных хозяев включают бактериальные плазмиды, такие как плазмиды из Е.coli, в том числе pBluescript, pGEX2T, pUC векторы, col El, pCRI, pBR322, pMB9 и их производные, плазмиды для более широкого круга хозяев, такие как RP4, фаговые ДНК, например многочисленные производные фага лямбда, например лямбда GTIO и лямбда GTI 1, NM989 и другие ДНК фаги, такие как М13 и нитчатые фаги одноцепочечной ДНК. Полезные векторы экспрессии для дрожжевых клеток включают плазмиду 2.mu. и ее производные. Полезные векторы для клеток насекомых включают pVL 941.
Кроме того, любая из широкого разнообразия последовательностей, контролирующих экспрессию, может быть использована в этих векторах для экспрессии нуклеотидных последовательностей/последовательностей ДНК по данному изобретению. Полезные последовательности, контролирующие экспрессию, включают последовательности, контролирующие экспрессию, ассоциированные со структурными генами вышеуказанных векторов экспрессии. Примеры полезных последовательностей, контролирующих экспрессию, включают, например, ранние и поздние промоторы SV40 или аденовируса, lac систему, trp систему, ТАС или TRC систему, промоторы Т3 и Т7, основные операторные и промоторные участки фага лямбда, участки контроля fd покровного белка, промотор для 3-фосфоглицераткиназы или других гликолитических ферментов, промоторы кислотной фосфатазы, например Pho5, промоторы дрожжевой альфа-спаренной системы и другие конститутивные и индуцибельные промоторные последовательности, о которых известно, что они контролируют экспрессию генов прокариотических или эукариотических клеток или их вирусов, и различные их комбинации.
Клетки-хозяева, трансформированные вышеуказанными векторами, составляют еще один аспект данного изобретения. Самые разнообразные одноклеточные хозяева полезны в экспрессировании нуклеотидных последовательностей/последовательностей ДНК по данному изобретению. Эти хозяева могут включать общеизвестные эукариотические и прокариотические хозяева, такие как грамотрицательные и грамположительные штаммы, такие как штаммы E.coli, Pseudomonas, Bacillus, Streptomyces, стрептококка, стафилококка, Lactobacillus, Aspergillus, шигеллы, сальмонеллы, листерии, гриба, дрожжей, клетки насекомых, такие как Spodoptera frugiperda (SF9), клетки животных, такие как СНО (клетки яичника китайского хомячка) и клетки мыши, клетки африканской зеленой мартышки, such как COS 1, COS 7, BSC 1, BSC 40, и ВМТ 10, клетки человека и клетки растений в культуре ткани. Предпочтительные организмы-хозяева включают бактерии, такие как Е.coli и В.subtilis, и клетки млекопитающих в культуре ткани.
Понятно, разумеется, что не у всех векторов и последовательностей, контролирующих экспрессию, функция экспрессирования нуклеотидных последовательностей/последовательностей ДНК по данному изобретению будет в равной степени хорошая. Также не у всех хозяев будет в равной степени хорошая функция с одной и той же системой экспрессии. Однако специалист в данной области может произвести отбор среди этих векторов, последовательностей, контролирующих экспрессию, и хозяев без чрезмерного экспериментирования и не выходя за рамки объема изобретения. Например, при отборе вектора необходимо учитывать хозяина, поскольку вектор должен реплицироваться в нем. Число копий вектора, способность контролировать это число копий и экспрессия любых других белков, кодируемых этим вектором, таких как антибиотические маркеры, также должны быть приняты во внимание. При отборе последовательности, контролирующей экспрессию, следует учитывать различные факторы. Они включают, например, относительную устойчивость последовательности, ее контролируемость и ее совместимость с нуклеотидными последовательностями/ДНК-последовательностями по данному изобретению, особенно в отношении потенциальных вторичных структур. Одноклеточные хозяева следует отбирать с учетом их совместимости с выбранным вектором, токсичности продукта, кодируемого нуклеотидными последовательностями/последовательностями ДНК по данному изобретению, характеристик их секреции, их способности правильно сворачивать белок, требований к их ферментации или культивированию и легкости очистки из них продуктов, кодируемых нуклеотидными последовательностями/ДНК-последовательностями по данному изобретению. В пределах этих параметров специалист в данной области может выбрать различные комбинации вектор/последовательность, контролирующая экспрессию/хозяин, которые будут экспрессировать нуклеотидные последовательности/последовательности ДНК по данному изобретению при культивировании или в животной культуре укрупненного масштаба.
Полипептиды, кодируемые нуклеотидными последовательностями/последовательностями ДНК по данному изобретению, могут быть выделены из микробиологической культуры или клеточной культуры и очищены с использованием различных общепринятых способов, включая жидкостную хроматографию, такую как нормальнофазная или обращеннофазная HPLC (высокоэффективная жидкостная хроматография), FPLC (быстрая жидкостная хроматография белков) и т.п., аффинную хроматографию (такую как с неорганическими лигандами или моноклональными антителами), ионообменную хроматографию, эксклюзионную хроматографию, металлхелатную хроматографию, гель-электрофорез и т.п. Специалист в данной области может выбрать наиболее подходящие методики выделения и очистки, не выходя за рамки объема изобретения.
Кроме того, полипептиды по данному изобретению могут быть получены любым из нескольких химических методов. Например, они могут быть получены с использованием твердофазного синтетического метода, первоначально описанного R.В.Merrifield (J.Am. Chem. Soc. 1963, 83: 2149-54), или они могут быть получены синтезом в растворе. Описание методов пептидного синтеза можно найти в Е.Gross & Н.J.Meinhofer, 4 The Peptides: Analysis Synthesis, Biology; Modern Techniques Of Peptide and Amino Acid Analysis, John Wiley & Sons, (1981); и М.Bodanszky, Principles Of Peptide Synthesis, Springer-Verlag (1984).
Предпочтительные композиции и способы по данному изобретению включают в себя полипептиды, имеющие повышенную иммуногенность. Такие полипептиды могут образовываться в результате модификации нативных форм полипептидов или их фрагментов или в результате