Фенолорганосилоксаны и способ их получения
Иллюстрации
Показать всеИзобретение относится к химии и технологии получения карбофункциональных силоксансодержащих фенолов с реакционно-способными гидроксифенильными группами. Предложены новые фенолорганосилоксаны, содержащие фталимидиновую структуру общей формулы (I), где R - силоксановый заместитель. Предложен также способ их получения взаимодействием 2-аллил-3,3-бис-(4- оксифенил)фталимидина с соответсвующими гидридсилоксанами в органических растворителях при мольном соотношении реагентов (1-8,8):(1-1,1) соответственно под действием платинового катализатора (1-50 мг на 1 кг реакционной смеси) при температуре 70-90°С, с последующей отгонкой растворителя при 90°С и остаточном давлении 2 мм рт.ст. Технический результат - предложенные соединения могут быть получены технологически простым способом из доступного сырья и могут использоваться в качестве исходных соединений для синтеза кремнийорганических сополимеров разного строения, а также в качестве модификаторов для различных полимеров. 2 н.п. ф-лы, 1 ил., 9 пр.
Реферат
Предлагаемое изобретение относится к химии и технологии получения карбофункциональных силоксансодержащих фенолов (далее фенолорганосилоксаны) с реакционноспособными гидроксифенильными групппами, которые широко используются в качестве исходных мономеров и олигомеров для синтеза кремнийорганических сополимеров разного строения, а также модификаторов для различных полимеров.
Кремнийорганические фенолы со связью Si-арил известны с 50-х годов прошлого века, впервые полученые Спайером из галоидфенокси-силилхлорсиланов и хлорсиланов металлоорганическим синтезом, с последующим гидролизом продуктов реакции до целевых кремний-органических фенолов [J. Amer. Chem. Soc., 1952, 74, p.1003]. Такой металлоорганический синтез имеет ряд недостатков: процесс многостадийный и требует использования активных металлов. Затем такие же фенолы были синтезированы Спайером с сотр. [J. Amer. Chem. Soc., 1956, 78, р.2278] реакцией гидросилилирования алкенилфенолов гидридсиланами в присутствии платинохлористоводородной кислоты в качестве катализатора. Впоследствии метод был распространен на синтез фенолорганосилоксанов из непредельных оганических фенолов или их силиловых эфиров и гидридорганосилоксанов [пат. Франции 1387338, 1965; пат. Германии 1694306, 1969; пат. США 3819744, 1974; пат. РФ 2211845, 2001].
Известно также получение фенолорганосилоксанов путем внутримолекулярного гидросилилирования винилфеноксисилангидридов вначале до циклических продуктов, при гидролизе которых образуются целевые Кремнийорганические фенолы. [В.Ф.Миронов и др., Журн. общ. химии., 1971, 41, №10, с.2470]
Задача настоящего изобретения - синтез новых кремнийорганических фенолов технологически простым способом на основе доступного сырья.
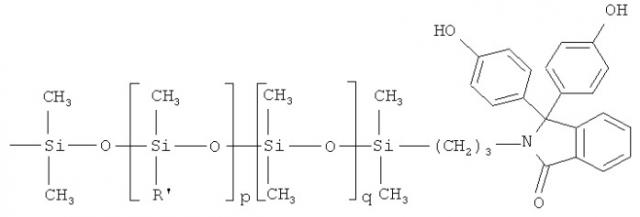
Поставленная задача решена тем, что в результате проведенных нами исследований получены новые фенолорганосилоксаны, содержащие фталимидиновую структуру и соответствующие общей химической формуле:
,
где ; ; ; ;
, где m=1-8, n=1-30;
, где R' - фенил или трифторпропил, p=0-30, q=0-50.
Приведенные нами фенолорганосилоксаны имеют линейную или разветвленную структуру, содержат силоксановую группировку и включают разное количество и расположение реакционноспособных феноксигрупп (две, четыре и более). Это дает возможность использовать их в качестве исходных для синтеза блок-сополимеров, модификаторов, отвердителей органических смол и компаундов.
Часть заявленных фенолорганосилоксанов содержит у атома кремния реакционноспособные этоксигруппы, которые в процессе гидролиза позволяют получать полициклические продукты (полисилсесквиоксаны с фенольными группами).
Предложенные нами фенолорганосилоксаны исследованы методом ЯМР-спектроскопии, их состав подтвержден результатами элементного анализа (см. примеры). По результатам 1Н-ЯМР анализов, новые соединения имеют химические сдвиги протонов, подтверждающие строение целевых фенолорганосилоксанов.
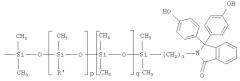
Разработан также способ получения фенолорганосилоксанов путем взаимодействия 2-аллил-3,3-бис-(4-оксифенил)фталимидина /далее N-аллилфталимидин фенолфталеина/ с гидридорганосилоксанами следующих структурных формул:
где ; ; ; ;
, где m=1-8, n=1-30;
, R' - фенил или трифторпропил, p=0-30, q=0-50.
Процесс проводят в органическом растворителе при температуре реакционной смеси 70-90°С под действием платинового катализатора (Спайера или Карстеда), добавляемого в количестве 1-50 мг на 1 кг реакционной смеси, при мольном соотношении N-аллилфталимидина фенолфталеина к гидридсилоксану в пределах (1-8,8):(1-1,1) соответственно, с последующей отгонкой растворителя при 90°С и остаточном давлении 2 мм рт.ст.
Схема реакции:
,
где ; ; ; ;
, где m=1-8, n=1-30;
, где R' - фенил или трифторпропил, p=0-30, q=0-50.
Предлагаемый способ базируется на доступных исходных соединениях: 2-аллил-3,3-бис-(4-оксифенил)фталимидине и гидрид органосилоксанах.
Выход целевых продуктов превышает 90 мас.%.
Пример 1
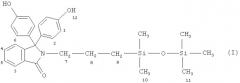
Получение N-[3-(1,1,3,3,3-пентаметилдисилоксан)пропил] фталимидина фенолфталеина структурной формулы:
В реакционную колбу загружают 7,148 г (0,02 моль) N-аллилфталимидина фенолфталеина, 3,264 (0,022 моль) 1,1,3,3,3-пентаметилдисилоксана, 20 мл диоксана, 1,3 мг катализатора Карстеда. Реакционную массу при температуре 70°С перемешивают в течение 4 часов. Контроль за ходом реакции осуществляют методом Чугаева-Церевитинова. Растворитель и избыток гидридсилоксана отгоняют на роторном испарителе при температуре 90°С и давлении 2 мм рт.ст. Получают 9,6 г фенолорганосилоксана I с выходом 95 мас.%.
Продукт реакции - белое порошкообразное вещество, растворимое в ацетоне, ДМСО, диоксане, этиловом спирте. Строение и состав соединения I подтверждены и охарактеризованы методами ЯМР-спектроскопии в дейтеро-ацетоне и элементного анализа (см. рис.1).
Сигналы протонов на ЯМР спектре соединения I в дейтеро-ацетоне - Н1:7,03-7,06; Н2:6,79-6,82; Н3:7,70-7,72; Н4:7,48-7.52; Н5:7,40-7,44; Н6:7,36-7,38; Н7:3,33-3,38; Н8:0,92; Н9:0,26; Н10:-0,12; Н11:-0,01; Н12:8,45.
Состав в мас.%, вычислено/найдено: С 66,49/66,30; Н 6,98/6,90; N 2,77/2,90; Si 11,11/11,30
Пример 2
Получение N-[3-(1,1,1,3,5,5,5-гептаметилтрисилоксан)пропил]-фталимидина фенолфталеина структурной формулы:
В реакционную колбу загружают 7,148 г (0,02 моль) N-аллилфталимидина фенолфталеина, 4,851 (0,022 моль) 1,1,1,3,5,5,5-гептаметилтрисилоксана, 20 мл диоксана, 1,3 мг катализатора Карстеда. Реакционную массу при температуре 80°С перемешивают в течение 3 часов. Ход реакции контролируют методом Чугаева-Церевитинова. Растворитель и избыток гидридсилоксана отгоняют на роторном испарителе при температуре 90°С и давлении 2 мм рт.ст. Получают 12,45 г бисфенолсилоксана II с выходом 94 мас.%.
Продукт реакции - белое порошкообразное вещество, растворимое в ацетоне, ДМСО, диоксане, этиловом спирте, метиленхлориде и хлороформе. Строение и состав соединения II подтверждены и охарактеризованы методами ЯМР-спектроскопии в дейтеро-ДМСО и элементного анализа.
Сигналы протонов на ЯМР спектре соединения II в дейтеро-ДМСО - Н1:6,94-6,96; Н2:6,72-6,74; Н3:7,68-7,70; Н4:7,48-7,53; Н5:7,40-7,44; Н6:7,34-7,37; Н7:3,26-3,29; Н8:0,88; Н9:0,15; Н10:-0,01; Н11:-0,18; Н12:9,53.
Состав в мас.%, вычислено/найдено: С 62,13/62,20; Н 7,13/7,24; N 2,42/2,35; Si 14,53/14,45
Пример 3
Получение N-[3-(трис-(триметилсилокси)силан)пропил]фталимидина структурной формулы:
В реакционную колбу загружают 7,148 г (0,02 моль) N-аллилфталимидина фенолфталеина, 6,5252 (0,022 моль) трис-триметилсилоксисилана, 20 мл диоксана, 1,3 мг катализатора Карстеда. Реакционную массу при температуре 75°С перемешивают в течение 3 часов. Ход реакции контролируют методом Чугаева-Церевитинова. Растворитель и избыток гидридсилоксана отгоняют на роторном испарителе при температуре 90°С и давлении 2 мм рт.ст. Получают 12,45 г бисфенолсилоксана III с выходом 93 мас.%.
Продукт реакции - белое порошкообразное вещество, хорошо растворимое в ацетоне, ДМСО, диоксане, этиловом спирте. Строение и состав соединения III охарактеризован методом ЯМР-спектроскопии в дейтеро-ДМСО и методом элементного анализа.
Сигналы протонов на ЯМР спектре соединения III в дейтеро-ДМСО -Н1:6,94-6,96; Н2:6,72-6,74; Н3:7,68-7,70; Н4:7,48-7,53; Н5:7,40-7,44; Н6:7,34-7,37; Н7:3,26-3,29; Н8:0,88; Н9:0,15; Н10:-0,20; Н11:9,52.
Состав в мас.%, вычислено/найдено: С 58,76/58,62; Н 7,24/7,29; N 2,14/2,19; Si 17,18/17,25
Пример 4
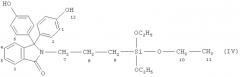
Получение N-[3-триэтоксисилоксан)пропил]фталимидина структурной формулы:
В реакционную колбу загружают 7,148 г (0,02 моль) N-аллилфталимидина фенолфталеина, 3,615 (0,022 моль) триэтоксисилана, 20 мл диоксана, 1,3 мг катализатора Карстеда. Реакционную массу при температуре 80°С перемешивают в течение 4 часов. Ход реакции контролируют методом Чугаева-Церевитинова. Растворитель и избыток гидридсилана отгоняют на роторном испарителе при температуре 90°С и давлении 2 мм рт.ст. Получают 10,90 г бисфенолсилоксана II с выходом 95 мас.%.
Продукт реакции - белое порошкообразное вещество, растворимое в ацетоне, ДМСО, диоксане, этиловом спирте. Строение и состав соединения IV охарактеризовано методом ЯМР-спектроскопии в дейтеро-ДМСО и методом элементного анализа.
Сигналы протонов на ЯМР спектре соединения IV в дейтеро-ДМСО - Н1:6,94-6,96; Н2:6,72-6,74; Н3: - 7,68-7,70; Н4:7,48-7,53; Н5:7,40-7,44; Н6:7,34-7,37; Н7:3,26-3,29; Н8:1,54; Н9:0,60; Н10:3,71-3,94; Н11:1,24; Н12:9,53.
Состав в мас.%, вычислено/найдено: С 66,77/66,30; Н 6,76/6,62; N 2,68/2,61; Si 5,38/5,40
Пример 5
Получение тетрафенолорганосилоксана структурной формулы:
В реакционную колбу загружают 7,148 г (0,02 моль) N-аллилфталимидина фенолфталеина, 1,343 (0,01 моль) 1,1,3,3-тетраметилдисилоксана, 20 мл диоксана, 1,3 мг катализатора Карстеда. Реакционную массу при температуре 85°С перемешивают в течение 4,5 часов. Ход реакции контролируют методом Чугаева-Церевитинова. Растворитель и избыток гидридсилоксана отгоняют на роторном испарителе при температуре 90°С и давлении 2 мм рт.ст. Получают 8,06 г тетрафенолсилоксана V с выходом 95 мас.%.
Продукт реакции - белое порошкообразное вещество, растворимое в ДМСО и диоксане. Строение и состав соединения V охарактеризовано методом ЯМР-спектроскопии в дейтеро-ДМСО и методом элементного анализа.
Сигналы протонов на ЯМР спектре соединения V в дейтеро-ДМСО - Н1:6,91-6,93; Н2:6,70-6,72; Н3:7,65-7,67; Н4:7,51-7,54; Н5:7,41-7,45; Н6:7,36-7,38; Н7:3,22-3,26; Н8:0,70; Н9:0,10; Н10: - 0,25; Н11:9,51.
Состав в мас.%, вычислено/найдено: С 70,72/70,25; Н 6,17/6,10; N 3,30/3,28; Si 6,62/6,50
Пример 6
Получение тетрафенолорганосилоксана структурной формулы:
В реакционную колбу загружают 7,148 г (0,02 моль) N-аллилфталимидина, 39,1262 (0,01 моль) α,ω-олигодигидридсилоксана, 20 мл диоксана, 2,0 мг катализатора Карстеда. Реакционную массу при температуре 90°С перемешивают в течение 4 часов. Ход реакции контролируют методом Чугаева-Церевитинова. Растворитель отгоняют на роторном испарителе при температуре 90°С и давлении 2 мм рт.ст. Получают 42,9 г тетрафенолорганосилоксана VI с выходом 93 мас.%.
Продукт реакции - прозрачная, вязкая жидкость. Строение и состав соединения VI охарактеризовано методом ЯМР-спектроскопии в дейтеро-ДМСО и методом элементного анализа.
Сигналы протонов на ЯМР спектре соединения VI в дейтеро-ДМСО - Н1:6,91-6,93; Н2:6,70-6,72; Н3:7,65-7,67; Н4:7,51-7,54; Н5:7,41-7,45; Н6:7,36-7,38; Н7:3,22-3,26; Н8:0,69; Н9:0,10; Н10: - 0,27; Н11:9,51; Н12:0,32.
Пример 7
Получение олигофенолорганосилоксана формулы:
В реакционную колбу загружают 31,41 г (0,088 моль) N-аллилфталимидина, 28,54 (0,01 моль) олигогидридсилоксана, 60 мл диоксана, 2,4 мг катализатора Карстеда. Реакционную массу при температуре 90°С перемешивают в течение 6 часов. Ход реакции контролировали методом Чугаева-Церевитинова. Растворитель отгоняют на роторном испарителе при температуре 90°С и давлении 2 мм рт.ст. Получают 54,2 г олигофенолсилоксана VII с выходом 95 мас.%.
Продукт реакции - смолообразная масса. Состав соединения VII охарактеризован методом элементного анализа.
Состав в мас.%, вычислено/найдено: С 52,40/52,20; Н 7,18/7.05; N 2,02/2,10; Si 20,21/20,50
Пример 8
Получение фторсодержащего тетрафенолорганосилоксана структурной формулы:
В реакционную колбу загружают 7,148 г (0,02 моль) N-аллилфталимидина, 47,47 (0,01 моль) α,ω-олигодигидридсилоксана, 100 мл тетрагидрофурана, 3,0 мг катализатора Карстеда. Реакционную массу при температуре 85°С перемешивают в течение 4 часов. Ход реакции контролируют методом Чугаева-Церевитинова. Растворитель отгоняют на роторном испарителе при температуре 90°С и давлении 2 мм рт.ст. Получают 49,6 г тетрафенолорганосилоксана VI с выходом 90 мас.%.
Продукт реакции - вязкая жидкость.
Пример 9
Получение тетрафенолорганосилоксана структурной формулы:
В реакционную колбу загружают 7,148 г (0,02 моль) N-аллилфталимидина, 64.542 г (0,01 моль) α,ω-олигодигидридсилоксана, 100 мл тетрагидрофурана, 3,0 мг катализатора Карстеда. Реакционную массу при температуре 80°С перемешивают в течение 5 часов. Ход реакции контролируют методом Чугаева-Церевитинова. Растворитель отгоняют на роторном испарителе при температуре 90°С и давлении 2 мм рт.ст. Получают 65,9 г тетрафенолорганосилоксана IX с выходом 92 мас.%.
Продукт реакции - смолообразная масса.
1. Фенолорганосилоксаны, содержащие фталимидиновую структуру, общей формулы , ; ; ; ;где где m=1-8, n=1-30; где R' - фенил или трифторпропил, p=0-30, q=0-50.
2. Способ получения фенолорганосилоксанов, содержащих фталимидиновую структуру, по п.1, характеризующийся тем, что 2- аллил-3,3-бис-(4'-оксифенил) фталимидин подвергают взаимодействию с гидридорганосилоксанами следующих химических формул: ; ; ; ; где m=1-8, n=1-30; где R' - фенил или трифторпропил, p=0-30, q=0-50.в органическом растворителе при температуре реакционной смеси 70-90°С под действием платинового катализатора, добавляемого в количестве 1-50 мг на 1 кг реакционной смеси, при соотношении реагентов в пределах (1,0-8,8):(1,0-1,1) соответственно, с последующей отгонкой растворителя при температуре 90°С и остаточном давлении 2 мм рт.ст.