Препарат с полифункциональной медико-биологической активностью, влияющий на тканевой обмен, на основе штамма гриба pleurotus ostreatus вкпм f-819
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Препарат с полифункциональной медико-биологической активностью, влияющий на тканевой обмен, получают в результате жидкофазного глубинного культивирования гриба Pleurotus ostreatus ВКПМ F-819 с последующим разделением мицелия и культуральной жидкости и выделением из мицелия биологически активных веществ в виде сгущенного экстракта. Полученный экстракт, который представляет собой фармакологическую субстанцию препарата, обогащают активным началом производного стерола 4-гидрокси-17Р-метилинцистерол с молекулярной массой 332,2452 дальтон, полисахаридом β 1-3 глюканом и дигидрокверцетином с молекулярной массой 304,26 дальтон. При этом указанные компоненты взяты в следующем массовом соотношении: (1):(2):(3):(4) как (79,0-158,0):(1,0-2,0):(10,0-20,0):(10,0-20,0). Изобретение позволяет повысить качество препарата за счет увеличения его противоопухолевой активности и снижения токсичности препаратов противоопухолевой химиотерапии при одновременном применении с предложенным препаратом. 1 з.п. ф-лы, 21 ил., 11 табл., 2 пр.
Реферат
Изобретение относится к медицине, медицинской и биотехнологической промышленностям, в частности к штаммам грибов-продуцентов биологически активных веществ и препаратам на их основе, и может быть использовано при производстве и применении физиологически активных препаратов и пищевых добавок на основе грибов - продуцентов.
Одной из перспективных групп продуцентов, чей химический состав биологически активных веществ и свойства этих веществ в настоящее время изучены достаточно полно, являются высшие базидиальные грибы.
Исследованием лечебных свойств высших базидиальных грибов и практическим их применением в области медицины занимаются ученые ряда стран на протяжении последних 50-ти лет. Результаты этих исследований особо широко используются в Китае, Японии, Корее, США, Канаде, России и в последнее время в Норвегии.
Среди метаболитов высших грибов выделены и идентифицированы вещества из шляпочных грибов, которые являются иммуномодуляторами и проявляют противоопухолевые, кардиоваскулярные, противовирусные, антибактериальные, противопаразитарные, гепатозащитные и противодиабетические свойства /Материалы IV Международной конференции «Наука и практика грибоводства»/ М., Международная Ассоциация Грибоводов. 1997 г. - 92 с.; Перспективы использования в медицине веществ, образуемых базидиальными грибами. Обзор /International Journal of Medicinal Mushrooms. Vol.3, 31-62, 1999)/.
Известно примерно 200 видов шляпочных грибов, которые обладают ярко выраженными вышеперечисленными свойствами, но только около 10 видов грибов используются для получения лекарственных средств. Однако большинство биологически активных веществ, входящих в состав этих грибов, полностью не определены. Так, например, в Японии, Китае, России, Украине, Белоруссии, США, Канаде и Норвегии были разработаны несколько цитостатиков-полисахаридов, используемых как лекарственные препараты. Их получают при культивировании в погруженных условиях Trametes versicolor (PSK, Krestin; Japan; Glucanova, Norway 2010).
Вместе с тем, создание новых препаратов до настоящего времени во многом сдерживается сложной дорогостоящей технологией получения из базидиомицетов линий чистых культур и веществ, обладающих стабильностью требуемых лечебных свойств. Прежде всего это объясняется тем, что образование ценных для фармакологии метаболитов зависит от условий культивирования продуцента и, по мнению большинства авторов, носит нестабильный штаммозависимый специфический характер.
Поэтому в настоящее время мы не располагаем современными безопасными препаратами на основе биологически активных веществ, получаемых из высших базидиомицетов, с полифункциональной специфической медико-биологической активностью и способностью усиливать проявление противоопухолевой активности, сопровождающейся гепатопротекторным и детоксицирующим действием с нормализацией липидного спектра в сыворотке крови.
Для лечения онкологических заболеваний широко применяются противоопухолевая химиотерапия с использованием целого ряда цитостатиков. К наиболее эффективно используемым относятся циклофосфан, доксорубицин, вепезид, таксаны, метатрексат, 5-фторурацил, применяемые на практике, как отдельно, так и в сочетании друг с другом.
Однако существенным ограничением в достижении максимальной эффективности противоопухолевой терапии является токсичность цитостатиков, широко применяемых в химиотерапии. Именно токсические проявления в ходе их применения и особенно гематологическая токсичность, как правило, ограничивают проведение адекватного лечения. Терапия зачастую проводится сниженными дозами лекарств с увеличением интервалов между курсами и, как результат, лечение бывает не всегда удовлетворительным.
Известно, что при длительно применяемых курсах полихимиотерапии с использованием известных цитостатиков значительно возрастает риск развития заболеваний печени, в т.ч. стеатоза печени, т.н. неалкогольного стеатогепатита (НАСГ) (жировой инфильтрации печени).
Так, например, применение циклофосфана, метатрексата и доксорубицина может вызвать развитие гепатита, сопровождающегося повышением активности в крови ферментов печеночного происхождения (аминотрансфераз, γ-глутамилтранспептидазы, кислой и щелочной фосфатаз), гипербилирубинемией, фиброзом, дистрофией печени с синдромом холестаза IVanSaun М.N., Lee I.K., Washington M.K., Matrisian L, Gorden D.L. High fat diet induced hepatic steatosis establishes a permissive microenvironment for colorectal metastases and promotes primary dysplasia in a murine model // Am. J. Pathol. 2009. V.175(1). P.355-364.; Блохин H.H., Переводчикова Н.И. Химиотерапия опухолевых заболеваний. М.: Медицина, 1984. 303 с.; Spitzer Т., Cirenza E., McAfee S., Foelber R., Zarzin J., Cahill R., Mazumder A. Phase I-II trial of high-dose cyclophosphamide, carboplatin and autologous bone marrow or peripheral blood steam cell rescue // Bone Marrow Transplant. 1995. V.15, №4. P.537-542/.
По этой причине затруднен поиск эффективных препаратов для лечения онкологических заболеваний при развитии НАСГ. Современные подходы к лечению этой патологии направлены главным образом на устранение или ослабление факторов, ведущих к развитию стеатоза: низкокалорийная диета, коррекция гиперлипидемии и гипергликемии, отмена потенциально гепатотоксичных препаратов. Однако эти мероприятия имеют слабую лечебную эффективность и то, только у относительно небольшой части больных.
Более значимые результаты могли бы быть получены у пациентов, страдающих онкологическими заболеваниями, если бы применяемые в химиотерапии цитостатики или препараты «сопровождения» в комплексном лечении больных, дополнительно обладая противоопухолевой активностью, оказывали гепатопротекторное и детоксицирующее действие, проявляющееся в блокировке НАСГ, и нормализовали липидный спектр в сыворотке крови.
Морфологический термин НАСГ, или по другой терминологии "жировая инфильтрация", обозначает патологический процесс, при котором в цитоплазме гепатоцитов происходит прогрессирующее накопление капель жира (Яковенко и др., 2004).
В настоящее время в области профилактики и сохранения здоровья человека самой большой и все более очевидной проблемой является остановка разрушения организма человека от применения химических препаратов.
Именно поэтому в последние 15 лет активно разрабатываются подходы по созданию и применению новых препаратов на основе биологически активных веществ, снижающих токсические проявления противоопухолевых препаратов. Однако до настоящего времени в практической медицине нет препаратов, достаточно эффективных для широкого применения.
К числу известных рекомендованных Министерством здравоохранения РФ такого рода растительных препаратов, начиная с 1996 года, необходимо прежде всего отнести: БАД к пище из бурых морских водорослей «Кламин» /Гигиенический сертификат Госкомсанэпиднадзора РФ №1П - 11/100 от 10.02.1995 г./; «Фитолон» и «Фитолон - М» /Гигиенический сертификат Госкомсанэпиднадзора РФ №1П - 11/101 от 10.02.1995 г./; лекарственное средство из культуры тканей женьшеня «Биоженьшень» /ВФС-42-1890-89/.
Включение в схемы комбинированного и комплексного лечения больных раком молочной железы, пищевода и прямой кишки вышеуказанных растительных адаптогенов позволяет, с одной стороны, ослабить повреждающее действие операционной травмы, химио- и лучевой терапии на организм, уменьшить частоту осложнений специфической терапии, а с другой стороны, повысить защитные силы организма, усилить режим специфического лечения, т.е. добиться синергизма противоопухолевой активности.
Вместе с тем, перечисленные выше препараты (растительные адаптогены) не обладают противоопухолевой активностью, а при их комплексном применении в сочетании с химио- и лучевой терапией не обладают способностью модулировать процессы снижения их гематологической токсичности, с сопровождением детоксицирующего и гепатопротекторного действия и нормализацией липидного спектра в сыворотке крови биологических систем, что значительно осложняет комплексное лечение онкологических больных.
Известен индуктор апоптоза полипептидный комплекс ГА-40, который был разработан в начале 90-х годов в медико-биологическом научно-исследовательском и производственном центре Alexis (Тбилиси, Грузия). Сырьевым источником получения препарата в виде пептидного лиофилизированного порошка служит горное растение Купена горная (Polgonatum varticillatum). После проведения биохимических исследований на предмет количественного и качественного состава было выявлено, что препарат содержит несколько сотен малых пептидов с молекулярной массой 10-50 кД. Для определения состава использовался метод высокоэффективной жидкостной хроматографии (HPLC) с последующей тандемной масс-спектрометрией с использованием LTQ FT ICR спектрометра масс (Hybrid-2D-Linear Quadrupole Ion Trap, Fourier Transform Ion Cyclotron Resonance Mass Spectrometer) (Thermo Electron Corp). /Великий Н.Н. Отчет об определении количественного и качественного состава препарата ГА-40. Институт биохимии им. Палладина НАН Украины, Киев, 2007/.
Препарат ГА-40 прошел серию экспериментов in vitro и in vivo, которые достоверно продемонстрировали ряд терапевтических эффектов его пептидного состава в комплексе, а именно:
- полипептиды препарата ГА-40 взаимодействуют с мембранными структурами атипичных клеток и инициируют механизм апоптоза / Loeb Lawrence A., «Investigation of molecular mechanisms of the anti-carcinogenic action of the GA-40 preparation» University of Washington, School of Medicine, Department of Pathology; WDC, 2005/;
- в опытах in vivo установлено, что введение препарата ГА-40 мышам в дозах 2, 20 и 200 мкг/кг вызывает достоверное увеличение количества антителообразующих клеток в 1,5, 2 и 2,4 раза соответственно по сравнению с животными, не получавшими препарат;
- в опытах in vitro установлено, что совместная культивация препарата ГА-40 в концентрации 100 мкг/мл с мононуклеарными клетками периферической крови здоровых доноров вызывает достоверное повышение продукции интерферона-гамма;
- препарат ГА-40 обладает выраженным антиоксидантным и антистрессовым действием. Он не вызывает аллергических реакций немедленного типа и псевдоаллергических реакций /Ю.М.Лопухин, А.К.Мартынов, «Исследование иммунотропной активности препарата ГА-40», «Исследование клеточных и молекулярных механизмов действия препарата ГА-40», ГУ НИИ ФХМ, Москва, 2006/.
Анализ медико-биологической активности известного препарата ГА-40 - индуктора апоптоза показывает, что несмотря на достоверно продемонстрированный ряд терапевтических эффектов препарата ГА-40 не применяется в практике медицины как препарат «сопровождения» в комплексной терапии онкологических заболеваний, так как не обладает способностью снимать проявление общей токсичности и гематологической токсичности, вызванных применяемыми цитостатиками, при этом оказывать гепатопротекторное и детоксицирующее действие, проявляющееся в блокировке развития НАСГ и нормализовать липидный спектр в сыворотке крови биологических систем.
Именно по тем же причинам ни один из известных методов лечения онкологических больных с применением известных растительных адаптогенов нельзя признать достаточно эффективным и пригодным для широкого применения.
Что касается модуляторов, снижающих токсические проявления противоопухолевых препаратов биологически активными веществами, выделенными из высших базидиомицетов, с полифункциональной медико-биологической активностью, вызывающей или усиливающей совместно с цитостатиками гибель клеток злокачественных опухолей путем индукции в них апоптоза, при этом оказывать гепатопротекторное и детоксицирующее действие, проявляющееся в блокировке развития стеатогепатита и нормализовать липидный спектр в сыворотке крови биологических систем, то сведения о подобного рода соединениях в литературе отсутствуют.
Известен «Препарат, влияющий на тканевой обмен и моделирующий процессы иммунитета в биологических системах, и биологически активная пищевая добавка «Мипро - ВИТ»» /патент РФ 2092179, кл. А61К 35/84, A23L 1/054, 1996 г./, используемый в медицине для профилактики и лечения заболеваний, связанных с нарушениями обмена веществ и функционирования иммунной системы организма, в частности способный стимулировать активность антиоксидантных систем организма и, как следствие, связывать и выводить из организма радионуклиды, кардинально нарушающие тканевый обмен в организме за счет инактивации белков-ферментов. Известный препарат не применяется в медицине как модулятор, снижающий токсические проявления цитостатиков, и в данном направлении не исследован.
Известен «Препарат, влияющий на тканевой обмен и применение штамма гриба Fusarium Sambucinum Fuskel var. ossicolum (berk. etcurf) bilai для его получения /патент РФ 2040932, кл. А61К 35/70, 1993 г./, используемый в медицинской промышленности для производства пищевых добавок и в медицине для профилактики и лечения заболеваний, связанных с нарушением обмена веществ, обладающий адаптогенным и иммуномодулирующим действием. Этот препарат оказывает нормализующее действие на нарушенные обменные процессы в организме, приводящие к сердечно-сосудистым заболеваниям, ожирению, диабету, иммунодефицитным состояниям, авитаминозам, а также сочетается с традиционными терапевтическими средствами, усиливая их действие на организм и снижая побочные неблагоприятные эффекты, в частности при проведении радиотерапии онкологическим больным. Однако данный препарат также не применяется в медицине как модулятор, снижающий токсические проявления противоопухолевых препаратов, так как в этом направлении не исследован.
Известен препарат, влияющий на тканевой обмен, и применение штамма гриба Pleurotus ostreatus 1137 для его получения /патент РФ 2192873, кл. А61К 35/70, 2001 г./, используемый в медицинской и биотехнологической промышленности для производства физиологически активных препаратов и пищевых добавок на основе грибных продуцентов биологически активных веществ, применяемых в медицине для снижения токсических проявлений противоопухолевых препаратов (прототип).
Согласно описанию и формуле этого изобретения известный препарат обладает противоопухолевой активностью и способностью модулировать процесс снижения гематологической токсичности цитостатиков. Препарат производят путем глубинного культивирования гриба Pleurotus ostreatus 1137 (ВКПМ, F-819) с последующим разделением мицелия и культуральной жидкости и выделением из мицелия экстракцией этанолом при кислом или нейтральном значениях pH среды биологически активных веществ с антимикробной активностью, содержащих аминокислоты (глицин, аланин, треонин, серин, лейцин) и углеводы (глюкозу, глюкозамин, арабинозу, ксилозу).
Препарат выполнен в виде обезвоженных гранул или таблеток, или в виде гелеобразного сиропа.
Штамм Pleurotus ostreatus 1137 (ВКПМ, F-819) применяется в качестве продуцента физиологически активных веществ с противоопухолевой активностью.
Кроме того, препарат проявляет антимикробную активность в отношении как грамположительных, так и грамотрицательных бактерий.
На основе описанного в патенте штамма гриба Pleurotus ostreatus 1137 (ВКПМ, F-819) получен препарат, обладающий широким спектром лечебно-профилактического действия, в т.ч. и антиоксидантной активностью.
Опыт применения вышеуказанного препарата (прототипа) показывает, что физиологическое действие препарата заключается в его способности оказывать влияние на тканевой обмен и модулировать процессы снижения гематологической токсичности эффективных и широко применяемых в клинике противоопухолевых препаратов. Применение этого препарата позволяет повысить эффективность противоопухолевой химиотерапии на фоне снижения токсических проявлений цитостатиков при комплексном лечении онкологических заболеваний.
Вместе тем в ходе медико-биологических и клинических испытаний нами установлено, что индивидуальное применение препарата, разработанного в соответствии с патентом РФ №2192873, недостаточно эффективно индуцирует апоптоз раковых клеток и практически обладает низкой физиологической активностью к способности усиливать гепатопротекторное и детоксицирующее действие и нормализовать липидный спектр в сыворотке крови при комплексном лечении онкологических больных.
Поэтому в основу изобретения положено применение штамма Pleurotus ostreatus 1137 для создания на его основе препарата с полифункциональной медико-биологической активностью, влияющего на тканевой обмен, который является индуктором апоптоза, механизм действия которого основан на способности вызывать гибель клеток злокачественных опухолей и при этом оказывать гепатопротекторное и детоксицирующее действие, проявляющееся в блокировке развития стеатогепатита с нормализацией липидного спектра в сыворотке крови биологических систем и не имеющего противопоказаний к применению.
Апоптоз - это форма гибели клетки, проявляющаяся в изменении свойств цитоплазматических мембран, конденсации и фрагментации хроматина /Imyanitov E.N., Kuligina E.Sh., Belogubova E.V., Togo A.V., Hanson K.P. Mechanisms of lung cancer. Drug Discov. Today: Dis. Mech., 2005a, 2, 213-223/.
В связи с тем, что раковые клетки теряют способность к дифференцировке и приобретают способность к неконтролируемому размножению, одной из приоритетных задач терапии рака является подбор препаратов, индуцирующих апоптоз раковых клеток.
Задачей настоящего изобретения является разработка и создание препарата на основе штамма Pleurotus ostreatus 1137 (ВКПМ, F-819) с полифункциональной медико-биологической активностью, влияющего на тканевой обмен и обладающего противоопухолевой активностью с индукцией апоптоза раковых клеток, а также способностью модулировать процесс снижения гематологической токсичности применяемых противоопухолевых препаратов, сопровождающийся гепатопротекторным и детоксицирующим действием с нормализацией липидного спектра в сыворотке крови биологических систем.
Технический результат состоит в повышении качества препарата за счет увеличения его противоопухолевой активности и снижения токсичности препаратов противоопухолевой химиотерапии при одновременном применении вместе с ними заявляемого препарата, обладающего способностью ингибировать размножение клеток рака, а также гепатопротекторнным и детоксицирующим действием, проявляющимся в блокировке развития стеатогепатита и нормализации липидного спектра в сыворотке крови.
Результат достигается тем, что заявляемый препарат с полифункциональной медико-биологической активностью, влияющий на тканевой обмен, получен в результате жидкофазного глубинного культивирования гриба Pleurotus ostreatus 1137 (ВКПМ, F-819) с последующим разделением мицелия и культуральной жидкости и выделением из мицелия биологически активных веществ в виде сгущенного экстракта с антимикробной активностью, который представляет собой фармакологическую субстанцию препарата и обогащен активным началом производного стерола 4-гидрокси-17R-метилинцистерол с молекулярной массой 332,2452 дальтон, полисахаридом β 1-3 глюканом и дигидрокверцетином с молекулярной массой 304,26 дальтон, при этом компоненты взяты в следующем массовом соотношении:
(1):(2):(3):(4) как (79,0-158,0):(1,0-2,0):(10,0-20,0):(10,0-20,0).
Препарат обладает способностью ингибировать размножение клеток рака, а также гепатопротекторным и детоксицирующим действием, проявляющимся в блокировке развития стеатогепатита и нормализации липидного спектра в сыворотке крови биологических систем.
Препарат выполнен в виде геля или сиропа, или таблеток, или обезвоженных гранул.
В вышеприведенном по тексту массовом соотношении компонент (1):(2):(3):(4) в готовой форме заявляемого препарата в качестве 1-го компонента применяют сгущенный экстракт с антимикробной активностью, который представляет собой фармакологическую субстанцию препарата; в качестве 2-го компонента применяют активное начало производного стерола 4-гидрокси-17R-метилинцистерол с молекулярной массой 332,2452 дальтон; в качестве 3-го компонента применяют полисахарид β 1-3 глюканом; в качестве 4-го компонента применяют дигидрокверцетин с молекулярной массой 304,26 дальтон.
Штамм культуры Pleurotus ostreatus 1137 хранится во Всероссийской коллекции Промышленных Микроорганизмов, ГосНИИ генетика под регистрационным номером ВКПМ, F-819 и характеризуется следующими признаками.
Культурно-морфологическая характеристика
1. Рост на агаризованных средах
Агаризованное сусло
Мицелий хорошо развит, ватообразный. Растущий мицелий стелющийся, край колонии войлочный, ровный. Скорость роста высокая: за 7-9 суток после высева в центр чашки Петри диаметром 10 см наблюдается полное обрастание агаровой среды. Цвет мицелия белый. Экзопигмент отсутствует. При длительном культивировании (до 30 суток) цвет мицелия не меняется.
Гифы септированные, ветвление частое, под острым или прямым углом, тип ветвления моноподиальный. Образуются пряжки. Диаметр большинства гиф от 2 до 4 мкм; также присутствуют гифы с диаметром от 1 до 8 мкм.
Пептонно-триптонный агар
Мицелий хорошо развит, войлочный. Рост стелющийся, растущий край паутинный, ровный. Скорость роста высокая. Цвет мицелия белый, при длительном культивировании (более 21 суток) возможны палевые или светло-коричневые участки. Экзопигмент отсутствует.
Соевый агар
Мицелий скудный, паутинный, сквозь мицелий видна агаровая среда. Характер роста стелющийся, растущий край ровный, паутинный. Скорость роста низкая: после высева в центр чашки Петри диаметром 10 см наблюдается полное обрастание агаровой среды только на 12-14 сутки роста. Цвет мицелия белый. Экзопигмент отсутствует.
2. Глубинное культивирование
Глубинное культивирование осуществляется в колбах емкостью 750 мл с объемом среды 40…150 мл на качалке с 200 оборотами в минуту. Засев проводили кусочками агара с мицелием.
Среда с суслом
Число колоний зависит от нагрузки посевного материала. За 10-14 суток роста образуется несколько плотных колоний округлой формы, сформировавшихся вокруг посевного материала, и/или много мелких дочерних колоний. Цвет мицелия от белого до светло-бежевого. Цвет среды в процессе культивирования осветляется. Прозрачность среды не меняется. Вес мицелия находится в прямой зависимости от концентрации сусла в среде (от 0,6 до 3 баллингов).
Среда с соевой мукой
Число точек роста значительное, что связано с иммобилизацией мицелия на частицах соевой муки в среде. Рост густой кашицеобразный. При отстаивании мицелий практически не оседает.
Физиолого-биохимическая характеристика
Штамм, как и другие представители рода Pleurotus, растет на различных источниках растительного сырья, содержащих целлюлозу.
Штамм утилизирует глюкозу, сахарозу, декстрин, крахмал, целлюлозу, глицерин.
В качестве источника азота штамм использует пептон, триптон, соевую и овсяную муку.
Растет в диапазоне температур от 8 до 34°С, сохраняет жизнеспособность при температуре от 0 до 40°С, оптимальная температура для роста 24°С.
Растет при значениях pH от 4 до 8, при оптимуме от 6 до 7.
Строгий аэроб.
Патогенность
Штамм не патогенен для людей и животных, но, как представитель вида Pleurotus ostreatus, фитопатогенен для ослабленных лиственных деревьев. Базидиоспоры могут вызывать аллергические реакции у людей.
Антагонистические свойства
В условиях глубинного культивирования проявляется антимикробная активность в отношении грамположительных, грамотрицательных бактерий и грибов.
Новое назначение штамма Pleurotus ostreatus 1137 заключается в его применении в качестве продуцента биологически активного вещества для создания препарата с полифункциональной медико-биологической активностью, влияющего на тканевой обмен и обладающего способностью ингибировать размножение клеток рака, а также гепатопротекторнным и детоксицирующим действием, проявляющимся в блокировке развития стеатогепатита и нормализации липидного спектра в сыворотке крови биологических систем.
Для поверхностного культивирования Pleurotus ostreatus 1137 и тест-штаммов использовали триптонный агар, а также соевую агаровую среду, овсяную агаровую среду и сусло-агар.
Препарат с полифункциональной медико-биологической активностью, влияющий на тканевой обмен, получали биотехническим способом с использованием гриба Pleurotus ostreatus 1137. Указанная культура выращивалась глубинным способом в жидкой стерильной питательной среде.
Процесс получения препарата включал 6 последовательно выполняемых этапов:
I ЭТАП - выращивание биомассы мицелия:
- селекционные работы со штаммом;
- приготовление посевного материала (на агаризованной среде);
- глубинное культивирование мицелия (выращивание на жидких средах и отделение мицелия от культуральной жидкости).
II ЭТАП - Производство сгущенного экстракта мицелия Pleurotus ostreatus 1137 в виде геля, составляющего фармакологическую субстанцию препарата:
- экстракция;
- фильтрация;
- упаривание экстракта (в вакууме).
III ЭТАП - Выделение из отобранной части сгущенного экстракта мицелия Pleurotus ostreatus 1137 в виде геля активного начала производного стерола 4-гидрокси-17R-метилинцистерол дихлорметаном.
IV ЭТАП - Выделение из переработанного мицелия Pleurotus ostreatus 1137, после экстракции из него сгущенного экстракта в виде геля, полисахарида β 1-3 глюкана, полученного путем ферментативного гидролиза экстрагированного этанолом мицелия.
V ЭТАП - Подготовка готовой формы дигидрокверцетина, используемого в составе препарата в качестве дополнительного вещества к сгущенному экстракту, выделенному из экстракта мицелия Pleurotus ostreatus 1137.
VI ЭТАП - Приготовление готовой формы препарата в виде геля, или сиропа, или таблеток или обезвоженных гранул.
Для определения антимикробной активности экстракта мицелия Pleurotus ostreatus 1137 (фармакологической субстанции) глубинное культивирование мицелия проводили в колбах объемом 750 мл на среде, содержащей 0,65 баллинга сусла; воду водопроводную, pH не корректировали. Также использовали среду Эттера, среду 2663, мясо-пептонный бульон и их модификации. Объем среды в колбах составлял 40…150 мл. Для аэрирования колбы помещали на роторную качалку с 200 об/мин. Культивирование и инкубирование проводили от 7 до 24 суток при температуре 26…28°С в регулируемых асептических условиях на жидкой питательной среде при интенсивном аэрировании.
Тест-штаммы инкубировали при температуре 28…37°С в течение 17…24 час.
Установлено, что из числа испытанных питательных сред наиболее оптимальной для роста мицелия по биомассе и антимикробной активности является 0,65 баллинговое сусло.
Для получения препарата вначале мицелий отделяли от нативного раствора центрифугированием.
Из мицелия биологически активные вещества выделяли экстракцией этанолом при кислом значении pH.
Экстракт упаривали в вакууме до гелеобразного состояния с процентным содержанием воды до 30%. Для биологических испытаний использовали упаренный концентрат в виде геля, выделенный из мицелия при кислом значении pH.
Экстракт мицелия Pleurotus ostreatus 1137 в виде геля представляет собой смесь низкомолекулярных биологически активных веществ, обладающих антимикробной активностью.
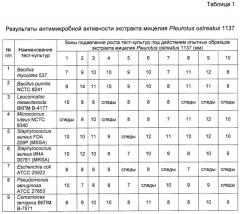
Для определения антимикробной активности экстракта мицелия Pleurotus ostreatus 1137 в качестве тест-культур использовали грамположительные и грамотрицательные бактерии.
Грамположительные бактерии:
Bacillus mycoides 537;
Bacillus pumilis NCTC 8241;
Leuconostoc mesenteroides ВКПМ B-4177;
Micrococcus luteus NCTC 8340;
Staphylococcus aureus FDA 209P (MSSA);
Staphylococcus aureus UHA 00761 (MRSA);
Грамотрицательные бактерии:
Escherichia coli ATCC 25922;
Pseudomonas aeruginosa ATCC 27853;
Comamonas terrigena ВКПМ В-7571.
Антимикробную активность экстракта мицелия Pleurotus ostreatus 1137 определяли методом диффузии в агаре.
В чашки Петри диаметром 10 см разливали по 15 мл триптонного агара. На застывшую поверхность среды высевали сплошным газоном тест-культуры.
Концентрат экстракта мицелия Pleurotus ostreatus 1137 в количестве 10 мл наносили на диски фильтровальной бумаги диаметром 6 мм. Диски помещали на поверхность агаровой среды, засеянной тест-культурами.
После суток инкубирования выявляли зоны задержки роста тест-штамма.
В результате установлено, что у данного штамма Pleurotus ostreatus 1137 на 10-14 сутки роста наблюдается наибольшая антимикробная активность в отношении как грамположительных, так и грамотрицательных бактерий (табл.1).
Задача медико-биологических исследований заявляемого препарата состояла в получении данных, гарантирующих безопасность его применения в лечебно-профилактических целях.
Изучены и стандартизованы:
- химический состав препарата, состоящего из: фармакологической субстанции, включающей экстракт мицелия Pleurotus ostreatus 1137 в виде геля; активного начала производного стерола 4-гидрокси-17R-метилинцистерола; полисахарида β 1-3 глюкана; дигидрокверцетина;
- токсическое действие препарата на мышах обоего пола линии BAL В/С, разведения питомника РАМН «Столбовая», в остром эксперименте для двух его доз 100 мг/кг, 200 мг/кг. При этом 100 мг готового препарата в своем составе содержит: 79,0 мг сгущенного экстракта, выделенного из мицелия Pleurotus ostreatus 1137, составляющего фармакологическую субстанцию препарата; 1,0 мг производного стерола 4-гидрокси-17R-метилинцистерола, составляющего активное начало препарата; 10,0 мг полисахарида β 1-3 глюкана; 10,0 мг дигидрокверцетина. 200 мг дозы готового препарата в своем составе содержит: 158,0 мг сгущенного экстракта, выделенного из мицелия Pleurotus ostreatus 1137, составляющего фармакологическую субстанцию препарата; 2,0 мг производного стерола 4-гидрокси-17R-метилинцистерола, составляющего активное начало препарата; 20,0 мг полисахарида β 1-3 глюкана; 20,0 мг дигидрокверцетина;
- действие активного начала производного стерола 4-гидрокси-17R-метилинцистерол в дозах 1,0 мг/кг и 2,0 мг/кг на клеточном уровне in vitro при использовании простой системы культивирования клеток нормальных (фибробласты человека) и трансформированных (Hela);
- противоопухолевая активность препарата на модели солидной опухоли меланомы В16, перевиваемой инбредным мышам BDF1 - гибриды первого поколения f1 (C57B1/6×DBA2) разведения питомника РАМН «Столбовая». Противоопухолевая активность готовой формы препарата и его составляющих веществ изучалась с учетом полученных результатов токсического действия препарата на следующих вариантах применяемых доз:
- вариант 1 - фармакологическая субстанция препарата, включающая сгущенный экстракт мицелия Pleurotus ostreatus 1137 в виде геля в дозе 100 мг/кг;
- вариант 2 - активное начало производное стерола 4-гидрокси-17R-метилинцистерола в дозе 2,0 мг/кг;
- вариант 3 - заявляемый препарат в виде геля в дозе 100 мг/кг;
- вариант 4 - заявляемый препарат в виде сиропа в дозе 6,0 мл/кг, что соответствует дозе 75 мг/кг препарата в виде геля;
- вариант 5 - заявляемый препарат в виде сиропа в дозе 8,0 мл/кг, что соответствует дозе 100 мг/кг препарата в виде геля;
- влияние фармакологической субстанции препарата и циклофосфана на гематологические показатели переферической крови здоровых мышей;
- гиполипидемическое и гепатопротекторное действие препарата и его составляющих веществ при развитии экспериментального стеатоза печени на модели атерогенной диеты (АД) белым нелинейным лабораторным половозрелым самцам крысам, полученным из питомника ФГУП ОПХ «Манихино». При этом гиполипидемическое и гепатопротекторное действие препарата и его составляющих веществ изучалось на следующих вариантах применяемых доз:
- вариант 1 - активное начало (АН Пр) производное стерола 4-гидрокси-17R-метилинцистерола в дозе 2,0 мг/кг;
- вариант 2 - фармакологическая субстанция (ФС Пр) экстракт мицелия Pleurotus ostreatus 1137 в виде геля в дозе 100 мг/кг;
- вариант 3 - заявляемый препарат в виде сиропа в дозе 8,0 мл/кг, что соответствует дозе 100 мг/кг препарата в виде геля.
На основании проведения экспериментальных исследований получены следующие результаты.
А. Изучение химического состава и стандартизация экстракта мицелия Pleurotus ostreatus 1137 в виде геля, составляющего фармакологическую субстанцию препарата, проводилось после упаривания этанольного экстракта в вакууме при t=40-50°С до однородного вязкого состава, состоящего из смеси липофильных и гидрофильных соединений.
В результате изучения химического состава экстракта мицелия Pleurotus ostreatus 1137 в виде геля было определено в процентном соотношении масс входящих в состав экстракта массовых долей следующих биологически-активных веществ: углеводов; аминокислот; высших жирных кислот; органических кислот; витаминов; минеральных веществ, содержание которых в составе фармакологической субстанции оказывает значительное влияние на результативность медико-биологической активности готовой формы заявляемого препарата.
Для изучения химического состава входящих в экстракт мицелия Pleurotus ostreatus 1137 биологически-активных веществ были отобраны образцы сгущенного экстракта в виде геля, полученного в течение 12-ти месяцев (с начала января по декабрь включительно).
Отбор проб экстракта и подготовка их к анализу проводили по ГОСТ 28495, 1511.0-77, ГОСТ 20438-75.
Определение массовой доли углеводов проводили методом сорбционной хромотографии, основанном на хроматографическом разделении углеводов на анализаторе Сахаров Boitronic LC 2000 с рефрактометрической детекцией бицинхенинатом и нингидрином соответственно /ГФ XI, вып.1, с.95 с изменениями/.
Определение содержания в экстракте аминокислот проводили методом ионообменной хроматографии аминокислот на сильном катионообменнике: сульфированном сополимере стирола с дивинилбензолом путем анализа аминокислот на аминокислотном анализаторе «Hitashi» модель 835, Япония, /ГФ XI, вып.1, с.95; S.Moore, D.Sparckman and W.Stein. Хромотография аминокислот на сульфированных полистироловых смолах, Analit. Chem., V.30, p.p.1185-1190. 1958/.
Определение содержания в экстракте высших жирных кислот проводили методом количественного выделения жирных кислот из сложных многокомпонентных природных смесей и последующего хроматографического анализа в виде метиловых эфиров /Руководство по методам контроля качества Р 4.1.1672-03 Минздрав России, 2004 г., ст.24/.
Определение содержания в экстракте органических кислот проводили методом высокоэффективной жидкостной хроматографии на цветном хроматографе «Kontron» с УФ детектором /Руководство по методам контроля качества Р 4.1.1672-03 Минздрав России, 2004 г., ст.109/.
Определение содержания в экстракте витаминов Е, B1, B2, B6, С, D проводили методом жидкостной хроматографии /Руководство по методам контроля качества Р 4.1.1672-03 Минздрав России, 2004 г., ст.51, 58, 62, 69/.
Определение содержания в экстракте витаминов В3, Вс, и РР проводили микробиологическим методом /Official Methods of Analisis, 15 edition, 1990. Association of Official Analytical Chemists. Volume one, p.129/.
Определение содержания в экстракте элементов минеральных веществ проводили методом инверсионной вольт-амперометрии /Руководство по методам контроля качества Р 4.1.1672-03 Минздрав России, 2004 г., ст.99/.
В результате исследования было установлено, что сгущенный экстракт мицелия Pleurotus ostreatus 1137 в виде геля, составляющий фармакологическую субстанцию препарата, в своем составе содержит находящиеся в нем изучаемые биологически-активные вещества в следующем процентном соотношении масс:
- 47,0-48,0% углеводов (глюкоза, галактозам, манноза, арабиноза, галактоза, ксилоза, глюкозамин - всего 7). Из них содержание глюкозы составляет до 90%;
- 3,5-9,6% аминокислот (аспаргин, серин, треонин, глутамин, пролин, глицин, аланин, валин, изолейцин, лейцин, лизин, гистидин, аргинин, цистин, метионин, тирозин, фенилаланин, этаноламин, орнитин, оксилизин - всего 20);
- 0,6-0,9% высших жирных кислот (каприновая (C10;0), лауриновая (C12:0), миристиновая (C14:0), пентадекановая (С15:0), пентадеценовая (C15:1), пальмитиновая (C16:0), пальмитолеиновая (C16:1), гептадекановая (C17:0), гептадеценовая (C17:1), стеариновая (C18:0), олеиновая (C18:1), линолевая (C18:2), арахиновая (C20:0), эруковая (С22:1), - всего 14);
- 1,02-1,26% органических кислот (масляная, молочная, уксусная, яблочная, щавелевая - всего 5);
- 0,6-1,2% витаминов (B1, B2, В3, B6, Bc, PP, E, D, С, каратиноиды - всего 10);
- 1,4-1,9% минеральных веществ (Na), калий (К), кальций (Са), магний (Mg), фосфор (Р), сера (S), железо (Fe), цинк (Zn), марганец (Mn), медь (Cu), алюминий (Al), бор (В), барий (Ва), кремний (Si), стронций (Sr), литий (Li) - всего 16).
При этом необходимо отметить, что минимальные и максимальные значения ингредиентов химического состава биологически-активных веществ, входящих в состав экстракта мицелия Pleurotus ostreatus 1137 из отобранных образцов экстракта, характеризуются только сезонными колебаниями их содержания в составе экстра