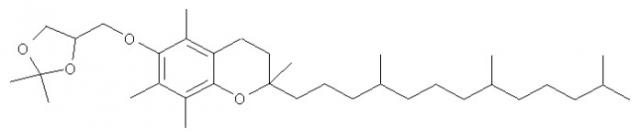
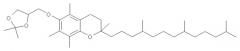
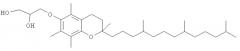
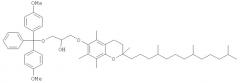
Нуклеиновая кислота формулы (i): glxmgn или (ii): glxmgn, предназначенная для применения прежде всего в качестве иммуностимулятора/адъюванта
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Описана однонитевая РНК общей формулы GlXmGn или ClXmCn, которая модифицирована липидом. Однонитевая РНК может действовать в качестве иммуностимулятора, индуцируя врожденный иммунный ответ. Описана также фармацевтическая композиция. Изобретение может быть использовано для лечения инфекционных болезней, аллергий или раковых заболеваний. 6 н. и 16 з.п. ф-лы, 15 ил., 24 пр., 2 табл.
Реферат
Настоящее изобретение относится к нуклеиновой кислоте общей формулы (I): GlXmGn или (II): ClXmCn, необязательно модифицированной липидом, которую предпочтительно применяют как таковую в качестве иммуностимулятора или в другом варианте в сочетании с другими биологически активными агентами, при этом иммуностимулятор, предлагаемый в изобретении, выполняет в композиции функцию адъюванта, который необязательно можно объединять с другими адъювантами. Таким образом, изобретение относится также к фармацевтической композиции или вакцине, каждая из которых содержит нуклеиновые кислоты формул (I) и/или (II) в качестве иммуностимулятора. Если фармацевтическая композиция содержит иммуностимулятор, предлагаемый в изобретении, в качестве адъюванта, то фармацевтическая композиция содержит по меньшей мере один дополнительное фармацевтически активный компонент, например, антигенный агент. Фармацевтическая композиция, предлагаемая в изобретении, как правило, может содержать фармацевтически приемлемый носитель и необязательно дополнительные вспомогательные вещества, добавки и/или дополнительные адъюванты. Настоящее изобретение относится также к применению фармацевтической композиции или вакцины, предлагаемой в изобретении, для лечения инфекционных болезней, раковых заболеваний, аллергий и аутоиммунных заболеваний. Настоящее изобретение относится также к применению иммуностимулирующего адъюванта, предлагаемого в изобретении, для приготовления фармацевтической композиции, предназначенной для лечения раковых заболеваний, инфекционных болезней, аллергий и аутоиммунных заболеваний.
При применении как обычных, так и генетических вакцин, часто возникает проблема, связанная с тем, что в обработанном или инокулированном организме часто возникает лишь невысокий и поэтому часто недостаточный иммунный ответ. По этой причине в вакцины или к фармацевтически активным компонентам часто добавляют так называемые адъюванты, представляющие собой субстанции или композиции, которые обладают способностью повышать и/или влиять целенаправленным образом на иммунный ответ, например на антиген. Например, известно, что эффективность некоторых применяемых для инъекций медицинских действующих веществ можно значительно повышать путем объединения действующего вещества с адъювантом, который обладает способностью высвобождать действующее вещество в клеточной системе хозяина и необязательно влиять на его поглощение клетками хозяина. Таким путем можно достигать действия, сопоставимого с периодическим введением нескольких небольших доз с регулярными интервалами. Понятие «адъювант» в контексте настоящего описания обычно относится к соединению или композиции, которое(ая) служит в качестве связующего вещества, носителя или вспомогательной субстанции для иммуногенов и/или других фармацевтических действующих веществ.
В данной области предложен в качестве адъювантов целый ряд соединений и композиций, например, адъювант Фрейнда, оксиды металлов (гидроксиды алюминия и т.д.), квасцы, неорганические хелаты или их соли, различные масла типа парафина, синтетические смолы, альгинаты, мукоиды, полисахариды, казеинаты, а также соединения, выделенные из крови и/или сгустков крови, такие, например, как фибриновые производные и т.д. Однако указанные адъюванты во многих случаях вызывают нежелательные побочные действия, например, раздражение и воспаление кожи в области введения. Кроме того, могут иметь место случаи токсических побочных действий, в частности некроз тканей. И, наконец, известные адъюванты в большинстве случаев вызывают неполную стимуляцию клеточного иммунного ответа, поскольку активируют только В-клетки.
Например, известно, что квасцы, оксиды металлов и хелаты солей ассоциированы с образованием стерильных абсцессов. Кроме того, у ученых существуют сомнения в том, что такие соединения полностью выводятся из организма. Скорее они приводят к образованию нежелательных неорганических остатков в организме. Хотя такие соединения, как правило, обладают низкой токсичностью, они могут в результате фагоцитоза проникать в клетки эндоплазматического ретикулума (литоральные и синусоидальные клетки печени и селезенки) в качестве части нежелательного дебриса. Кроме того, есть данные о том, что указанный дебрис может оказывать вредное воздействие на различные механизмы фильтрации в организме, например, в почках, печени или селезенке. Поэтому такие остатки представляют собой скрытый постоянный источник риска в организме, и, как правило, источник риска для иммунной системы.
Синтетические масла и продукты переработки нефти, применяемые в качестве адъювантов в известных прототипах, также обладают побочными действиями. Однако эти соединения являются нежелательными, в частности из-за их быстрого метаболизма в организме и расщепления на ароматические углеводороды. Однако известно, что такие ароматические углеводороды могут обладать очень высоким канцерогенным действием и/или могут вызывать непоправимое повреждение ДНК другими путями, например, в результате интеркаляции в ДНК. Кроме того, продемонстрировано, что указанные соединения связаны также с образованием стерильных абсцессов и редко могут быть удалены полностью из организма.
Соединения, выделенные из животных, например, желатин, также часто являются нежелательными в качестве адъювантов, применяемых для иммунной стимуляции. Хотя указанные соединения, как правило, не обладают деструктивным действием на организм-хозяин или представляющие интерес клетки-хозяева, они обычно слишком быстро мигрируют от места инъекции в организм-хозяин или в клетки-хозяева, в результате чего редко достигаются требования, обычно применяемые к адъюванту, такие, например, как замедленное высвобождение действующего вещества, необязательно инъецируемого вместе с адъювантом, и т.д. Такое быстрое распределение может в некоторых случаях противодействовать танинам или другим (неорганическим) соединениям. Однако метаболизм указанных дополнительных соединений и их приблизительное местонахождение в организме пока не полностью изучены. Однако в этом случае также можно предположить, что эти соединения накаливаются в дебрисе и поэтому могут оказывать воздействие на механизмы фильтрации, например, клеток почки, печени и/или селезенки. Кроме того, желатин, набухающий при парентеральном введении, может приводить в условиях in vivo к нежелательным побочным действиям, таким, например, как опухание, прежде всего в месте введения, и болезненное ощущение.
Соединения, выделенные из крови и/или сгустков крови, такие, например, как фибриновые производные и т.д., как правило, обладают иммуностимулирующими действиями. Однако большинство этих соединений, когда они присутствуют в качестве адъювантов, являются неприемлемыми из-за их побочных действий на иммунную систему (которые имеют место наряду с их требуемыми иммуногенными свойствами). Например, многие такие соединения рассматриваются как аллергенные и в некоторых обстоятельствах приводят к избыточной реакции иммунной системы, существенно превышающей требуемый уровень. Таким образом, эти соединения также являются непригодными в качестве адъювантов для иммунной стимуляции по вышеуказанным причинам.
Таким образом, первым объектом настоящего изобретения являются иммуностимуляторы, которые действуют в качестве адъювантов, при их введении в сочетании с другими биологическим активными соединениями, в частности, при их введении с иммуномодуляторами, предпочтительно в сочетании с соединениями, которые специфически стимулируют иммунную систему, такими как антигены.
Однако (неспецифические) иммуностимулирующие действия можно получать также путем непосредственного применения нуклеиновых кислот для инициации неспецифического иммунного ответа (врожденный иммунный ответ). Последовательности бактериальных CpG-ДНК не только служат в качестве носителей генетической информации. Например, известно, что ДНК играет основную роль в производстве неспецифических иммунных ответов. Бактериальная ДНК, например, действует в качестве сигнала «опасности», предназначенного для изменения иммунных клеток, таких как макрофаги и дендритные клетки, для усиления защитного Th1-поляризованного (специфического) T-клеточного иммунного ответа. Иммуностимулирующее действие, вероятно, обусловлено присутствием неметилированных CG-мотивов, и поэтому такие CpG-ДНК, предложено применять как таковые в качестве иммуностимуляторов (см.US 5663153). CpG-ДНК непосредственно вызывает активацию компонентов врожденный иммунной системы, приводят к повышающей регуляции костимулирующих молекул и провоспалительных цитокинов. Для достижения указанных иммуностимулирующих свойств ДНК можно применять также олигонуклеотиды ДНК, стабилизированные путем фосфоротиоатной модификации (US 6239116). И, наконец, в US 6406705 описаны иммуностимулирующие композиции, которые содержат синергетическую комбинацию олигодекосирибонуклеотида CpG и соединения, не относящегося к нуклеиновым кислотам, для усиления стимулирующего действия на врожденную иммунную систему.
Однако применение ДНК для усиления неспецифического иммунного ответа может быть менее предпочтительным с нескольких позиций. Расщепление ДНК происходит относительно медленно in vivo, поэтому, когда применяют иммуностимулирующую (чужеродную) ДНК, то может происходить образование антител к ДНК, что было подтверждено при создании моделей на животных, таких как мыши (Gilkeson и др., J. Clin. Invest. 95, 1995, cc.1398-1402). Персистентность (чужеродной) ДНК в организме может в результате приводить к сверх активации иммунной системы, что, как известно, вызывает у мышей спленомегалию (Montheith и др., Anticancer Drug Res., 12(5), 1997, cc. 421-432). Кроме того (чужеродная) ДНК может взаимодействовать с геномом хозяина и вызывать мутации, в частности при интеграции в геном хозяина. Например, может иметь место инсерция интродуцированной (чужеродной) ДНК в интактный ген, что представляет собой мутацию, которая может мешать или даже полностью элиминировать функцию эндогенного гена. В результате случаев такой интеграции, с одной стороны, может происходить нарушение ферментных систем, которые являются жизненно важными для клетки, а, с другой стороны, существует риск того, что измененная таким образом клетка может быть трансформирована в состояние дегенерации, если при интеграции (чужеродной) ДНК изменен ген, имеющий решающее значение для регуляции клеточного роста. Таким образом, в известных к настоящему времени процессах нельзя исключать возможный риск образования рака при применении (чужеродной) ДНК в качестве иммуностимулятора.
Таким образом, существенно более целесообразным является применение специфических молекул РНК в качестве соединения, предназначенного для вызывания неспецифического иммунного ответа с помощью врожденной иммунной системы. Известно, что олигонуклеотиды РНК связываются с рецепторами TLR-7/-8, тем самым, усиливая иммуностимулирующее действие. РНК, применяемая в качестве иммуностимулятора, как правило, имеет существенно более короткое время полужизни in vivo, чем ДНК. Несмотря на это, применение даже указанных специфических молекул РНК, известных в данной области в качестве иммуностимуляторов, имеет ограничение. Например, известные к настоящему времени в данной области специфические последовательности РНК обладают лишь ограниченной способностью проникать в клетки in vivo. В результате для иммунной стимуляции могут требоваться увеличенные количества РНК, что, даже без учета повышенной стоимости, связанной с необходимостью вводить повышенные количества РНК, включают риск значительного усиления описанных в целом выше нежелательных побочных действий, например, раздражение и воспаление в области введения. Кроме того, нельзя исключать токсические побочные действия при введении больших количеств иммуностимулятора.
Несмотря на продемонстрированные к настоящему времени успехи, сохраняется потребность и значительный интерес к улучшенным иммуностимуляторам, которые могут усиливать иммунный ответ врожденной иммунной систему пациента, благодаря иммунному ответу на них самих. Таким образом, вторым объектом изобретения являются иммуностимуляторы, которые усиливают неспецифический иммунный ответ путем активации врожденной иммунной системы пациента.
В качестве обоих объектов настоящего изобретения предложены молекулы нуклеиновых кислот следующих формул (I) и (II). Эти предлагаемые в изобретении молекулы нуклеиновых кислот активируют врожденную иммунную систему, вызывая тем самым неспецифический иммунный ответ, и действуют в качестве адъювантов (например, компонентов вакцины), которые поддерживают иммуностимулирующую активность второго соединения, специфически активирующего приобретенную иммунную систему.
Настоящее изобретение относится к нуклеиновой кислоте формулы (I):
GlXmGn,
в которой:
G обозначает гуанозин, урацил или аналог гуанозина или урацила;
Х обозначает гуанозин, урацил, аденозин, тимидин, цитозин или аналог указанных выше нуклеотидов;
l обозначает целое число от 1 до 40,
где, если l обозначает 1, то G обозначает гуанозин или его аналог,
если l>1, то по меньшей мере 50% нуклеотидов представляют собой гуанозин или его аналог;
m обозначает целое число, и оно равно по меньшей мере 3;
где, если m равно 3, то Х обозначает урацил или его аналог,
если m>3, то встречаются по меньшей мере 3 последовательных остатка урацила или аналога урацила;
n обозначает целое число от 1 до 40,
где, если n равно 1, то G обозначает гуанозин или его аналог,
если n>1, то по меньшей мере 50% нуклеотидов представляют собой гуанозин или его аналог.
Кроме того, настоящее изобретение относится к нуклеиновой кислоте формулы (II):
ClXmCn
в которой:
С обозначает цитозин, урацил или аналог цитозина или урацила;
Х обозначает гуанозин, урацил, аденозин, тимидин, цитозин или аналог указанных выше нуклеотидов;
l обозначает целое число от 1 до 40,
где, если l обозначает 1, то С обозначает цитозин или его аналог,
если l>1, то по меньшей мере 50% нуклеотидов представляют собой цитозин или его аналог;
m обозначает целое число, и оно равно по меньшей мере 3;
где, если m равно 3, то Х обозначает урацил или его аналог,
если m>3, то встречаются по меньшей мере 3 последовательных остатка урацила или аналога урацила;
n обозначает целое число от 1 до 40,
где, если n равно 1, то С обозначает цитозин или его аналог,
если n>1, то по меньшей мере 50% нуклеотидов представляют собой цитозин или его аналог.
Нуклеиновые кислоты формулы (I) или (II), предлагаемые в изобретении, как правило, представляют собой сравнительно короткие молекулы нуклеиновой кислоты. Так, нуклеиновая кислота либо формулы (I), либо формулы (II), предлагаемая в изобретении, как правило, включает примерно от 5 до 100 (но в конкретных вариантах осуществления изобретения она может состоять также из более чем 100 нуклеотидов, например, может включать вплоть до 200 нуклеотидов), от 5 до 90 или от 5 до 80 нуклеотидов, предпочтительно от 5 до 70, более предпочтительно примерно от 8 до 60, и более предпочтительно примерно от 15 до 60 нуклеотидов, более предпочтительно от 20 до 60, наиболее предпочтительно от 30 до 60 нуклеотидов. Если нуклеиновая кислота, предлагаемая в изобретении, включает, например, максимум 100 нуклеотидов, то, как правило, m должно быть ≤98.
Нуклеиновая кислота либо формулы (I), либо формулы (II), предлагаемая в изобретении, может представлять собой РНК или ДНК (например, кДНК), она может быть одноцепочечной или двухцепочечной, иметь форму гомо- или гетеродуплекса и быть линейной или кольцевой. Наиболее предпочтительно нуклеиновая кислота либо формулы (I), либо формулы (II), предлагаемая в изобретении, находится в форме одноцепочечной РНК.
G в нуклеиновой кислоте формулы (I), предлагаемой в изобретении, обозначает гуанозин или урацил, или его аналог. В этой связи аналоги гуанозинового или урацилового нуклеотида определяют как не встречающиеся в естественных условиях варианты встречающихся в естественных условиях нуклеотидов. В соответствии с этим аналоги гуанозина или урацила представляют собой дериватизированные химическим путем нуклеотиды, несущие не встречающиеся в нативных нуклеотидах функциональные группы, которые предпочтительно добавлены или удалены путем делении из встречающегося в естественных условиях гуанозинового или урацилового нуклеотида, или которыми заменены встречающиеся в естественных условиях функциональные группы гуанозинового или урацилового нуклеотида. Следовательно, можно модифицировать каждый компонент встречающегося в естественных условиях гуанозинового или урацилового нуклеотида, а именно, компонент, представляющий собой основание, сахарный (рибозный) компонент и/или фосфатный компонент, формирующие остов олигонуклеотида. Фосфатные фрагменты можно заменять, например, фосфорамидатами, фосфоротиоатами, пептидными нуклеотидами, метилфосфонатами и т.д.
Таким образом, аналоги гуанозина или урацила включают, но, не ограничиваясь только ими, любой встречающийся в естественных условиях или не встречающийся в естественных условиях гуанозин или урацил, который изменен химическим путем, например, путем ацетилирования, метилирования, гидроксилирования и т.д., включая, например, 1-метилгуанозин, 2-метилгуанозин, 2,2-диметилгуанозин, 7-метилгуанозин, дигидроурацил, 4-тиоурацил, 5-карбоксиметиламинометил-2-тиоурацил, 5-(карбоксигидроксилметил)урацил, 5-фторурацил, 5-бромурацил, 5-карбоксиметиламинометилурацил, 5-метил-2-тиоурацил, метиловый эфир N-урацил-5-оксиуксусной кислоты, 5-метиламинометилурацил, 5- метоксиаминометил-2-тиоурацил, 5'-метоксикарбонилметилурацил, 5-метоксиурацил, метиловый эфир урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусную кислоту (v). Получение таких аналогов известно специалисту в данной области, оно описано, например, в US 4373071, US 4401796, US 4415732, US 4458066, US 4500707, US 4668777, US 4973679, US 5047524, US 5132418, US 5153319, US 5262530 и 5700642, содержание которых полностью включено в настоящее описание в качестве ссылки. В случае применения указанных выше аналогов предпочтительными согласно изобретению являются те аналоги, которые повышают иммуногенность нуклеиновой кислоты формулы (I), предлагаемой в изобретении, и/или не взаимодействуют с другими интродуцированными модификациями. По меньшей мере один аналог может присутствовать во фланкирующей последовательности Gl и/или Gn, необязательно по меньшей мере 10, 20, 30, 50, 60, 70, 80, 90% нуклеотидов во фланкирующих последовательностях Gl и/или Gn обладают свойствами указанных в настоящем описании аналогов, если фланкирующая последовательность вообще содержит по меньшей мере один аналог. Наиболее предпочтительно все нуклеотиды во фланкирующей последовательности являются аналогами, которые могут (что является наиболее предпочтительным) быть идентичными аналогами нуклеотидов одного и того же типа (например, все гуанозиновые нуклеотиды присутствуют в виде 1-метилгуанозина) или они могут быть различными (например, по меньшей мере два различных гуанозиновых аналога присутствуют вместо встречающегося в естественных условиях гуанозинового нуклеотида). Предпочтительно l и n представляют собой целые числа от 1 до 20, более предпочтительно от 1 до 10 и еще более предпочтительно от 2 до 8.
Количество нуклеотидов G в нуклеиновой кислоте формулы (I), предлагаемой в изобретении, определяется величиной l или n. l и n каждый независимо друг от друга представляют собой целые числа от 1 до 40, причем, если l или n равно 1, то G представляет собой гуанозин или его аналог, и если l или n>1, то по меньшей мере 50% нуклеотидов представляют собой гуанозин или его аналог. Например, если 1 или n=4, то Gl или Gn может представлять собой, но, не ограничиваясь только ими, например, GUGU, GGUU, UGUG, UUGG, GUUG, GGGU, GGUG, GUGG, UGGG или GGGG и т.д.; если l или n равно 5, то Gl или Gn могут представлять собой, например, GGGUU, GGUGU, GUGGU, UGGGU, UGGUG, UGUGG, UUGGG, GUGUG, GGGGU, GGGUG, GGUGG, GUGGG, UGGGG или GGGGG и т.д. Нуклеотид, смежный с Xm в нуклеиновой кислоте формулы (I), предлагаемой в изобретении, предпочтительно не представляет собой урацил.
С в нуклеиновой кислоте формулы (II), предлагаемой в изобретении, обозначает цитозин или урацил, или его аналог. В этой связи аналоги цитозинового или урацилового нуклеотида определяют как не встречающиеся в естественных условиях варианты встречающихся в естественных условиях цитозиновых или урациловых нуклеотидов. В соответствии с этим аналоги цитозина или урацила представляют собой дериватизированные химическим путем нуклеотиды, несущие не встречающиеся в нативных нуклеотидах функциональные группы, которые предпочтительно добавлены или удалены путем делеции из встречающегося в естественных условиях цитозинового или урацилового нуклеотида, или которыми заменены встречающиеся в естественных условиях функциональные группы цитозинового или урацилового нуклеотида. Следовательно, можно модифицировать каждый компонент встречающегося в естественных условиях цитозинового или урацилового нуклеотида, а именно, компонент, представляющий собой основание, сахарный (рибозный) компонент и/или фосфатный компонент, формирующий остов олигонуклеотида. Фосфатные фрагменты можно заменять, например, фосфорамидатами, фосфоротиоатами, пептидными нуклеотидами, метилфосфонатами и т.д.
Таким образом, аналоги цитозина или урацила включают, но, не ограничиваясь только ими, любой встречающийся в естественных условиях или не встречающийся в естественных условиях цитозин или урацил, который изменен химическим путем, например, путем ацетилирования, метилирования, гидроксилирования и т.д., включая, например, 2-тиоцитозин, 3-метилцитозин, 4-ацетилцитозин, дигидроурацил, 4-тиоурацил, 5-карбоксиметиламинометил-2-тиоурацил, 5-(карбоксигидроксилметил)урацил, 5-фторурацил, 5-бромурацил, 5-карбоксиметиламинометилурацил, 5-метил-2-тиоурацил, метиловый эфир N-урацил-5-оксиуксусной кислоты, 5-метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, 5'-метоксикарбонилметилурацил, 5- метоксиурацил, метиловый эфир урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусную кислоту (v). Получение таких аналогов известно специалисту в данной области, оно описано, например, в US 4373071, US 4401796, US 4415732, US 4458066, US 4500707, US 4668777, US 4973679, US 5047524, US 5132418, US 5153319, US 5262530 и 5700642, содержание которых полностью включено в настоящее описание в качестве ссылки. В случае применения указанных выше аналогов предпочтительными согласно изобретению являются те аналоги, которые повышают иммуногенность нуклеиновой кислоты формулы (II), предлагаемой в изобретении, и/или не взаимодействуют с другими интродуцированными модификациями. По меньшей мере один аналог может присутствовать во фланкирующей последовательности Cl и/или Cn, необязательно по меньшей мере 10, 20, 30, 50, 60, 70, 80, 90% нуклеотидов во фланкирующих последовательностях Cl и/или Cn обладают свойствами указанных в настоящем описании аналогов, если фланкирующая последовательность вообще содержит по меньшей мере один аналог. Наиболее предпочтительно все нуклеотиды во фланкирующей последовательности являются аналогами, которые могут (что является наиболее предпочтительным) быть идентичными аналогами нуклеотидов одного и того же типа (например, все цитозиновые нуклеотиды во фланкирующей(их) последовательности(ях) присутствуют в виде 2-тиоцитозина) или они могут быть различными (например, по меньшей мере два различных аналога цитозина присутствуют вместо встречающихся в естественных условиях цитозиновых нуклеотидов во фланкирую щей(их) последовательности(ях)). Предпочтительно l и n представляют собой целые числа от 1 до 20, более предпочтительно от 1 до 10 и еще более предпочтительно от 2 до 8.
Аналогичным образом количество нуклеотидов С в нуклеиновой кислоте формулы (II), предлагаемой в изобретении, определяется величиной l или n. l и n каждый независимо друг от друга представляют собой целые числа от 1 до 40, причем, если l или n равно 1, то С представляет собой цитозин или его аналог, и если l или n>1, то по меньшей мере 50% нуклеотидов представляют собой цитозин или его аналог. Например, если l или n равно 4, то Cl или Cn может представлять собой, но, не ограничиваясь только ими, например, CUCU, CCUU, UCUC, UUCC, CUUC, CCCU, CCUC, CUCC, UCCC или СССС и т.д.; если l или n равно 5, то Cl или Cn может представлять собой, например, CCCUU, CCUCU, CUCCU, UCCCU, UCCUC, UCUCC, UUCCC, CUCUC, CCCCU, CCCUC, CCUCC, CUCCC, UCCCC или ССССС и т.д. Нуклеотид, смежный с Xm в нуклеиновой кислоте формулы (II), предлагаемой в изобретении, предпочтительно не представляет собой урацил.
В контексте настоящего описания понятие «идентичность» относится к сравнению последовательностей с референс-последовательностью, при этом сравнении определяют процент идентичности. Например, для того, чтобы определить процент идентичности двух нуклеотидных последовательностей, прежде всего следует расположить определенным образом последовательности относительно друг друга (выравнивание) для того, чтобы иметь возможность осуществлять последующее сравнение последовательностей. Для этой цели можно, например, в первую нуклеотидную последовательность вводить бреши и можно сравнивать нуклеотиды с нуклеотидами в соответствующем положении второй нуклеотидной последовательности. Если рассматриваемое положение в первой нуклеотидной последовательности занято таким же нуклеотидом, что и в соответствующем положении второй последовательности, то две последовательности являются идентичными в этом положении. Процент идентичности двух последовательностей является функцией количества идентичных положений, распределенных по последовательностям. Если, например, для конкретной нуклеиновой кислоты установлена определенная идентичность последовательности при сравнении с референс-нуклеиновой кислотой, имеющей определенную длину, то этот процент идентичности указывают по отношению к референс-нуклеиновой кислоте. Следовательно, если исходить, например, из нуклеиновой кислоты, которая идентична на 50% референс-нуклеиновой кислоте, состоящей из 100 нуклеотидов, то нуклеиновая кислота может представлять собой, например, нуклеиновую кислоту, состоящую из 50 нуклеотидов, которая полностью идентична участку референс-нуклеиновой кислоты, состоящему из 50 нуклеотидов. Однако, она может представлять собой также нуклеиновую кислоту, состоящую из 100 нуклеотидов, которая является идентичной на 50%, это означает, что в этом случае она имеет 50% идентичных нуклеиновых кислот с референс-нуклеиновой кислотой по всей ее длине. В альтернативном варианте нуклеиновая кислота может представлять собой нуклеиновую кислоту, состоящую из 200 нуклеотидов, которая на участке нуклеиновой кислоты, состоящем из 100 нуклеотидов, полностью идентична референс-нуклеиновой кислоте, состоящей из 100 нуклеотидов. Естественно, существуют другие нуклеиновые кислоты, также удовлетворяющие этим критериям.
Определение процента идентичности двух последовательностей можно осуществлять с помощью математического алгоритма. Примером предпочтительного математического алгоритма, который можно применять для сравнения двух последовательностей, является, но, не ограничиваясь только им, алгоритм, описанный у Karlin и др., PNAS USA, 90, 1993, cc.5873-5877. Этот алгоритм используется в программе NBLAST, с помощью которой можно идентифицировать последовательности, обладающие требуемой идентичностью с последовательностями, предлагаемыми в настоящем изобретении. Для осуществления сравнения последовательностей с использованием брешей можно применять программу «Gapped BLAST», описанную у Altschul и др., Nucleic Acids Res, 25, 1997, cc.3389-3402. При использовании программ BLAST и Gapped BLAST можно применять задаваемые по умолчанию параметры конкретной программы (например, NBLAST). Кроме того, последовательности можно сравнивать с помощью версии 9 программы GAP (программа глобального сравнительного анализа), разработанной «Genetic Computing Group» с использованием задаваемой по умолчанию матрицы (BLOSUM62) (значения от -4 до +11), где штраф за открытие бреши равен -12 (для первого нуля в бреши) и штраф за расширение бреши составляет -4 (для каждого дополнительного последующего нуля в бреши). После сравнения рассчитывают процент идентичности в виде процента относительно количества нуклеиновых кислот в заявляемой последовательности. Описанные методы определения процента идентичности двух нуклеотидных последовательностей можно применять соответственно также и для аминокислотных последовательностей с использованием соответствующих программ.
Когда в формуле (I) l или n>1, то предпочтительно также, чтобы по меньшей мере 60, 70, 80, 90 или даже 100% нуклеотидов представляли собой гуанозин или его аналог, как он определен выше в настоящем описании. Остальные нуклеотиды, дополняющие до 100% (если на долю гуанозина приходится менее 100% нуклеотидов) фланкирующие последовательности Gl и/или Gn, представляют собой урацил или его аналог, как он определен выше в настоящем описании. Предпочтительно также l и n каждый независимо друг от друга обозначают целое число от 2 до 30, более предпочтительно целое число от 2 до 20, и еще более предпочтительно целое число от 2 до 15. При необходимости нижний предел значений l или n можно варьировать, он составляет по меньшей мере 1, предпочтительно по меньшей мере 2, более предпочтительно по меньшей мере 3, 4, 5, 6, 7, 8, 9 или 10. Это определение применимо соответственно также и к формуле (II).
Х в нуклеиновой кислоте либо формулы (I), либо формулы (II), предлагаемой в изобретении, обозначает гуанозин, урацил, аденозин, тимидин, цитозин или его аналог. В этом контексте аналоги нуклеотидов определяют как не встречающиеся в естественных условиях варианты встречающихся в естественных условиях нуклеотидов. В соответствии с этим аналоги представляют собой дериватизированные химическим путем нуклеотиды, несущие не встречающиеся в нативных нуклеотидах функциональные группы, которые предпочтительно добавлены или удалены путем делеции из встречающегося в естественных условиях нуклеотида, или которыми заменены встречающиеся в естественных условиях функциональные группы нуклеотида. Следовательно, можно модифицировать каждый компонент встречающегося в естественных условиях нуклеотида, а именно, компонент, представляющий собой основание, сахарный (рибозный) компонент и/или фосфатный компонент, формирующий остов олигонуклеотида. Фосфатные фрагменты можно заменять, например, фосфорамидатами, фосфоротиоатами, пептидными нуклеотидами, метилфосфонатами и т.д. Предпочтительно по меньшей мере 10%, более предпочтительно по меньшей мере 20%, более предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 70% и еще более предпочтительно по меньшей мере 90% всех обозначенных символом «X» нуклеотидов обладают свойствами аналога, как он определен в настоящем описании, если нуклеиновая кислота, предлагаемая в изобретении, вообще содержит по меньшей мере один аналог. Аналоги, замещающие конкретный тип нуклеотида в коровой последовательности, образованной «Xm», могут быть идентичными, например, все цитозиновые нуклеотиды, встречающиеся в коровых последовательностях, могут представлять собой 2-тиоцитозин, или они могут представлять собой различные аналоги конкретного нуклеотида, например, в коровой последовательности могут содержаться по меньшей мере два различных аналога цитозина.
Аналоги гуанозина, урацила, аденозина, тимидина, цитозина включают, но, не ограничиваясь только ими, любой встречающийся в естественных условиях или не встречающийся в естественных условиях гуанозин, урацил, аденозин, тимидин или цитозин, который изменен химическим путем, например, путем ацетилирования, метилирования, гидроксилирования и т.д., включая, 1-метиладенозин, 2-метиладенозин, 2-метилтио-N6-изопентиниладенозин, N6-метиладенозин, N6-изопентениладенозин, 2-тиоцитозин, 3-метилцитозин, 4-ацетилцитозин, 2,6-диаминопурин, 1-метилгуанозин, 2-метилгуанозин, 2,2-диметилгуанозин, 7-метилгуанозин, инозин, 1-метилинозин, дигидроурацил, 4-тиоурацил, 5-карбоксиметиламинометил-2-тиоурацил, 5-(карбоксигидроксилметил)урацил, 5-фторурацил, 5-бромурацил, 5-карбоксиметиламинометилурацил, 5-метил-2-тиоурацил, метиловый эфир N-урацил-5-оксиуксусной кислоты, 5-метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, 5'-метоксикарбонилметилурацил, 5-метоксиурацил, метиловый эфир урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусную кислоту (v), квеозин, β-D-маннозилквеозин, вибутоксизин и инозин. Получение таких аналогов известно специалисту в данной области, оно описано, например, в US 4373071, US 4401796, US 4415732, US 4458066, US 4500707, US 4668777, US 4973679, US 5047524, US 5132418, US 5153319, US 5262530 и 5700642, содержание которых полностью включено в настоящее описание в качестве ссылки. В случае применения указанных выше аналогов предпочтительными согласно изобретению являются те аналоги, которые повышают иммуногенность нуклеиновой кислоты либо формулы (II), либо формулы (II), предлагаемой в изобретении, и/или не взаимодействуют с другими интродуцированными модификациями.
Количество Х в нуклеиновой кислоте либо формулы (II), либо формулы (II), предлагаемой в изобретении, определяется величиной m. m представляет собой целое число и, как правило, оно равно по меньшей мере 3, 4, 5, 6, 7, 8, 9 или 10, при этом, когда m равно 3, то X представляет собой урацил или его аналог, и когда m>3, то присутствуют по меньшей мере 3 расположенных непосредственно друг за другом остатка урацила или его аналогов. Такую последовательность, включающую по меньшей мере 3 расположенных непосредственно друг за другом остатка урацила, обозначают в контексте настоящего описания как «монотонная урациловая последовательность». Монотонная урациловая последовательность, как правило, содержит по меньшей мере 3, 4, 5, 6, 7, 8, 9 or 10, 10-15, 15-20, 20-25, 25-30, 30-50 или 50-90 остатков урацила или необязательно аналогов урацила, как они определены выше. Такая монотонная урациловая последовательность встречается по меньшей мере один раз в нуклеиновой кислоте либо формулы (I), либо формулы (II), предлагаемой в изобретении. Таким образом, может встречаться, например, 1, 2, 3, 4, 5 или большее количество монотонных урациловых последовательностей, содержащих по меньшей мере 3 остатка урацила или его аналогов, причем монотонные урациловые последовательности могут прерываться по меньшей мере одним остатком гуанозина, аденозина, тимидина, цитозина или его аналога, предпочтительно 2, 3, 4, 5 или большим количеством остатков. Например, если m равно 3, то Xm представляет собой UUU. Если m равно 4, то Xm может представлять собой, но, не ограничиваясь только ими, например, UUUA, UUUG, UUUC, UUUU, AUUU, GUUU или CUUU и т.д. Если n равно 10, то Xn, может представлять собой, но, не ограничиваясь только ими, например, UUUAAUUUUC, UUUUGUUUUA, UUUGUUUGUU, UUGUUUUGUU, UUUUUUUUUU и т.д. Нуклеотиды, смежные с Gl или Gn в нуклеиновой кислоте формулы (I), предлагаемой в изобретении, предпочтительно представляют собой урацил или его аналоги. Аналогично этому нуклеотиды, смежные с Cl или Cn в нуклеиновой кислоте формулы (II), предлагаемой в изобретении, предпочтительно представляют собой урацил или его аналоги.
Когда m>3, то, как правило, по меньшей мере 50%, предпочтительно по меньшей мере 60, 70, 80, 90 или даже 100% нуклеотидов представляют собой урацил или его аналог, как он определен выше. Тогда остальные нуклеотиды, дополняющие последовательность до 100% (если на долю урацила приходится менее 100% нуклеотидов в последовательности Xm) представляют собой гуанозин, урацил, аденозин, тимидин, цитозин или их аналоги, как они определены выше. Предпочтительно также m представляет собой целое число и оно равно по меньшей мере 4, 5, 6, 7, 8, 9 или 10, 10-15, 15-20, 20-25, 25-30, 30-50 или 50-90.
Нуклеиновая кислота формулы (I), предлагаемая в изобретении, наиболее предпочтительно содержит по меньшей мере одну из следующих последовательностей, представленных в SEQ ID NO:1-80:
GGUUUUUUUUUUUUUUUGGG (SEQ ID NO:1);
GGGGGUUUUUUUUUUGGGGG (SEQ ID NO:2);
GGGGGUUUUUUUUUUUUUUUUUUUUUUUUUUUUUUGGGGG (SEQ ID NO:3);
GUGUGUGUGUGUUUUUUUUUUUUUUUUGUGUGUGUGUGU (SEQ ID NO:4);
GGUUGGUUGGUUUUUUUUUUUUUUUUUGGUUGGUUGGUU (SEQ ID NO:5);
GGGGGGGGGUUUGGGGGGGG (SEQ ID NO:6);
GGGGGGGGUUUUGGGGGGGG (SEQ ID NO:7);
GGGGGGGUUUUUUGGGGGGG (SEQ ID NO:8);
GGGGGGGUUUUUUUGGGGGG (SEQ ID NO:9);
GGGGGGUUUUUUUUGGGGGG (SEQ ID NO:10);
GGGGGGUUUUUUUUUGGGGG (SEQ ID NO:11);