Способ моделирования спаечной болезни в эксперименте
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и может быть применимо для моделирования спаечной болезни в эксперименте. Выполняют экспериментальному животному под наркозом срединную лапаротомию. Для формирования спаек накладывают один-два стежка на париетальную сторону брюшной стенки стерильной полипропиленовой нитью, размером 4/0-6/0. Способ позволяет сформировать контролируемый спаечный процесс без излишнего развития воспалительного процесса. 2 ил.
Реферат
Изобретение относится к медицине и может быть использовано в экспериментальной хирургии для моделирования спаечной болезни у лабораторных животных.
Одной из актуальной проблем как сердечно-сосудистой, так и абдоминальной хирургии является развитие спаечного процесса и формирование спаек после оперативного вмешательства. Спаечная болезнь сопровождается высоким риском осложнений при повторных операциях и высокой летальностью. Литературные данные свидетельствуют, что до настоящего времени отсутствуют надежные методы профилактики послеоперационных спаек. В целях разработки и экспериментальной апробации антиспаечных средств необходимы адекватные методики формирования спаек в эксперименте на животных.
В качестве объекта для моделирования спаечного процесса преимущественно используют лабораторных крыс, поскольку площадь перитонеальной поверхности относительно поверхности тела больше у мелких лабораторных животных, чем у крупных. Модель патологического состояния должна быть воспроизводимой и надежной.
Известна комплексная модель формирования спаек в эксперименте (патент на изобретение РФ №2217801, МПК G09B 23/28, А61В 17/00, опубл. 27.11.2003 г.). В стерильных условиях при проведении эксперимента лабораторным животным под наркозом производят срединную лапаротомию, после вскрытия брюшной полости париетальную брюшину вентральной брюшной стенки справа и слева отслаивают и иссекают на площади 1 см2 с каждой стороны. В лапаратомную рану выводят органокомплекс, состоящий из петель тонкого и толстого кишечника, а на основание комплекса накладывают латексное кольцо, диаметром 0,5-2 см на 30 минут. По истечении времени экспозиции органы брюшной полости, париетальную брюшину, в том числе с десерозированными участками, обрабатывают 0,1% раствором перманганата калия.
Недостатками способа являются высокая хирургическая агрессия, ишемизация и высушивание брюшины, механическое и химическое повреждение органов брюшной полости, которое влечет за собой высокую смертность экспериментальных животных - до 30%, а у выживших животных лишь в 50% наблюдается формирование спаечного процесса.
Известен способ моделирования спаечной болезни путем внутрибрюшинного введения крысам 15 мл 2% раствора хитозана (патент на изобретение РФ №2234741, МПК G09B 23/28, опубл. 20.08.2004). При использовании данного способа животные подвергаются минимальному хирургическому вмешательству, а формирование плотных спаек наблюдается к 14 суткам эксперимента. К недостаткам способа можно отнести большой объем введенного гелеобразного хитозана в брюшную полость по отношению к массе животного, что приводит к заполнению брюшной полости раствором хитозана и повышению внутрибрюшного давления. Кроме того, предложенная модель не позволяет оценить влияние шовного материала на формирование спаечного процесса и не учитывает реальные условия хирургического вмешательства, что исключает возможность тестирования образцов антиспаечных материалов.
Наиболее близким к заявляемому является способ моделирования спаечной болезни с использованием биорезорбируемых шовных материалов, полидиоксанона и полиглактина (Neff, MR Adhesion formation and histologic reaction with polydioxanone and polyglactin suture/ Neff MR, Holtz GL, Betsill WL Jr.// Am J Obstet Gynecol. - 1985. - Jan 1; 151(1). - P.20-3). Кроликам-самкам после лапаротомии рассекали рога матки и затем сшивали, используя различный шовный материал. По истечении 28 суток после операции оценивали наличие и выраженность спаечной болезни.
Недостатками способа являются сложность моделирования спаечной болезни, большая площадь раневой поверхности, что приводит к применению излишнего количества шовного материала и, как следствие, к развитию воспалительного процесса в брюшной полости животного и избыточному спайкообразованию, что в конечном итоге не позволяет оценить эффективность антиспаечных материалов в эксперименте.
Техническим результатом предлагаемого изобретения является формирование контролируемого спаечного процесса в брюшной полости животного в 100% случаев на 7-е сутки эксперимента.
Предложен способ моделирования спаечной болезни в эксперименте, включающий выполнение экспериментальному животному под наркозом срединной лапаротомии и повреждение брюшины шовным материалом.
Отличием является то, что для формирования спаек накладывают один-два стежка на париетальную сторону брюшной стенки стерильной полипропиленовой нитью размером 4/0-6/0.
Для определения спайкообразующего эффекта шовного материала, проведено исследование с использованием лабораторных крыс линии Wistar. Использование в эксперименте лабораторных крыс позволяет увеличить число животных в эксперименте, провести корректную статистическую обработку полученных результатов.
Разделение животных по группам в зависимости от вида шовного материала представлено в таблице 1.
| Таблица 1 | ||
| № серии | Количество животных | Шовный материал |
| 1 | 21 | Прошивание брюшины нитью Пролен 5/0 |
| 2 | 21 | Прошивание брюшины нитью Gore-Tex 5/0 |
| 3 | 21 | Прошивание брюшины рассасывающейся нитью MonoPlus 5/0 |
| 4 | 21 | Прошивание брюшины нитью на основе сплава из никелида титана 5/0 |
Прошивание брюшины осуществляли нитью Пролен 5/0, Gore-Tex 5/0, MonoPlus 5/0 и нитью на основе сплава из никелида титана 5/0. Через 7, 14 и 28 суток после операции оценивали выраженность спаечной болезни, наличие и плотность образованных спаек. Наиболее выраженные спайки во всех контрольных точках эксперимента были отмечены в группе животных, которым брюшную стенку прошивали полипропиленовой нитью (Пролен 5/0). К седьмым суткам эксперимента у 100% животных были сформированы плотные, васкуляризованные спайки, отделяемые только острым способом. При использовании нити на основе политетрафторэтилена Gore-Tex, полидиоксанона и на основе никелида титана спайки сформировались лишь у 50% животных. У остальных животных диагностированы рыхлые спайки, за исключением 2-й группы, где у 60% спайки были плотные, васкуляризованные, а у 40%- рыхлые, отделяемые тупым способом. Результаты исследования представлены в таблице 2.
| Таблица 2 | ||||
| № серии | Летальный исход в эксперименте | Кол-во животных с выраженными спайками | Кол-во животных с рыхлыми спайками | Количество животных без спаек |
| 1 | 0 | 20 | 0 | 0 |
| 2 | 0 | 6 | 4 | 10 |
| 3 | 0 | 2 | 9 | 9 |
| 4 | 0 | 3 | 8 | 9 |
При гистологическом исследовании удаленных спаек с окружающими тканями, вокруг нитей наблюдали лимфоцитарную инфильтрацию, локализованную преимущественно вокруг шовного материала. Особенно характерна данная картина при использовании полипропиленовой нити. Менее выраженная реакция была отмечена при применении TiNi, Gore-Tex и MonoPlus.
Преимущество предложенного способа заключается в том, что уже через семь дней после операции в брюшной полости животного формируются плотные, васкуляризированные спайки в 100% случаев, что позволяет в короткие сроки проводить оценку эффективности противоспаечных материалов. Кроме того, для формирования спаечной болезни необходимо наложить всего один-два стежка полипропиленовой нитью, что позволяет сократить время операции и значительно уменьшить количество используемого шовного материала.
Для оценки эффективности противоспаечных агентов образцы материала необходимо помещать между прошитой брюшной стенкой и кишечником.
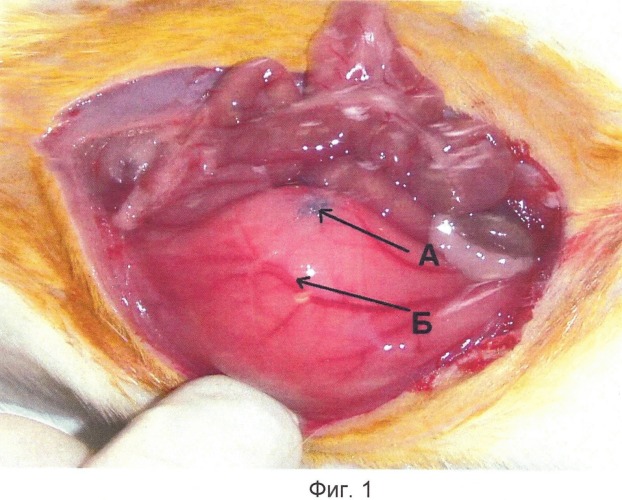
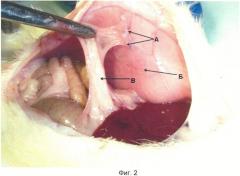
Сущность изобретения поясняется чертежами, где на фиг.1 изображена висцеральная брюшина экспериментального животного с наложенными стежками полипропиленовой нити, на фиг.2 - сформированные спайки, припаивающие висцеральную и париетальную брюшину животного.
Способ осуществляют следующим образом. Крысам линии Wistar, весом 250-300 г, под наркозом проводят срединную лапаротомию, после вскрытия брюшной полости на париетальную брюшину (Б) вентральной брюшной стенки накладывают один-два стежка стерильной полипропиленовой нитью (А). Затем в операционную рану вводят 5 мл стерильного физиологического раствора во избежание высыхания органов брюшной полости, после чего нитью Лавсан послойно ушивают брюшину. На 7-е сутки эксперимента проводят оценку спаечного процесса, при этом в брюшной полости в местах наложенных швов (А) определяют формирование зрелых, васкуляризованных спаек (В).
Таким образом, предложенный способ формирования спаечной болезни в эксперименте позволяет создать управляемую модель адгезивного процесса и может быть использован для оценки эффективности противоспаечных барьеров в короткие сроки.
Способ моделирования спаечной болезни в эксперименте, включающий выполнение экспериментальному животному под наркозом срединной лапаротомии и повреждение брюшины шовным материалом, отличающийся тем, что для формирования спаек накладывают один-два стежка на париетальную сторону брюшной стенки стерильной полипропиленой нитью размером 4/0-6/0.