Синтез наночастиц оксида церия в сверхкритической воде
Иллюстрации
Показать всеИзобретение может быть использовано в химической промышленности. Получение наночастиц оксида церия СеО2 осуществляют смешением 0,2 М раствора Се(NO3)3·6Н2О со сверхкритической водой. Реакцию проводят при температуре 370-390°С и при давлении 240-260 атмосфер. Отношение объема раствора соли церия к объему свекрхкритической воды равно, предпочтительно, 2:10. Изобретение позволяет получить технический результат, заключающийся в синтезе наночастиц оксидов металлов и создании экологически чистой безотходной технологии. 1 з.п. ф-лы, 1 пр., 2 ил.
Реферат
Изобретение относится к области получения нано- и микрочастиц оксидов металлов, а именно оксида церия, в сверхкритической воде и может найти применение в получении материалов и соединений высокой чистоты и с уникальными свойствами.
Для синтеза наноструктурных материалов, представителями которых являются наночастицы, нанопленки и нанопроволоки, предложено много методов, которые можно разделить на две принципиальные группы. Первая, получение наноструктур из материалов нормальных размеров, т.е. bulk materials. Вторая, получение наноструктур из систем молекулярного уровня.
Чистые оксиды различных металлов находят широкое применение в практике. Многие оксиды, в первую очередь, Al2O3, W2O5, Cr2O3, Fe2O3 и др., используются в качестве катализаторов, другие - для упрочнения металлов и для получения ферритов.
Основными методами синтеза или получения чистых оксидов металлов являются термическое разложение солей (сухой метод) при высоких температурах и осаждение гидроокисей из растворов (влажный метод) с последующим их прокаливанием.
К основным недостаткам известных методов синтеза оксидов металлов следует отнести:
1. Нитраты щелочных металлов, применяемые в качестве исходных веществ, при прокаливании переходят в нитриты и оксидов не образуют.
2. Прокаливанием некоторых солей очень трудно получить, например, оксиды стронция или бария, так как их карбонаты начинают разлагаться только при 1200-1300°С.
3. Прокаливанием солей трудно получить чистые оксиды металлов.
4. Соли, образованные нелетучими кислотами (фосфаты, бораты, вольфраматы и др.), при нагревании не разлагаются, за исключением солей аммония и ртути, и потому не могут служить исходными веществами для получения оксидов соответствующих металлов.
5. При прокаливании аммонийных солей выделяется аммиак-восстановитель, что может привести к загрязнению получаемого продукта низшими оксидами элементов.
6. Поскольку большинство гидроокисей (для метода получения окислов металлов из гидроокисей), осаждаемых из растворов, трудно получить в чистом, свободном от примесей состоянии, трудно получить индивидуальные окислы в чистом виде также.
7. Дегидратация гидроокисей при их прокаливании не всегда идет до конца, и часто полученные таким образом оксиды содержат небольшое количество гидроокиси.
8. Чистота и свойства оксидов металлов, полученных этими методами, сильно зависят от режима и температуры прокаливания.
Сверхкритические флюиды являются привлекательной средой для синтеза, модификации и формирования наночастиц неорганических материалов, в частности оксидов металлов (TiO2, Cr2O3, LiFePO4) [Reverchon E., Adami R. Nanomaterials and supercritical fluids // J. of Supercritical Fluids. 2006. V.37. P.1; Jung J., Perrut M. Particle design using supercritical fluids: Literature and patent survey // J. of Supercritical Fluids. 2001. V.20. P.179; Zhang Y., Erkey C. Preparation of supported metallic nanoparticles using supercritical fluids: A review // J. of Supercritical Fluids. 2006. V.38. P.252; Aymonier C., Loppiner-Serani A., Reveron H., Garrabos Y., Cansell F. Review of supercritical fluids in inorganic materials science // J. of Supercritical Fluids. 2006. V.38. P.242]. Такие наноструктуры и материалы демонстрируют необычные свойства, отличные от таковых для массивных материалов.
Известен метод синтеза частиц оксидов металлов [T.Adschiri, Y.Hakuta, K.Arai, Hydrothermal synthesis of metal oxide fine particles at supercritical conditions, Ind. Eng. Chem. Res. 39 (2000) 4901; T.Adschiri, Y.Hakuta, K.Sue, K.Arai, Hydrothermal synthesis of metal oxide nanoparticles at supercritical conditions, J.Nanopart. Res. 3 (2001) 227; A.Cabanas, J.Darr, E.Lester, M.Poliakoff, Continuous hydrothermal synthesis of inorganic materials in a near-critical water flow reactor; the one-step synthesis of nano-particulate Ce1-xZrxO2 (x=0-1) solid solutions, J. Mater. Chem. 11 (2001) 561], при помощи которого осуществляют гидротермальный синтез нано- и микрочастиц оксидов металлов в сверхкритической воде - ск-Н2О.
Несколько основных одно- и многостадийных химических реакций прекурсора и солей металлов могут реализовываться при синтезе частиц в ск-Н2О: гидролиз и дегидратация, термолиз, восстановление (как правило, в присутствии водорода) и окисление. В области критических параметров воды увеличивается ее диссоциация и, следовательно, концентрация в ней H+и ОН--. В результате этого, гидротермический синтез в ск-Н2О наночастиц оксидов металлов из их солей осуществляется в результате двухстадийных реакций гидролиза и дегидратации:
Гидролиз: MeBn+nHO-→Me(OH)n+nB-
Дегидратация: Me(OH)n→MeOn/2+n/2H2O
Гидротермальный метод прост в реализации и масштабировании, осуществляется в реакторах автоклавов или проточных трубчатых реакторах, позволяет контролировать свойства и размер частиц.
Известен способ гидротермального синтеза частиц оксидов металлов, принятый нами за прототип [S.Kawasaki, Y.Xiuyi, K.Sue, Y.Hakuta, A.Suzuki, K.Arai. Continuous supercritical hydrothermal synthesis of controlled size and highly crystalline anatase TiO2 nanoparticles. J. Supercritical Fluids 50 (2009) 276-282], при помощи которого проводят непрерывный синтез наночастиц двуокиси титана - TiO2 в сверхкритической воде в присутствие КОН.
К главному недостатку прототипа следует отнести применение КОН для изменения растворимости материалов прекурсора. В результате применения КОН в процессе реакции образуется калия сульфат - K2SO4, удаление которого из продуктов реакции требует дополнительно промывки.
Изобретение решает задачу эффективного синтеза соединений оксидов металлов, а именно оксида церия
Предложен способ получения наночастиц оксида церия CeO2, который осуществляют смешением 0.2 М раствора соли церия Се(NO3)3 6H2O со сверхкритической водой при температуре реакции 370-390°С и давлении 240-260 атм.
Отношение объема раствора соли церия к объему сверхкритической воды равно, предпочтительно, 2:10.
Технический результат - синтез оксида церия на основе наночастиц, создание экологически чистой безотходной технологии.
Исходный маточный раствор для синтеза оксида церия готовят растворением в воде 0.2 М Се(NO3)3 6H2O в воде.
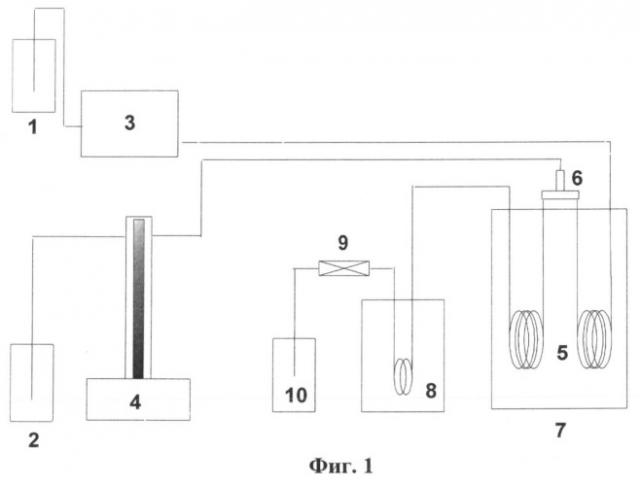
Гидротермальный синтез проводят в непрерывном режиме в реакторе проточного типа, Фиг.1.
Маточный раствор из емкости - 2 шприцевым насосом - 4 подают в трубчатый реактор - 5 объемом 7.2 см3, помещенный в печь с кипящим слоем песка - 7, - поток 1 через смеситель - 6, в котором происходит его смешение со ск-Н2О - поток 2, подаваемый поршневым насосом - 3 из емкости - 1 в непрерывном режиме. Превращения проводят при температурах и давлениях, близких к критическим параметрам смеси, содержащей более 95% воды, - температура 370-390°С, давление 240-260 атм. Продукты взаимодействия солей с ск-Н2О выходят из реактора в теплообменник - 8 через клапан обратного давления - 9 в накопительную емкость - 10.
Продукты гидротермального синтеза, в зависимости от размера и свойств образующихся кристаллов, часто представляют собой неосаждающуюся смесь частиц в воде. Выделение образующихся частиц оксида металла из раствора для анализа твердой фазы проводят центрифугированием раствора или выпариванием, с последующей сушкой твердой фазы.
Структура, фазовый и элементный состав образцов полученных соединений анализируют методами электронной сканирующей микроскопии (HRTEM), рентгено-фазового анализа (XRD). В отдельных случаях, образовавшиеся водные продукты анализируют с использованием метода UV спектроскопии.
Сущность изобретения иллюстрируется следующим примером и иллюстрациями.
Пример 1. Синтез оксида церия СеО2
Для синтеза готовят 0.2 М раствор соли Се(NO3)3 6H2O в воде. Температура проведения реакции равняется 370-390°С, давление 240-260 атм. Объемный расход воды - поток 2 составляет 10 мл/мин, объемный расход реагента - поток 1 равен 3 мл/мин. Продукты реакции представляют собой раствор белесовато-желтого цвета, с последующим медленным осаждением твердого осадка.
По данным HRTEM, твердые продукты синтеза представляют собой однородную смесь хорошо ограненных изометричных кристаллов с размерами ~100 нм, Фиг.2а, б. Структура кристаллов дислокационная, блочная, наблюдаются дендритовидные срастания этих кристаллов. EDX раствора продуктов дает интенсивную линию Се. По результатам XRD основной синтезируемой твердой фазой является СеО2.
Приведенный пример и иллюстрации демонстрируют, что предложенный метод и условия гидротермального синтеза позволяют синтезировать наночастицы оксидов металлов требуемого размера и свойств.
Как видно из текста и примеров, изобретение решает задачу синтеза соединений оксидов металлов на основе наночастиц, создание экологически чистой безотходной технологии.
1. Способ получения наночастиц оксида церия CeO2, отличающийся тем, что его осуществляют смешением 0,2М раствора соли церия Се(NO3)3·6Н2О со сверхкритической водой при температуре реакции 370-390°С и давлении 240-260 атм.
2. Способ по п.1, отличающийся тем, что отношение раствора соли церия к сверхкритической воде равно предпочтительно 2:10.