Композиции рекомбинантных антител против рецептора эпидермального фактора роста
Иллюстрации
Показать всеИзобретение относится к области иммунологии. Предложена композиция, содержащая по меньшей мере два антитела, которые связывают различные эпитопы EGFR (ErbB-1) человека, обеспечивая синергетический эффект, а также биспецифическая молекула, представляющая собой антитело или его фрагмент, содержащий последовательности CDR антител в составе композиции по изобретению. Рассмотрено применение композиции по изобретению для изготовления лекарственного средства и фармацевтическая композиция, содержащая композицию по изобретению. Композиция по настоящему изобретению обеспечивает синергетическое действие анти-EGFR антител, что может найти дальнейшее применение в лечении рака. 5 н. и 15 з.п. ф-лы, 42 ил., 17 табл., 21 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к области рекомбинантных антител, применяемых для терапевтического лечения рака у человека.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Рецептор эпидермального фактора роста (EGFR) играет важную роль в клеточной пролиферации, а также в апоптозе, ангиогенезе и распространении метастазов, процессах, которые имеют ключевое значение для прогрессирования опухолей (Salomon et al., Crit. Rev. Oncology/Haematology, 19:183-232 (1995); Wu et al., J. Clin. Invest., 95:1897-1905 (1995); Karnes et al., Gastroenterology, 114:930-939 (1998); Woodburn et al., Pharmacol. Therap. 82: 241-250 (1999); Price et al., Eur. J. Cancer, 32A:1977-1982 (1996)). Действительно, исследования показали, что EGFR-опосредованный клеточные рост увеличивается при многих солидных опухолях, включая немелкоклеточный рак легкого, рак предстательной железы, рак молочной железы, рак желудка, а также опухоли головы и шеи (Salomon DS et al., Critical Reviews in Oncology/Haematology, 19:183-232 (1995)). Кроме того, сейчас известно, что избыточная активация EGFR на поверхности раковых клеток ассоциирована с поздними стадиями заболевания, развитием метастатического фенотипа и плохим прогнозом у пациентов, страдающих раком (Salomon DS et al., Critical Reviews in Oncology/Haematology 19:183-232 (1995)).
Кроме того, экспрессия EGFR часто сопровождается выработкой клетками, экспрессирующими EGFR, среди прочего, EGFR-лигандов, TGF-альфа и EGF, что позволяет думать об участии аутокринной петли в прогрессировании этих клеток (Baselga, et al. (1994) Pharmac. Therapeut. 64: 127-154; Modjtahedi, et al. (1994) Int. J. Oncology. 4:277-296). Следовательно, блокирование взаимодействия между такими EGFR-лигандами и EGFR способно ингибировать рост и выживание опухолей (Baselga, et al. (1994) Pharmac. Therapeut. 64:127-154).
EGFR представляет собой мембраносвязанный гликопротеин с молекулярным весом приблизительно 170 кДа. EGFR состоит из гликозилированного наружного лигандсвязывающего домена (621 остаток) и цитоплазматического домена (542 остатка), связанных коротким трансмембранным линкером из 23 аминокислот. Внеклеточная часть EGFR содержит 25 дисульфидных мостиков, 12 N-связанных сайтов гликозилирования и обычно считается состоящей из четырех субдоменов. Рентгеновские кристаллические структуры EGFR позволяют полагать, что рецептор может принимать как аутоингибированную связанную конформацию, которая неспособна связывать EGF (Ferguson et al., Mol Cell, 2003, vol 11:507-517), так и активную конформацию, которая может опосредовать связывание лиганда EGF и димеризацию рецептора (Garret et al., Cell 2002, vol 110:763-773; Ogiso et al., Cell, 2002, vol 110:775-787). Было выдвинуто предположение о том, что домен I и домен III, в частности, обеспечивают аддитивный вклад в образование высокоаффинного сайта связывания лиганда. Домены II и IV представляют собой богатые цистеином ламининоподобные области, которые стабилизируют укладку структуры белка и содержат возможную поверхность раздела для димеризации EGFR.
Известно, что EGFR существует на поверхности клетки во множестве различных конформаций, причем наиболее частой из них является связанная или закрытая конформация. Связанная конформация неспособна к димеризации и, следовательно, неактивна. Известно, что терапевтическое антитело Erbitux стабилизирует связанную конформацию за счет связывания с доменом III и создания такой пространственной конфигурации рецептора, которая не позволяет ему достичь несвязанного состояния. Однако некоторые рецепторы могут все еще сохранять способность принять несвязанную конформацию, связать лиганд и димеризироваться. Моноклональное антитело (mAb) в типичном случае способно эффективно связываться только с одной из конформаций, следовательно, не может эффективно нацеливаться на раковые клетки, проявляющие другие конформации, или раковые клетки, проявляющие несколько конформаций.
Моноклональные антитела (mAb), направленные на лигандсвязывающий домен EGFR, могут блокировать взаимодействие с лигандами EGFR и, сопутствующим образом, возникающий в результате этого взаимодействия внутриклеточный сигнальный путь.
Erbitux™ (эрбитукс, цетуксимаб) представляет собой рекомбинантное химерное (человек/мышь) моноклональное антитело, которое специфически связывается с внеклеточным доменом EGFR человека. Эрбитукс состоит из Fv-областей мышиного антитела против EGFR с константными областями тяжелой и каппа-легкой цепи IgG1 человека, имея приблизительный молекулярный вес 152 кДа. Эрбитукс вырабатывается в культуре клеток млекопитающих (мышиная миелома). Эрбитукс официально разрешен для лечения пациентов с метастатическим колоректальным раком, опухоли которых экспрессируют EGFR. В дополнение к этому, эрбитукс применяют в комбинации с лучевой терапией для лечения пациентов с плоскоклеточным раком головы и шеи при невозможности хирургического удаления опухоли или в виде лечения второй очереди, если плоскоклеточный рак головы и шеи не поддается стандартной терапии на основе препаратов платины.
Vectibix™ (вектибикс, панитумумаб) представляет собой рекомбинантное каппа моноклональное антитело IgG2 человека, которое специфически связывается с EGFR человека. Вектибикс имеет приблизительный молекулярный вес 147 кДа. Панитумумаб вырабатывается в генноинженерных клетках млекопитающих (из яичника китайского хомячка). Вектибикс официально разрешен для лечения пациентов с метастатическим колоректальным раком, опухоли которых экспрессируют EGFR, при прогрессировании болезни или после химиотерапии по схемам, содержащим фторпиримидин, оксалиплатин и иринотекан.
На опухолевых клетках человека было идентифицировано множество мутантных рецепторов EGF. Они способны воспроизводить рецепторную активность независимо от связывания лиганда (EGFRvIII), приводя к повышенной онкогенности. Можно генерировать моноклональные антитела против мутантов EGFR, но такие моноклональные антитела не всегда будут эффективными против немутантного EGFR.
У людей, больных раком, были идентифицированы такие мутации EGFR, которые влияют на ответную реакцию на химиотерапию, направленную на EGFR. Документ WO 2006/110478 (Novartis) раскрывает 43 мутации, а также 18 вариантов SNP (однонуклеотидного полиморфизма) в открытой рамке считывания EGFR. В двух или более типах опухолей идентифицированы некоторые бессмысленные мутации. Документ WO 2006/091899 (Amgen) раскрывает еще восемь мутаций, идентифицированных в различных раковых клетках. Одна или несколько таких мутаций могут локализоваться в эпитопе или изменять структуру эпитопа, связываемого с одним из разрешенных терапевтических моноклональных антител. Пациенты, несущие такую мутацию (мутации), будут невосприимчивы к лечению моноклональным антителом.
Кроме того, в литературе имеются сообщения, в которых отмечена гетерогенность по гликозилированию, по меньшей мере, одного из сайтов гликозилирования (Whitson et al., 2005 Biochemistry 44:14920-31; Zhen et al. 2003 Biochemistry 42; 5478-92). Такая гетерогенность может прямым или опосредованным образом приводить к разной экспозиции эпитопов, варьирующих в различных опухолевых клетках.
Антителозависимая клеточноопосредованная цитотоксичность (ADCC) представляет собой альтернативный механизм, посредством которого антитела опосредуют уничтожение опухолевых клеток. Уровень ADCC зависит от нескольких факторов, включая подтип IgG (IgM>IgG1 >IgG2), плотность антител на целевых клетках, характер гликозилирования антитела, а также свойства мишени, как таковой.
Friedmann et al (PNAS 2005, 102:1915-20) показали, что два мышиных моноклональных антитела, отобранных по их способности ингибировать связывание EGF с EGFR за счет связывания различных эпитопов EGFR, проявляют способность к синергическому подавлению экспрессии рецептора в клетках KB и СНО, кратковременно экспрессирующих EGFR. Перекрестно конкурирующие антитела, ингибирующие EGF, не проявляют никакой синергии.
Modjtahedi et al (Cell Biophysics vol 22, 1993, 129-146) протестировали комбинации нескольких крысиных антител против EGFR с неперекрывающимися эпитопами. Антитела принадлежали к разным изотипам. Во всех случаях эффект от применения двух антител был промежуточным между эффектами, наблюдаемыми при применении двух моноклональных антител по отдельности в том же количестве. Это наблюдение было подтверждено как in vivo, так и in vitro.
Документ WO 2004/032960 (патент Merck) раскрывает, что комбинированное применение двух моноклональных антител, Mab 425 и Mab 225 (цетуксимаб), приводит к повышению количества связанных антител на поверхности раковых клеток, экспрессирующих EGFR, по сравнению с применением каждого из моноклональных антител по отдельности в том же количестве. Эта публикация также раскрывает усиление подавления EGFR при использовании комбинации антител по сравнению с двумя моноклональными антителами.
Perera et al (Clin Cancer Res 2005; 11(17):6390-99) раскрыли синергический эффект при лечении мышей, несущих ксенотрансплантаты U8 7MG.de2-7, комбинацией двух мышиных моноклональных антител. Одно из антител (mAb 528) связывает все подтипы EGFR примерно с такой же специфичностью, что и цетуксимаб. Другое антитело (mAB 806) связывает только EGFR подтипа de2-7. Клеточная линия U87MG.de2-7 представляет собой трансфицированную клеточную линию de2-7EGFR. Клеточная линия U87MG.DK экспрессирует вариант EGFR подтипа de2-7 с неактивной киназой. Если для лечения мышей, несущих ксенотрансплантаты U87MG.DK, применяли два антитела, то никаких синергических эффектов не наблюдалось. В модели ксенотрансплантата с клеточной линией A431, экспрессирующей EGFR дикого типа, авторы не нашли никаких подтверждений синергии. EGFR de2-7 представлен только в небольшом числе типов рака, в частности, в глиомах, в некоторой степени в опухолях молочной железы и в опухолях легких.
Хотя эти исследования показали, что в некоторых случаях между двумя мышиными моноклональными антителами может существовать синергия, они также показали, что во многих случаях никакой синергии не наблюдается. Эти исследования также не выявили какой-либо композиции антител против EGFR, которая была бы эффективной против широкого ряда клинически важных линий раковых клеток.
В связи с этим существует потребность в улучшенных терапевтических антителах против EGFR, которые были бы эффективны для лечения и/или профилактики заболеваний, связанных со сверхэкспрессией EGFR, при введении в низких дозах. Также существует потребность в широко применимых терапевтических антителах против рака, которые можно было бы применять, даже не обладая глубокими знаниями о структуре EGFR, экспрессируемого представляющими интерес раковыми клетками.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном из аспектов изобретение относится к композиции рекомбинантных антител, содержащей, по меньшей мере, 3 различные молекулы антител против EGFR, где антитела связывают различные первый, второй и третий эпитопы EGFR.
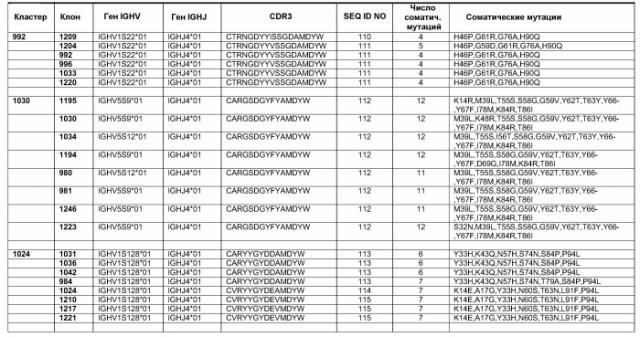
В дополнительном аспекте изобретение относится к композиции рекомбинантных антител, содержащей, по меньшей мере, две различные молекулы антител против EGFR, где одна индивидуальная молекула антитела против EGFR может быть выбрана из группы, состоящей из антител: 992, 1024, 1030, 1042, 1208, 1229, 1254, 1257, 1260, 1261, 1277, 1284, 1308, 1320, 1344 и 1347, или антител, имеющих области CDR указанных антител.
Предпочтительно, чтобы, по меньшей мере, одна индивидуальная молекула антитела против EGFR была выбрана из группы, состоящий из антител 992, 1030, 1024, 1347, 1277, 1254, 1320, 1260, 1261 и 1284, или антител, имеющих области CDR указанных антител. В особенно предпочтительном варианте осуществления изобретения композиция антител содержит антитела 992 и 1024 или два антитела, основанные на их последовательностях CDR3 или на их последовательностях VL и VH, либо содержит два антитела, обладающих, по существу, такой же специфичностью связывания.
Иллюстративные композиции антител по изобретению обладают доказанной эффективностью в ингибировании пролиферации типичных линий раковых клеток, что свидетельствует о пригодности их применения для лечения рака in vivo. Эти результаты были подтверждены в анализах со сфероидами раковых клеток, которые, по-видимому, в большей степени соответствуют ситуации in vivo, когда раковые клетки формируют опухоли. Кроме того, композиция антител по изобретением явно снижает подвижность клеток из раковых сфероидов, то есть уменьшает предрасположенность к метастазированию. Была также продемонстрирована эффективность иллюстративной композиции антител в модели ксенотрансплантата in vivo. Эти результаты были подтверждены при использовании особо предпочтительной композиции антител, состоящей из антител 992 и 1024.
В модели ксенотрансплантата рака человека у мышей иллюстративная композиция антител, предложенная изобретением, приводила к значительно более высокой степени терминальной дифференциации опухолевых клеток по сравнению с имеющимися в продаже антителами вектибикс и эрбитукс. Оказалось, что предпочтительная композиция антител по изобретению реализует свой эффект через другой механизм действия по сравнению с моноклональными антителами, поскольку после прекращения лечения указанной композицией антител возобновления роста опухоли не наблюдалось. Возобновление роста опухоли наблюдается после прекращения лечения моноклональными антителами.
В исследованиях по связыванию авторы настоящего изобретения продемонстрировали, что некоторые из антител, описанных в этой заявке, очевидно, облегчают связывание других антител, благодаря чему увеличивается общее количество антител, связанных с рецептором. Они также продемонстрировали, что связывание трех антител домена III облегчает последующее связывание других антител. Эти наблюдения несомненно поддерживают концепцию применения композиции, содержащей, по меньшей мере, 3 различные молекулы антител против EGFR, где антитела связывают различные первый, второй и третий эпитопы EGFR. Может также наблюдаться эффект при использовании специфической комбинации двух антител по изобретению, за счет выбора антител, обладающих этим специфическим эффектом. Такие антитела являются предпочтительными кандидатами для смешивания с другими антителами.
Композиции по изобретению могут обеспечивать некоторые дополнительные преимущества. Раковые клетки экспрессируют ряд EGFR. Наблюдается вариабельность в их конформации, гликозилировании и первичной структуре (мутации и SNP). Одно моноклональное антитело может быть нацелено на несколько таких вариантов EGFR, но не на все сразу. Мутанты EGFR могут быть невидимыми мутантами для моноклональных антител. Композиция антител, содержащая два антитела по изобретению или три и более различных антител, связывающих разные эпитопы EGFR, менее уязвима для мутантов, SNP, делеционных мутантов и вариаций в гликозилировании. Это доказывается широкой эффективностью смесей антител по настоящему изобретению против целой панели линий раковых клеток, представляющих разнообразные конформации и вариации EGFR.
Введение одного моноклонального антитела может также неполностью выключить киназную активность EGFR. При комбинировании антител можно достичь более эффективного ингибирования передачи сигналов.
Таким образом, может оказаться полезным включение антител, связывающих разные конформации EGFR (например, незакрытые конформации и димеры рецептора) в указанную смесь антител. Такая смесь антител может более эффективно ингибировать активность EGFR, чем моноклональное антитело, связывающее только одну из конформации.
Кроме того, применение подхода с тремя или более антителами против EGFR в композиции создает возможность для увеличения плотности антител на поверхности опухолевой клетки, благодаря чему увеличивается уничтожающее действие ADCC по сравнению с моноклональными антителами.
В дальнейшем аспекте изобретение относится к способу получения композиции антител, включающему
а) трансфицирование первой популяции эукариотических клеток первой экспрессирующей конструкцией, кодирующей первое антитело, содержащее первую когнатную пару цепей VH и VL, способных связывать первый индивидуальный эпитоп EGFR,
b) трансфицирование второй популяции эукариотических клеток второй экспрессирующей конструкцией, кодирующей второе антитело, содержащее вторую когнатную пару цепей VH и VL, способных связывать второй индивидуальный эпитоп EGFR,
c) необязательное повторение стадии b) для третьей или последующих клеточных популяций, экспрессирующих конструкций, когнатных пар и эпитопов EGFR,
d) отбор трансфицированных первой, второй и (необязательно) последующих клеточных популяций,
e) объединение трансфицированных популяций в одном сосуде для получения банка клеток,
f) культивирование клеток из банка клеток в условиях, обеспечивающих экспрессию антител, и
g) восстановление композиции антител из супернатанта и ее очистка.
Для простоты получения, единой технологии производства и выделения целевого продукта, а также для определения параметров все антитела содержат одну и ту же константную область тяжелой цепи.
В дальнейшем аспекте изобретение относится к банку клеток, содержащему, по меньшей мере, две субпопуляции эукариотических клеток, причем каждая субпопуляция трансфицирована или трансдуцирована одной экспрессирующей конструкцией, кодирующей антитело, содержащее когнатную пару цепей VH и VL, способных связывать индивидуальный эпитоп EGFR. Предпочтительно, чтобы клетки были трансфицированы с применением сайт-специфической интеграции.
Кроме того, изобретение относится к способу уменьшения передачи сигнала EGFR, включающему введение в композицию клеток, экспрессирующих EGFR, композиции антител по изобретению, что приводит к уменьшению передачи сигнала EGFR.
Изобретение также относится к способу уничтожения клеток, экспрессирующих EGFR, включающему введение в композицию клеток, экспрессирующих EGFR, композиции антител по изобретению, что приводит к уничтожению клеток, экспрессирующих EGFR.
Также предлагается способ индукции апоптоза в клетках, экспрессирующих EGFR, включающий введение в композицию клеток, экспрессирующих EGFR, композиции антител по изобретению, посредством чего индуцируется апоптоз.
Дальнейший аспект относится к способу ингибирования пролиферации клеток, экспрессирующих EGFR, включающему введение в композицию клеток, экспрессирующих EGFR, композиции антител по изобретению, посредством чего ингибируется пролиферация.
Изобретение относится к способу индуцирования дифференциации опухолевых клеток in vivo, включающему введение индивиду, страдающему раковым заболеванием, композиции антител, по изобретению, посредством чего индуцируется дифференциация опухолевых клеток. Этот аспект основан на наблюдаемых in vivo эффектах терминальной дифференциации раковых клеток при контакте с композицией антител по изобретению.
В дальнейшем аспекте изобретение относится к фармацевтическим изделиям, содержащим композицию антител по изобретению, а также, по меньшей мере, одно соединение, способное индуцировать дифференциацию раковых клеток, в виде комбинации для одновременного, раздельного или последовательного введения по схеме противораковой терапии. Комбинируя композиции антител по изобретению со средствами, о которых известно, что они индуцируют терминальную дифференциацию раковых клеток, можно добиться дополнительного улучшения лечебного эффекта.
Еще в одном аспекте изобретение относится к фармацевтическим изделиям, содержащим композицию антител по изобретению, а также, по меньшей мере, одно химиотерапевтическое или противоопухолевое соединение в виде комбинации для одновременного, раздельного или последовательного введения по схеме противораковой терапии. Вполне вероятно, что композицию антител по изобретению можно использовать для лечения второй очереди, то есть после лечения традиционными химиотерапевтическими или противоопухолевыми средствами или одновременно с таким лечением, после лучевой терапии или одновременно с ней, после хирургической операции или параллельно с ней.
В отдельном аспекте изобретение предлагает полинуклеотид, выбранный из группы, состоящей из нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную на фиг.23 (SEQ ID NO 100), нуклеиновой кислоты, кодирующей полипептид, имеющий аминокислотную последовательность, показанную на фиг.23 (SEQ ID NO 101), нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную на фиг.34A (SEQ ID NO 102), и нуклеиновой кислоты, кодирующей полипептид, имеющий аминокислотную последовательность, показанную на фиг.34B (SEQ ID NO 103). Кроме того, предлагается полипептид, содержащий аминокислотную последовательность, показанную на фиг.23 (SEQ ID NO 101), и полипептид, содержащий аминокислотную последовательность, показанную на фиг.34B (SEQ ID NO 103), векторы экспрессии, содержащие указанную нуклеиновую кислоту, как определено выше, функционально связанные с промоторной последовательностью, способной управлять экспрессией указанной нуклеиновой кислоты, и клетка, трансфицированная или трансдуцированная указанным вектором экспрессии.
Эти последовательности составляют полинуклеотидные и полипептидные последовательности EGFR у обезьян Cynomolgous, например, у Macaca fascicularis. Указанный вид обезьян широко используется в токсикологических исследованиях на животных. Для того чтобы определенный животный вид имел какую-либо ценность в токсикологических исследованиях с антителами против аутоантигенов человека, необходимо, чтобы антитела также связывали целевой белок у животного, подвергнутого токсическому воздействию, предпочтительно, приблизительно с такой же аффинностью. Благодаря вкладу авторов настоящего изобретения теперь стали доступны тестирующие антитела для связывания с EGFR обезьян cynomolgous. EGFR обезьян cynomolgus и человека являются высоко гомологичными белками, но было обнаружено на удивление много антител с весьма разной аффинностью к EGFR человека и обезьян cynomolgus. Это подчеркивает важность строгого применения для скрининга того белка EGFR Cynomolgus, который был предложен авторами настоящего изобретения.
Кроме того, предлагается способ скрининга антител по связыванию с EGFR cynomolgous, включающий следующие стадии:
- получение, по меньшей мере, одного испытуемого антитела,
- проведение анализа для определения связывания антитела с внеклеточным доменом EGFR cynomolgous (фиг.23, SEQ ID NO 101)) или с полноразмерным EGFR cynomolgous (фиг.34B, SEQ ID NO 103)), либо с поверхностью клетки, экспрессирующей внеклеточный домен EGFR cynomolgous или экспрессирующей полноразмерный EGFR cynomolgous,
- выбор, по меньшей мере, одного антитела, которое связывается с внеклеточным доменом EGFR cynomolgous.
Способ может дополнительно включать скрининг по связыванию с EGFR человека или по связыванию с клетками, экспрессирующими EGFR человека.
В дальнейшем аспекте изобретение относится к способу идентификации антител против EGFR, способных усиливать одновременное связывание другого антитела против EGFR с EGFR, где указанный способ включает:
a. В первом анализе определение максимальной способности связывания первого антитела с фиксированным количеством антигена EGFR,
b. Во втором анализе насыщение фиксированного количества антигена EGFR вторым антителом против EGFR,
c. Контактирование комплекса EGFR-антитело с указанным первым антителом и определение максимальной способности связывания, и
d. Сравнение способностей связывания для определения того, превышает ли максимальная способность связывания на стадии c. максимальную способность связывания на стадии a.
Этот анализ можно использовать для идентификации дополнительных комбинаций антител, обладающих сходными свойствами с антителами 992 и 1024.
Определения
Термин "антитело" описывает функциональный компонент сыворотки и часто относится или к совокупности молекул (антител или иммуноглобулина), или к одной молекуле (антитела или иммуноглобулина). Молекула антитела способна связываться или взаимодействовать со специфическим антигенным детерминантом (антигеном или антигенным эпитопом), который, в свою очередь, может привести к индукции иммунологических эффекторных механизмов. Индивидуальная молекула антитела обычно рассматривается как моноспецифическая, а композиция молекул антитела может быть моноклональной (то есть состоящей из идентичных молекул антитела) или поликлональной (то есть состоящей из двух или более различных молекул антитела, взаимодействующих с одним и тем же или различными эпитопами на одном антигене или даже на отдельных, различных антигенах). Каждая молекула антитела имеет уникальную структуру, которая позволяет ей специфически связываться с соответствующим антигеном, а все природные молекулы антитела имеют одну и ту же общую базовую структуру, состоящую из двух идентичных легких цепей и двух идентичных тяжелых цепей. Антитела в собирательном значении также известны как иммуноглобулины. Термин антитело или антитела при использовании здесь дополнительно включает химерные и одноцепочечные антитела, а также такие связывающие фрагменты антител как Fab, фрагменты Fv или фрагменты scFv, а также такие мультимерные формы, как димерные молекулы IgA или пентавалентные IgM. Антитело может быть человеческим, мышиным, химерным, гуманизированным или реконструированным.
Терминологическое определение "когнатная кодирующая пара VH и VL" описывает кодирующие последовательности исходной пары VH и VL, содержащиеся в одной и той же клетке, продуцирующей антитело, или извлеченные из этой клетки. Таким образом, когнатная пара VH и VL представляет собой пару VH и VL, исходно представленную у донора, от которого получена такая клетка. Терминологическое определение "антитело, экспрессируемое из кодирующей пары VH и VL", указывает, что антитело или фрагмент антитела выработан из вектора, плазмиды или т.п. конструкций, содержащих кодирующую последовательность VH и VL. Когда когнатная кодирующая пара VH и VL экспрессирует либо полное антитело, либо его стабильный фрагмент, эти продукты сохраняют аффинность связывания и специфичность антитела, изначально экспрессируемого из той клетки, откуда они были извлечены. Библиотеку когнатных пар также терминологически обозначают как репертуар или совокупность когнатных пар, которые могут быть представлены по отдельности или в виде общего пула.
Термин "CDR" - определяющая комплементарная область (или гипервариабельный участок) соответствует определению, данному в ссылке Lefranc et al (2003) IMGT unique numbering for immunoglobulin and T cell receptor variable domains and Ig superfamily V-like domains. Dev. Comp Immunol 27, 55-77.
Термин "отдельный член рекомбинантного поликлонального белка" обозначает одну молекулу белка из белковой композиции, содержащей разные, но гомологичные молекулы белка, в которой каждая молекула белка гомологична другим молекулам композиции, но также содержит один или несколько фрагментов вариабельной полипептидной последовательности, который (которые) характеризуется различиями в аминокислотной последовательности между отдельными членами поликлонального белка.
Терминологическое определение "промоторы головка к головке" относится к паре промоторов, расположенных очень близко друг к другу, в результате чего транскрипция двух фрагментов гена, управляемая этими промоторами, идет в противоположных направлениях. Промотор головка к головке можно также сконструировать при помощи фрагмента-вставки, кодирующего посторонние аминокислоты и находящегося между двумя промоторами. Такой вставочный фрагмент вполне может содержать более 500 нуклеотидов. Промоторы головка к головке также могут упоминаться под названием двунаправленные промоторы.
Термин "иммуноглобулин" обычно употребляют как собирательное обозначение смеси антител, обнаруживаемых в крови или сыворотке, но его также используют для обозначения смеси антител, полученной из других источников.
Термин "молекула иммуноглобулина" означает индивидуальную молекулу антитела, например, представляющую собой часть иммуноглобулина или часть любой композиции поликлональных или моноклональных антител.
Терминологическое определение "библиотека вариантных молекул представляющей интерес нуклеиновой кислоты" используется для описания совокупности молекул нуклеиновой кислоты, которые вместе кодируют "представляющий интерес рекомбинантный поликлональный белок". При использовании для трансфекции библиотека вариантных молекул представляющей интерес нуклеиновой кислоты содержится в библиотеке векторов экспрессии. Такая библиотека в типичном случае имеет, по меньшей мере, 2, 3, 5, 10, 20, 50, 1000, 104, 105 или 106 отдельных членов.
Термин "перенос массы" используют для описания переноса последовательностей представляющей интерес нуклеиновой кислоты из одной совокупности векторов в другую совокупность векторов, который осуществляется для каждой ДНК одновременно, не прибегая к выделению представляющей интерес индивидуальной ДНК. Такие совокупности векторов могут представлять собой библиотеки, содержащие, например, те вариабельные области, промоторы, лидерные или энхансерные элементы, которые представляют интерес. Затем эти последовательности можно перемещать без предварительного выделения, например, из фагового вектора в вектор экспрессии млекопитающих. Особенно применительно к библиотекам антител эта методика позволяет, чтобы разнообразие в сцеплении между VH и VL не утрачивалось при перемещении библиотек, например, из вектора отбора (например, вектора фагового дисплея) в вектор экспрессии млекопитающих. Таким образом, сохраняется первоначальное спаривание VH и VL.
При использовании здесь термин "функционально связанный" относится к сегменту, сцепленному с другим сегментом, при том условии, что он попадает в функциональную взаимосвязь с другим сегментом. Например, ДНК, кодирующая сигнальную последовательность, функционально связана с ДНК, кодирующей полипептид, если она экспрессируется как лидер, принимающий участие в переносе полипептида в эндоплазматическую сеть. Таким же образом, промотор или энхансер функционально связан с кодирующей последовательностью, если он стимулирует транскрипцию этой последовательности.
Термин "поликлональное антитело" описывает композицию различных молекул антитела, которая способна связываться или взаимодействовать с несколькими различными специфическими антигенными детерминантами на одном и том же или на различных антигенах. Обычно принято считать, что вариабельность поликлонального антитела локализована в так называемых вариабельных областях поликлонального антитела. Однако в контексте настоящего изобретения термин поликлональность можно также понимать как описание различий между индивидуальными молекулами антитела, локализованных в так называемых константных областях, например, как в случае смесей антител, содержащих два или более изотипов антитела, таких как изотипы человека IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2 или мышиные изотипы IgG1, IgG2a, IgG2b, IgG3 и IgA. В целях настоящего изобретения такое поликлональное антитело также можно называть "композицией антител".
Термин "эпитоп" обычно используют для описания доли более крупной молекулы или части более крупной молекулы (например, антигена или антигенного сайта), проявляющей антигенную или иммуногенную активность у животного, предпочтительно, млекопитающего и, наиболее предпочтительно, человека. Эпитоп, обладающий иммуногенной активностью, представляет собой часть более крупной молекулы, которая вызывает у млекопитающего ответную реакцию антител. Эпитоп, обладающий антигенной активностью, представляет собой часть более крупной молекулы, с которой иммуноспецифически связывается антитело, как это можно определить любым способом, хорошо известным в данной области техники, например, описанными здесь иммунологическими анализами. Антигенные эпитопы необязательно должны быть иммуногенными. Антигены представляют собой вещества, например, токсины, вирусы, бактерии, белки или ДНК, с которыми иммуноспецифически связывается антитело или фрагмент антитела. Антигены или антигенные сайты, за исключением очень маленьких, часто имеют более одного эпитопа и часто способны стимулировать иммунный ответ. Эпитопы могут быть линейными или конформационными. Линейный эпитоп состоит приблизительно из 6-10 прилегающих аминокислот в белковой молекуле и распознается антителом. В отличие от этого конформационный эпитоп состоит из аминокислот, которые не упорядочены последовательно. В данном случае антитело распознает только 3-мерную структуру. Когда белковая молекула сворачивается в трехмерную структуру, аминокислоты, образующие эпитоп, сопоставляются, позволяя антителу распознать последовательность. В денатурированном белке может быть распознан только линейный эпитоп. Конформационный эпитоп по определению должен располагаться на наружной поверхности свернутого белка. Антитело, которое распознает конформационный эпитоп, может связываться с ним только в условиях мягких, не денатурирующих процедур. Антитела, связывающиеся с различными эпитопами на одном и том же антигене, могут разным образом влиять на активность антигена, с которым они связываются, в зависимости от локализации эпитопа. Антитело, связывающееся с эпитопом в активном сайте антигена, может полностью заблокировать функцию антигена, тогда как другое антитело, связывающееся с другим эпитопом, может незначительно влиять или совсем не влиять на активность одиночного антигена. Однако такие антитела все еще способны активировать комплемент, благодаря чему происходит элиминация антигена, кроме того, возможны синергические эффекты при комбинировании одного или нескольких антител, связывающихся с различными эпитопами на одном и том же антигене. В настоящем изобретении эпитоп, предпочтительно, является частью внеклеточного домена EGFR. Антигены, рассматриваемые настоящим изобретением, предпочтительно, являются внеклеточными доменами белков, полипептидов EGFR или их фрагментов, с которыми иммуноспецифически связываются антитела или фрагменты антител. EGFR-ассоциированный антиген также может представлять собой аналог или производное внеклеточного домена полипептида EGFR или его фрагмента, с которым иммуноспецифически связывается антитело или фрагмент антитела.
Антитела, способные конкурировать друг с другом за связывание с одним и тем же антигеном, могут связываться с одними и теми же или с перекрывающимися эпитопами либо могут иметь сайты связывания, расположенные в близком соседстве друг с другом, благодаря чему конкуренция обусловлена, главным образом, стерическим препятствием. Способы определения конкуренции между антителами описаны в примерах.
При использовании здесь термины "поликлональный белок" или "поликлональность" относятся к белковой композиции, содержащей разные, но гомологичные молекулы белка, предпочтительно, выбранные из суперсемейства иммуноглобулинов. Таким образом, каждая молекула белка гомологична другим молекулам композиции, но также содержит один или несколько участков вариабельной последовательности полипептида, которые характеризуются различиями в аминокислотной последовательности между индивидуальными элементами поликлонального белка. Известные примеры таких поликлональных белков включают молекулы антитела или иммуноглобулина, рецепторы T-клеток и рецепторы B-клеток. Поликлональный белок может состоять из определенной подгруппы молекул белка, которые были охарактеризованы таким общим признаком как совпадающая активность связывания с желаемой мишенью, например, в случае поликлонального антитела, направленного против желаемого антигена-мишени.
Под "белком" или "полипептидом" подразумевается любая цепочка аминокислот независимо от ее длины или посттрансляционной модификации. Белки могут существовать в виде мономеров или мультимеров, содержащих две или более собранные полипептидные цепочки, фрагментов белка, полипептидов, олигопептидов или пептидов.
Термин "RFLP" относится к "полиморфизму длины рестрикционных фрагментов", то есть к способу, посредством которого анализируют характер миграции фрагментов нуклеиновой кислоты в геле после ее расщепления рестрикционными ферментами.
Термин "скремблирование" описывает ситуацию, когда два или более различных элемента поликлонального белка, состоящие из двух различных полипептидных цепочек, например, из суперсемейства иммуноглобулинов, экспрессируются из отдельной клетки. Эта ситуация может возникнуть, когда от