Гормон роста, модифицированный двухцепочечным полиэтиленгликолем, способ его получения и применение
Иллюстрации
Показать всеИзобретение относится к области технологий изготовления биологических препаратов и может быть использовано в фармацевтической промышленности. Способ получения пегилированного человеческого гормона роста предусматривает пегилирование указанного белка двухцепочечным полиэтиленгликолем в одном сайте при рН не ниже 6,0. Полученный пегилированный гормон роста подвергают электрофорезу в полиакриламидном геле в невосстанавливающих условиях и выделяют целевой продукт из полосы, соответствующей более низкой кажущейся молекулярной массе. Способ, предусматривающий пегилирование человеческого гормона роста при рН не ниже 8,0 и выделение полученного продукта, позволяет получить препарат, содержащий главным образом пегилированный человеческий гормон роста с более низкой кажущейся молекулярной массой. Пегилированный гормон роста с низкой кажущейся молекулярной массой и обогащенный им препарат применяют для изготовления медикамента для лечения заболевания, нуждающегося в лечении гормоном роста. Применение изобретения позволяет повысить биологическую активность гормона роста и увеличить период его метаболического полувыведения. 5 н. и 14 з.п. ф-лы, 10 ил., 3 табл., 6 пр.
Реферат
Область техники
Настоящее изобретение относится к области технологий изготовления биологических препаратов, в частности к гормону роста (ГР) с высокой биологической активностью, модифицированному двухцепочечным полиэтиленгликолем (ПЭГ), способу его получения, а также к использованию полученного пегилированного гормона роста в фармацевтике.
Уровень техники
Гормон роста человека (ГРЧ) является белковым гормоном, секретируемьм передней долей гипофиза, прекурсор которого состоит из 217 аминокислотных остатков, где первые 26 аминокислотных остатков составляют сигнальный пептид, и 191 аминокислотный остаток составляет зрелую молекулу. Существуют две внутримолекулярные дисульфидные связи (Cys79 и Cys191, Cys208 и Cys215), и молекула не гликозилирована при молекулярной массе 22 кД. Последовательность ГРЧ изложена в SEQ ID NO:1 (NCBI: P01241, AAA72260; Деното Ф.М. и др. "ДНК-последовательность и структура мРНК гормона роста человека: возможный альтернативный сплайсинг", Nucleic Acids Res., 9: 3719-3730, 1981; Роскам У. и др. "Молекулярное клонирование и нуклеотидная последовательность структурного гена гормона роста человека". Nucleic Acids Res., 7: 305-320, 1979; Мартиал Дж.Э. и др. "Гормон роста человека: "Клонирование и экспрессия в бактериях комплементарной ДНК", Science, 205: 602-607, 1979; Чен Э.Й. и др. "Локус гормона роста человека: нуклеотидная последовательность, биология и эволюция", Genomics, 4: 479-497, 1989). Первичные функции ГРЧ включают промотирование росту клетки, органа или кости, и это тесно связано с анаболизмом организма (Иглесиас П. и др. "Терапия рекомбинантного гормона роста человека у плохо питающихся пациентов на диализе: рандомизированное контролируемое исследование", Am. J. Kidney Dis., 32(3): 454-463, 1998; Нили Э.К. "Использование гормона роста человека и злоупотребление им", Annu. Rev. Med., 45:407-410, 1994). После более чем 20 лет клинического применения рекомбинантного гормона роста человека (рГРЧ), полученного по технологии рекомбинантной ДНК, были продемонстрированы клиническая эффективность и безопасность рГРЧ.
Результаты многих исследований показывают, что рГРЧ проявляет значительные терапевтические эффекты при лечении низкорослости, ожогов, ран, переломов костей, кровоточащих язв, почечной недостаточности, СПИД, анаболических расстройств, низкорослости, вызванной дефицитом эндогенного гормона роста, синдрома Тернера и дефицитом гормона роста у взрослых, а также показывает значительный эффект в терапии против старения. В данной области хорошо известно, что пегилированный гормон роста может использоваться для лечения указанных заболеваний и против старения, например, информацию об использовании пегилированного гормона роста для лечения заболеваний и против старения можно найти на сайте http://en.wikipedia.org/wiki/Growth_hormone#Normal_functions_of_GH_produced_by_the_body. Специалист в данной области сможет определить дозировки пегилированного гормона роста по изобретению для лечения заболеваний и против старения. В настоящее время рГРЧ является единственным эффективным лекарством для лечения низкорослости. К марту 2001 года показания, которые одобрены Управлением США по контролю за лекарствами (FDA) для начала клинических исследований рГРЧ, включают: интенсивную терапию для удержания азота в тяжелом ожоге, синдром короткой кишки (назначается отдельно или в сочетании с глутамином), остановка роста в связи с СПИДом и т.д. В настоящее время показания рГРЧ, которые одобрены для продажи, включают: подростковую низкорослость, вызванную дефицитом эндогенного гормона роста, низкорослость в связи с синдромом Тернера, подростковую низкорослость, вызванную спонтанным или органным дефицитом гормона роста, синдром Прадера-Вилли, раннее расстройство роста, катаболическое нарушение в связи со СПИДом, замедление роста в связи с хронической почечной недостаточностью, дефицит гормона роста у взрослого человека и т.д.
Полиэтиленгликоль является инертным, нетоксичным и биоразлагаемым органическим полимером, имеющим большое значение в областях биотехнологии и фармацевтики. Технология ПЭГ-модифицирования заключается в связывании ПЭГ с активным белком посредством ковалентной связи. После полиэтиленгликолирования (пегилиро-вания) свойства белка могут быть значительно улучшены, например, продлен метаболический полураспад лекарства, снижена иммуногенность, повышена безопасность, повышена эффективность терапии, снижена частота доз, улучшена растворимость лекарства/растворимость в воде, повышена сопротивляемость к протеолизу, повышено контролируемое высвобождение лекарства и т.д. (Инада и др., J. Bioact. и Compatible Polymers, 5, 343, 1990; Делгадо и др. "Критические обзоры терапевтических систем носителей лекарств", 9, 249, 1992; Катре, "Современные системы доставки лекарств", 10, 91, 1993; и Дэвис и др., патент США №4179337). В патенте США №4179337 раскрыто, что после связывания ПЭГ с таким белком, как фермент или инсулин, иммуногенность белка снижалась при одновременном уменьшении активности белка, но в то же время модифицированный белок сохранял определенную долю активности первоначального не-модифицированного белка. Такой эффект также был обнаружен в G-CSF (Сатаке-Исикава и др. Cell Structure и Function, 17, 157-160, 1992), IL-2 (Катре и др., Proc. Natl. Acad. Sci. USA, 84, 1487, 1987), TNF-a (Цуцуми и др. Jpn. J. Cancer Res., 85, 9, 1994), IL-6 (Инуэ и др. J. Lab. Clin. Med., 124, 529, 1994) и CD4-IgG (Чамов и др. Bioconj. Chem., 5, 133, 1994).
В патенте США №5824784 раскрыто, что модификатор ПЭГ с альдегидной группой на конце использовали для получения ПЭГ-G-CSF, который модифицировали ПЭГ в фиксированном сайте (N-концевая аминокислота белка). Модификатор ПЭГ-NHS, синтезированный путем активации N-гидроксисукцинимида (NHS), может образовывать амидную связь с г-аминогруппой лизина в G-CSF. ПЭГ-NHS имеет высокую химическую активность, но плохую селективность, и, таким образом, трудно получить продукт, модифицированный одной молекулой ПЭГ, в фиксированном сайте. По сравнению с продуктом, модифицированным несколькими молекулами ПЭГ, продукт, модифицированный одной молекулой ПЭГ, является более однородным и лучше поддается разделению и очистке, что облегчает контроль качества и обеспечивает стабильность партий при крупномасштабном производстве.
В настоящее время некоторые типы пегилированных терапевтических белковых лекарств, таких как пегилированная аденозиндеаминаза (Adagen.RTM, Enzon Pharmaceuticals), пегилированная L-аспарагиназа (Oncapspar.RTM, Enzon Pharmaceuticals), пегилированный интерферон-α2b (PEG-Intron.RTM, Schering-Plough) и пегилированный интерферон-α2а (Pegasys, Roche), колониестимулирующий фактор пегилированного гранулоцита (Neulasta.RTM, Amgen) применяются клинически. Метаболизм in vivo доли ПЭГ в лекарстве (или самого ПЭГ) уже четко понят, и ПЭГ доказал, что он является хорошим и безопасным модификатором лекарств без какого-либо отрицательного действия.
ПЭГ, который может быть связан с белковым лекарством, обычно необходимо дериватировать так, чтобы одна или две концевые группы на концах ПЭГ могли быть химически активированы, чтобы иметь требуемую функциональную группу, которая проявляет активность к по меньшей мере одной функциональной группе лекарства, и таким образом может образовывать стабильную ковалентную связь с ней, с которой она должна быть связана. Например, ПЭГ может быть связан с ε-NH2 остатка Lys в пептидной цепи белка или с α-NH2 остатка N-концевой аминокислоты пептидной цепи белка. Есть три формы полиэтиленгликолей, которые используют для модифицирования белка: молекула с линейной цепью (ЕР 0593868; Ю-Сен Ван и др., Advanced Drug Delivery Reviews, 54: 547-570, 2002; Ю-Сен Ван и др., Biochemistry, 39, 10634-10640, 2000.), U-образная разветвленная молекула (ЕР 0809996) и Y-образная разветвленная молекула (CN1243779C, ЕР1496076). В европейском патенте №ЕР 0809996 описано пегилирование IFN-α.
В данной области обычно считается, что после ПЭГ-модифицирования в свойствах большинства белков произойдут следующие изменения: 1) иммуногенность и антигенность снижаются; 2) циклический период полувыведения продлевается; 3) растворимость возрастает; 4) белок становится толерантным к протеолизу; 5) биодоступность увеличивается; 6) токсичность снижается; 7) термостабильность и механическая стабильность возрастают; 8) изоэлектрическая точка, электрофоретическое поведение и динамические свойства изменяются и т.д. Кроме того, одним из наиболее важных аспектов является то, что ПЭГ-модифицирование приводит к снижению клеточной активности белка, что происходит из-за групп, введенных в конечный продукт, включая ПЭГ и связи между ПЭГ и модифицируемым белком, а также относится к состоянию связи и получаемому побочному продукту. Дорис Брюггер и др. (патент США, публикация №US 2004/0223950 А1) раскрыли, что продукты модификации интерферона-α2а, мономодифицированного одной U-образной молекулой ПЭГ с двумя цепями в одном из разных сайтов, показывают значительно отличающуюся in vitro противовирусную активность, причем продукт модификации одной U-образной молекулой ПЭГ в сайте Lys31 имеет самую высокую удельную активность, а продукт, модифицированный одной U-образной молекулой ПЭГ в сайте Lys121 имеет самую низкую удельную активность, и разница между обеими может быть пятикратной.
Ли Вейхуа и др. (патент КНР №CN 1477126A) раскрыли способ получения ПЭГ-модифицированного гормона роста. Предпочтительно, реакцию модификации гормона роста выполняют разветвленной молекулой ПЭГ (mPEGn-NHS) при pH 6.5-7.0, и биологическую активность очищенного гормона роста, модифицированного разветвленной молекулой ПЭГ в одном сайте, измеряют у крыс с удаленным гипофизом. Результаты показывают, что связанный с ПЭГ гормон роста (где ПЭГ является молекулой с двойной цепью ПЭГ-NHS с молекулярной массой 40 кД) имеет сравнимую массу, увеличивающую эффект по сравнению с равным количеством гормона роста, получаемым путем инъекций ежедневно.
Раскрытие изобретения
Изобретение предлагает способ получения гормона роста, модифицированного двухцепочечным ПЭГ, включающий:
a) в растворе с pH не ниже 6,0, предпочтительно не ниже 7,0, предпочтительно не ниже 8,0, предпочтительно не ниже 9,0, предпочтительно не ниже 9,5, предпочтительно не ниже 10,0, наиболее предпочтительно pH 10,5, введение U-образного или Y-образного разветвленного двухцепочечного ПЭГ в контакт с гормоном роста, предпоч тительно гормоном роста человека, причем молярное отношение гормона роста и двух цепочечного ПЭГ предпочтительно составляет 1:2;
b) анализ продукта, модифицированного ПЭГ, в одном сайте, полученном на этапе а), в SDS-PAGE подходящей концентрации, предпочтительно 12% SDS-PAGE, причем продукт показывает две полосы или является в основном одной полосой более низкой кажущейся молекулярной массы;
с) отделение и извлечение продукта с более низкой кажущейся молекулярной массой в упомянутых двух полосах, который модифицирован ПЭГ в одном сайте;
по выбору также включающий этап очистки, предпочтительно с использованием гель-хроматографии, такой как хроматография на Q Sepharose FF, хроматография на DEAE Sepharose FF или хроматография MacroCap SP.
В предпочтительном варианте осуществления изобретение предлагает способ получения гормона роста, пегилированного двухцепочечным ПЭГ, где двухцепочечный ПЭГ является Y-образным разветвленным ПЭГ, имеющим следующую структурную формулу (I),
где: Ра и Pb - те же или разные ПЭГ; j - целое число от 1 до 12; Ri - H, замещенный или незамещенный алкил С1-12, замещенный арил, аралкил или гетероалкил; X1 и X2 - независимо связанная группа, где X1-(CH2)n, X2 выбирают из группы, состоящей из: (СН2)n, (СН2)nOCO, (CH2)nNHCO, (CH2)nCO, где n - целое число от 1 до 10; F - концевая группа, выбираемая из группы, состоящей из: гидроксила, карбоксила, эфирной группы, ацилхлорида, гидразида, малеинида, пиридиндисульфида, способного реагировать с амино-, гидроксильной или гидросульфидной группой терапевтического вещества или субстрата для формирования ковалентной связи.
В предпочтительном варианте осуществления изобретение предлагает способ получения гормона роста, пегилированного двухцепочечным ПЭГ, причем Y-образный ПЭГ имеет следующую структурную формулу (II):
где: каждый из R и R1 является независимым низкомолекулярным алкилом, предпочтительно алкилом С1-С4, наиболее предпочтительно метилом; m и m′ обозначают степень полимеризации и могут быть любым целым числом; m+m′ предпочтительно от 600 до 1500; j - целое число от 1 до 12; Ri - H, замещенный или незамещенный алкил С1-12, замещенный арил, аралкил или гетероалкил; F - концевая группа, выбираемая из группы, состоящей из: гидроксила, карбоксила, эфирной группы, ацилхлорида, гидразида, ма-леинида, пиридиндисульфида, способного реагировать с амино-, гидроксильной или гидросульфидной группой терапевтического вещества или субстрата для формирования ковалентной связи.
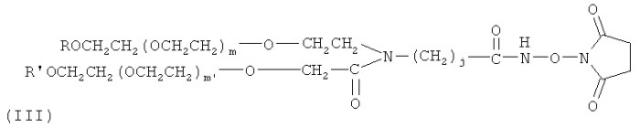
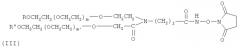
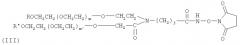
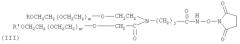
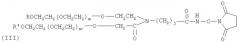
В предпочтительном варианте осуществления изобретение предлагает способ получения гормона роста, пегилированного двухцепочечным ПЭГ, где Y-образный ПЭГ имеет следующую структурную формулу (III):
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом C1-C4, наиболее предпочтительно метилом; m и m′ обозначают степень полимеризации и могут быть любым целым числом; m+m′ предпочтительно от 600 до 1500, наиболее предпочтительно 910; средняя совокупная молекулярная масса Y-образного ПЭГ составляет приблизительно от 26 кД до 60 кД, предпочтительно 40 кД; j - целое число от 1 до 12.
В предпочтительном варианте осуществления изобретение предлагает способ получения гормона роста, пегилированного двухцепочечным ПЭГ, где двухцепочечный ПЭГ является U-образным ПЭГ, имеющим следующую структурную формулу (IV),
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом С1-С4; n и n′ обозначают степень полимеризации и могут быть любым целым числом; n+n′ предпочтительно от 600 до 1500, наиболее предпочтительно 910; средняя молекулярная масса U-образного ПЭГ приблизительно от 26 кД до 66 кД, наиболее предпочтительно около 40 кД.
В предпочтительном варианте осуществления изобретение предлагает способ получения гормона роста, пегилированного двухцепочечным ПЭГ, включающий:
а) в растворе с pH 9,0 или 10,5 введение ПЭГ, имеющего следующую формулу (III), в контакт с гормоном роста человека, причем молярное отношение гормона роста с двухцепочечным ПЭГ составляет 1:2;
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом C1-C4, наиболее предпочтительно метилом; m+m′=910; j - целое число от 1 до 12; средняя совокупная молекулярная масса ПЭГ составляет приблизительно 40 кД;
b) анализ продукта, модифицированного ПЭГ в одном сайте, полученном на этапе а) в 12% SDS-PAGE, причем продукт показывает две полосы;
c) очистку, отделение и извлечение продукта с более низкой кажущейся молеку лярной массой, который модифицирован в одном сайте, путем использования гель- хроматографии, выбираемой из хроматографии на Q Sepharose FF, хроматографии на DEAE Sepharose FF или хроматографии MacroCap SP.
Изобретение также предлагает пегилированный гормон роста, полученный вышеописанным способом, причем гормон роста извлекают из натурального источника, или он является рекомбинантным гормоном роста, полученным по рекомбинантной биотехнологии, предпочтительно гормон роста имеет последовательность SEQ ID NO:1.
В предпочтительном варианте осуществления изобретение предлагает пегилиро-ванный гормон роста следующей формулы (VII), который получен вышеописанным способом и имеет молекулярную массу 62 кД:
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом C1-C4, наиболее предпочтительно метилом; m+m′=910; и j - целое число от 1 до 12.
Изобретение также предлагает способ получения препарата пегилированного гормона роста, включающий:
a) в растворе с pH не ниже 8,0, предпочтительно не ниже 9,0, предпочтительно не ниже 9,5, предпочтительно не ниже 10,0, наиболее предпочтительно pH 10,5, введение U-образного или Y-образного разветвленного двухцепочечного ПЭГ в контакт с гормоном роста, предпочтительно гормоном роста человека, причем предпочтительно молярное отношение гормона роста и двухцепочечного ПЭГ составляет около 1:2;
b) анализ продукта, модифицированного ПЭГ в одном сайте, полученном на этапе а) в SDS-PAGE подходящей концентрации, предпочтительно 12% SDS-PAGE, причем продукт показывает две полосы;
c) отделение и извлечение продукта, модифицированного ПЭГ в одном сайте;
причем упомянутым извлекаемым продуктом является смесь, которая главным образом содержит продукт с более низкой кажущейся молекулярной массой, который модифицирован ПЭГ в одном сайте, причем содержание продукта с более низкой кажущейся молекулярной массой, который модифицирован ПЭГ в одном сайте, детектируемое SDS-PAGE, не ниже 70%, предпочтительно не ниже 80%, наиболее предпочтительно не ниже 90%,
по выбору включает этап очистки, предпочтительно с использованием гель-хроматографии, такой как хроматография на Q Sepharose FF, хроматография на DEAE Sepharose FF или хроматография MacroCap SP.
В предпочтительном варианте осуществления изобретение предлагает способ получения препарата гормона роста, пегилированного двухцепочечным ПЭГ, причем двухцепочечным ПЭГ является Y-образный ПЭГ, имеющий следующую структурную формулу (I),
где: каждый из Pa и Pb является тем же или другим ПЭГ; j - целое число от 1 до 12; Ri - H, замещенный или незамещенный алкил C1-12, замещенный арил, аралкил или гетероалкил; каждый из X] и Х2 представляет связываемую группу, где X1 - (СН2)n, X2 выбирают из группы, состоящей из: (CH2)n, (CH2)nOCO, (CH2)nNHCO, (CH2)nCO, где n - целое число от 1 до 10; F - концевая группа, выбираемая из группы, состоящей из: гидроксила, карбоксила, эфирной группы, ацилхлорида, гидразида, малеинида, пиридиндисульфида, способного реагировать с амино-, гидроксильной или гидросульфидной группой терапевтического вещества или субстрата для формирования ковалентной связи.
В предпочтительном варианте осуществления изобретение предлагает способ получения препарата гормона роста, пегилированного двухцепочечным ПЭГ, причем Y-образный ПЭГ имеет следующую структурную формулу (II):
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом С1-С4, наиболее предпочтительно метилом; шит' обозначают степень полимеризации и могут быть любым целым числом; m+m′ предпочтительно от 600 до 1500, наиболее предпочтительно 910; j - целое число от 1 до 12; Ri - Н, замещенный или незамещенный алкил C1-12, замещенный арил, аралкил или гетероалкил; F - концевая группа, выбираемая из группы, состоящей из: гидроксила, карбоксила, эфирной группы, ацилхлорида, гидразида, малеинида, пиридиндисульфида, способного реагировать с амино-, гидроксильной или гидросульфидной группой терапевтического вещества или субстрата для формирования ковалентной связи.
В предпочтительном варианте осуществления изобретение предлагает способ получения препарата гормона роста, пегилированного двухцепочечным ПЭГ, причем Y-образный ПЭГ имеет следующую структурную формулу (III):
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом C1-C4, наиболее предпочтительно метилом; m и m′ обозначают степень полимеризации и могут быть любым целым числом; m+m′ предпочтительно от 600 до 1500, наиболее предпочтительно 910; j - целое число от 1 до 12; предпочтительно средняя совокупная молекулярная масса ПЭГ составляет приблизительно от 26 кД до 60 кД, предпочтительно 40 кД.
В предпочтительном варианте осуществления изобретение предлагает способ получения препарата гормона роста, пегилированного двухцепочечным ПЭГ, причем двухцепочечным ПЭГ является U-образный ПЭГ, имеющий следующую структурную формулу (IV),
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом C1-C4; n и n′ обозначают степень полимеризации и могут быть любым целым числом; n+n′ предпочтительно от 600 до 1500, наиболее предпочтительно 910; средняя молекулярная масса U-образного ПЭГ составляет приблизительно от 26 кД до 66 кД, наиболее предпочтительно около 40 кД.
В предпочтительном варианте осуществления изобретение также предлагает способ получения препарата гормона роста, пегилированного двухцепочечным ПЭГ, включающий:
а) в растворе с pH 9,0 или 10,5 введение ПЭГ следующей формулы (III) в контакт с гормоном роста человека, причем молярное отношение гормона роста и двухцепочечного ПЭГ составляет предпочтительно 1:2;
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом C1-C4; m+m′=910, j - целое число от 1 до 12; средняя совокупная молекулярная масса ПЭГ составляет приблизительно 40 кД;
b) анализ продукта, модифицированного ПЭГ в одном сайте, полученном на этапе а) в 12% SDS-PAGE;
c) отделение и извлечение продукта, модифицированного ПЭГ в одном сайте, путем использования гель-хроматографии, выбираемой из хроматографии на Q Sepharose FF, хроматографии на DEAE Sepharose FF или хроматографии MacroCap SP, и содержание SDS-PAGE продукта с более низкой кажущейся молекулярной массой, который модифицирован ПЭГ в одном сайте, в извлеченном продукте не ниже 70%, предпочтительно не ниже 80%, наиболее предпочтительно не ниже 90%.
Изобретение также предлагает препарат пегилированного гормона роста, полученный вышеописанным способом, причем гормон роста извлекают из натурального источника, или он является рекомбинантным гормоном роста, полученным по рекомбинантной технологии, предпочтительно гормон роста имеет последовательность SEQ ID NO:1. Предпочтительно, продукт модифицированного ПЭГ в одном сайте в препарате пегилированного гормона роста имеет следующую формулу (VII):
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом С1-С4, наиболее предпочтительно метилом; m+m′ - 910, j - целое число от 1 до 12, причем содержание SDS-PAGE продукта с более низкой кажущейся молекулярной массой, который модифицирован ПЭГ в одном сайте, в препарате пегилированного гормона роста не ниже 70%, предпочтительно не ниже 80%, наиболее предпочтительно не ниже 90%.
В предпочтительном варианте осуществления изобретения рекомбинантный гормон роста человека синтезируют искусственным путем или выражают из системы экспрессии, выбираемой из группы, состоящей из: прокариотной системы, такой как Е.coli., эукариотной системы, такой как дрожжи Pichia; системы клетки насекомого и системы клетки млекопитающего, такой как клетка CHO.
Изобретение также предлагает состав, содержащий фармацевтически эффективное количество вышеописанного пегилированного гормона роста или препарата пегилированного гормона роста и фармацевтически приемлемый носитель или наполнитель, предпочтительно содержащий маннитол, аминокислоту, хлорид натрия, уксусную кислоту или ацетат натрия, предпочтительно аминокислоту выбирают из группы, состоящей из аспартата, аспарагина, лизина и глицина.
Изобретение также предлагает использование вышеописанного пегилированного гормона роста или препарата пегилированного гормона роста или состава в производстве медикамента для лечения заболевания с необходимостью использования гормона роста или для лечения против старения, предпочтительно заболевание с необходимостью лечения гормоном роста выбирают из группы, состоящей из низкорослости, ожога, раны, перелома кости, кровоточащей язвы, почечной недостаточности, СПИД, низкорослости в связи с дефицитом эндогенного гормона роста, синдрома Тернера, анаболического нарушения и дефицита гормона роста у взрослых людей.
Изобретение также предлагает способ лечения пациента при заболевании, нуждающемся в лечении гормоном роста или для лечения против старения, причем способ включает назначение терапевтически эффективного количества вышеописанного пегилированного гормона роста или препарата пегилированного гормона роста или состава упомянутому пациенту, предпочтительно заболевание, нуждающееся в лечении гормоном роста, выбирают из группы, состоящей из низкорослости, ожога, раны, перелома кости, кровоточащей язвы, почечной недостаточности, СПИД, низкорослости в связи с дефицитом эндогенного гормона роста, синдрома Тернера, анаболического нарушения и дефицита гормона роста у взрослых людей.
Подробное описание изобретения
Изобретение предлагает гормон роста с высокой биологической активностью, модифицированный двухцепочечным полиэтиленгликолем (ПЭГ), и способ его получения. Существенный признак настоящего изобретения заключается в том, что после оптимизации состояния реакции и способа отделения содержание компонента с низкой клеточной активностью в гормоне роста, модифицированном ПЭГ в одном сайте, значительно снижается. В одном примере двухцепочечного ПЭГ с молекулярной массой 40 кД, продукт с низкой клеточной активностью, модифицированный в одном сайте, отличается тем, что этот продукт и продукт с высокой клеточной активностью, модифицированный в одном сайте, полностью разделены в две полосы в 12% SDS-PAGE, и кажущаяся молекулярная масса продукта с низкой клеточной активностью, модифицированного в одном сайте, больше чем таковая у продукта с высокой клеточной активностью, модифицированного в одном сайте. Используя крысу с удаленным гипофизом в качестве модели животного и рекомбинантный гормон роста человека в качестве положительного контроля, биологическую активность in vivo продукта с высокой клеточной активностью, модифицированного в одном сайте, анализировали согласно биологическому анализу гормона роста, описанному в Pharmacopoeia of the People′s Republic of China, version 2005, Volume 2, Appendix XII P. Продукт с высокой клеточной активностью, модифицированный в одном сайте, имеет значительно более высокую удельную биологическую активность, чем обычный гормон роста, проявляя более чем в 1,5 раза большую биологическую активность, чем обычный гормон роста, и при фармако-кинетических исследованиях на макаке-крабоеде (Масаса fascicularis) доказано, что он имеет средний период метаболического полувыведения лекарства в сыворотке более чем в 20 раз больше, чем таковой у обычного гормона роста и, таким образом, длительные эффекты.
В одном варианте осуществления изобретения реакцию модификации двухцепочечным ПЭГ-NHS для гормона роста выполняют при pH 8,0, используя электрофорез SDS-PAGE для анализа продуктов реакции и окрашивание серебром для визуализации. Удивительно, что продукт гормона роста, модифицированного ПЭГ в одном сайте, показывает две основные полосы, что отличается от предыдущих докладов (Росс Кларк, Кеннет Ольсон и др. "Гормоны роста длительного действия, продуцированные соединением с полиэтиленгликолем", J. Biol. Chem., 271:21969-21977, 1996. Ли Вейхуа, Донг Дзянь и др., "Гормон роста, эффективный в течение длительного времени и фармакологический состав", опубликованный патент КНР №CN1477126A). В дальнейших экспериментах были изучены модификации гормона роста двухцепочечным ПЭГ-NHS, выполненные в диапазоне pH 6,0-10,5, и с помощью SDS-PAGE выяснили, что все продукты, модифицированные в одном сайте, показывают две основные полосы. С увеличением pH также возрастает содержание полосы с более низкой кажущейся молекулярной массой. При pH≥10,0 продукт, модифицированный в одном сайте, показывает в сущности одну полосу более низкой кажущейся молекулярной массы.
В одном предпочтительном варианте осуществления изобретения используются некоторые подходящие способы очистки гель-хроматографией для подготовки очищенного рекомбинантного гормона роста человека, модифицированного ПЭГ в одном сайте при pH 10,5 и pH 6,0, соответственно. Для детектирования использовали SDS-PAGE с 12% разделяющим гелем, и для визуализации использовали окрашивание серебром. Очищенный рекомбинантный гормон роста человека, модифицированный ПЭГ в одном сайте при pH 6,0, четко показывает две полосы. Очищенный рекомбинантный гормон роста человека, модифицированный ПЭГ в одном сайте при pH 10,5, показывает в основном полосу более низкой кажущейся молекулярной массы, содержание SDS-PAGE которой не ниже 80%. В обоих случаях детектировали только ничтожное количество белка (не более 0,5%). MALDI-TOF MS подтверждает, что модифицированные продукты при этих двух значениях pH в сущности являются продуктами гормона роста, модифицированного ПЭГ в одном сайте. Анализ клеточной активности показывает, что продукт, модифицированный в одном сайте при pH 10,5, имеет значительно более высокую клеточную активность, чем продукт, модифицированный в одном сайте при pH 6,0, причем удельная клеточная удельная клеточная активность первого приблизительно в два раза больше таковой у последнего.
В одном предпочтительном варианте осуществления изобретения очищенный продукт модификации рекомбинантного гормона роста человека, который модифицирован ПЭГ в одном сайте при pH 6,0 и имеет более высокую кажущуюся молекулярную массу, подготовлен путем очистки хроматографией на Q Sepharose FF или путем очистки хроматографией MacroCap SP. Детектирование MALDI-TOF MS подтверждает, что рекомбинантный гормон роста человека, модифицированный ПЭГ, является продуктом, модифицированным ПЭГ в одном сайте, и анализ клеточной активности показал, что его удельная клеточная активность значительно ниже чем таковая у очищенного рекомбинантного гормона роста человека, модифицированного в одном сайте (с более низкой кажущейся молекулярной массой) при pH 10,5. Удельная клеточная активность последнего до 3 раз больше, чем таковая у первого.
В еще одном варианте осуществления изобретения, согласно биологическому анализу на гормон роста, который описан в Pharmacopoeia of the People′s Republic of China, version 2005, Volume 3, Appendix XII P, с использованием рекомбинантного гормона роста человека в качестве положительного контроля способ, примененный на крысе с удаленным гипофизом, использовали для анализа биологической активности in vivo продуктов модификации рекомбинантного гормона роста человека, модифицированного ПЭГ-NHS 40 кД в одном сайте при pH 10,5. Рекомбинантный гормон роста человека назначали один раз в сутки, всего 6 раз. Продукт рекомбинантного гормона роста человека, модифицированный ПЭГ в одном сайте, назначали один раз в дозе, равной сумме 6-разового назначения рекомбинантного гормона роста человека. Рекомбинантный гормон роста человека, модифицированный ПЭГ в одном сайте, имеет значительно более высокую биологическую активность, чем рекомбинантный гормон роста человека, и может достигать удельной биологической активности в 1,5 раза больше, чем у последнего. Его фармакология имеет длительный эффект. Фармакологические исследования на макаке-крабоеде показали, что период метаболического полувыведения рекомбинантного гормона роста человека, модифицированного ПЭГ в одном сайте, увеличивается более чем в 20 раз по сравнению с таковым для обычного рекомбинантного гормона роста.
Изобретение применяет разветвленные дериваты ПЭГ (U-образный разветвленный и Y-образный разветвленный) для модификации гормона роста. Y-образный разветвленный дериват ПЭГ, использованный в изобретении, является новым разветвленным дериватом ПЭГ, структура которого отличается от линейного ПЭГ или U-образного разветвленного ПЭГ, и его основное отличие от U-образного разветвленного ПЭГ заключается в том, что две разветвленные цепи ПЭГ Y-образного деривата ПЭГ настоящего изобретения связаны между собой через атом N, тогда как две разветвленные цепи ПЭГ U-образного деривата ПЭГ связаны между собой через атом С. Модификация с U-образным или Y-образным ПЭГ в основном происходит в N-концевой свободной α-аминогруппе белка или пептида или в s-аминогруппе боковой цепи остатка Lys. Y-образный дериват ПЭГ имеет следующую молекулярную формулу (I):
где: каждый из Pa и Pb - те же или разные ПЭГ; j - целое число от 1 до 12; Ri - H, замещенный или незамещенный алкил С1-12, замещенный арил, аралкил или гетероалкил;
каждый из X1 и X2 - связывающая группа, соответственно, где X1 - (CH2)n, X2 выбирают из группы, состоящей из: (CH2)n, (CH2)nOCO, (CH2)nNHCO, (CH2)nCO, где n - целое число от 1 до 10; F - концевая группа, выбираемая из группы, состоящей из: гидроксила, карбоксила, эфирной группы, ацилхлорида, гидразида, малеинида, пиридиндисульфида, способного реагировать с амино-, гидроксильной или гидросульфидной группой терапевтического вещества или субстрата для формирования ковалентной связи.
В одном предпочтительном варианте осуществления изобретения Pa и Pb Y-образного деривата ПЭГ могут быть те ми же или разными ПЭГ, как показано в формуле (II):
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом С1-С4, наиболее предпочтительно метилом; m и m′ обозначают степень полимеризации и могут быть любым целым числом; m+m' предпочтительно от 600 до 1500, наиболее предпочтительно 910; Ri - H, замещенный или незамещенный алкил Сип, замещенный арил, аралкил или гетероалкил; j - целое число от 1 до 12. F - концевая группа, выбираемая из группы, состоящей из: гидроксила, карбоксила, эфирной группы, ацилхлорида, гидразида, малеинида, пиридиндисульфида, способного реагировать с амино-, гидроксильной или гидросульфидной группой терапевтического вещества или субстрата для формирования ковалентной связи. Предпочтительно, средняя совокупная молекулярная масса ПЭГ составляет от 26 кД до 60 кД, наиболее предпочтительно 40 кД.
В одном варианте осуществления изобретение предлагает пегилированный гормон роста, имеющий следующую структурную формулу (VI):
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом С1-С4, наиболее предпочтительно метилом; j - целое число от 1 до 12; m и m′ обозначают степень полимеризации и могут быть любым целым числом; m+m′ предпочтительно от 600 до 1500; Ri - Н, замещенный или незамещенный алкил Сип, замещенный арил, аралкил или гетероалкил; F - концевая группа, выбираемая из группы, состоящей из: гидроксила, карбоксила, эфирной группы, ацилхлорида, гидразида, малеинида, пиридиндисульфида, способного реагировать с амино-, гидроксильной или гидросульфидной группой терапевтического вещества или субстрата для формирования ковалентной связи. В одном предпочтительном варианте осуществления изобретения структура молекулы Y-образного деривата ПЭГ (YPEG-NHS) показана в следующей формуле (III):
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом С1-С4, наиболее предпочтительно метилом; j - целое число от 1 до 12; m и m′ обозначают степень полимеризации и могут быть любым целым числом; m+m′ предпочтительно от 600 до 1500, наиболее предпочтительно 910.
В одном предпочтительном варианте осуществления изобретения структура молекулы U-образного деривата ПЭГ (UPEG-NHS) показана в следующей формуле (IV):
где: каждый из R и R′ является низкомолекулярным алкилом, предпочтительно алкилом C1-C4; n и n′ обозначают степень полимеризации и могут быть любым целым числом;
n+n′ предпочтительно от 600 до 1500, наиболее предпочтительно 910; средняя молекулярная масса ПЭГ составляет от 26 кД до 66 кД, наиболее предпочтительно около 40 кД.
В одном варианте осуществления изобретения для получения ГР, модифицированного Y-ПЭГ или U-ПЭГ, доля ПЭГ активированного деривата Y-ПЭГ и U-ПЭГ, такого как сукциминидный эфир ПЭГ (Y-ПЭГ-NHS) ковалентно связана с аминогруппой (-NH2) белка посредством нуклеофильной замены, группа -NH2 включает N-концевую α-NH2 бел