Способ оценки активности туберкулезного процесса и степени деструкции легочной ткани
Иллюстрации
Показать всеИзобретение относится к клинической медицине, а именно фтизиатрии, и может быть использовано для оценки активности туберкулезного процесса (ТП). Для этого определяют процент клеток, имеющих фенотип CD27-, по отношению к лимфоцитам крови CD4+, продуцирующим IFN-γ в ответ на стимуляцию микобактериальными антигенами. При значениях показателя выше 47% делают вывод об активном ТП, сопровождающимся выраженными деструктивными изменениями в легких (наличием множественных полостей распада легочной ткани). При значении показателя ниже 47%, но выше 31,2% делают вывод об активном ТП без или с незначительными деструктивными изменениями в легких (отсутствие полостей распада или единичные мелкие полости распада). Значения показателя ниже 31,2% наблюдаются при низкой активности туберкулезного процесса, латентной инфекции или отсутствии инфицирования. Использование данного способа позволяет оценить активность туберкулезного процесса с выраженностью деструктивных процессов в легочной ткани, а также их репарацию в процессе лечения. 5 пр., 2 ил.
Реферат
Изобретение относится к клинической медицине, а именно фтизиатрии и иммунологии, и может быть использовано для оценки активности туберкулеза (ТБ) и выраженности деструктивных процессов в легочной ткани.
В настоящее время резко возросла заболеваемость туберкулезом и смертность от этой инфекции. При этом отмечается множественная лекарственная устойчивость возбудителей заболевания и высокий уровень инфицирования Mycobacterium tuberculosis (Mtb) среди здорового населения. Для предупреждения распространения заболевания большое значение имеют своевременная диагностика и эффективное лечение активных форм туберкулеза.
Основными методами диагностики и мониторинга ТБ, используемыми в настоящее время, являются клинические, микробиологические, молекулярно-генетические и лучевые исследования. Однако каждый из этих подходов имеет свои ограничения. Идентификация микобактерий в мокроте с помощью микробиологических (мазок, посев, ВАСТЕС) или молекулярно-генетических (ПЦР) методов может быть невозможна в связи с отсутствием мокроты (например, у пациентов с ограниченными процессами в легочной ткани без деструкции). При наличии мокроты, микобактерий в мокроте нередко не удается идентифицировать, что, однако, не может служить показателем отсутствия инфекции или ее низкой активности. Кроме того, при исходном (в начале лечения) отсутствии микобактерий микробиологические методы не могут быть использованы для мониторинга за эффективностью проводимой терапии. При наличии бактериовыделения его исчезновение в процессе лечения позволяет говорить об эффекте от проводимой терапии, однако даже в этом случае микробиологические методы не позволяют судить о прекращении патологических процессов в легочной ткани, т.е. служить критерием излеченности больного (в большинстве случаев микобактерии в мокроте исчезают существенно раньше, чем происходит заживление процессов в легочной ткани). В целом, микробиологические методы исследования обычно не позволяют оценить состояние патологического процесса в легочной ткани больного.
Лучевые методы исследования, особенно компьютерная томография, дают наиболее адекватную информацию о процессах, проходящих в легочной ткани, таких как степень инфильтрации и деструкции. Однако даже компьютерная томография не всегда позволяет однозначно определить активность процесса или дифференцировать ТБ, опухолевые и некоторые другие заболевания. Кроме того, рентгенологическое обследование обладает рядом побочных эффектов, является дорогостоящим, а рентгенологическая оценка динамики туберкулезного процесса является достаточно субъективной.
Клинические симптомы ТБ не являются специфичными, их отсутствие не является показателем отсутствия активности ТБ процесса.
В целом, в настоящее время имеется острая необходимость в новых методах диагностики и мониторинга ТБ, не требующих мокроты для проведения анализа и позволяющих оценивать активность патологических процессов, идущих в легочной ткани, инфицированной Mtb. Следует отметить, что оценка активности ТБ инфекции важна не только для идентификации больных ТБ и лиц с латентной инфекцией (этому вопросу уделяется внимание в научной литературе), но и для оценки активности инфекционного процесса внутри группы больных ТБ - активность инфекционного процессе может быть разной у разных больных и у одного больного на разных стадиях развития (лечения) ТБ.
В связи с их высокой антигенной специфичностью, большим потенциалом для диагностики активности туберкулезного процесса (ТП) обладают иммунологические методы, в частности методы, основанные на оценке продукции интерферона-гамма Т-лимфоцитами (так называемые «интерфероновые» тесты).
Существующие интерфероновые тесты основаны на определении количества (частоты) клеток, продуцирующих интерферон-гамма (метод T-SPOT), или уровня продукции интерферона-гамма (метод QuantiFERON-TB) клетками периферической крови при стимуляции образцов крови антигенами микобактерий. Метод иммунологической диагностики и мониторинга туберкулезной инфекции T-SPOT (USPTO Application №20070196878) основан на определении количества клеток, продуцирующих интерферон-гамма в ответ на стимуляцию образцов крови антигенами микобактерий ESAT-6 и CFP-10. Данный метод был предложен для диагностики туберкулеза, дифференциальной диагностики активного туберкулеза и латентной инфекции и мониторинга течения ТБ. Однако, по данным большинства исследователей, основной областью применения данного метода является диагностика инфекции М. tuberculosis, а не активности инфекционного процесса или эффективности лечения (Streitz М, Tesfa L, Yildirim V, Yahyazadeh A, Ulrichs Т, et al. 2007 Loss of Receptor on Tuberculin-Reactive T-Cells Marks Active Pulmonary Tuberculosis. PLoS ONE 2(8): e735. doi:10.1371/journal.pone.0000735). Помимо этого, метод является сложным и трудоемким, требует культивирования клеток в стерильных условиях и дорогостоящих реагентов.
Метод QuantiFERON-TB Gold in-tube основан на определении уровня продукции интерферона-гамма клетками периферической крови в ответ на стимуляцию клеток антигенами микобактерий ESAT-6 и CFP-10. Метод используется для диагностики туберкулезной инфекции. Основным недостатком данного метода является то, что он не позволяет проводить дифференциальную диагностику активной и латентной туберкулезной инфекции, оценивать активность туберкулезного процесса или эффективность лечения. В 2011 г. ВОЗ пришла к заключению, что «интерфероновые тесты» не могут быть использованы для диагностики ТБ в странах с низким и средним уровнем дохода на душу населения, что связано с широким распространением латентной инфекции в этих странах.
Наиболее близким по своей сущности к методу, предлагаемому в данном изобретении, является подход, описанный Streitz и соавт. (Streitz М, Tesfa L, Yildirim V, Yahyazadeh A, Ulrichs Т, et al. (2007) Loss of Receptor on Tuberculin-Reactive T-Cells Marks Active Pulmonary Tuberculosis. PLoS ONE 2(8): e735. doi:10.1371/journal.pone.0000735). В этом подходе из образцов периферической крови выделяют мононуклеарные клетки и культивируют их с антигеном (ППД или пептидами, входящими в антиген микобактерий ESAT-6). После окончания культивирования клетки обрабатывают антителами, специфичными к маркерам CD4 и CD27, а также к внутриклеточному интерферону-гамма (IFN-γ), и среди лимфоцитов CD4+, отвечающих на стимуляцию антигеном продукцией IFN-γ (лимфоциты IFN-γ+), определяют долю лимфоцитов CD27-. По данным авторов, содержание лимфоцитов CD27- выше 49% от всех лимфоцитов CD4+, продуцирующих IFN-γ, свидетельствует об активном туберкулезе, ниже 49% - о латентной инфекции. Показано, что данный способ позволяет различить больных активным ТБ и носителей латентной инфекции. Однако следует обратить внимание на тот факт, что в работе Streitz и соавт. в группу больных ТБ были включены только больные, имеющие несколько патологических очагов в легочной ткани и не меньше одного очага размером более 3 см, т.е. больные с выраженными патологическими изменениями в легочной ткани. Дифференциальная диагностика активного ТБ и латентной инфекции у таких больных, как правило, не вызывает больших затруднений. Возможность использования метода для дифференциальной диагностики латентной инфекции и активного ТБ при незначительных поражениях легочной ткани, а также для оценки активности патологического процесса и степени деструктивных изменений легочной ткани внутри группы больных с диагностированным ТБ легких, в подходе, описанном Streitz и соавт, не рассматривается.
Задачей, решаемой данным изобретением, является разработка способа, который позволял бы объективно оценивать активность ТП, наличие и выраженность деструктивных изменений в легочной ткани у больных ТБ легких, а также их репарацию в процессе лечения, путем анализа клеток периферической крови. Технический результат вытекает из задачи и состоит в том, что при анализе небольших образцов периферической крови способ позволяет объективно оценивать активность ТП, наличие и выраженность деструктивных изменений в легочной ткани, эффективность лечения ТБ с точки зрения развития в легких репаративных процессов, при этом способ является недорогостоящим и простым в исполнении.
Технический результат достигается тем, что оценивают процентное содержание лимфоцитов, имеющих фенотип CD27-, не среди всех лимфоцитов CD4+ (как в способе Лядовой и соавт., Лядова, Никитина, Кондратюк, Васильева «Способ оценки эффективности лечения и динамики деструктивных изменений в легочной ткани при туберкулезе легких», заявка на патент №2010150484/15 (072863), а среди лимфоцитов CD4+, продуцирующих IFN-γ (подобно тому, как это делают в способе Streitz и соавт). В отличие от способа Streitz и соавт., исследование проводят на клетках цельной крови (а не на мононуклеарах крови), что существенно упрощает процедуру. Принципиальным отличием предлагаемого способа от метода Streitz и соавт. является то, что предлагаемый способ направлен на оценку выраженности деструктивных изменений легочной ткани у больных ТБ и позволяет идентифицировать больных с выраженными и незначительными деструктивными изменениями в легких. Способ, описанный Streitz и соавт., направлен на дифференциальную диагностику лиц с латентной инфекцией и больных ТБ, причем только больных с достаточно выраженными изменениями легочной ткани.
В предлагаемом способе клетки крови стимулируют антигенами микобактерий (ППД), что вызывает продукцию антиген-специфичными клетками цитокина IFN-γ. По продукции IFN-γ лимфоцитами CD4+ идентифицируют клетки, специфичные к антигенам микобактерий, и определяют содержание среди них лимфоцитов CD27- (процент клеток «IFN-γ+CD27-»).
Изобретение основано на открытии того факта, что процентное содержание в периферической крови лимфоцитов CD4+, специфичных к антигенам микобактерий и экспрессирующих фенотип CD27-, зависит от выраженности деструктивных изменений в легочной ткани. Эффекторные лимфоциты CD4 (лимфоциты CD4+CD62L-) образуются из наивных лимфоцитов при стимуляции последних антигеном и костимуляционными сигналами. Известно, что начальные стадии дифференцировки эффекторных лимфоцитов происходят за пределами легочной ткани, в лимфоидных органах. При этом большинство лимфоцитов, находящихся в лимфатических узлах, экспрессируют маркер CD27 и имеют фенотип CD62L+CD27+ или CD62L-CD27+. Ранее нами было показано, что когда лимфоциты CD62L-CD27+ мигрируют из лимфатических узлов в очаг инфекции в легочной ткани, они теряют экспрессию молекул CD27 и превращаются в эффекторные лимфоциты CD62L-CD27- (Kapina MA, Shepelkova GS, Bogacheva PV, Mischenko VV, Sayles P, Winslow G, Apt AS, Lyadova IV. CD27low CD4+ lymphocytes that accumulate in the mouse lung tissue during mycobacterial infection differentiate from CD27hi precursors in situ, produce IFN-γ, and protect the host against TB infection. J. Immunol., 2007, 178: 976-985). Лимфоциты CD62L-CD27- характеризуются высоким «сродством» к легочной ткани, в связи с чем они накапливаются преимущественно в легких, где при туберкулезе составляют подавляющее большинство Mtb-специфичных лимфоцитов CD4. Находящиеся в легких лимфоциты CD27- выходят в кровь, по-видимому, только тогда, когда целостность легочной ткани становится нарушенной. Именно это, по-видимому, и обусловливает установленную в настоящем изобретении ассоциацию между содержанием в крови Mtb-специфичных лимфоцитов CD27- и степенью деструкции легочной ткани.
Предлагаемый способ осуществляют следующим образом. Образцы цельной крови (500 мкл), стабилизированной гепарином (50 ед/мл), культивируют в течение 12 часов в присутствии антигена(ов) микобактерий (ППД или других) и ингибитора комплекса Гольджи. После окончания культивирования клетки собирают, добавляют к ним флуоресцентно-меченые антитела, специфичные к антигенам CD4 и CD27, инкубируют полученную смесь при комнатной температуре 15 мин, после чего лизируют эритроциты и смесь отмывают центрифугированием в забуференном физиологическом растворе с добавлением белка. Полученные клетки пермеабилизируют и добавляют к ним меченые антитела, специфичные к IFN-γ. Клетки анализируют на проточном цитофлуориметре и определяют процентное содержание лимфоцитов CD27- среди лимфоцитов «CD4+IFN-γ+». Исследование проводят в начале лечения ТБ и в процессе лечения.
Оценка результатов. У людей с подозрением на ТБ определяют процентное содержание клеток CD27- среди лимфоцитов CD4+, продуцирующих IFN-γ+. При значении исследуемого показателя более 31,2% делают вывод об активном ТБ. Значения показателя менее 31,2% расценивают как признак низкой активности туберкулезного процесса, латентной инфекции или отсутствия инфицирования. Значение показателя выше 31,2%, но менее 47% является признаком активного ТП без выраженных деструктивных изменений легочной ткани (отсутствие полостей деструкции, единичная полость деструкции или несколько мелких полостей распада), значения показателя более 47% является признаком ТП, сопровождающегося выраженными деструктивными изменениями легочной ткани (множественные полости деструкции, система полостей деструкции).
Предложенные критерии (31,2% - для идентификации больных ТБ с выраженной активностью ТП от больных с низкой активностью ТП; 47% - для разделения больных активным ТБ с разной степенью деструкции легочной ткани) подобраны на основании клинических исследований 52 больных туберкулезом легких (30 женщин и 22 мужчин в возрасте от 20 до 70 лет, средний возраст - 31 год), 21 здорового человека из зон контакта с больными ТБ (16 женщин, 5 мужчин, средний возраст 47 лет) и 15 здоровых людей с низким риском инфицирования М.tuberculosis (8 женщин, 7 мужчин, средний возраст 38 лет). Обследование больных проводили в первые дни поступления в стационар. Кровь забирали из вены утром натощак и анализировали согласно описанному способу. У всех больных с помощью микробиологических, клинических и рентгенологических методов анализировали: наличие микобактерий в мокроте, клинические проявления ТБ, распространение инфекции (сегмент, сегменты, доля, несколько долей одного легкого, оба легких), выраженность инфильтративных изменений, наличие в легочной ткани полостей деструкции. Все исследования проводили двойным слепым методом. Для математической обработки результатов и выявления факторов, определяющих высокое содержание в крови больных ТБ клеток IFN-γ+CD27-, выраженность указанных выше проявлений ТБ оценивали в баллах по следующей системе. Распространенность ТБ: 1 балл - поражен один или несколько сегментов; 2 балла - доля; 3 балла - целое легкое или оба легких. Степень деструкции легочной ткани: 0 - полости распада отсутствуют, 1 - единичная полость распада; 2 - несколько полостей распада; 3 - множественные полости распада; 4 - системы полостей распада. Клиническая тяжесть течения ТБ: 0 - жалобы (похудение, слабость и др.) отсутствуют, температура тела нормальная, 1 - незначительные жалобы, нормальная температура; 2 - жалобы на слабость, похудение, субфебрильная температура тела; 3 - выраженные признаки интоксикации (кахексия, сильная слабость), фебрильная температура.
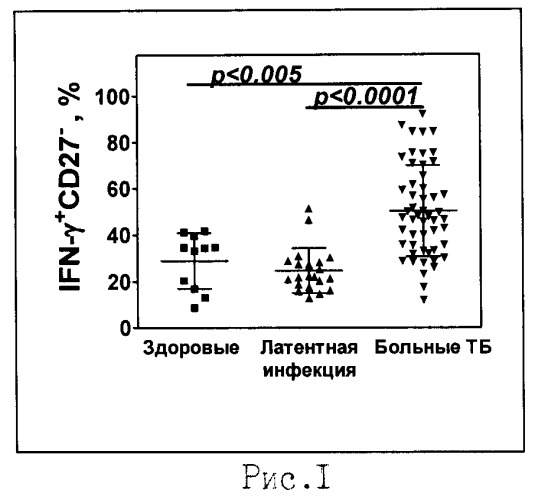
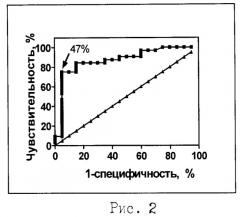
Проведенный анализ показал, что у больных ТБ процент клеток IFN-γ+CD27- достоверно выше (50.3±2.7), чем у здоровых людей (28.9±3.6, р<0.005), в том числе и людей, имеющих длительный контакт с больными ТБ и высокий риск инфицирования Mtb (24.7±2.1, p≤0.0001, Рис.1). Анализ ROC-кривых показал, что порог в 31,2% клеток IFN-γ+CD27- разделяет больных ТБ и здоровых людей, находящихся в контакте с больными ТБ, с чувствительностью 83% и специфичностью 90%. В группе больных ТБ содержание клеток IFN-γ+CD27- варьировалось в широких пределах (от 15% до 95%). Вариабельность не была связана с длительностью заболевания, слабо ассоциирована с распространенностью инфекции (r=0.28, p=0.04), но зависела от бактериовыделения (r=0.41, р=0.002), клинической тяжести заболевания (r=0.55, р=2.4×10-5) и выраженности деструктивных изменений в легочной ткани (r=0.55, р=2.4×10-5). Основным фактором, определяющим высокие значения исследуемого показателя, явилось наличие и выраженность деструктивных изменений легочной ткани (данные множественного регрессионного анализа, р=0.005377). Анализ ROC-кривых показал, что содержание лимфоцитов IFN-γ+CD27-, равное 47%, разделяло больных с выраженной деструкцией легочной ткани (значения показателя >47%) и больных с отсутствием или единичными полостями распада (значения показателя <47%) с чувствительностью 95% и специфичностью 75% (Рис.2).
В валидационных исследованиях, проведенных на группе больных с диагнозом туберкулез легких (n=14), определяли процентное содержание лимфоцитов IFN-γ+CD27-. На основе полученных результатов делали вывод о степени деструкции легочной ткани и сравнивали его с результатами рентгенологических исследований (исследования проводили двойным слепым методом). У 6 из 14 больных процентное содержание лимфоцитов IFN-γ+CD27- составило менее 47%. Рентгенологически ни у одного из 6 больных не было обнаружено множественных полостей распада: у 2 больных (34%) полости распада отсутствовали полностью, у одного больного (16%) была описана одна полость распада, у 3 больных (50%) - несколько мелких полостей распада. У 8 из 14 больных содержание лимфоцитов IFN-γ+CD27- было выше 47%. У 6 из них (85%) рентгенологические исследования выявили множественные полости распада.
Примеры
Пример 1. Больной Т. Диагноз: инфильтративный туберкулез легких в фазе распада. Процент лимфоцитов IFN-γ+CD27-: 83,6% (>47%). Результаты рентгенологического обследования и компьютерной томографии. В S2 правого легкого и S1+2, S6 левого легкого крупные инфильтраты и фокусы средней плотности с множественными участками распада. Бактериоскопия мазков мокроты: присутствие кислотоустойчивых микобактерий. Посев мокроты - рост микобактерий. Жалобы на слабость, утомляемость, потливость. Температура тела нормальная. Общий анализ крови: умеренный лейкоцитоз. Заключение: высокая активность туберкулезного процесса с выраженными деструктивными изменениями легочной ткани.
Пример 2. Больная М. Диагноз: инфильтративный ТБ верхний доли левого легкого в фазе распада и обсеменения. Процент лимфоцитов IFNγ+CD27-: 32% (<47%, >31.2%). Результаты рентгенологического обследования: в S1, S2 левого легкого, в кортикальных отделах небольшой округлый инфильтрат с полостью деструкции, в окружающей ткани - мелкие полиморфные очаги, в верхних отделах с обеих сторон наслоение плевры. Результаты бактериоскопии и посева мокроты отрицательные. Жалобы на слабость, потливость, утомляемость. Температура тела нормальная, общий анализ крови в норме. Заключение: активный туберкулезный процесс с единичной полостью деструкции.
Пример 3. Больная С. Диагноз: очаговый туберкулез верхней доли правого легкого в фазе уплотнения и кальцинации. Процент лимфоцитов IFNγ+CD27-: 23,1% (<31.2%). Результаты рентгенологического обследования и компьютерной томографии: в S1 и S2 правого легкого отдельная группа очагов ацинозно-надозного характера (полиморфные), в отдельных очагах кальцинаты. Полостей деструкции не выявлено. Результаты бактериоскопии и посева мокроты отрицательные. Жалоб нет. Общий анализ крови в норме. Заключение: туберкулезный процесс неактивный.
Пример 4. Медицинский работник со стажем работы в противотуберкулезном учреждении более 10 лет. Процент лимфоцитов IFNγ+CD27-: 18,6% (<31.2%). Результаты рентгенологического обследования: изменений в легочной ткани не выявлено. Жалоб нет. Клинические признаки ТБ отсутствуют. Результат теста на инфицирование M.tuberculosis (QuantiFERON-TB Gold in-tube): положительный. Заключение: инфицирование М.tuberculosis без признаков заболевания.
Пример 5. Здоровый донор. Процент лимфоцитов IFNγ+CD27- 18,6%. Результаты рентгенологического обследования: изменений в легочной ткани не выявлено. Жалоб нет, клинические признаки ТБ отсутствуют. Результат теста на инфицирование М. tuberculosis (QuantiFERON-TB Gold in-tube): отрицательный.
Таким образом, способ, предлагаемый в настоящем изобретении, отличается от других существующих методов и обеспечивает преимущества, состоящие в том, что: а) основан на анализе небольших образцов периферической крови; б) позволяет оценивать активность туберкулезного процесса, наличие и выраженность деструктивных изменений в легочной ткани.
Краткое описание чертежей
На рис.1 показано процентное содержание клеток CD27- среди лимфоцитов крови CD4+, продуцирующих IFN-γ в ответ на стимуляцию антигенами микобактерий (ППД).
На рис.2 изображена ROC кривая зависимости чувствительности и специфичности от выбранного значения анализируемого параметра (процента клеток CD4+IFN-γ+CD27-). Стрелка - значения показателя =47%.
Способ оценки активности туберкулезного процесса (ТП) и выраженности деструктивных процессов в легочной ткани, отличающийся тем, что проводят определение показателя процентного содержания лимфоцитов CD27- по отношению к лимфоцитам CD4+ периферической крови, отвечающим на стимуляцию микобактериальными антигенами продукцией IFN-γ, и при значениях показателя выше 47% устанавливают активную туберкулезную инфекцию, сопровождающуюся выраженными деструктивными изменениями в легких, а именно наличием множественных полостей распада легочной ткани; при значении показателя ниже 47%, но выше 31,2%, устанавливают активный ТП без или с незначительными деструктивными изменениями в легких, т.е. с единичными мелкими полостями распада или отсутствием полостей распада; а при значении показателя ниже 31,2% устанавливают низкую активность туберкулезного процесса, или латентную инфекцию, или отсутствие инфицирования.