Фармацевтические композиции, содержащие ера и сердечно-сосудистое средство, и способ их применения
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и представляет собой фармацевтическую композицию для снижения триглицеридов у индивидуума, нуждающегося в этом, где фармацевтическая композиция содержит по меньшей мере 95% ЕРА по массе от всех жирных кислот, присутствующих в композиции, и ингибитор редуктазы HMG-CoA. Изобретение обеспечивает снижение триглицеридов у индивидуума, нуждающегося в этом. 5 н. и 23 з.п. ф-лы, 1 пр., 4 ил.
Реферат
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Сердечно-сосудистые заболевания являются одной из основных причин смертности в Соединенных Штатах Америки и большинстве стран Европы. Рассчитано, что только в Соединенных Штатах Америки более 70 миллионов человек страдают от сердечно-сосудистых заболеваний или нарушений, включая в качестве неограничивающих примеров высокое артериальное давление, ишемическую болезнь сердца, дислипидемию, застойную сердечную недостаточность и инсульт.
СУЩНОСТЬ
В одном из вариантов осуществления настоящее изобретение относится к фармацевтической композиции, содержащей EPA и необязательно одно или несколько дополнительных сердечно-сосудистых средств. В другом варианте осуществления EPA включает этиловый эфир эйкозапентаеновой кислоты. В другом варианте осуществления композиция по существу не содержит никакого количества докозагексаеновой кислоты или ее производного (например, этил-DHA), если вообще содержит.
В других вариантах осуществления настоящее изобретение относится к способам лечения и/или предотвращения связанного с сердечно-сосудистой системой заболевания, включающим введение нуждающемуся в этом индивидууму фармацевтической композиции или композиции(й), содержащей(их) EPA и необязательно одно или несколько дополнительных сердечно-сосудистых средств.
В любом из указанных выше вариантах осуществления EPA и дополнительное сердечно-сосудистое средство(а) можно комбинировать в виде одной единицы дозирования или можно формулировать в виде от двух до множества единиц дозирования для согласованного, комбинированного или одновременного введения.
Ниже в настоящем документе более подробно описаны эти и другие варианты осуществления настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
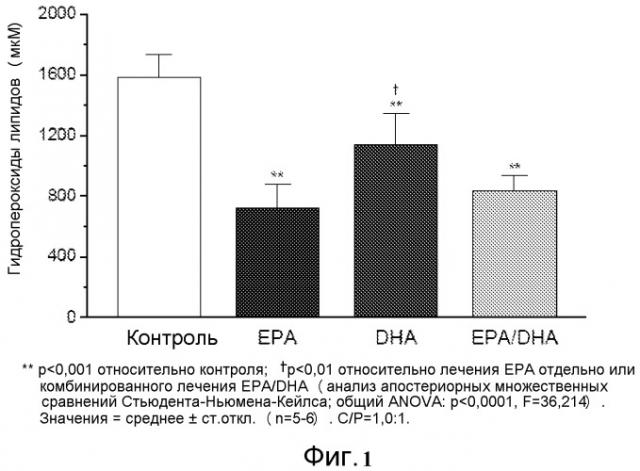
На фиг.1 представлено действие EPA, DHA и комбинированного лечения на перекисное окисление липидов мембран при соотношении холестерина к фосфолипидам 1,0.
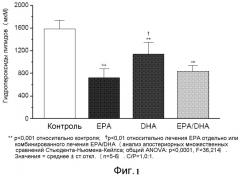
На фиг.2 представлено действие EPA, DHA и комбинированного лечения на перекисное окисление липидов мембран при соотношении холестерина к фосфолипидам 0,5.
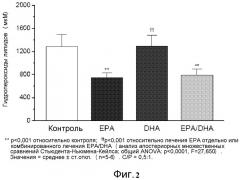
На фиг.3 представлено зависимое от холестерина действие EPA, DHA и комбинированного лечения на перекисное окисление липидов мембран.
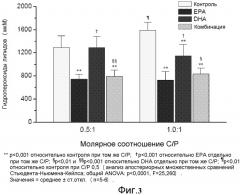
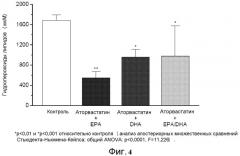
На фиг.4 представлено действие EPA, DHA или EPA/DHA с аторвастатином (молярное отношение 10:1) на уровни пероксидов липидов в обогащенных холестерином мембранах (соотношение холестерина к фосфолипидам 1:1).
ПОДРОБНОЕ ОПИСАНИЕ
Хотя настоящее изобретение можно осуществлять в различных формах, предоставленное ниже описание нескольких вариантов осуществления сделано с пониманием, что настоящее описание следует рассматривать как пример изобретения, и оно не предназначено для ограничения изобретения конкретными проиллюстрированными вариантами изобретения. Заголовки предоставлены исключительно для удобства, и их не следует рассматривать, как каким-либо образом ограничивающие изобретение. Варианты осуществления, проиллюстрированные под любым заголовком, можно комбинировать с вариантами осуществления, проиллюстрированными под любым другим заголовком.
При использовании числовых значений в различных количественных величинах, указанных в настоящей заявке, если не конкретно не указано иначе, они указаны как приближения, как если бы минимальному и максимальному значениям в указанных диапазонах предшествовало бы слово "приблизительно". Таким образом, для достижения по существу тех же результатов, как указанная величина, можно использовать небольшие отклонения от указанного значения. Также описание диапазонов приведено как непрерывный диапазон, включающий каждое значение между приведенными минимальным и максимальным значениями, а также любые диапазоны, которые можно образовать из таких значений. Также в настоящем документе описаны любые и все соотношения (и диапазоны любых из таких соотношений), которые можно образовывать, деля приведенное числовое значение на любое другое приведенное числовое значение. Таким образом, специалист поймет, что из числовых значений, предоставленных в настоящем документе, можно однозначно получить многие такие соотношения, диапазоны и диапазоны соотношений, и во всех случаях таких соотношений, диапазонов и диапазонов соотношений предоставлены различные варианты осуществления настоящего изобретения.
Эйкозапентаеновая кислота
В одном из вариантов осуществления композиции по изобретению в качестве активного ингредиента содержат EPA. Как применяют в настоящем документе, термин "EPA" относится к эйкозапентаеновой кислоте (например, эйкоза-5,8,11,14,17-пентаеновая кислота) и/или ее фармацевтически приемлемому сложному эфиру, производному, конъюгату или соли или смеси любого из указанного выше. Термин "фармацевтически приемлемый" в настоящем контексте означает, что рассматриваемое вещество не вызывает неприемлемой токсичности для индивидуума или взаимодействия с другими компонентами композиции.
В одном из вариантов осуществления EPA содержит полностью цис-эйкоза-5,8,11,14,17-пентаеновую кислоту. В другом варианте осуществления EPA находится в форме сложного эфира эйкозапентаеновой кислоты (также обозначаемого в настоящем документе как E-EPA или этил-EPA). В другом варианте осуществления EPA содержит C1-C5-алкиловый эфир EPA. В другом варианте осуществления EPA содержит, метиловый эфир эйкозапентаеновой кислоты, пропиловый эфир эйкозапентаеновой кислоты или бутиловый эфир эйкозапентаеновой кислоты. В другом варианте осуществления EPA содержит этиловый эфир полностью цис-эйкоза-5,8,11,14,17-пентаеновой кислоты.
В другом варианте осуществления EPA содержит литиевую соль EPA, моно-, ди- или триглицерид EPA или любой другой сложный эфир или соль EPA или форму свободной кислоты EPA. Также EPA может находиться в форме 2-замещенного производного или другого производного, которое замедляет скорость ее окисления, но в другом отношении не изменяет ее биологическое действие в какой-либо значимой степени.
В одном из вариантов осуществления EPA, присутствующая в композиции по изобретению, содержит ультрачистую EPA. Как применяют в настоящем документе, термин "ультрачистая" в отношении EPA относится к композиции, содержащей по меньшей мере 96% по массе EPA (как термин "EPA" определена и проиллюстрирована в настоящем документе). Ультрачистая EPA может содержать даже более чистую EPA, например, по меньшей мере 97% по массе EPA или по меньшей мере 98% по массе EPA, где EPA представляет собой любую форму EPA, как указано в настоящем документе. Ультрачистую EPA можно дополнительно определять (например, составом примесей) посредством любого из определений EPA, предоставленных в настоящем документе.
В другом варианте осуществления EPA содержит конъюгат EPA-жирная кислота, где EPA конъюгирована с другой молекулой EPA или с другой жирной кислотой. В одном из вариантов осуществления конъюгат EPA-жирная кислота содержит сложный диэфир, образованный EPA и EPA или EPA и второй жирной кислотой, как показано в структурах (I) и (II). В одном из вариантов осуществления R1 представляет собой ацильную группу жирной кислоты, происходящую из EPA, а R2 выбран из H, ацила жирной кислоты с количеством атомов углерода от 12 до 30 с двумя или более цис- или транс-двойными связями и групп жирных спиртов с количеством атомов углерода от 12 до 30, таких же, как R1, или отличных от него. R1 и R2 могут происходить из EPA (EPA-EPA) или один может происходить из EPA, а второй из другой жирной кислоты (EPA-жирная кислота), например, гамма-линоленовой кислоты, дигомо-гамма-линоленовой кислоты, арахидоновой кислоты, адреновой кислоты, стеаридоновой кислоты, докозапентаеновой кислоты n-3 и т.д.). R3 в основном представляет собой водород, полностью углеводород или содержит гетероатомы, а в одном из вариантов осуществления представляет собой C1-C4-алкильную группу.
Синтез конъюгата сложного диэфира можно проводить хорошо известными в данной области способами, включая, например, использование в качестве катализаторов металлов, хлоридов металлов или органических кислот; использование хлоридов жирных кислот, таких как хлорид EPA, хлорид γ-линоленовой кислоты (хлорид GLA), хлорид дигомо-γ-линоленовой кислоты (хлорид DGLA), хлорид линолевой кислоты (хлорид LA), хлорид арахидоновой кислоты (хлорид AA), хлорид конъюгированной линолевой кислоты (хлорид cLA), хлорид ALA, хлорид STA, хлорид ETA, хлорид DPA и т.д.; и использование в качестве катализаторов иммобилизованных ферментов.
В другом варианте осуществления композиция по настоящему изобретению содержит смеси сложных диэфиров EPA-жирная кислота. В связанном варианте осуществления композиции по настоящему изобретению содержит менее 20% конъюгата EPA-DHA, менее 15% конъюгата EPA-DHA, менее 10% конъюгата EPA-DHA, менее 9% конъюгата EPA-DHA, менее 8% конъюгата EPA-DHA, менее 7% конъюгата EPA-DHA, менее 6% конъюгата EPA-DHA, менее 5% конъюгата EPA-DHA, менее 4% конъюгата EPA-DHA, менее 3% конъюгата EPA-DHA, менее 2% конъюгата EPA-DHA, менее 1% конъюгата EPA-DHA, менее 0,5% конъюгата EPA-DHA или менее 0,1% по массе конъюгата EPA-DHA.
В другом варианте осуществления композиция по настоящему изобретению содержит по меньшей мере 96% конъюгата EPA-жирная кислота (например, EPA-EPA), по меньшей мере 97% конъюгата EPA-жирная кислота, по меньшей мере 98% конъюгата EPA-жирная кислота или по меньшей мере 99% конъюгата EPA-жирная кислота. В другом варианте осуществления композиция по настоящему изобретению содержит не более 10%, не более 9%, не более 8%, не более 7%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2%, не более 1% или не более 0,6%, не более 0,5%, не более 0,4%, не более 0,3%, не более 0,2 или не более 0,1% любого конъюгата EPA-жирная кислота, отличного от сложного диэфира EPA-EPA.
В другом варианте осуществления EPA присутствует в композиции по изобретению в количестве приблизительно от 50 мг до приблизительно 5000 мг, приблизительно от 75 мг до приблизительно 2500 мг или приблизительно от 100 мг до приблизительно 1000 мг, например, приблизительно 75 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1100 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1200 мг, приблизительно 1225 мг, приблизительно 1250 мг, приблизительно 1275 мг, приблизительно 1300 мг, приблизительно 1325 мг, приблизительно 1350 мг, приблизительно 1375 мг, приблизительно 1400 мг, приблизительно 1425 мг, приблизительно 1450 мг, приблизительно 1475 мг, приблизительно 1500 мг, приблизительно 1525 мг, приблизительно 1550 мг, приблизительно 1575 мг, приблизительно 1600 мг, приблизительно 1625 мг, приблизительно 1650 мг, приблизительно 1675 мг, приблизительно 1700 мг, приблизительно 1725 мг, приблизительно 1750 мг, приблизительно 1775 мг, приблизительно 1800 мг, приблизительно 1825 мг, приблизительно 1850 мг, приблизительно 1875 мг, приблизительно 1900 мг, приблизительно 1925 мг, приблизительно 1950 мг, приблизительно 1975 мг, приблизительно 2000 мг, приблизительно 2025 мг, приблизительно 2050 мг, приблизительно 2075 мг, приблизительно 2100 мг, приблизительно 2125 мг, приблизительно 2150 мг, приблизительно 2175 мг, приблизительно 2200 мг, приблизительно 2225 мг, приблизительно 2250 мг, приблизительно 2275 мг, приблизительно 2300 мг, приблизительно 2325 мг, приблизительно 2350 мг, приблизительно 2375 мг, приблизительно 2400 мг, приблизительно 2425 мг, приблизительно 2450 мг, приблизительно 2475 мг или приблизительно 2500 мг.
В одном из вариантов осуществления композиция по изобретению содержит не более чем приблизительно 10%, не более чем приблизительно 9%, не более чем приблизительно 8%, не более чем приблизительно 7%, не более чем приблизительно 6%, не более чем приблизительно 5%, не более чем приблизительно 4%, не более чем приблизительно 3%, не более чем приблизительно 2%, не более чем приблизительно 1% или не более чем приблизительно 0,5% по массе докозагексаеновой кислоты или ее производного, такого как этил-DHA (E-DHA) от всех жирных кислот, если вообще содержит. В другом варианте осуществления композиция по изобретению по существу не содержит докозагексаеновой кислоты или ее производного, такого как E-DHA. В другом варианте осуществления композиция по изобретению не содержит докозагексаеновой кислоты или E-DHA.
В другом варианте осуществления EPA составляет по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99% или 100% по массе от всех жирных кислот, присутствующих в композиции по изобретению.
В другом варианте осуществления композиция по изобретению содержит менее 30%, менее 20%, менее 10%, менее 9%, менее 8%, менее 7%, менее 6%, менее 5%, менее 4%, менее 3%, менее 2%, менее 1%, менее 0,5% или менее 0,25% любой жирной кислоты, отличной от EPA или ее производного, по массе от общей композиции или по массе от содержания всех жирных кислот. Иллюстративные примеры "жирной кислоты, отличной от EPA" включают линоленовую кислоту (LA) или ее производное, такое как этиллиноленовая кислота, арахидоновую кислоту (AA) или ее производное, такое как этил-AA, докозагексаеновую кислоту (DHA) или ее производное, такое как этил-DHA, альфа-линоленовую кислоту (ALA) или ее производное, такое как этил-ALA, стеаридоновую кислоту (STA) или ее производное, такое как этил-SA, эйкозатриеновую кислоту (ETA) или ее производное, такое как этил-ETA, и/или докозапентаеновую кислоту (DPA) или ее производное, такое как этил-DPA.
В другом варианте осуществления композиция по изобретению обладает одной или несколькими из следующих характеристик: (a) этиловый эфир эйкозапентаеновой кислоты составляет по меньшей мере 96%, по меньшей мере 97% или по меньшей мере 98% по массе от всех жирных кислот, присутствующих в композиции; (b) композиция содержит не более 4%, не более 3% или не более 2% по массе от всех жирных кислот, отличных от этилового эфира эйкозапентаеновой кислоты; (c) композиция содержит не более 0,6%, 0,5% или 0,4% каждой отдельной жирной кислоты, отличной от этилового эфира эйкозапентаеновой кислоты; (d) показатель преломления композиции составляет (20°C) приблизительно от 1 до приблизительно 2, приблизительно от 1,2 до приблизительно 1,8 или приблизительно от 1,4 до приблизительно 1,5; (e) удельная плотность композиции составляет (20°C) приблизительно от 0,8 до приблизительно 1,0, приблизительно от 0,85 до приблизительно 0,95 или приблизительно от 0,9 до приблизительно 0,92; (f) композиция содержит не более 20 ч/млн, 15 ч/млн или 10 ч/млн тяжелых металлов, (g) композиция содержит не более 5 ч/млн, 4 ч/млн, 3 ч/млн или 2 ч/млн мышьяка и/или (h) перекисное число композиции составляет не более 5, 4, 3 или 2 мг-экв./кг.
В другом варианте осуществления композиция, пригодная по изобретению, содержит по меньшей мере, по существу состоит по меньшей мере из или состоит по меньшей мере из 95% этилэйкозапентаеноата (EPA-E), приблизительно от 0,2% до приблизительно 0,5% этилоктадекатетраеноата (ODTA-E), приблизительно от 0,05% до приблизительно 0,25% этилнонаэкапентаеноата (NDPA-E), приблизительно от 0,2% до приблизительно 0,45% этиларахидоната (AA-E), приблизительно от 0,3% до приблизительно 0,5% этилэйкозатетраеноата (ETA-E) и приблизительно от 0,05% до приблизительно 0,32% этилгенэйкозапентаеноата (HPA-E), каждого по массе от всех жирных кислот, присутствующих в композиции. В другом варианте осуществления композиция находится в капсульной оболочке. В другом варианте осуществления капсульная оболочка не содержит химически модифицированного желатина.
В другом варианте осуществления композиции, пригодные по изобретению, содержат по меньшей мере, по существу состоят по меньшей мере из или состоят по меньшей мере из 95%, 96% или 97% этилэйкозапентаеноата, приблизительно от 0,2% до приблизительно 0,5% этилоктадекатетраеноата, приблизительно от 0,05% до приблизительно 0,25% этилнонаэкапентаеноата, приблизительно от 0,2% до приблизительно 0,45% этиларахидоната, приблизительно от 0,3% до приблизительно 0,5% этилэйкозатетраеноата и приблизительно от 0,05% до приблизительно 0,32% этилгенэйкозапентаеноат, каждый по массе от всех жирных кислот, присутствующих в композиции. Необязательно, композиция содержит не более чем приблизительно 0,06%, приблизительно 0,05% или приблизительно 0,04% по массе DHA или ее производного, такого как этил-DHA, от всех присутствующих жирных кислот. В одном из вариантов осуществления композиция по существу не содержит или не содержит никакого количества DHA или ее производного, такого как этил-DHA. Кроме того, композиция необязательно содержит один или несколько антиоксидантов (например, токоферол) в количестве не более чем приблизительно 0,5% или не более 0,05%. В другом варианте осуществления композиция содержит приблизительно от 0,05% до приблизительно 0,4%, например, приблизительно 0,2% по массе токоферола. В другом варианте осуществления приблизительно от 500 мг до приблизительно 1 г композиции предоставлено в капсульной оболочке. В другом варианте осуществления капсульная оболочка не содержит химически модифицированного желатина.
В другом варианте осуществления композиции, пригодные по изобретению, содержат по меньшей мере, по существу состоят по меньшей мере из или состоят по меньшей мере из 96% этилэйкозапентаеноата, приблизительно от 0,22% до приблизительно 0,4% этилоктадекатетраеноата, приблизительно от 0,075% до приблизительно 0,20% этилнонаэкапентаеноата, приблизительно от 0,25% до приблизительно 0,40% этиларахидоната, приблизительно от 0,3% до приблизительно 0,4% этилэйкозатетраеноата и приблизительно от 0,075% до приблизительно 0,25% этилгенэйкозапентаеноата, каждый по массе от всех жирных кислот, присутствующих в композиции. Необязательно, композиция содержит не более чем приблизительно 0,06%, приблизительно 0,05% или приблизительно 0,04% по массе DHA или ее производного, такого как этил-DHA, от всех присутствующих жирных кислот. В одном из вариантов осуществления композиция по существу не содержит или не содержит никакого количества DHA или ее производного, такого как этил-DHA. Кроме того, композиция необязательно содержит один или несколько антиоксидантов (например, токоферол) в количестве не более чем приблизительно 0,5% или не более 0,05%. В другом варианте осуществления композиция содержит приблизительно от 0,05% до приблизительно 0,4%, например, приблизительно 0,2% по массе токоферола. В другом варианте осуществления изобретение относится к лекарственной форме, содержащей приблизительно от 500 мг до приблизительно 1 г указанной выше композиции в капсульной оболочке. В одном из вариантов осуществления лекарственная форма представляет собой содержащую гель или жидкость капсулу, и ее упаковывают в блистерные упаковки с количеством капсул на пластину приблизительно от 1 до приблизительно 20.
В другом варианте осуществления композиции, пригодные по изобретению, содержат по меньшей мере, по существу состоят по меньшей мере из или состоят по меньшей мере из 96%, 97% или 98% по массе этилэйкозапентаеноата, приблизительно от 0,25% до приблизительно 0,38% по массе этилоктадекатетраеноата, приблизительно от 0,10% до приблизительно 0,15% по массе этилнонаэкапентаеноата, приблизительно от 0,25% до приблизительно 0,35% по массе этиларахидоната, приблизительно от 0,31% до приблизительно 0,38% по массе этилэйкозатетраеноата и приблизительно от 0,08% до приблизительно 0,20% этилгенэйкозапентаеноата, каждый по массе от всех жирных кислот, присутствующих в композиции. Необязательно, композиция содержит не более чем приблизительно 0,06%, приблизительно 0,05% или приблизительно 0,04% по массе DHA или ее производного, такого как этил-DHA, от всех присутствующих жирных кислот. В одном из вариантов осуществления композиция по существу не содержит или не содержит никакого количества DHA или ее производного, такого как этил-DHA. Кроме того, композиция необязательно содержит один или несколько антиоксидантов (например, токоферол) в количестве не более чем приблизительно 0,5% или не более 0,05%. В другом варианте осуществления композиция содержит приблизительно от 0,05% до приблизительно 0,4%, например, приблизительно 0,2% по массе токоферола. В другом варианте осуществления изобретение относится к лекарственной форме, содержащей приблизительно от 500 мг до приблизительно 1 г указанной выше композиции в капсульной оболочке. В другом варианте осуществления капсульная оболочка не содержит химически модифицированного желатина.
Сердечно-сосудистые средства
В одном из вариантов осуществления композиция (или схема лечения с совместным введением) по изобретению включает одно или несколько дополнительных сердечно-сосудистых средств. Одно или несколько дополнительных сердечно-сосудистых средств можно комбинировать с EPA или можно совместно вводить с EPA. Взаимозаменяемые термины "сердечно-сосудистое средство" или "сердечно-сосудистое лекарственное средство" в настоящем документе относятся к лекарственному средству или средству, которое способно к лечению, предотвращению или снижению риска развития сердечно-сосудистого заболевания или нарушения или его факторов риска или симптомов у индивидуума. Сердечно-сосудистые средства в настоящем документе в качестве неограничивающих примеров могут включать средства, модулирующие холестерин и триглицерид, средства, лечащие ишемическую болезнь сердца, средства, лечащие гипертензию или легочную артериальную гипертензию, средства, лечащие фибрилляцию предсердий или аритмию, средства, лечащие инсульт, средства, лечащие ишемию миокарда, и/или средства, лечащие тромбоз.
Неограничивающие примеры классов, из которых можно выбирать сердечно-сосудистые средства, пригодные для использования по настоящему изобретению, включают: ингибиторы ацил-коэнзим A:холестеринацилтрансферазы (ACAT), включая селективные ингибиторы ACAT-1, ACAT-2, а также двойные ингибиторы ACAT-1 и ACAT-2, лекарственные средства, блокирующие альфа-адренэргические рецепторы (альфа-блокаторы), альфа/бета-блокаторы, ингибиторы ангиотензин-превращающего фермента (ACE), антагонисты альдостерона, антагонисты рецепторов ангиотензина II, антиаритмические средства, антикоагулянты, антитромбоцитарные средства, миметики аполипопротеина A-1 (apoA-1), бета-блокаторы, усилители экскреции желчных кислот, блокаторы кальциевых каналов, ингибиторы белка-переносчика сложных эфиров холестерина с ApoB (CETP), ингибиторы всасывания холестерина, диуретики, средства против дислипидемии, антагонисты рецепторов эндотелина, фибраты, ингибиторы редуктазы 3-гидрокси-3-метилглутарил-коэнзима A (HMG-CoA), активаторы LCAT, индукторы рецепторов LDL, ингибиторы липазы, ингибиторы липопротеин-ассоциированной фосфолипазы A2 (Lp-PLA2), ингибиторы микросомального белка-переносчика триглицеридов (MTP), ингибиторы агрегации тромбоцитов, агонисты PPAR и активаторы, включающие агонисты PPARγ, PPARα агонисты и двойные агонисты PPAR α/γ, антисмысловую РНК или РНКи PCSK9, ингибиторы скваленэпоксидазы, ингибиторы скваленсинтетазы, тромболитики и активаторы тиреоидных рецепторов бета.
Ингибиторы ACAT
Ацил-CoA:холестринацилтрансфераза ("ACAT") представляет собой ацилтрансферазный фермент. В биосинтезе желчных кислот ACAT катализирует внутриклеточное образование сложных эфиров холестерина из холестерина. ACAT способствует накоплению сложных эфиров холестерина в тканях сосудов. Таким образом, средства, ингибирующие ACAT, пригодны для предотвращения или лечения атеросклероза. Неограничивающие примеры подходящих ингибиторов ACAT включают CI-1011 (авазимиб (Avasimibe), Pfizer), CS-505 (сульфат пактимиба (Pactimibe), Sankyo Pharma) или их сочетания.
При желании один или несколько ингибиторов ACAT, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 1000 мг, например, приблизительно 1 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 266 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 324 мг, приблизительно 325 мг, приблизительно 330 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг.
Ингибиторы ACE
Ангиотензин-I-превращающий фермент ("ACE") преобразует ангиотензин I в ангиотензин II и ингибирует брадикинин. Вследствие того, что увеличенные уровни ангиотензина II и сниженные уровни брадикинина способствуют ряду сердечно-сосудистых заболеваний и нарушений, средства, ингибирующие ACE, пригодны для предотвращения или лечения связанных с сердечно-сосудистой системой заболеваний, таких как гипертензия, сердечная недостаточность, диабетическая нейропатия и диабет 2 типа. Неограничивающие примеры подходящих ингибиторов ACE включают каптоприл, эналаприл, эналаприлат, трандолаприл, моэксиприл, рамиприл, хинаприл, периндоприл, лизиноприл, беназеприл, фозиноприл или их сочетания.
При желании один или несколько ингибиторов ACE, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,5 мг до приблизительно 50 мг, например, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 1,25 мг, приблизительно 2 мг, приблизительно 2,5 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 7,5 мг, приблизительно 8 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 11 мг, приблизительно 12 мг, приблизительно 13 мг, приблизительно 14 мг, приблизительно 15 мг, приблизительно 16 мг, приблизительно 17 мг, приблизительно 18 мг, приблизительно 19 мг, приблизительно 20 мг, приблизительно 21 мг, приблизительно 22 мг, приблизительно 23 мг, приблизительно 24 мг, приблизительно 25 мг, приблизительно 26 мг, приблизительно 27 мг, приблизительно 28 мг, приблизительно 29 мг, приблизительно 30 мг, приблизительно 31 мг, приблизительно 32 мг, приблизительно 33 мг, приблизительно 34 мг, приблизительно 35 мг, приблизительно 36 мг, приблизительно 37 мг, приблизительно 38 мг, приблизительно 39 мг, приблизительно 40 мг, приблизительно 41 мг, приблизительно 42 мг, приблизительно 43 мг, приблизительно 44 мг, приблизительно 45 мг, приблизительно 46 мг, приблизительно 47 мг, приблизительно 48 мг, приблизительно 49 мг или приблизительно 50 мг.
Антагонисты альдостерона
Альдостерон представляет собой стероидный гормон, способствующий гипертензии посредством ингибирования функции почек. Таким образом, средства, конкурирующие с альдостероном за рецепторы к минералокортикоидам, пригодны для предотвращения или лечения гипертензии. Неограничивающие примеры подходящих средств против альдостерона включают эплеренон и альдактон или их сочетания.
При желании антагонисты альдостерона, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 5 мг до приблизительно 100 мг, например, приблизительно 5 мг, приблизительно 10 мг, приблизительно 12 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 или приблизительно 100 мг.
Альфа-блокаторы
Альфа-блокаторы, также называемые антагонисты альфа-адренергических рецепторов, конкурируют с адреналином за связывание с α-адренорецепторами. Связывание адреналина с такими рецепторами приводит к вазоконстрикции и, таким образом, гипертензии. Таким образом, средства, конкурирующие с адреналином или блокирующие α-адренорецепторы, пригодны для предотвращения или лечения гипертензии. Неограничивающие примеры подходящих альфа-блокаторов включают доксазозин, метилдофу, клонидин, празозин, теразозин или их сочетания.
При желании альфа-блокаторы, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,02 мг до приблизительно 0,5 мг, например, приблизительно 0,02 мг, приблизительно 0,03 мг, приблизительно 0,04 мг, приблизительно 0,05 мг, приблизительно 0,06 мг, приблизительно 0,07 мг, приблизительно 0,08 мг, приблизительно 0,09 мг, приблизительно 0,1 мг, приблизительно 0,2 мг, приблизительно 2,5 мг, приблизительно 0,3 мг, приблизительно 3,5 мг, приблизительно 0,4 мг, приблизительно 4,5 мг или приблизительно 0,5 мг; в количестве приблизительно от 0,5 мг до приблизительно 15 мг, например, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 11 мг, приблизительно 12 мг, приблизительно 13 мг, приблизительно 14 мг или приблизительно 15 мг или в количестве приблизительно от 100 мг до приблизительно 500 мг, например, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг или приблизительно 500 мг.
Альфа/бета-блокаторы
При желании один или несколько альфа/бета-блокаторов, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 25 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 3,125 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 6,25 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 11 мг, приблизительно 12 мг, приблизительно 13 мг, приблизительно 14 мг, приблизительно 15 мг, приблизительно 16 мг, приблизительно 17 мг, приблизительно 18 мг, приблизительно 19 мг, приблизительно 20 мг, приблизительно 21 мг, приблизительно 22 мг, приблизительно 23 мг, приблизительно 24 или приблизительно 25 мг. Неограничивающий пример альфа/бета-блокатора представляет собой карведилол.
Антагонисты рецепторов ангиотензина II
Антагонисты рецепторов ангиотензина II, иначе называемые блокаторы рецепторов ангиотензина, ARB, антагонисты AT1-рецепторов или сартаны, пригодны для лечения гипертензии, застойной сердечной недостаточности и различных других заболеваний и нарушений. Неограничивающие примеры антагонистов рецепторов ангиотензина II включают кандесартан, ирбесартан, олмесартан, лозартан, валсартан, телмисартан, эпросартан или их сочетания.
При желании один или несколько антагонистов рецепторов ангиотензина II, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 100 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 12 мг, приблизительно 15 мг, приблизительно 16 мг, приблизительно 20 мг, приблизительно 24 мг, приблизительно 25 мг, приблизительно 28 мг, приблизительно 30 мг, приблизительно 32 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг, приблизительно 100 мг; в количестве приблизительно от 40 мг до приблизительно 320 мг, например, приблизительно 40 мг, приблизительно 60 мг, приблизительно 80 мг, приблизительно 100 мг, приблизительно 120 мг, приблизительно 140 мг, приблизительно 160 мг, приблизительно 180 мг, приблизительно 200 мг, приблизительно 220 мг, приблизительно 240 мг, приблизительно 260 мг, приблизительно 280 мг, приблизительно 300 мг, приблизительно 320 мг; в количестве приблизительно от 200 мг до приблизительно 800 мг, например, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг, приблизительно 500 мг, приблизительно 550 мг, приблизительно 600 мг, приблизительно 650 мг, приблизительно 700 мг, приблизительно 750 мг или приблизительно 800 мг.
Антиаритмические средства
Антиаритмические лекарственные средства действуют, корректируя нерегулярные сердечные сокращения и/или замедляя сердце со слишком высокой частотой сердечных сокращений. Неограничивающие примеры подходящих антиаритмические средства включают аденозин, амиодарон, дигоксин, дизопирамид, флекаинид, лидокаин, мексилетин, прокаинамид, глюконат хинидина, гидрохлорид пропафенона, токайнид или их сочетания.
При желании одно или несколько антиаритмических средств, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,1 мг до приблизительно 1500 мг, приблизительно от 1 мг до приблизительно 1200 мг или приблизительно от 5 мг до приблизительно 1000 мг, например, приблизительно 0,1 мг, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 266 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 324 мг, приблизительно 325 мг, приблизительно 330 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1100 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг или приблизительно 1200 мг,